WYKŁAD 4
Białka żywności i peptydy
Białko – polimery zbudowane z łańcuchów (jednego lub więcej) aminokwasów, połączonych
ze sobą wiązanie peptydowym.
Dolna granica pomiędzy białkami a polipeptydami ustalona jest umownie – 100
aminokwasów masy cząsteczkowej białek wynoszą od 10 do kilku milionów kDa
Niektóre białka zawierają inne dodatkowe komponenty (cukry, tłuszcz, nukleotydy,
atomy metali, inne związki organiczne) są to tzw. białka złożone
Aminokwasy – element budulcowy białek
W białkach występuje do 20 różnych aminokwasów o konfiguracji (19 – α –
aminokwasów i iminokwasów – proliny).
Arginina, histydyna, fenyloalanina, prolina, tryptofan, tyrozyna.
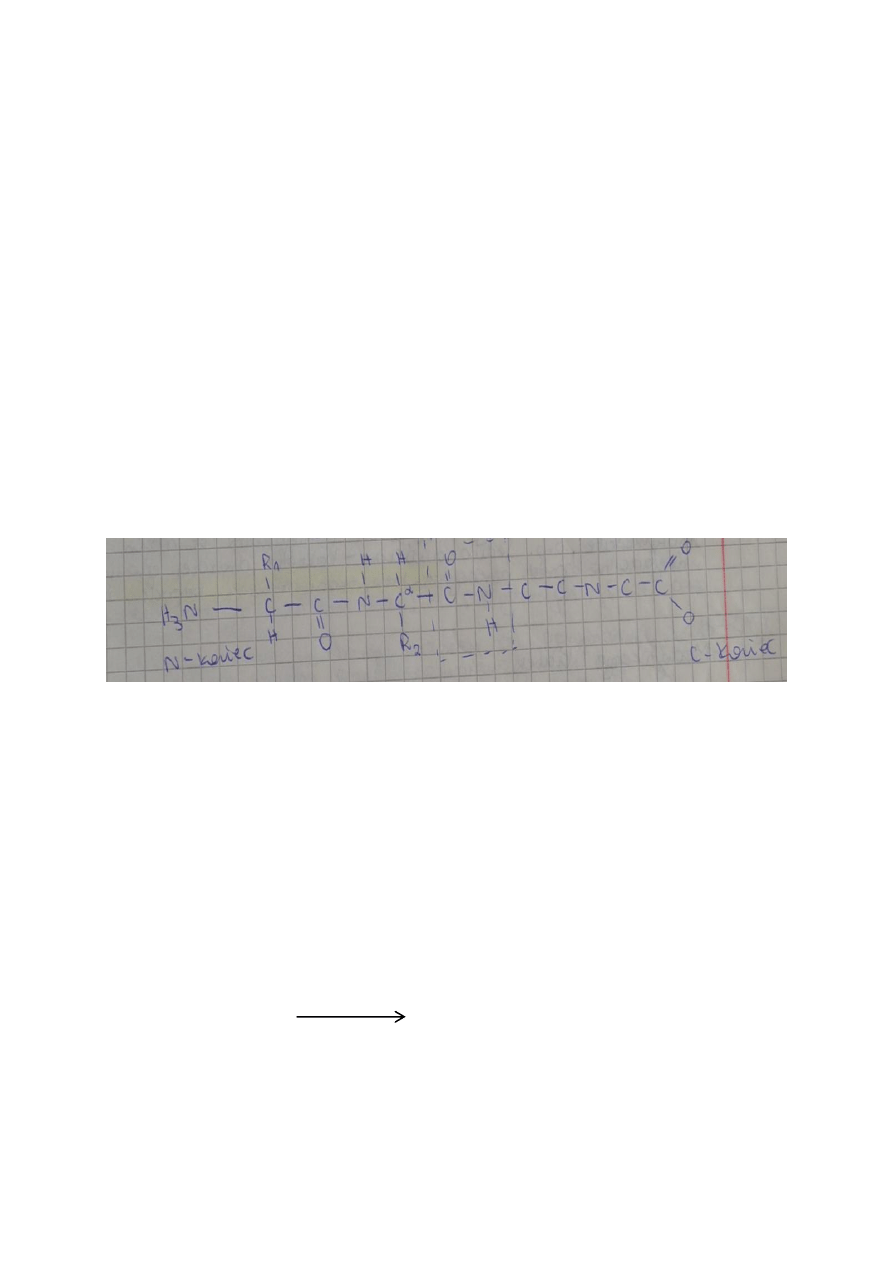
Struktura peptydów i białek
Łańcuch aminokwasów:
H-10 –aligo
10-100 – polip
> 10 – białko
Struktura pierwszorzędowa – sekwencja aminokwasów w łańcuchu peptydowym.
Odmienna ilość i kolejność ułożenia aminokwasów w liniowych łańcuchach
polimerowych – różnorodność trójwymiarowych struktur.
Polimer 100 – aminokwasy
Możliwe są 20
100
różnych sekwencji
Sekwencja środowiskowa Struktura
Sekwencje aminokwasów białka determinują jego strukturę przestrzenną.
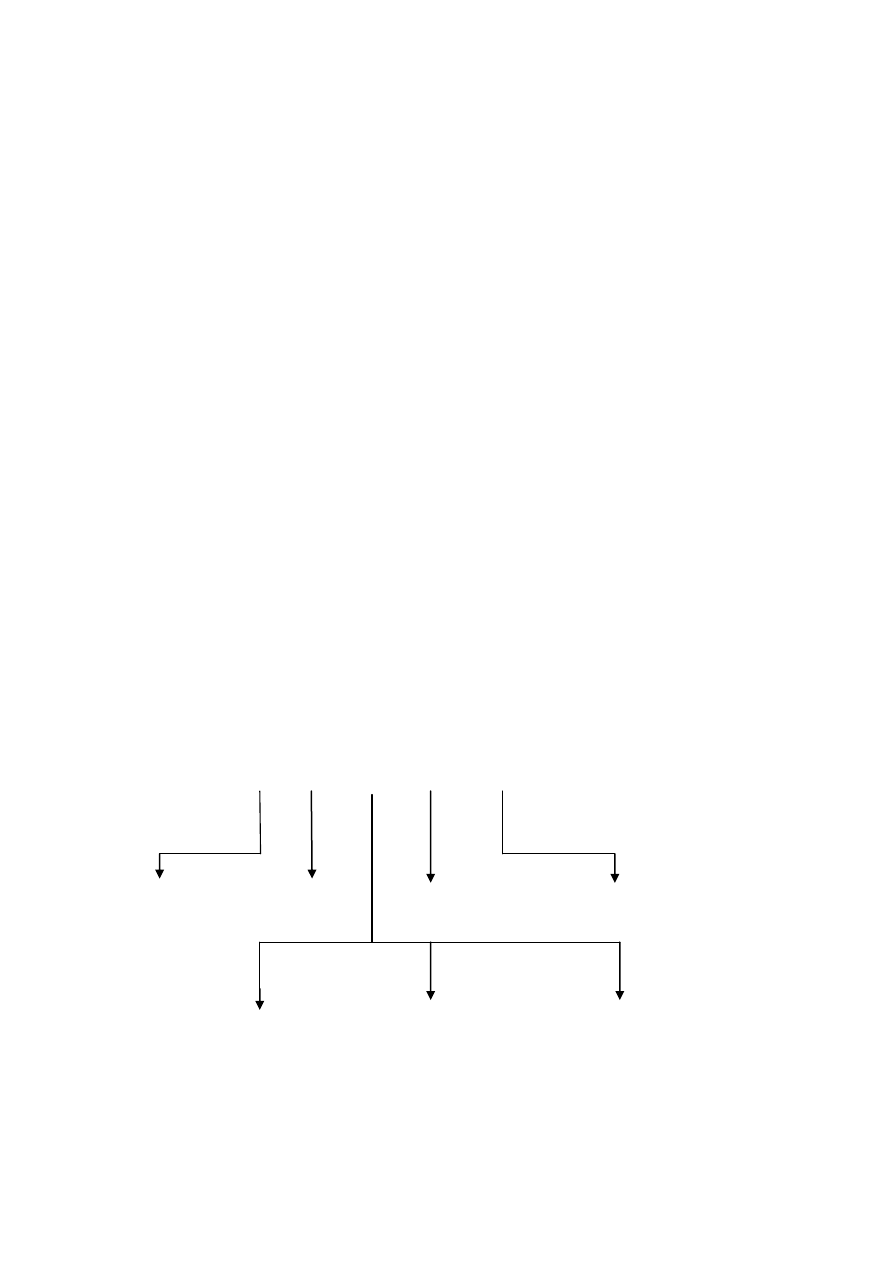
Funkcje białek:
1) Ochronna
2) Hormony
3) Strukturalne
4) Ruchowe
5) Enzymy
6) Transportowe
Białka w żywności:
1) Własności żywieniowe (źródło aminokwasów, biologicznie aktywnych peptydów,
alergenów).
2) Własności funkcjonalne (cechy technologiczne).
Źródła białka:
1. Surowce wysokobiałkowe (nasiona roślin strączkowych, mleko, ryby, białka jajek).
2. Surowce niekonwencjonalne (liście i niejadalne części roślin np. motylkowate,
organizmy jednokomórkowe – bakterie, drożdże, glony, niejadalne produkty
poubojowe – krew, skóry, skrawki, odpady)
MODYFIKACJE BIAŁEK: ENZYMATYCZNE
1) Kierunkowy atak na określone wiązania peptydowe – łatwość kontrolowania
reakcji i minimalna ilość produktów ubocznych.
2) Możliwość zastosowania znacznie łagodniejszych warunków niż w
modyfikacjach chemicznych – nie powoduje rozkładu aminokwasów.
Kierunki enzymatycznej modyfikacji białek
Redukcja alergenów
Modyfikacja
właściwości
funkcjonalnych
Wydzielenie
lub
usuwanie frakcji
Hydrolizaty
Biotiny
Plasteiny
Odgoryczanie

Modyfikacje enzymatyczne:
Hydroliza (łagodna i pełna)
Reakcje sieciowania katalizowane transglutaminazą
Plasteinowanie (produkt o strukturze żelu) – hydroliza + przyłączenie reszty
konkretnych aminokwasów.
Stopień enzymatycznej hydrolizy białka (DH) procentowo definiuje się jako stan
uwolnionego azotu aminowego azotu ogólnego zawartego w hydrolizie.
Aby oznaczyć produkt hydrolizy wykorzystuje się metody pośrednie (np. pomiary pH) i
bezpośrednie (np. przyrost ilości azotu niebiałkowego rozpuszczalnego w 5-10% w kwasie
trichlorooctowym.
Rodzaj enzymu
Endoproteazy
Endopeptydazy + endoproteazy
Hydroliza łagodna (limitowana) – polega na rozszczepieniu pojedynczych (niewielkich
ilości) wiązań peptydowych głównie na powierzchni cząsteczki białka.
Inkubacja mieszaniny w temperaturze niższej od optymalnej (<15-30°C) dla danego
enzymu przez stosunkowo krótki czas (5-30 minut)
Niskie stężenie hydrolizy – od kilku do kilkunastu procent
Stosowanymi enzymami są endopeptydazy – np.
podpuszczka rozszczepia wiązania peptydowe w k-kazeinie (pomiędzy Phe
105 i Met 106) w wyniku czego kazeina ulega przekształceniu w skrzep
Trypsyna i chymotrypsyna o dobrze znanej specyfikacji
Proteazy - papaina, bromelina, ficyna, termolizyna oraz niektóre preparaty
proteolityczne pochodzenia bakteryjnego.
Częściowa hydroliza białek:
Zmniejszenie masy cząsteczkowej
Wzrost dostępności aminokwasów (zmiana równowagi hydrofobowo-
hydrofilowej).
Zmiana własności funkcjonalnych (np. wzrost rozpuszczalności).
Własności funkcjonalne białek – to specyficzne własności, dzięki którym w produktach
żywnościowych poddanych obróbce przy optymalnych parametrach wytworzą się pożądane
cechy sensoryczne – określające wygląd zewnętrzny, tekturę, soczystość oraz barwę żywności

Właściwości funkcjonalne białek – wynikają z oddziaływań z innymi składnikami
żywności:
1) Wodą
2) Innymi białkami
3) Jonami
4) Lipidami
5) Sacharydami
Właściwości funkcjonalne
Rozpuszczalność
Wiązanie wody
Lepkość
Żelowanie
Emulsyjność
Pianotwórczość
Produkty
Napoje
Mięso, wędliny i chleb
Zupy, sosy
Mięso galarety sery
Wędliny zupy ciasta
Kremy, desery biszkopty
Enzymatyczne modyfikacje własności funkcjonalnych
Funkcjonalne właściwości hydrolizatów białek determinuje specyficzność enzymów i
zakres proteolizy (np. dla białek izolatów sojowych optymalna zdolność emulgująca
przy DH ~ 5%)
Czynnikiem krytycznym jest minimalna masa cząsteczkowa uwalnianych peptydów
2 kDa lub 5 kDa (dla białek serwatkowych).
Hydroliza:
1) Poprawienie rozpuszczalności
2) Obniżenie lepkości
3) Poprawa własności powierzchniowych przy umiarkowanej hydrolizie, szcegulnie
białek o upakowanej strukturze (wzrost dostępności aminokwasów hydrofobowych)
4) Pogorszenie właściwości powierzchniowych przy przedłużonej hydrolizie
Poprawa rozpuszczalności:
Częściowe zhydrolizowanie, nierozpuszczalność lub trudna rozpuszczalność białek na
mniejsze fragmenty mające zdolność rozpuszczania się w roztworach wodnych.
Usuwanie hydrofobowych resztek aminokwasów polipeptydowych białkowych
Dołączanie hydrofilowych aminokwasów do łańcucha polipeptydowego
Hydroliza naturalnych osłon pochodzenia białkowego utrudniającego wnikanie
rozpuszczalników do głębiej położonych zespołów białek, np. skarkolemma
otaczająca włókna mięśni

Rozszczepienie naturalnych połączeń białka z innymi składnikami żywności czy
wtórnych biopolimerów powstałych w wyniku interakcji między białkami lub z
innymi substancjami
Hydrofobowość powierzchniowa – właściwość ta wynika z niepolarnych reszt
aminokwasów rozmieszczonych na powierzchni cząsteczki.
Hydrofobowość ogólna białka jest sumą hydrofobowości wszystkich zawartych w nim
aminokwasów – wywiera ona znaczny wpływ na konformację białek.
Hydrofobowość aminokwasów
Aminokwasy niepolarne:
Alifatyczne (Leu, Ile, Val, Ale, Gly )
Aromatyczne (Phe, Tyr, Trp) aminokwasy o niewielkiej polarności związanej z
występowaniem grup niedysocjujących
OH (Ser, Thr)
SH (Cys, Met)
Aminokwasy polarne:
Kwaśne (Asp, Glu)
Zasadowe (Lys, Arg, His)
Obojętny (Asn, Gln)
Zastosowanie procesu hydrolizy enzymatycznej:
W serowarstwie
W produkcji tradycyjnych przetworów sojowych
W browarnictwie – odpowiednia klarowność, pienistość smak piwa
W celu uzyskania pulchności pieczywa
Przyspieszenie dojrzewania mięs (głównie wołowego)
Modyfikacja funkcjonalnych właściwości izolatów białkowych
Hydroliza pełna – degradacja białek możliwie małych fragmentów, głównie aminokwasów i
oligopeptydów
W optymalnych dla danego enzymu wartości inkubacji
Stosowana do otrzymania preparatów aminokwasowych, hydrolizatów białkowych np.
hydrolizaty o ściśle zdefiniowanym profilu peptydowym stosowane w produkcjach
dietetycznych
Hydrolizat – mieszaniny składająca się głównie z poli- i oligopeptydów oraz wolnych
aminokwasów otrzymywane w wyniku hydrolizy enzymatycznej, kwasowej, zasadowej
białek.
Metody otrzymywania hydrolizatów:
Hydroliza enzymatyczna – enzymy proteolityczne hydrolizują wiązania łańcuchowe
peptydowego białka umożliwiając zachowanie wartości biologicznej.
Konieczność stosowania hydrolizy kontrolowanej przy optymalnych parametrach procesu
(czas, temperatura, pH, stosunek E-S)
Autoliza
Hydroliza białek może być prowadzona w systemie:
1) Jednoetapowym – przebieg w sposób ciągły z zastosowaniem preparatów
zawierających mieszaninę endopeptydaz i egzopeptydaz, które daje znacznie wyższy
stopień hydrolizy niż typowe endoprotezy, bez pojawienia się goryczki w
hydrolizatach (powstawanie dużej ilości hydrofobowych peptydów o gorzkim smaku)
Przyjmuje się, że goryczka w hydrolizatach białkowych pojawia się już przy
DH powyżej 10% (ale np. hydrolizat z kazeiny wykazuje goryczkę przy ok.
1% DH)
2) Dwuetapowy – stosowane są różne enzymy –
Najczęściej endoprotezy w pierwszym etapie i egzopeptydazy w drugim (co
pozwala otrzymać hydrolizaty białka prawie całkowicie pozbawione goryczki)
Lub różne pH początkowe w poszczególnych etapach przy tym samym
enzymie
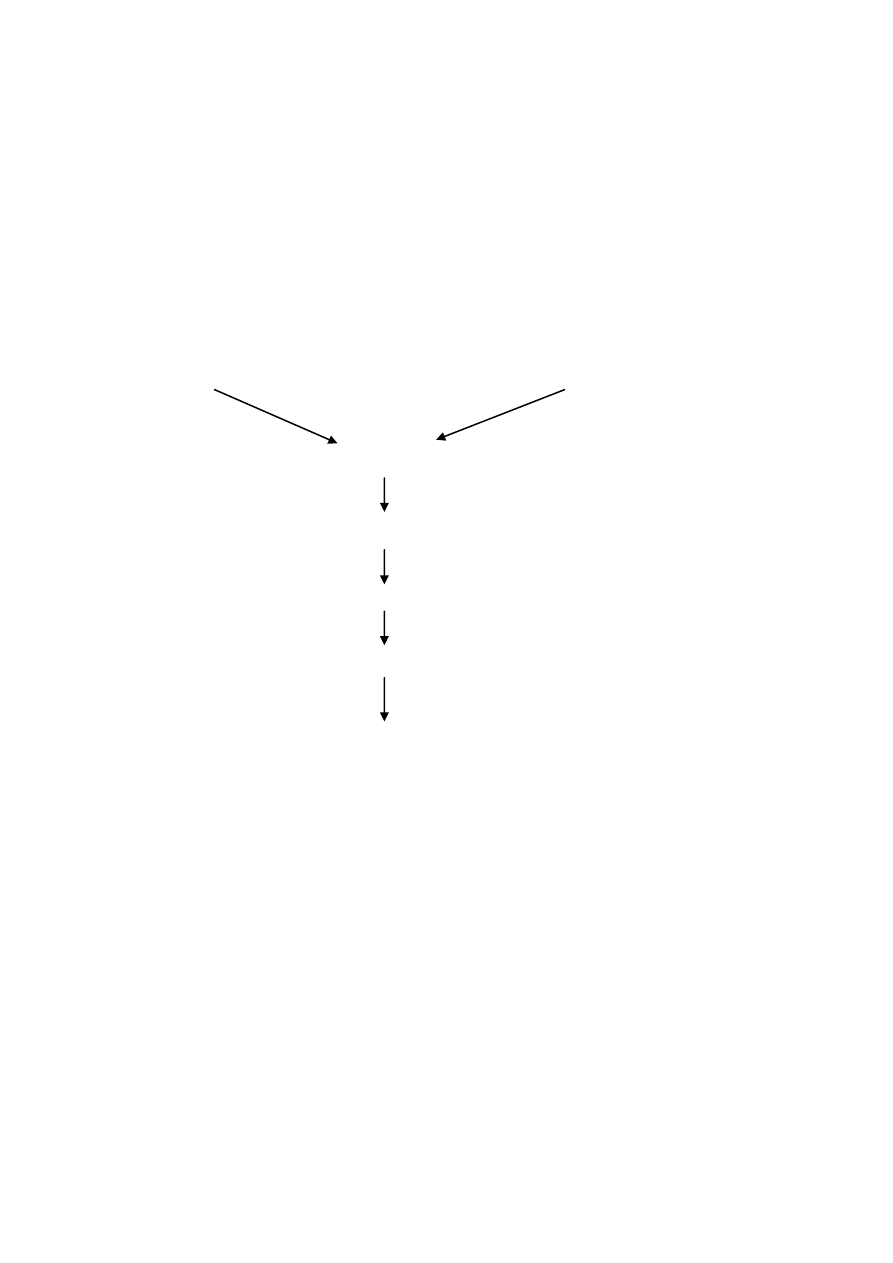
Hydroliza enzymatyczne (odżyw.)
Surowce białkowe
Enzymy – egzo- i endopeptydazy
HYDROLIZA
Inaktywacja enzymatyczne
Ultrafiltracja
Dodatkowe modyfikacje pohydrolityczne
Suszenie

MODYFIKACJE BIAŁEK: CHEMICZNE
1) Hydroliza kwasowa
Wady: rozpad tryptofanu, tyrozyny, cysteiny, powstawanie związków
złożonych (huminy)
Zastosowanie: głownie jako komponenty pożywek mikrobiologicznych, w
przemyśle kosmetycznym
2) Hydroliza alkaliczna:
Wady: rozkład aminokwasów siarkowych: seryna, treonina, racemizacja
aminokwasów z formy L na D oraz utworzenie związków toksycznych, np.
lizynoalaniny
Zastosowanie: głównie jako komponent pożywek mikrobiologicznych
Hydrolizaty przyprawowe
Otrzymuje się je głównie z mąki z nasior roślin strączkowych (soja), kazeiny, albumin
mleka, glutenu
W wyniku hydrolizy kwasowej w temperaturze około 110
o
C w roztworze kwasu
solnego lub siarkowego
Dalsza obróbka, dojrzewanie
Reakcje z sacharydami – preparaty o aromacie gotowanego, pieczonego mięsa
Mogą zawierać chlorowcopochodne lipidów i steroli, w tym rakotwórcze
(3-monochloropropen-1,2-diol, czyli 3-MCPD)
Najwyższy dopuszczalny poziom 3-MCPD (Rozporządzenie WE): hydrolizowane białka
roślinne, sos sojowy – 20 µg/kg)
Modyfikacja enzymatyczne
Wytwarzanie sieciujących wiązań międzycząsteczkowych
Np. transglutaminaza katalizuje reakcję pomiędzy grupą amidową Gln a grupami
aminowymi Lys lub N-końcowym łańcuchami polipeptydowymi:
R-CONH
2
+ H
2
N-R R-CONHR + NH
3
Teksturowanie białek, poprawa wartości odżywczej białek bogatych w Lys (ochrona
podczas obróbki)
Transglutaminazę stosuje się do wspomagania żelowania białek w farszach
wędliniarskich, wiązania kawałków mięsa
Zastosowanie transglutaminazy
Jogurty
Świeże serki
Sery świeże i dojrzewające
Lody
Wzrost tworzenia żelu, spadek synerezy
Wzrost wydajności, spadek synerezy
Wzrost zdolności wiązania wody

Wpływ modyfikacji enzymatycznej na właściwości funkcjonalne białek:
Wiązanie sieciujące:
Wzrost lepkości
Spadek rozpuszczalności (przy daleko posuniętym sieciowaniu)
Silne sieciowanie – tworzenie żelu w temperaturze pokojowej (często o innych
właściwościach reologicznych – żel miękki)
Umiarkowane sieciowanie – spadek zdolności sieciowania (utrudnienie powstawania
naturalnych połączeń międzycząsteczkowych)
Modyfikacje enzymatyczne
Reakcje plasteinowania – enzymatyczne przyłączenie pożądanych aminokwasów do
peptydów hydrolizatu poprzez utwardzanie wiązań peptydowych podczas kilkudniowej
inkubacji. Stężanie hydrolizatu białka z estrami etylowymi wybranych aminokwasów w
obecności odpowiedniej endopeptydazy (przy pH innym niż optymalne dla reakcji hydrolizy)
Reakcja plasteinowania:
Wbudowanie aminokwasów egzogennych w białka i peptydy
Usuwanie niepożądanych aminokwasów przy stosowaniu specjalnej diety np.
fenyloalaniny w przypadku fenyloketonurii
Usuwanie niepoządanych związków zapachowych z surowcow białkowych
Teksturowanie i strukturowanie mechaicznie odkostnionego mięsa
Otrzymywanie bioaktywnych peptydów
Usuwanie gorzkiego smaku z koncentratów białkowych
Białko natywne
Hydrolizat
Endopeptydaza A
Zagęszczanie
Koncentrat oligopeptydów
(30-40%)
Ewentualna zmiana pH
Endopeptydaza B
Plasteina nierozpuszczalna
Etap hydrolizy
Etap resyntezy

Problem gorzkiego smaku hydrolizatów:
Spowodowany obecnością krótkich i średnich peptydów zawierajacych hydrofobowe
reszty aminokwasowe w pozycji C-końcowej łańcuchów peptydowych, zazwyczaj
stanowią 5 – 10% suchej masy hydrolizatu
Gorzkie aminokwasy wolne – aminokwasy hydrofobowe (z wyjątkiem alaniny i
proliny) oraz dwa aminokwasy zasadowe – histydyna i arginina,
Wyczuwalność gorzkiego smaku w aminokwasach hydrofobowych jest znacznie
słabsza nię z odpowiadających im oligopeptydach
Usuwanie gorzkiego smaku hydrolizatów:
Poprzez hydrolizę gorzkich peptydów (aminopeptydazami alkalicznymi lub
obojętnymi peptydazami, karbopeptydazami – najczęściej bakterii i grzybów)
Poprzez resyntezę peptydów za pomocą peptydaz w reakcji plasteinowania
Modyfikacje enzymatyczne:
Biofilmy (powłoki jadalne)
Tworzenie usieciowionej struktury białek serwatkowych (α-la, β-lg lub ich mieszaniny
w proporcji masowej 1:1) w 3-5% roztworze z wytworzeniem wewnątrz- i
międzycząsteczkowych poprzecznych wiązań katalizowane transglutaminazę –
umożliwia otrzymywanie żeli, które po dehydratacji mogą być stosowane jako jadalne
osłonki produktów żywnościowych.
Osłonki są oporne na rozpuszczanie w środowisku o pH 3-8 i na ogrzewanie (w temperaturze
100
o
C przez 10 min po 24h i inkubacji)
Powłoki białek serwatkowych:
Utrudniają migrację wilgoci do produktu (zapobiegają utracie chrupkości przez
chrupki, wafle)
Zapobiegają uwalnianiu się substancji smakowych i zapachowych z produktu do
otoczenia, co może znaleźć zastosowanie przy przechowywaniu owoców i warzyw, do
pakowania wędlin i mięsa
Preparaty białek sojowych:
Dzięki właściwościom żelującym wykorzystywane są jako składniki powłok
jadalnych (o małej przepuszczalności pary wodnej i tlenu) na świeże owoce,
warzywa, gdzie zapewniają im połysk i jędrność, pełnią funkcję naturalnych wosków
roślinnych, które chronią tkanki przed niepożądanymi czynnikami środowiska,
chorobotwórczymi drobnoustrojami, a także ograniczają utratę wody.
Na innych produktach spożywczych pełnią rolę nośników przypraw, barwników i
dodatków – chrponią przed utratą aromatów.

Modyfikacje fizyczne – polegają na dostosowaniu warunków uzyskiwania preparatów białek
w celu poprawy jego czystości (izolacja i frakcjonowanie) lub właściwości jego
komponentów.
Zastosowanie odpowiedniego pH przy frakcjonowaniu białek serwatkowych w celu
uzyskania praparatów wzbogaconych w poszczególne frakcje (selektywne wytrącanie)
Zastosowanie odpowiedniego pH roztworu podczas uzyskiwania preparatu białek w
celu wymuszenia przekształceń konformacyjnych korzystnych dla jego właściwości
powierzchniowych
Ogrzewanie białek w celu częściowej denaturacji i wzrost dostępności aminokwasów
(rozfałdowanie cząsteczek)
Denaturacja białek:
Zniszczenie struktury wyższego rzędu połączone z rozwinięciem łańcucha polipeptydowego i
utratą biologicznej aktywności (np. enzymatycznej).
Wyszukiwarka
Podobne podstrony:
Bialka osocza wyklad id 84800 Nieznany
Biochemia TZ wyklad 5 bialka kon low id 86518
LOGIKA wyklad 5 id 272234 Nieznany
ciagi liczbowe, wyklad id 11661 Nieznany
Badania operacyjne wyklad 2 id Nieznany
historia gospodarcza wyklady id Nieznany
Metodologia nauk spolecznych wyklad id 294758
AF wyklad1 id 52504 Nieznany (2)
Neurologia wyklady id 317505 Nieznany
Finanse miedzynarodowe B Pus wszystkie wyklady id 171643
Biotechnologia w ochronie srodo wyklad 1 5 id 89126
Geologia inzynierska Egzamin Wyklady id 189201
6 11 2013 EGIPT W OKRESIE STA wyklad id 43515 (2)
ZP wyklad1 id 592604 Nieznany
Administracja publiczna wyklady id 51845
Chemia Wyklad 4 id 111675
Filozofia wspolczesna wyklad id 170440
więcej podobnych podstron