GIST
monografia kliniczna

spis treÊci
Wprowadzenie
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
2
Nowotwory podÊcieliskowe przewodu pokarmowego (GIST):
wyodr´bniona jednostka chorobowa. . . . . . . . . . . . . . . . . . . . . . . . 4
Omówienie choroby . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .4
c-Kit: podstawowy marker . . . . . . . . . . . . . . . . . . . . . . . . . . . .5
Ekspresja komórkowa . . . . . . . . . . . . . . . . . . . . . . . . . . . . .5
Budowa i czynnoÊç . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .6
Inne guzy wykazujàce ekspresj´ c-Kit . . . . . . . . . . . . . . . . . . . . .8
Ostateczne rozpoznanie GIST . . . . . . . . . . . . . . . . . . . . . . . . . .9
Epidemiologia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .9
Obraz kliniczny . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .10
Budowa histologiczna GIST . . . . . . . . . . . . . . . . . . . . . . . .11
Badanie immunohistochemiczne GIST . . . . . . . . . . . . . . . . .12
Obrazowanie GIST: metoda PET . . . . . . . . . . . . . . . . . . . . . 14
Czynniki rokownicze i ocena ryzyka . . . . . . . . . . . . . . . . . . . . .15
Mutacje c-kit w patogenezie GIST . . . . . . . . . . . . . . . . . . . . . .17
Ograniczona skutecznoÊç dotychczasowych metod leczenia . . . . .19
Leczenie chirurgiczne . . . . . . . . . . . . . . . . . . . . . . . . . . . .19
Napromienianie/chemioterapia . . . . . . . . . . . . . . . . . . . . . .20

Glivec
®
: skuteczna nowa metoda leczenia GIST . . . . . . . . . . . . . . . 21
Wskazania do leczenia preparatem Glivec
®
w GIST . . . . . . . . . . . 21
Dawkowanie. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 21
Glivec
®
: celowane dzia∏anie na poziomie c-Kit w GIST . . . . . . . . . 21
Mechanizm dzia∏ania . . . . . . . . . . . . . . . . . . . . . . . . . . . . 22
Badania przedkliniczne . . . . . . . . . . . . . . . . . . . . . . . . . . . 23
Badanie klniczne - udowodnienie s∏usznoÊci koncepcji . . . . . . . . . 24
DoÊwiadczenia kliniczne: badania kliniczne
preparatu Glivec
®
w GIST . . . . . . . . . . . . . . . . . . . . . . . . . . . . 26
Faza I badania klinicznego EORTC: STS, ∏àcznie z GIST . . . . . 26
Opis badania klinicznego. . . . . . . . . . . . . . . . . . . . . . . . 26
Wyniki badania klinicznego: bezpieczeƒstwo. . . . . . . . . . . 27
Wyniki badania klinicznego: skutecznoÊç . . . . . . . . . . . . . 27
Wnioski . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 28
Faza II badania klinicznego: okreÊlenie skutecznoÊci . . . . . . . . 28
Opis badania klinicznego. . . . . . . . . . . . . . . . . . . . . . . . 28
Cele badania klinicznego . . . . . . . . . . . . . . . . . . . . . . . . 30
Wyniki badania klinicznego: skutecznoÊç . . . . . . . . . . . . . 31
Wyniki badania klinicznego: bezpieczeƒstwo. . . . . . . . . . . 33
Wnioski . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 35
Faza III badania klinicznego: optymalizacja dawki . . . . . . . . . 36
Badanie miedzyoÊrodkowe EORTC . . . . . . . . . . . . . . . . . 36
Badanie kliniczne w Ameryce Pó∏nocnej . . . . . . . . . . . . . 36
Bezpieczeƒstwo: podstawa wykonywanych badaƒ klinicznych . . . . 37
Farmakokinetyka . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 38
Interakcje leku. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 38
OpornoÊç na Glivec
®
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 40
Protokó∏y badawcze: Glivec
®
w leczeniu innych guzów litych . . . . . . 41
Wnioski
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 42
PiÊmiennictwo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 43

2
Wprowadzenie
Naukowa koncepcja celowanego dzia∏ania na poziomie molekularnym dokonuje
obecnie rewolucji w dziedzinie praktyki medycznej a zw∏aszcza w onkologii
klinicznej. Stosujàc zasad´ celowanego dzia∏ania molekularnego, przemys∏
farmaceutyczny i wy˝sze uczelnie prowadzà badania poszukujàc czàsteczek
(moleku∏) decydujàcych o patogenezie chorób. Badania przesiewowe (skriningi)
ró˝nych zwiàzków chemicznych i ich optymalizacja poprzez naukowe
zaprogramowanie leku pozwalajà wy∏oniç leki kandydujàce, które wykazuja
silnà i specyficznà aktywnoÊç skierowanà przeciwko tym czàsteczkom.
Pierwszym takim naukowo opracowanym lekiem, dzia∏ajàcym w sposób
celowany na poziomie molekularnym, okaza∏ si´ inhibitor kinazy tyrozynowej,
Glivec
®
(imatinib, poprzednio znany jako STI571).
Glivec
®
jest specyficznym, wspó∏zawodniczàcym inhibitorem receptora c-kit
kinazy tyrozynowej, wykazujàcego ekspresj´ w komórkach nowotworowych
i kierujàcego rozwojem nowotworów podÊcieliskowych przewodu pokarmowego
(gastrointestinal stromal tumours – GIST).
1-4
Glivec
®
hamuje równie˝ Bcr-Abl
i receptor p∏ytkopochodnego czynnika wzrostu (platelet-derived growth factor –
PDGF).
Inhibitor kinazy tyrozynowej, Glivec
®
(imatinib,
poprzednio znany jako STI571). jest pierwszym naukowo
opracowanym lekiem, dzia∏ajàcym w sposób celowany
na poziomie molekularnym. Glivec
®
jest specyficznym,
wspó∏zawodniczàcym inhibitorem receptora c-Kit kinazy
tyrozynowej, wykazujàcego ekspresj´ w komórkach
nowotworowych i kierujàcego rozwojem nowotworów
podÊcieliskowych przewodu pokarmowego
(gastrointestinal stromal tumours - GIST).
1-4

3
Wi´kszoÊç GIST (ok. 95%) to nowotwory o wysokim stopniu opornoÊci na
napromienianie i chemioterapi´ systemowà i jedynie zabieg chirurgiczny
mo˝e stanowiç skutecznà metod´ leczenia. 5 Jednak liczne nowotwory tej
grupy sà nieoperacyjne ju˝ w chwili rozpoznania a postaç z∏oÊliwa GIST
przewa˝nie jest nieuleczalna, z medianà prze˝ycia od 10 do 21 miesi´cy,
co sprawia, ˝e jedyna formà leczenia w tej grupie nowotworów pozostaje
chirurgia i chemioterapia o charakterze paliatywnym.
3,5,6
Z tych powodów
leczenie tego schorzenia wymaga∏o zastosowania nowych form terapii.
W oparciu o rewelacyjne wyniki badaƒ klinicznych II fazy, przedstawiono
do rejestracji dokumentacje preparatu Glivec
®
, który zosta∏ przyj´ty przez
Uni´ Europejskà (European Union – EU), Agencj´ d/s ˚ywnoÊci i Leków
(Food and Drug Administration – FDA) w Stanach Zjednoczonych i kilka
innych krajów do leczenia doros∏ych pacjentów z c-kit (CD117) –
pozytywnym, nieoperacyjnym i/lub przerzutowym z∏oÊliwym GIST. W ciàgu
kilku nast´pnych miesi´cy spodziewane jest zarejestrowanie tego leku
w celu leczenia GIST przez wiele innych krajów. Akceptacja preparatu
Glivec
®
nast´puje w Êlad za pierwotnym przyj´ciem tego leku w roku
2001 przez wiele instytucji prawnych na Êwiecie do leczenia chorych
z przewlek∏à bia∏aczkà szpikowà (chronic myeloid leukaemia – CML),
w fazie przewlek∏ej po niepowodzeniu terapii z zastosowaniem interferonu-
alfa (IFN-alpha), w fazie przyspieszenia oraz prze∏omie blastycznym tej
choroby. W CML aktywnoÊç preparatu Glivec
®
polega na zahamowaniu
kinazy tyrozynowej Bcr-Abl.
Monografia ta przedstawia definicj´ GIST, przeglàd patofizjologii tych
nowotworów, z podkreÊleniem roli receptora c-kit kinazy tyrozynowej
i zwraca szczególna uwag´ na precyzyjne rozpoznanie tej choroby.
Przedstawiono naukowe podstawy zastosowania preparatu Glivec
®
w leczeniu GIST, podajàc nast´pnie podsumowanie wyników II fazy
badania klinicznego i kontynuowanej nadal fazy III, ∏àcznie z profilem
bezpieczeƒstwa i farmakokinetyki leku.

4
Nowotwory podÊcieliskowe przewodu
pokarmowego (GIST): wyodr´biona
jednostka chorobowa
Omówienie choroby
Obecna definicja GIST podaje, ˝e sà to c-kit pozytywne guzy mezenchymalne
(podÊcieliskowe lub ∏àcznotkankowe) o charakterystycznych cechach
histopatologicznych, wyst´pujàce w obr´bie przewodu pokarmowego.
7-9
W przesz∏oÊci klasyfikowano GIST jako nowotwory ∏agodne lub z∏oÊliwe,
z przewagà wyst´powania guzów ∏agodnych. Obecnie jednak wielu klinicystów
i patologów sàdzi, ze wszystkie GIST posiadajà przynajmniej cz´Êciowy
potencja∏ z∏oÊliwoÊci.
7
Definicja GIST ewoluowa∏a szybko w ciàgu ostatnich kilku lat w miar´, jak
coraz lepiej poznawano ich patofizjologi´. Guzy rozpoznawane obecnie jako
GIST by∏y w przesz∏oÊci ogromnie trudne do zdefiniowania na podstawie
kryteriów histologicznych i by∏y cz´sto rozpoznawane nieprawid∏owo.
3,7,10
Uprzednio klasyfikowano GIST jako jeden z typów mi´saków tkanek mi´kkich
(soft tissue sarcomas – STS), do których zaliczano guzy wywodzàce si´
z mi´Êniówki g∏adkiej (najcz´Êciej jako mi´sak g∏adkokomórkowy –
leiomyosarcoma, a tak˝e mi´Êniak g∏adkokomorkowy – leiomyoma lub mi´Êniak
g∏adkokomórkowy zarodkowy – leiomyoblastoma) lub listewki nerwowej
(np. schwannoma, czyli os∏oniak nerwowy). Zaakceptowanie c-kit jako
podstawowego markera diagnostycznego pozwolilo na wyjaÊnienie klasyfikacji
tych guzów. Jest jednak mo˝liwe, ˝e cz´Êç GIST jest nadal nierozpoznawana na
skutek utrzymywania si´ wàtpliwoÊci co do w∏aÊciwej definicji tych guzów oraz
braku doÊwiadczenia, które nie pozwala braç pod uwag´ istnienia tej grupy
guzów i przeprowadziç post´powania diagnostycznego.

c-Kit: podstawowy marker
Ekspresja komórkowa
O rozpoznaniu GIST7 decyduje obecnoÊç bia∏ka c-kit (znanego równie˝
jako antygen powierzchniowy CD117 komórki), w po∏àczeniu
z charakterystycznymi cechami histologicznymi c-kit to receptor kinazy
tyrozynowej b∏ony komorkowej, który ∏àczy si´ z czynnikiem wzrostu
nazywanego czynnikiem komórki pnia (stem cell factor – SCF).
11-13
SCF jest tak˝e znany jako czynnik wzrostu mastocytów, czynnik Steela
(Steel factor – SLF) i ligand c-kit (KL). Badanie immunohistochemiczne
(immunohistochemistry- IHC) pozwala wykryç obecnoÊç c-kit
w komórkach i w tkankach za pomocà dost´pnych w handlu przeciwcia∏
anty-c-kit/Cd117.
Tak wi´c rozpoznanie GIST zostaje potwierdzone przez dodatni odczyn
barwienia IHC na obecnoÊç c-kit (Ryc. 1).
7-9
Rycina 1. GIST c-Kit (CD117) -pozytywny.
5
Courtesy of Christopher Corless, MD, PhD.

6
Poczàtkowo opisywano wyst´powanie c-kit w niedojrza∏ych komórkach
krwiotwórczych. Obecnie wiadomo, ˝e ca∏y szereg komórek wykazuje ekspresj´
c-kit zarówno w okresie rozwoju zarodkowego, jak te˝ ˝ycia doros∏ego.
14,15
Nale˝à do nich macierzyste i prekursorowe komórki krwiotwórcze, komórki
tuczne (mastocyty), melanocyty i komórki zarodkowe. Istotne jest wyst´powanie
c-kit w komórkach podÊcieliskowych przewodu pokarmowego, znanych jako
komórki Êródmià˝szowe Cajala (interstitial Cajal cells – ICCs). ICC dzia∏ajà jako
komórki rozrusznikowe przewodu pokarmowego i regulujà perystaltyk´ jelit.
16
Obecnie sugeruje si´, ˝e ICC albo ich prekursorowa macierzysta komórka
mezenchymalna to komórki, z których powstajà GIST.
17,18
Z tego powodu GIST
mogà byç niekiedy nazywane guzami komórek rozrusznikowych przewodu
pokarmowego (gastrointestinal pacemaker cell tumour – GIPACT).
10
Budowa i czynnoÊç
Proteina c-kit nale˝y do rodziny receptorów kinazy tyrozynowej (receptor
tyrosine kinase – RTK), którà tworzy kilka receptorów b∏ony komorkowej
o charakterze czynnika wzrostu, ∏àcznie z receptorem PDGF (Ryc. 1).
Receptory tej grupy posiadajà kilka wspólnych cech charakterystycznych
w zakresie zarówno domen pozakomórkowych, jak te˝ wewnàtrzkomórkowych,
ale istniejà mi´dzy nimi tak˝e istotne ró˝nice. Receptory c-kit i PDGF posiadajà
wspólne cechy wyró˝niajàce je od innych receptorów du˝ej rodziny RTK18;
posiadajà one domeny kinazy o cechach charakterystycznych dla
wewnàtrzkomórkowej nie-receptorowej kinazy tyrozynowej, jak Abl i po∏àczona
onkoproteina Bcr-Abl, (zaburzenie uznane za przyczyn´ CML).
18
Podobieƒstwa
w zakresie domen tych kinaz tyrozynowych sà podstawà wybiórczoÊci
terapeutycznej preparatu Glivec
®
, który w sposób intensywny i specyficzny
hamuje c-kit, receptor PDGF, Abl i Bcr-Abl.
1,19
Podobieƒstwa w zakresie domen tych kinaz tyrozynowych sà
podstawà wybiórczoÊci terapeutycznej preparatu Glivec
®
, który
w sposób intensywny i specyficzny hamuje c-Kit, receptor
PDGF, Abl i Bcr-Abl.
1,19
7
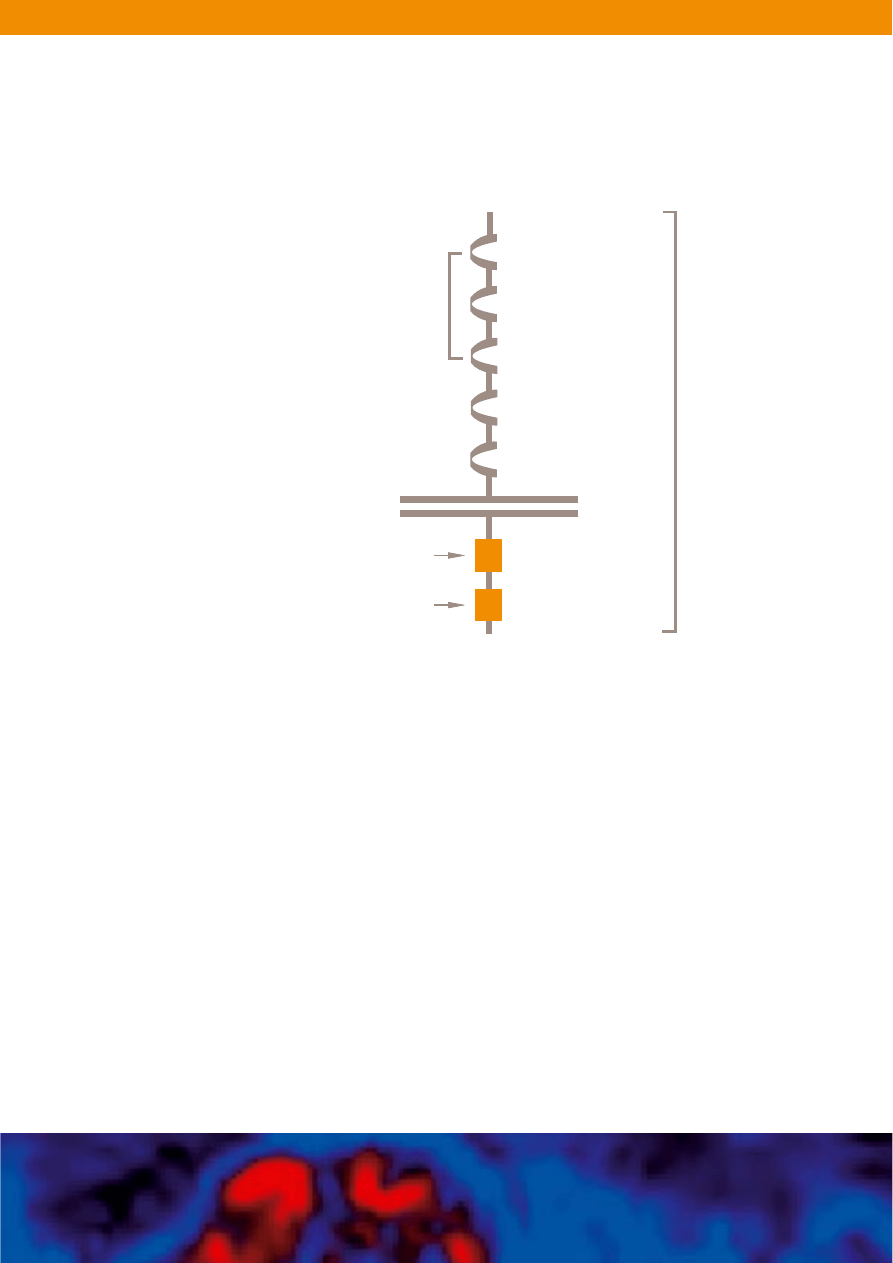
Rycina 2. Schemat budowy c-Kit kinazy tyrozynowej. Domena pozakomorkowa
receptora c-Kit ∏àczy si´ z ligandem SCF. AktywnoÊç kinazy tyrozynowej jest zwiàzana
z domenà wewnàtrzkomórkowà proteiny, miejscem, gdzie Glivec
®
wià˝e si´ z c-Kit.
Do zainicjowania kaskad sygna∏owych przez c-kit dochodzi na powierzchni
komórki w nast´pstwie przy∏àczenia ligandu SCF. Po∏àczenie z ligandem
wywo∏uje dimeryzacj´ 2 sàsiednich czàsteczek c-kit, auto-fosforylacj´
i jego aktywacj´ (Ryc. 2). Uaktywniony c-kit wyzwala reakcje sygna∏owe
w komórce przekazywane poprzez drogi wewnàtrzkomórkowego
przekazywania sygna∏u (Ryc. 3). Jak w przypadku wiekszoÊci RTK
czynnika wzrostu, przekazywaniu sygna∏ów za poÊrednictwem c-kit
przypisuje si´ liczne procesy fizjologiczne. Zalicza si´ do nich prze˝ywanie
komórki, proliferacj´, ró˝nicowanie, przyleganie (adhezj´) komórek,
czynnoÊci takie, jak chemotaksja i wydzielanie oraz apoptoz´
(zaprogramowanà Êmierç komórki).
20
Ponadto czynnoÊç c-kit jest
niezb´dna dla prawid∏owej hematopoezy, melanogenezy oraz rozwoju
i prawid∏owego funkcjonowania komórek tucznych w wielu tkankach
a tak˝e dojrzewania komórek ICCs w jelitach.
Cz´Êç
pozakomórkowa
c-Kit
receptor
Cz´Êç
wewnàtrzkomórkowa
B∏ona
komórkowa
Domena katalityczna
kinazy tyrozynowej
Miejsce wià˝àce
ligand (SCF)
Domena kinazy
z miejscem wià˝àcym ATP
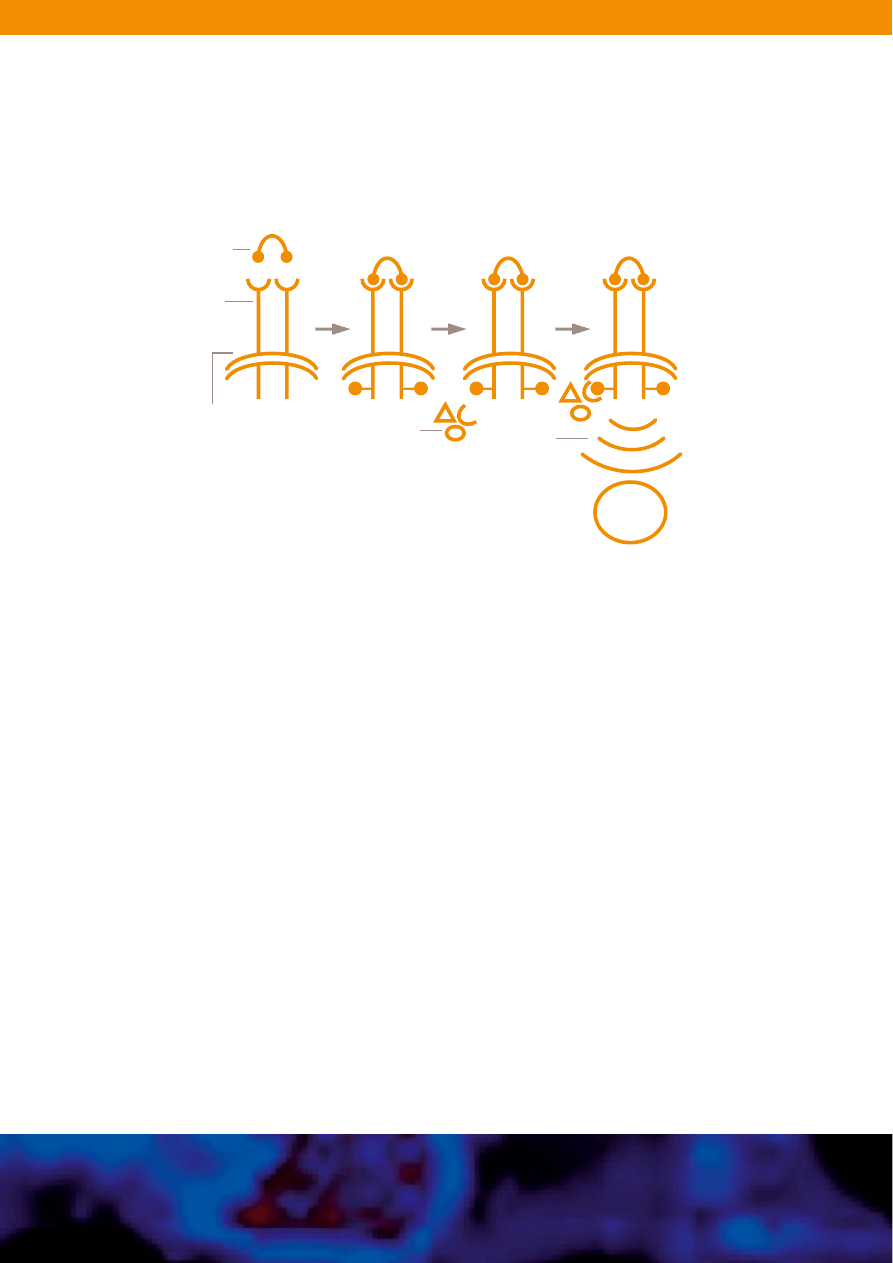
8
Rycina 3. Przekazywanie sygna∏ów przez c-Kit. Przy∏àczenie ligandu SCF do receptora c-Kit
kinazy tyrozynowej wywo∏uje dimeryzacj´ receptora, autofosforylacj´ i jego aktywacj´.
Przy∏àczenie innych protein sygna∏owych w kompleks sygna∏owy inicjuje przekazywanie
kaskad sygna∏owych, których koƒcowe etapy realizowane sà w cz´Êci w jàdrze komórkowym.
Inne guzy wykazujace ekspresj´ c-Kit
Ekspresja c-kit nie jest wy∏àcznà cechà GIST i zosta∏a udokumentowana
badaniem immunohistochemicznym równie˝ w wielu innych guzach litych,
stanowiàcych transformacj´ fenotypowà ich prawid∏owych, c-kit-pozytywnych
odpowiedników komórkowych. Nale˝y zaliczyç do nich guzy z komórek
tucznych (mastocyty), czerniaki (melanocyty), nowotwory jàder (nasieniak),
podgrup´ raków piersi (komórki nab∏onkowe prawid∏owych przewodów
mlecznych sutka) i niektóre przypadki ostrej bia∏aczki szpikowej (macierzyste
komórki szpiku).
4,15,21-23
Rola c-kit w patogenezie tych nowotworów z∏osliwych
nie zosta∏a okreÊlona.
SCF
Receptor
c-Kit
Powierzchnia
komórki
Kompleks
sygna∏owy
Przekazywanie
kaskad
sygna∏owych
Jàdro
komórkowe
Cz´Êç
wewnàtrzkomórkowa
Cz´Êç
pozakomórkowa
P
P
P
P
P
P

9
Dla innych guzów c-kit-pozytywnych, w których komórki nowotworowe
wykazujà ekspresj´ tego receptora, prawid∏owe odpowiedniki komórkowe
nie sà znane. Uwa˝a si´, ˝e ekspresja c-kit w tej grupie guzów jest
nieprawid∏owa, a przyczyna tego nie jest znana. Przyk∏ady tych guzów
obejmujà podgrup´ mi´saków tkanek mi´kkich STS (jak maziówczak
z∏oÊliwy, z∏oÊliwy fibrohistiocytoma i mi´sak Ewinga) a tak˝e glejaki,
∏agodne os∏oniaki nerwowe, nerwiaki zarodkowe wspó∏czulne
(neuroblastoma), drobnokomórkowe raki p∏uca (small-cell lung cancer –
SCLC), raki jajnika i raki jelita grubego.
4,15,24,25
Ekspresja c-kit czyni te
guzy potencjalnym celem dzia∏ania leczniczego preparatu Glivec
®
. Wa˝na
jest tutaj nie tylko ekspresja c-kit, ale wytworzona aktywacja. Znane sà
dwie g∏ówne drogi aktywacji: aktywacja wewnàtrzpochodna (np. droga
mutacji, jak w guzach z komórek tucznych, niektórych guzach
zarodkowych i AML) oraz aktywacja zewnàtrzpochodna (np. przez
pobudzenie SCF, jak w SCLC i neuroblastoma). Ostatecznie jednak
dzia∏anie leku Glivec
®
dotyczyç b´dzie jedynie tych guzów, w których c-kit
lub inne wra˝liwe na Glivec
®
kinazy odgrywajà podstawowà rol´ w ich
patogenezie.
Ostateczne rozpoznanie GIST
Epidemiologia
Brak ogólnie przyj´tych podstaw diagnostycznych dla GIST prowadzi∏ do
wahaƒ w ocenie cz´stoÊci wyst´powania tej choroby. W rzeczywistoÊci
publikowane szacunkowe liczby mogà byç niskie, poniewa˝ wiele guzów
zakwalifikowanych obecnie jako GIST, grupowano dawniej ∏àcznie z innymi
guzami przewodu pokarmowego. Dzi´ki wi´kszej precyzji w rozpoznawaniu
GIST przysz∏e oceny stanà si´ bardziej wiarygodne i wyka˝à prawdziwà
(wy˝szà w stosunku do wartoÊci obecnej) zapadalnoÊç na t´ chorob´.
Dzi´ki wi´kszej precyzji w rozpoznawaniu GIST przysz∏e oceny
stanà si´ bardziej wiarygodne i wyka˝à prawdziwà (wy˝szà
w stosunku do wartoÊci obecnej) zapadalnoÊç na t´ chorob´.

10
GIST to nowotwory wyst´pujàce stosunkowo rzadko, które stanowià <1%
wszystkich pierwotnych guzów przewodu pokarmowego. Tym nie mniej,
zgodnie z obecnà definicjà tych nowotworów (ekspresja c-kit/CD117), sà to
najcz´stsze nowotwory z∏oÊliwe przewodu pokarmowego wywodzàce si´
z tkanki mezenchymalnej (∏àcznej). ZapadalnoÊç na t´ chorob´ wydaje si´ byç
jednakowa niezale˝nie od regionu geograficznego czy rasy populacji i dotyczy
w równym stopniu m´˝czyzn i kobiet. GIST to nowotwory z∏oÊliwe rozwijajàce
si´ przewa˝nie w piàtej do siódmej dekadzie ˝ycia, rzadko zaÊ przed 40 rokiem
˝ycia.
3,4,9
¸àczne wystepowanie GIST jest trudne do oceny, bioràc pod uwag´ zarówno
pacjentów z prawid∏owo obecnie rozpoznawanà chorobà (pacjenci z pozytywnà
ekspresjà c-kit) jak te˝ pacjentów dawnych i z nieprawid∏owym rozpoznaniem.
Pos∏ugujàc si´ danymi rocznej zapadalnoÊci i danymi odnoÊnie prze˝ywalnoÊci,
nale˝y ca∏kowità zapadalnoÊç na Êwiecie oceniç na 20.000 do >50.000.26
Obraz kliniczny
Objawy w GIST ró˝nià si´ w zale˝noÊci od lokalizacji guza, szybkoÊci wzrostu
i rozmiarów. WielkoÊç GIST waha si´ od kilku milimetrów do >40
centymetrów. Najcz´stszym objawem klinicznym wystepujàcym u 50% do 70%
pacjentów jest stwierdzenie guza przy badaniu jamy brzusznej, któremu mogà
towarzyszyç nieokreÊlone bóle brzucha lub uczucie dyskomfortu. Drugi
najcz´stszy objaw choroby to krwawienie z przewodu pokarmowego, które
wyst´puje w przybli˝eniu u jednej trzeciej chorych. Mniej charakterystyczne
objawy i dolegliwoÊci, jak brak ∏aknienia, utrata masy cia∏a, nudnoÊci,
niedro˝noÊç jelitowa czy ˝ó∏taczka zastoinowa wyst´pujà rzadziej.
4,8,9
Wiele mniejszych guzów rozwija si´ bezobjawowo i sà one wówczas wykrywane
przypadkowo w czasie zabiegu chirurgicznego lub innych procedur. Tak wi´c
przebieg wielu GIST jest „niemy” klinicznie, dopóki nie dojdzie do krwawienia
lub p´kni´cia guza.

GIST mogà wystàpiç w ka˝dym miejscu przewodu pokarmowego.
Najcz´stszà lokalizacjà pierwotnego guza jest ˝o∏àdek i jelito cienkie,
stanowiàc odpowiednio 60% do 70% i 30% wszystkich nowotworów tej
grupy. Inne umiejscowienie GIST to prze∏yk, sieç, krezka, okr´˝nica
i odbytnica. Oko∏o 30% GIST ma charakter „z∏oÊliwy” – pod postacià
przerzutów lub rozleg∏ego naciekania przy pierwszym zg∏oszeniu si´
pacjenta (patrz Czynniki rokownicze w dyskusji o z∏oÊliwoÊci guzów).
Przerzuty GIST wyst´pujà przewa˝nie w obr´bie jamy brzusznej, zajmujàc
zazwyczaj wàtrob´ i rzadko naciekajàc w´z∏y ch∏onne.
4,8,9
Budowa histologiczna GIST
Ró˝na budowa histologiczna GIST by∏a niewàtpliwie w przesz∏oÊci
przyczynà wàtpliwoÊci diagnostycznych. Badanie histologiczne GIST
przeprowadza si´ na materiale pobranym drogà aspiracji ig∏owej lub
wycinkach guza usuni´tego w czasie resekcji chirurgicznej. Utrwalone
próbki tkanek bada si´ w pracowni histopatologicznej w mikroskopie
Êwietlnym po podzieleniu materia∏u na skrawki i wykonaniu podstawowego
barwienia za pomocà hematoksyliny i eozyny (H&E). GIST wyst´puje
w kilku postaciach morfologicznych. Komórki guza mogà przypominaç
kilka ró˝nych typów komórek, jak komórki mezenchymalne (tkanki
∏àcznej), nerwowe i komórki mi´Êni g∏adkich. Komórki guza mogà mieç
kszta∏t „wrzecionowaty” (wyd∏u˝ony) lub, rzadziej, „epitelioidny”
(wielokàtny, nab∏onkowopodobny) albo przedstawiaç mieszany fenotyp
komórkowy (Ryc. 4A, 4B).
9,10
11
Oko∏o 30% GIST ma charakter „z∏oÊliwy“ - pod postacià
przerzutów lub rozleg∏ego naciekania przy pierwszym zg∏oszeniu
si´ pacjenta.
12
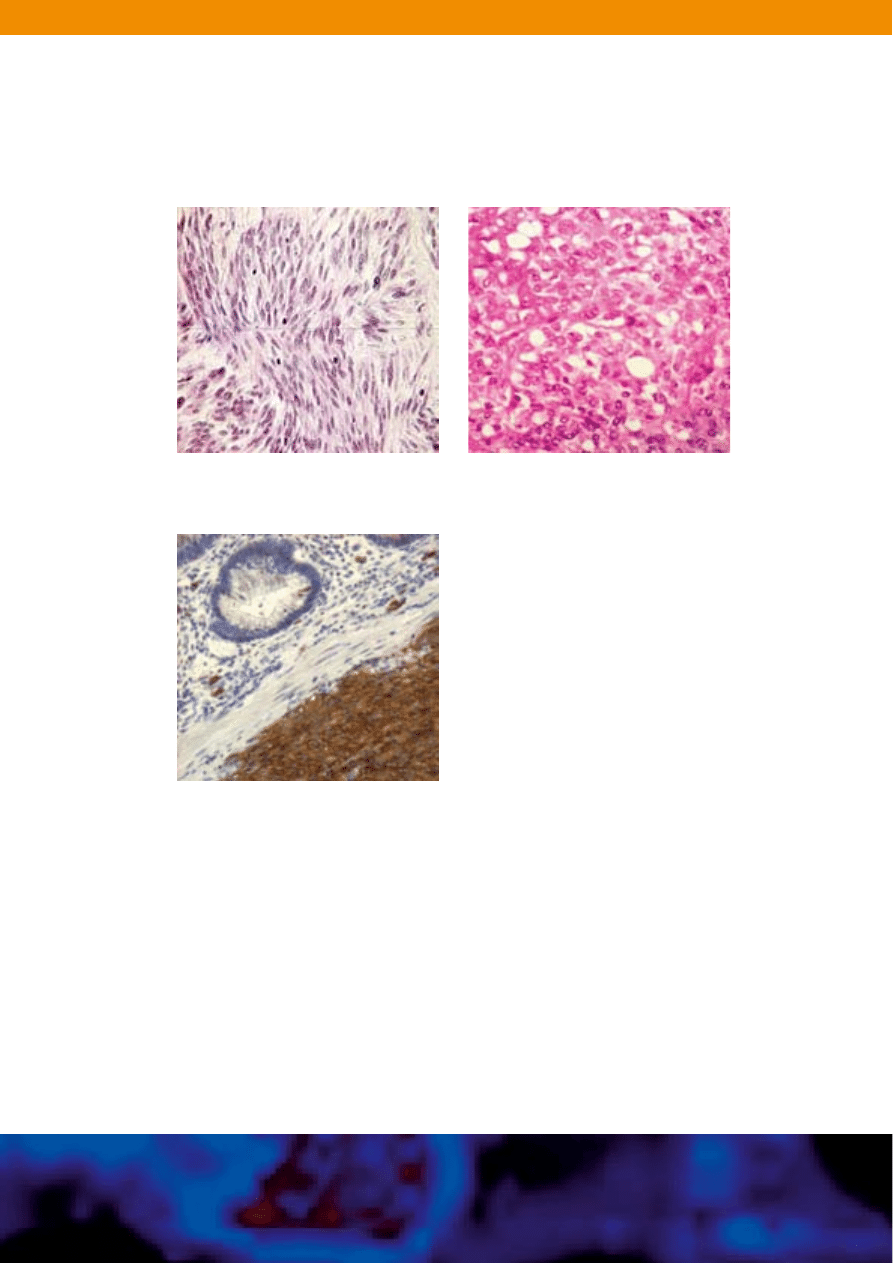
Rycina 4. Histologia i IHC GIST. Guz mo˝e mieç budow´ „wrzecionowatokomórkowà” (A)
i/lub „nab∏onkowokomórkowà (B) (H&E). Barwienie immunohistochemiczne GIST
(CD117/c-Kit) wykazuje rozlane, silnie dodatnie zabarwienie cytoplazmy wykazujàce
obecnoÊç proteiny c-Kit.
Badanie immunohistochemiczne GIST
Uzgodniony obecnie poglàd wielu patologów mówi o koniecznoÊci wykonywania
barwienia IHC dla wykazania ekspresji c-kit (CD117) w celu uzyskania
prawid∏owego rozpoznania GIST.
7
Zaleca si´, ˝eby barwienie na obecnoÊç c-kit
wykonywano w przypadku wszystkich wewnàtrzbrzusznych, mi´sakopodobnych
guzów. JeÊli badania tego nie mo˝na wykonaç w oÊrodku, gdzie
przeprowadzono biopsj´ lub zabieg chirurgiczny, nale˝y zwróciç si´ do
odpowiedniego laboratorium referencyjnego.
B. Komórki nab∏onkowe GIST.
Photomicrographs courtesy of Christopher Corless, MD, PhD.
Courtesy of Dako Corporation. Polyclonal antibody (rabbit) A4502.
C. IHC (CD117/c-Kit) GIST.
A. Komórki GIST o kszta∏cie wrzecionowatym.

13
Barwienie IHC wykonuje si´ typowo na skrawkach tkanki guza uzyskanych z bloczków po
utrwaleniu materia∏u w parafinie. Badanie mo˝na równie˝ wykonaç na skrawkach tkanki
zamro˝onej, jeÊli konieczne jest uzyskanie szybkiego rozpoznania (np. badanie doraêne
potrzebne do podj´cia decyzji w czasie operacji). Protokó∏y do wykonania barwienia IHC
za pomocà przeciwcia∏ c-kit/CD117 sà dost´pne u dostawców handlowych tych
przeciwcia∏. W czasie resekcji guza pobiera si´ równie˝ rutynowo materia∏ do badania
zawierajàcy prawid∏owà Êluzówk´ jelita, dzi´ki czemu c-kit pozytywne komórki tuczne
Êluzówki mogà s∏u˝yç jako wewn´trzna kontrola dodatnia. Barwienie c-kit/CD117 jest
dodatnie w wi´kszoÊci komórek GIST, dajàc silny, rozlany odczyn w cytoplazmie (Ryc. 4C).
4,7
W diagnostyce ró˝nicowej GIST po˝yteczne sà równie˝ inne markery
antygenowe. Chocia˝ nie posiadajà one tak zasadniczego znaczenia jak
CD117, sà jednak pomocne w rozpoznawaniu GIST. Zalicza si´ do nich
nast´pujàce markery
4,8,10,24
:
l
CD34 – jest to marker towarzyszàcy najcz´Êciej komórkom
krwiotwórczym i komórkom Êródb∏onka naczyƒ. Jest on dodatni w 60%
do 70% komórek GIST, ale poniewa˝ wiele guzów wykazuje ekspresj´
tego antygenu, jest on w ma∏ym stopniu specyficzny dla GIST.
l
Aktyna g∏adko-mi´Êniowa (smooth-muscle actin – SMA) i desmina – sà
to 2 proteiny wyst´pujàce w komórkach mi´Êni g∏adkich (np. w mi´saku
g∏adkokomórkowym – leiomyosarcoma, który jest c-kit negatywny), ale
przewa˝nie nie znajduje si´ ich w GIST. Dlatego barwienie z c-
kit/CD117, desminà i SMA pomaga w ró˝nicowaniu mi´dzy mi´sakami
g∏adko-komórkowymi a prawdziwymi GIST, wykazujàcymi podobieƒstwo
lub ró˝nicowanie w kierunku „mi´Êniówki g∏adkiej”.
l
S-100 – jest to proteina wyst´pujàca w guzach wywodzàcych si´
z listewki nerwowej (jak w schwannoma – os∏oniaku nerwowym), ale nie
wyst´puje w prawdziwych GIST, wykazujacych podobieƒstwo do guzów
pochodzenia nerwowego.
l
Ki67 – jest to bia∏ko jàdra komórkowego, b´dàce markerem proliferacji
komórkowej, które mo˝e zwi´kszaç si´ w szybko dzielàcych si´
komórkach raka. Barwienie na obecnoÊç Ki67 mo˝na w∏àczyç do
poczatkowego zestawu IHC do rozpoznawania GIST, aby ustaliç
podstawowy poziom ekspresji Ki67, co mo˝e byç pomocne w obserwacj
progresji i monitorowaniu procesu nowotworowego.

14
W podsumowaniu bie˝àcych opinii przyjmuje si´, ˝e typowy GIST wykazuje
ekspresj´ c-kit i cz´sto CD34, ale rzadko SMA. DoÊwiadczony patolog powinien
oceniç wszystkie dane histologiczne i kliniczne w celu dok∏adnego rozpoznania
GIST. Kiedy dane histologiczne i objawy kliniczne guza przewodu pokarmowego
wskazujà na GIST, pozytywny odczyn barwienia na c-kit/CD117 potwierdza
rozpoznanie.
7
Obrazowanie GIST metodà PET
Do obrazowania pierwotnych GIST i ognisk przerzutowych s∏u˝y kilka technik
radiologicznych. Zalicza si´ do nich seryjne zdj´cia rtg z zastosowaniem barytu
i podwójnego kontrastu, ultrasonografi´ endoskopowà, tomografi´ komputerowà
(CT) i rezonans magnetyczny (MRI).
9
Wprowadzona ostatnio pozytronowa
emisyjna tomografia (positron-emission tomography – PET) okaza∏a si´
u˝ytecznà, nieinwazyjnà metodà s∏u˝àcà do monitorowania leczenia GIST.
28,29
Technologia PET wykorzystuje znacznik metaboliczny 18F- fluorodezoksyglukoz´
(FDG) dla oceny aktywnoÊci metabolicznej nowotworów. Guzy charakteryzujàce
si´ wy˝szym metabolizmem wykazujà zwi´kszone wychwytywanie
i zatrzymywanie znacznika FDG w porównaniu z otaczajàcymi tkankami
prawid∏owymi. Wydaje si´, ˝e
18
FDG-PET jest bardziej czu∏a ni˝ MRI
w wykrywaniu drobnych przerzutów GIST i monitorowaniu odpowiedzi procesu
chorobowego na leczenie. 30 W czasie pozytywnej odpowiedzi na leczenie,
GIST mogà wykazywaç zmniejszenie metabolizmu ale jednoczeÊnie przejÊciowe
powi´kszenie rozmiarów guza, zanim nastàpi regresja i Êmierç komórek
nowotworowych.. Dlatego PET mo˝e zapobiegaç nieprawid∏owej interpretacji
odpowiedzi na leczenie dokonywanej w oparciu jedynie o rozmiary guza.
JednoczeÊnie nale˝y braç tak˝e pod uwag´ mo˝liwoÊç zwi´kszonego wychwytu
FDG przez komórki uk∏adu immunologicznego towarzyszàce zmianom
nowotworowym (np. przy zmianach zapalnych).
Kiedy dane histologiczne i objawy kliniczne guza przewodu
pokarmowego wskazujà na GIST, pozytywny odczyn barwienia
na c-Kit/CD117 potwierdza rozpoznanie.
7

15
Chocia˝ PET jest bardzo dobrym narz´dziem badawczym, które mo˝e byç
zastosowane w ocenie odpowiedzi na leczenie preparatem Glivec
®
, nie jest
ono dost´pne w wielu oÊrodkach. Z powodu trudnoÊci w ocenie STS za
pomocà standardowych metod radiologciznych, nale˝y zach´caç lekarzy do
wnikliwej oceny standardowych zdj´ç uzyskanych metodà CT lub MRI,
∏àcznie z pomiarami g´stoÊci guza.
Czynniki rokownicze i ocena ryzyka
W chwili pierwotnego rozpoznania oko∏o 25% do 30% GIST ma charakter
zdecydowanie z∏oÊliwy. Podstawà takiej oceny jest obecnoÊç przerzutów
i/lub naciekanie sàsiednich narzàdów lub tkanek. Pozosta∏à cz´Êç GIST
nale˝y rozpatrywaç jako guzy, które mogà wykazywaç z∏oÊliwy przebieg
i dlatego okreÊla si´ je jako guzy o „niepewnym potencjale z∏oÊliwoÊci”.
Cz´sto bardzo trudno jest przewidzieç przebieg kliniczny GIST a poniewa˝
wielu patologów sàdzi, ˝e ˝aden GIST nie jest w rzeczywistoÊci ∏agodny,
termin „∏agodny” w przeciwstawieniu do „z∏oÊliwego” zast´puje si´
bardziej u˝ytecznym okreÊleniem guza o „niskim ryzyku”
w przeciwstawieniu do „wysokiego ryzyka” oraz o „niepewnym potencjale
z∏oÊliwoÊci”. Przewidywanie prawdopodobieƒstwa z∏oÊliwego przebiegu
GIST jest trudne, ale istniejà pewne czynniki, które mogà pomóc w ocenie
tego ryzyka.
Kilka cech histologicznych u˝ywanych dawniej jako wskaêniki rokownicze
obejmowa∏y bogate utkanie komórkowe guza (ca∏kowita liczba komórek),
obecnoÊç martwicy (Êmierç komórek), obecnoÊç torbieli, atypowy wyglàd
jàder komórkowych i stopieƒ unaczynienia guza. 8,9 W opracowaniu
patologów, sponsorowanym przez Narodowy Instytut Raka w USA
podwa˝ono je jako niezale˝ne czynniki w okreÊlaniu z∏oÊliwoÊci
Cz´sto bardzo trudno jest przewidzieç przebieg kliniczny GIST
a poniewa˝ wielu patologów sàdzi, ˝e ˝aden GIST
nie jest w rzeczywistoÊci ∏agodny, termin „∏agodny”
w przeciwstawieniu do „z∏oÊliwego” zast´puje si´
bardziej u˝ytecznym okreÊleniem guza o „niskim ryzyku”
w przeciwstawieniu do „wysokiego ryzyka” oraz o „niepewnym
potencjale z∏oÊliwoÊci”.

16
stwierdzajàc dalej, ˝e intensywnoÊç barwienia na obecnoÊç c-kit/CD117 nie
Êwiadczy o wzgl´dnym ryzyku w GIST. 7 Czynniki rokownicze u˝ywane obecnie
do oceny potencja∏u z∏oÊliwoÊci GIST przedstawiono w tabeli 1.
Tabela 1. Czynniki rokownicze w ocenie potencja∏u z∏oÊliwoÊci GIST
9
Ryzyko z∏osliwoÊci
Niskie Wysokie
WielkoÊç guza
<5cm
>5 cm
Liczba komórek
Ma∏a
Du˝a
Martwica
Brak/minimalna
Mo˝e byç wydatna
Mitozy
<5 na 50 HPF
>5 na 50 HPF
Typ wzrostu
Bez naciekania
Mo˝e naciekaç otaczajàce tkanki
Mutacje c-kit
Nieobecne
Cz´sto obecne
HPF - high-powered field (pole du˝ego powi´kszenia w mikroskopie), 400x
Uwa˝a si´ obecnie, ˝e wielkoÊç guza jest istotnym czynnikiem rokowniczym.
Guzy o niskim lub nieznanym potencjale z∏oÊliwoÊci stanowià oko∏o 70%
wszystkich GIST i sà najcz´Êciej rozpoznawane przypadkowo w czasie
operacji.4 Guzy te sà zazwyczaj ma∏e, o najwi´kszej Êrednicy przewa˝nie <5
cm; jednak cz´Êç klinicystów wymaga dla GIST o niskim ryzyku jeszcze ni˝szej
granicy, t.j. <2 cm Êrednicy. Przy stosowaniu tego surowego kryterium guzy
GIST o rozmiarach mi´dzy 2 cm a 5 cm znalaz∏yby si´ w t.zw. „szarej strefie“.
Dodatkowo guzy te najcz´Êciej wykazujà ni˝szy odsetek dzielàcych si´
komórek, co wykazuje barwienie na Ki67.4,8,9

17
W dawnych badaniach klinicznych podawano, ˝e a˝ do 30% GIST ma
charakter „z∏oÊliwy”, to znaczy, ˝e sà to guzy du˝e (>5 cm), szybko
rosnàce, czesto o charakterze naciekajàcym i prawdopodobnie
z obecnoÊcià przerzutów. Guzy te majà wysoki wskaênik mitotyczny
z licznymi figurami podzia∏u (aktywnie dzielàce si´ komórki), widocznymi
w obrazie histologicznym i barwià si´ dodatnio na obecnoÊç antygenu
Ki67.
4,8,9
Nale˝y zaznaczyç, ˝e powy˝sze kryteria potencja∏u z∏oÊliwoÊci
mogà nadal ewoluowaç.
Mutacje
c-kit
w patogenezie GIST
Poznanie, ˝e patogeneza GIST jest istotnie zale˝na od nieprawid∏owej
funkcji c-kit, przyspieszy∏a w sposób dramatyczny nasze zrozumienie tej
choroby. Proteina c-kit jest kodowana przez proto-onkogen c-kit.
13,18
W przypadku GIST dochodzi w tym genie do wielu dobrze poznanych
zaburzeƒ genetycznych i mutacje w zakresie c-kit stanowià znamienny
czynnik rokowniczy prze˝ywalnoÊci w tej grupie guzów.
9,31-34
Mutacje
wykrywa si´ analizà mRNA w wycinkach guza metodà reakcji
polimeryzacji ∏aƒcuchowej odwrotnej transkryptazy albo bezpoÊredniego
sekwencjonowania genomu DNA.
Udokumentowane przypadki rodzinnego (dziedzicznego) GIST, w których
nast´puje germinalna mutacja c-kit, dostarczajà przekonujàcego dowodu
dla roli tego genu w patogenezie choroby.
35
Wi´kszoÊç z∏oÊliwych GIST jest
jednak zwiàzana z mutacjami somatycznymi (nie-germinalnymi) w obr´bie
genu c-kit.
33
Bardziej specjalistyczne metody oceny mutacji wykazujà, ˝e
liczne GIST uwa˝ane uprzednio za wolne od mutacji, w rzeczywistoÊci
mieszcza w sobie aktywujàce mutacje c-kit.
36

18
Aktywujàce mutacje c-kit albo mutacje z nabytkiem funkcji opisano po raz
pierwszy w roku 1998.35 Mutacje c-kit z nabytkiem funkcji wywo∏ywa∏y
zmiany w budowie proteiny c-kit, co z kolei inicjowa∏o aktywacj´ receptora
niezale˝nà od liganda (t. j. autofosforylacj´ i zasadniczà aktywacj´ kinazy
tyrozynowej). Uwa˝a si´, ˝e nieprawid∏owa aktywacja c-kit wywo∏uje
niekontrolowane przekazywanie sygna∏ów prowadzàc do zwi´kszonej proliferacji
komórek i/lub zmniejszenia apoptozy a w koƒcu do nadmiernego prze˝ywania
komórek zawierajàcych mutacje c-kit.
33
Mutacje te mogà mieç form´ delecji
lub zmian punktowych i mogà byç skupione w szczególnych goràcych punktach
w genie c-kit. Oko∏o 50% aktywujàcych mutacji zawartych w GIST wyst´puje
w 11 eksonie genu, a pozosta∏e dotyczà g∏ównie eksonu 9.
31,32,34,35
Rzadkie mutacje punktowe eksonów 13 i 17 genu c-kit, które odpowiednio
kodujà miejsce po∏àczenia z ATP i domen´ c-kit kinazy tyrozynowej, wywo∏ujà
równie˝ aktywacj´ czynnoÊci c-kit. Mutacje te majà na celu zapobieganie
hamujàcemu dzia∏aniu imatinibu.
21
Guzy GIST, w których dosz∏o do mutacji
w zakresie eksonów 13 lub 17 nie b´dà wi´c prawdopodobnie odpowiadaç na
dzia∏anie leku Glivec
®
; jednak w publikacjach podaje si´, ˝e mutacje te w GIST
sà niezwykle rzadkie.
21,22
ObecnoÊç licznych nieprawid∏owoÊci chromosomowych, jak translokacje,
amplifikacje i delecje jest charakterystyczna dla GIST, wyst´pujàc w ponad
90% tych guzów.
37
Do wykrywania tych nieprawid∏owoÊci s∏u˝à takie
technologie badawcze, jak porównawcza hybrydyzacja genetyczna (comparative
genetic hybridisation – CGH), za pomocà której mo˝na oceniaç nabytek lub
utrat´ materia∏u chromosomów niezale˝nie od specyficznych sekwencji DNA
i genów. Do najbardziej sta∏ych udokumentowanych zaburzeƒ genetycznych
nale˝à delecje chromosomu 14q.
37
Analiza CGH wykazuje, ˝e w z∏oÊliwych
GIST wyst´puje znamiennie wiecej amplifikacji i delecji genów ni˝ w guzach
niskiego ryzyka. Ponadto przerzutowa postaç GIST zawiera jeszcze wi´cej
nieprawid∏owoÊci genetycznych ni˝ pierwotna z∏oÊliwa postaç GIST.
31,32,37

19
Ograniczona skutecznoÊç dotychczasowych metod leczenia
Do chwili obecnej pacjenci z GIST mieli ograniczony wybór metod
leczenia, wykazujàcych choçby ograniczonà skutecznoÊç. Brak odpowiedzi
na radioterapi´ i chemioterapi´ powodowa∏, ˝e z∏oÊliwe postacie GIST by∏y
jednoznacznie Êmiertelne. Jest oczywiste, ˝e istnia∏a potrzeba
zastosowania nowego, odmiennego podejÊcia do leczenia tych pacjentów.
Leczenie chirurgiczne
Przed rokiem 2001 leczenie chirurgiczne by∏o jedynà skutecznà metodà
w leczeniu GIST i radykalne wyci´cie chirurgiczne guza pozostaje nadal
jedynà metodà oferujàcà mo˝liwoÊç trwa∏ego wyleczenia. Jednak nawet
u pacjentów po radykalnym wyci´ciu guza i wykluczeniu mikroskopowego
naciekania nowotworowego w linii ci´cia, istnieje wysokie
prawdopodobieƒstwo miejscowej wznowy guza w jamie brzusznej.
Doniesienia na temat mediany czasu do wystàpienia wznowy bardzo si´
ró˝nià (od 7 miesi´cy do 2 lat) 38 a wg ostatniego du˝ego,
retrospektywnego badania klinicznego mediana ta wynosi
19 miesi´cy.
5
Tym nie mniej istniejà udokumentowane przypadki
wystàpienia wznowy nawet po up∏ywie >20 lat od pierwotnej operacji,
który to fakt podkreÊla koniecznoÊç prowadzenia d∏ugoletniej obserwacji
pacjentów, tak˝e tych po udanym ca∏kowitym wyci´ciu nowotworu. JeÊli
guz jest nieoperacyjny, mediana prze˝ycia pacjentów jest krótka i waha si´
od 10 do 21 miesi´cy.
3,5,6,9,38,39
Mo˝liwosci leczenia pacjentów z przerzutowym lub nawrotowym GIST sà
jeszcze bardziej ograniczone. Prawdopodobieƒstwo wznowy u tych chorych
zbli˝a si´ do 100% po powtórnej operacji wznowy lub przerzutu a czas do
wystàpienia progresji wynosi mniej ni˝ 4 miesiàce.
40

20
Napromienianie/chemioterapia
Napromienianie (czyli radioterapi´) stosuje si´ rzadko w leczeniu GIST
z powodu znacznej wra˝liwoÊci na napromienianie sàsiednich narzàdów przy
znacznej radioopornoÊci samej tkanki nowotworowej. Mimo niewielkiej
odpowiedzi na chemioterapi´, u wielu pacjentów z przerzutowà postacià GIST
przeprowadza si´ liczne kuracje chemioterapii, poniewa˝ nie ma dla nich po
prostu innej opcji leczenia. W leczeniu pacjentów ze wznowà stosowano ró˝ne
programy wielolekowej chemioterapii (jak doksorubicyna i dakarbazyna) a tak˝e
IFN-alfa i talidomid, ale odpowiedê na to leczenie by∏a z regu∏y
minimalna.
5,9,38,41
Ponure rokowanie u pacjentów ze z∏oÊliwymi GIST uleg∏o ostatnio zmianie
dzi´ki wprowadzeniu do leczenia tych chorych preparatu Glivec
®
, specyficznego
inhibitora receptora c-kit kinazy tyrozynowej.
41

21
Glivec
®
: skuteczna nowa metoda
leczenia GIST
Wskazania do leczenia preparatem Glivec
®
w GIST
42
l
Glivec
®
jest wskazany w leczeniu doros∏ych pacjentów
w zaawansowanym stadium z∏oÊliwych GIST c-kit-pozytywnych (zmiany
nieoperacyjne i/lub obecnoÊç przerzutów)
l
Ocena skutecznoÊci preparatu Glivec
®
opiera si´ na obiektywnej
odpowiedzi w stosunku do pierwotnego stanu nowotworu i mo˝e
wyra˝aç si´ jako: odpowiedê ca∏kowita (complete response – CR),
odpowiedê cz´Êciowa (partial response – PR), stabilizacja choroby
(stable disease – SD) lub progresja choroby (progressive disease – PD)
Dawkowanie
l
Zalecana poczàtkowa dawka leku Glivec
®
wynosi 400 mg lub 600 mg
w zale˝noÊci od uzgodnieƒ lokalnych, przy czym leczenie prowadzi si´
tak d∏ugo, jak d∏ugo utrzymuje si´ korzystne dzia∏anie leku.
Podwy˝szenie dawki do 600 mg mo˝e byç wskazane u niektórych
pacjentów, którzy nie wykazujà spodziewanej odpowiedzi obiektywnej na
dawk´ 400 mg leku.
Glivec
®
: celowane dzia∏anie na poziomie
c-kit
w GIST
Kilka przyczyn sprawia, ˝e wÊród guzów litych GIST stanowià atrakcyjny
cel leczenia przeciwnowotworowego za pomocà naukowo opracowanego
leku takiego, jak Glivec
®
. Przewa˝ajàca wi´kszoÊç komórek
nowotworowych GIST wykazuje ekspresj´ proteiny c-kit i istnieje wiele
dowodów na to, ˝e na rozwój tei choroby wp∏ywajà aktywujàce mutacje
genu c-kit. Wi´kszoÊç GIST wykazuje trwa∏à aktywacj´ c-kit, co jest
uwa˝ane za pojedynczy g∏ówny mechanizm odpowiedzialny za rozwój
nowotworu. Przez analogi´ ze zdolnoÊcià preparatu Glivec
®
do hamowania
WÊród guzów litych GIST stanowià atrakcyjny cel leczenia
przeciwnowotworowego za pomocà naukowo opracowanego leku
takiego, jak Glivec
®
.
22
aktywnoÊci kinazy tyrozynowej Bcr-Abl, molekularnej przyczyny CML,
43
przyj´to
za∏o˝enie, ˝e wybiórcze zahamowanie c-kit, istotnego dla GIST, powinno
wywieraç dzia∏anie przeciwnowotworowe.
Mechanizm dzia∏ania
Imatinib, pochodna 2-fenyloaminopirymidyny, jest ma∏à czàsteczkà, wykazujàcà
aktywnoÊç skierowanà przeciwko wybranej liczbie pokrewnych protein kinazy
tyrozynowej, jak c-kit, receptor PDGF, Abl i Bcr-Abl (Ryc. 5).
1,19
Rycina 5. Imatinib jest pochodnà 2-fenyloaminopirymidyny, która zosta∏a zmodyfikowana
chemicznie w celu uzyskania lepszej rozpuszczalnoÊci w wodzie i poprawy wch∏aniania leku
przy stosowaniu doustnym.
Imatinib jest wspó∏zawodniczàcym antagonistà przy∏àczania ATP, blokujàc
zdolnoÊç c-kit do przenoszenia grup fosforowych z ATP do resztek tyrozyny
w proteinach pod∏o˝a, co z kolei przerywa pobudzenie sygna∏owe przekazywane
przez c-kit. Na poziomie molekularnym jest to podobny sposób, w jaki imatinib
∏àczy si´, wykazujàc wysokie powinowactwo, z zachowanym miejscem
przy∏àczania ATP w domenie Abl i Bcr-Abl kinazy tyrozynowej.
44
Uwa˝a si´, ˝e
imatinib ∏àczy si´ z receptorem PDGF w podobny spoob.
Fakt, ˝e poza hamowaniem Bcr-Abl imatinib hamuje dodatkowo c-kit i receptor
PDGF, mo˝e zwi´kszyç mo˝liwoÊci terapeutyczne tego leku. Poza skutecznym
dzia∏aniem w leczeniu CML i GIST, Glivec
®
mo˝e posiadaç w∏aÊciwoÊci leczenia
innych schorzeƒ, w których nieprawid∏owa aktywacja c-kit i receptora PDGF
kinaz tyrozynowych jest zwiàzana z ich powstaniem.
Zahamowanie 3 g∏ównych kinaz tyrozynowych nast´puje przy podobnym
st´˝eniu (oko∏o 100 nM), co sugeruje, ˝e imatinib mo˝e wykazywaç istotne
dzia∏anie kliniczne w dawkach uznanych za bezpieczne w leczeniu CML i GIST.
•
•
C
29
H
31
N
7
O
•
CH
4
S
O
3
•
CH
3
S
O
3
H

23
Badania przedkliniczne
Badania doÊwiadczalne wykaza∏y, ˝e imatinib hamuje aktywnoÊç c-kit
kinazy tyrozynowej w wolnych komórkach i testach in vitro.
1,2
Szczególne znaczenie dla GIST posiada∏o wykazanie du˝ej ktywnoÊci
imatinibu skierowanej przeciwko komórkom z mutacja c-kit, których
rozwój by∏ niezale˝ny od aktywacji SCF. Lini´ komórkowà, zawierajàcà
mutacje c-kit o charakterze nabytku funkcji, otrzymano z przerzutowego
guza GIST. Po dodaniu do tych komórek imatinibu zosta∏y zablokowane
wewnàtrzkomórkowe drogi przekazywania sygna∏u, odpowiedzialne za
˝ywotnoÊç i proliferacj´ linii komórkowej.
45
Te wa˝ne obserwacje
potwierdza∏y za∏o˝enie, ˝e imatinib mo˝e spowodowaç odwrócenie
nieprawid∏owego wzrostu komórek kierowanego przez c-kit i dostarczy∏y
naukowej podstawy do przeprowadzenia pierwszego klinicznego badania
preparatu Glivec
®
w leczeniu GIST.
Glivec
®
mo˝e posiadaç w∏aÊciwoÊci leczenia innych schorzeƒ,
w których nieprawid∏owa aktywacja c-Kit i receptora PDGF
kinaz tyrozynowych jest zwiàzana z ich powstaniem.

24
Badanie kliniczne – udowodnienie s∏usznoÊci koncepcji
28
Koncepcj´ zak∏adajàcà leczenie GIST za pomocà preparatu Glivec
®
udowodniono na podstawie przypadku opublikowanego w kwietniu 2001 roku
przez Joensuu i kolegów. Przed 5 laty 50-letnia kobieta zg∏osi∏a si´ do leczenia
z powodu Êrednio nasilonych bólów brzucha i guza wyczuwalnego
w nadbrzuszu. U pacjentki dokonano resekcji dwóch du˝ych guzów ˝o∏àdka
i licznych guzów przerzutowych. Badanie mikroskopowe wykaza∏o szybko
dzielàce si´ komórki a IHC intensywnie pozytywny c-kit. W badaniu
genetycznym stwierdzono typowe mutacje z nabytkiem funkcji w zakresie genu
c-kit. Po wystàpieniu wznowy usuwano kolejno chirurgicznie liczne guzy
z wàtroby, jajników i jamy brzusznej. Pomimo chemioterapii i doÊwiadczalnej
kuracji z zastosowaniem talidomidu i podskórnie podawanego IFN-alfa,
obserwowano nadal sta∏à progresj´ choroby. Ekspresja c-kit i mutacje
o charakterze nabytku funkcji sugerowa∏y, ˝e pacjentka mo˝e byç kandydatkà
do zastosowania preparatu Glivec
®
. W zwiàzku z tym w marcu 2000 roku
rozpocz´to prób´ klinicznà leczenia za pomocà leku Glivec
®
podajàc dawk´ 400
mg dziennie.
Odpowiedê biologicznà u pacjentki monitorowano wykonujàc biopsje ig∏owe
przerzutów zlokalizowanych w wàtrobie. Barwienie na c-kit/Cd117 i Ki67
wykaza∏o dramatyczne zmniejszenie liczby dzielàcych si´, c-kit-pozytywnych
komórek nowotworowych a obiektywna reakcja guza na leczenie u tej pacjentki
by∏a bardzo szybka. Badanie MRI wykonane w 2 tygodnie po rozpocz´ciu
podawania preparatu Glivec
®
, wykaza∏o zmniejszenie rozmiarów guza o 41%,
przy czym odpowiedê ta uleg∏a dalszej poprawie – po up∏ywie 8 miesi´cy masa
guza uleg∏a zmniejszeniu o 75% a po 14 miesiàcach >80%. Ca∏kowità
odpowiedê obserwowano w 6 z 28 pierwotnych przerzutów w wàtrobie; zmiany
te ustàpi∏y ca∏kowicie i badanie MRI nie wykaza∏o pojawienia si´ nowych
ognisk.
18
FDG-PET wykonana po 4 tygodniach terapii lekiem Glivec
®
robi∏a
równie˝ wra˝enie wykazujàc znaczne zwi´kszenie czynnoÊci metabolicznej
w zakresie zmian przerzutowych w wàtrobie (Ryc. 6).

25
Rycina 6. Badanie PET pacjenta w badaniu klinicznym potwierdzajàcym s∏usznoÊç
przyj´tej koncepcji – przed rozpocz´ciem leczenia wykazuje liczne przerzuty w wàtrobie
i górnej cz´Êci jamy brzusznej gromadzàce znacznik metabolizmu
18
FDG (A) i znaczne
zmniejszenie wychwytywania znacznika w 4 tygodnie po rozpocz´ciu leczenia
preparatem Glivec
®
(B).
28
Reprinted from Joensuu et al.
28
©2001 Massachusetts Medical Society. All rights reserved.
Glivec
®
by∏ dobrze tolerowany przez pacjentk´; wyst´powa∏y u niej tylko
nieznaczne objawy niepo˝àdane (w stopniu I wg kryterium najcz´stszych
objawów toksycznych NCI, Common Toxicity Criteria – CTC) jak
przejÊciowe nudnoÊci, luêne stolce, kurcze mi´Êniowe, bóle w nadbrzuszu
i wzd´cia. Nie obserwowano ˝adnych objawów toksycznych ze strony
wàtroby, nerek, serca czy uk∏adu krwiotwórczego, zwiàzanych ze
stosowanym lekiem. Zach´cajàce wyniki uzyskane u tej pacjentki
pozwoli∏y na szybkie rozpocz´cie fazy I i II badania klinicznego.

26
DoÊwiadczenia kliniczne: badania kliniczne z zastosowaniem preparatu
Glivec
®
w GIST
Faza I badania klinicznego EORTC: STS, ∏àcznie z GIST
29
Opis badania klinicznego
29
W sierpniu roku 2000 Grupa d/s Mi´saków Tkanek Mi´kkich i KoÊci
Europejskiej Organizacji dla Badania i Leczenia Raka (EORTC) zainicjowa∏a
I faz´ mi´dzynarodowego badania klinicznego z eskalacjà dawek preparatu
Glivec
®
, w leczeniu pacjentów w zaawansowanym stadium STS, ∏àcznie
z pacjentami z GIST. Pacjenci zakwalifikowani do leczenia posiadali dajàcy si´
zmierzyç guz z objawami Êwie˝ej progresji (<6 tygodni przed rozpocz´ciem
leczenia). Do badania w∏àczono 40 pacjentów, w tym 36 chorych
z udokumentowanymi c-kit-pozytywnymi GIST oraz 4 pacjentów z STS,
nie-GIST. Poczàtkowo pacjenci otrzymywali dawk´ 400 mg preparatu Glivec
®
jeden raz dziennie. Dawk´ t´ zwi´kszano stopniowo o 200 mg w ustalonych
podgrupach pacjentów stosujàc 4 schematy dawkowania: 400 mg dziennie
(n=8), 300 mg dwa razy dziennie (n=8), 400 mg dwa razy dziennie (n=16)
i 500 mg dwa razy dziennie (n=8). Podstawowym celem badania by∏o
ustalenie maksymalnej tolerowanej dawki leku Glivec
®
, zgodnie z NCI CTC.
Dalszym celem by∏a ocena skutecznosci preparatu Glivec
®
w leczeniu pacjentów
z GIST. Odpowiedê nowotworu na leczenie kwalifikowano zgodnie z kryteriami
oceny odpowiedzi w guzach litych (Response Evaluation Criteria in Solid
Tumours – RECIST).
46
W ocenie pos∏ugiwano si´ wynikami pomiarów
dokonywanymi na podstawie standardowych badaƒ radiologicznych oraz
u niektórych pacjentów badania
18
FDG-PET.
Wyniki badania klinicznego: bezpieczeƒstwo29
• Uzyskano potwierdzenie cz´Êciowej odpowiedzi u 52,7%
pacjentów z GIST
• Wi´kszoÊç chorych z GIST doznawa∏a ulgi dzi´ki ustàpieniu
dolegliwoÊci po 1 tygodniu stosowania preparatu Glivec
®
* Ustalono, ˝e dzienna dawka 800 mg jest bezpieczna dla
pacjentów z GIST*
(* Dawka 800 mg nie jest dawkà zatwierdzonà)

27
Glivec
®
by∏ z regu∏y dobrze tolerowany przez pacjentów (n=40).
Najpowa˝niejsze objawy niepo˝àdane w zakresie wszystkich stosowanych
dawek by∏y 2 i 3 stopnia ci´˝koÊci i prawie ˝adne nie by∏y zwiàzane
z uk∏adem krwiotwórczym. Do objawów tych nale˝a∏y obrz´ki (n=10),
nudnoÊci (n=7), wymioty (n=5), wysypka (n=5), dusznoÊç (n=1)
i goràczka z neutropenià (n=1).
Objawy toksyczne zmuszajàce do ograniczenia dawki (stopieƒ 3)
obserwowano u 5 pacjentów, którzy otrzymywali dziennie 1000 mg leku.
Obejmowa∏y one nudnoÊci, wymioty, obrz´ki i dusznoÊç. Dawk´ dziennà
800 mg przyj´to jako bezpiecznà i tolerowanà u pacjentów z GIST.
U pacjentów przyjmujàcych dawki ni˝sze objawy uboczne mia∏y lekkie lub
Êrednie nasilenie i ∏atwo dawa∏y si´ leczyç. Objawy zwiàzane
z mielosupresjà by∏y niewielkie i nie mia∏y wp∏ywu na ograniczenie dawki.
Wyniki badania klinicznego: skutecznoÊç29
Odpowiedê obiektywnà uzyskano u 25 z 36 (69%) pacjentów z GIST,
a w tej grupie u 19 (53%) potwierdzonà odpowiedê cz´Êciowà.
U pozosta∏ych 6 pacjentów reakcja na leczenie mia∏a charakter
niepotwierdzonej odpowiedzi cz´Êciowej albo regresji guza wynoszàcej
20% do 29%. Z grupy pacjentów z GIST, którzy nie uzyskali odpowiedzi
obiektywnej,
7
(19%) wykazywa∏o stabilizacj´ choroby a tylko u 4 (11%)
nastàpi∏a progresja procesu nowotworowego. Odpowiedê na leczenie
nastepowa∏a z regu∏y szybko, zazwyczaj ju˝ w ciagu 8 dni od rozpocz´cia
leczenia, jak to wykaza∏o badanie za pomocà
18
FDG-PET.
DolegliwoÊci zwiàzane z guzem ustàpi∏y u 24 z 27 (89%) pacjentów
leczonych preparatem Glivec
®
, cz´sto ju˝ w ciàgu tygodnia od rozpocz´cia
leczenia.
Dane uaktualizowane wskazujà, ˝e po minimalnym okresie obserwacji
wynoszàcym 11 miesi´cy (zakres od 11 do 15 miesi´cy) leczenie
kontynuowa∏o 29 pacjentów; 18/36 (50%) wykazywa∏o PR a 11/36
(30%) SD, co dawa∏o korzyÊç klinicznà ogó∏em u 80% pacjentów.
47
Nie
stwierdzono utrzymywania si´ odpowiedzi na leczenie u ˝adnego pacjenta
nie-GIST (t. j. z c-kit-negatywnym STS), co potwierdza koncepcj´ o roli
c-kit w procesie chorobowym GIST i mechanizmie dzia∏ania preparatu
Glivec
®
.
28
Wnioski
W badaniu tym Glivec
®
by∏ ogólnie dobrze tolerowany przez pacjentów
i wykaza∏ skuteczne dzia∏anie w zakresie wszystkich dawek, do 1000 mg.
Wyniki badania sta∏y si´ podstawà do ustalenia dawek stosowanych w II fazie
badania. U pacjentów z potwierdzonym c-kit-pozytywnym GIST obiektywna
odpowiedê guza i ustàpienie objawów uzyskano w znaczàcym odsetku chorych
a brak odpowiedzi dotyczy∏ jedynie 11% pacjentów.
Faza II badania klinicznego: okreÊlenie skutecznoÊci
26
Opis badania klinicznego
26
Otwarte, randomizowane, wielo-oÊrodkowe badanie kliniczne II fazy preparatu
Glivec
®
rozpocz´to w lipcu 2000 roku u pacjentów z nieoperacyjnym lub
przerzutowym c-kit-pozytywnym GIST. Pacjentów podzielono losowo na 2 grupy
otrzymujàce dziennà dawk´ leku albo 400 mg albo 600 mg. WysokoÊç dawek
ustalono na podstawie wyników kontynuowanej II fazy badania klinicznego
preparatu Glivec
®
w leczeniu CML oraz kontynuowanego leczenia pierwszych
pacjentów z GIST. U pacjentów otrzymujàcych dawk´ 400 mg, u których
stwierdzono progresj´ choroby, podwy˝szano dawk´ leku do 600 mg, jednak
jeÊli progresja wyst´powa∏a u pacjentów otrzymujàcych od poczàtku dawk´
600 mg, wykluczano ich z badania. Leczenie kontynuowano do 24 miesi´cy
pod warunkiem utrzymujàcego si´ korzystnego dzia∏ania leku.
Do badania zakwalifikowano pacjentów doros∏ych z histologicznym
rozpoznaniem GIST i udokumentowanym dodatnim barwieniem na c-kit.
Chocia˝ zaawansowanie GIST pod postacià nieoperacyjnego guza i/lub
obecnoÊci przerzutów wskazywa∏o na brak mo˝liwoÊci wyleczenia, wymagano,
aby prawdopodobieƒstwo prze˝ycia u tych pacjentów wynosi∏o przynajmniej 6
• Ogólnie ponad 81% pacjentów odnios∏o korzyÊç
z leczenia preparatem Glivec
®
- 40,1% pacjentów uzyska∏o odpowiedê cz´Êciowà
- 41,5% uzyska∏o stabilizacj´ choroby
• Glivec
®
okaza∏ si´ lekiem bezpiecznym i by∏ ogólnie dobrze
tolerowany przez pacjentów z GIST

29
miesi´cy, a stan ogólny oceniany wg Eastern Cooperative Oncology Group
(ECOG) wynosi∏ od 0 do 3, z odpowiednio wydolnà czynnoÊcià narzàdów.
Wiek zakwalifikowanych do badania 147 pacientów waha∏ si´ od 18 do
83 lat. Przewa˝ajàca wi´kszoÊç pacjentów (98%) przeby∏a uprzednio
zabieg operacyjny, a w przybli˝eniu 50% otrzymywa∏o chemioterapi´
(Tabela 2).
Tabela 2. Charakterystyka pacjentów z GIST w II fazie badania klinicznego
26
Dane pacjentów
400mg
600mg
Obydwie dawki
(n=73) (n=74)
(N=147)
Wiek (w latach)
Ârednia 56.6
52.2
54.4
Ârodkowa 58
52 54
Zakres 28–83
18–79
18–83
P∏eç M:K (%)
60%:40%
53%:47%
56.5%:44.5%
Rasa (%)
Kaukaska 94.5%
90.5%
92.5%
Czarna
1.4% 5.4% 3.4%
Wschodnia
2.7% 2.7% 2.7%
Inne
1.4%
1.4% 1.4%
Stan ogólny wf ECOG (%)
Stopieƒ 0
38.4%
45.9%
42.2%
Stopieƒ 1
38.4%
39.2%
38.8%
Stopieƒ 2
21.9%
14.9%
18.4%
Stopieƒ 3
1.4%
0
0.7%
Stopieƒ 4
0
0
0
Lokalizacja guza pierwotnego (%)
Jelito cienkie
49%
˚o∏àdek
34%
Wàtroba
17%
Otrzewna
12.9%
Sieç
11.6%
Lokalizacja wznowy (%)
Wàtroba 78%
Otrzewna 38%
Okolica zaotrzewnowa
14%
Uprzednie leczenie
Chirurgiczne 98%
Chemioterapia 51%
Hormonalne/immunoterapia 1%

30
Cele badania klinicznego
26
G∏ównym celem badania klinicznego by∏a ocena aktywnoÊci klinicznej preparatu
Glivec
®
w oparciu o wskaêniki obiektywnej odpowiedzi. Monitorowanie
prowadzono za pomocà MRI, CT a u wybranych pacjentów wykonywano
18
FDG-
PET. Stan GIST oceniano wykonujac pomiary wg kryterium SWOG (Southwest
Oncology Group) dla odpowiedzi guzów litych na leczenie.
48
Zmiany dajàce si´
zmierzyç definiowano – w badaniu CT, MRI,
18
FDG-PET lub w badaniu
palpacyjnym – jako ogniska guza o Êrednicy wynoszàcej w 2 wymiarach
>2 cm. Zmiany chorobowe wykrywalne to ogniska mniejsze od 2 cm lub
których granic nie mo˝na by∏o wyraênie ustaliç. W badaniu klinicznym
stwierdzono kilka rodzajów odpowiedzi obiektywnych:
l
Odpowiedê ca∏kowita: ca∏kowite znikni´cie wszystkich dajàcych si´ zmierzyç
i wykrywalnych zmian chorobowych, bez wystàpienia nowych ognisk
nowotworowych.
l
Odpowiedê cz´Êciowa: >50% zmniejszenie si´ w stosunku do stanu
wyjÊciowego sumy najwi´kszych wymiarów wszystkich ognisk chorobowych.
Nie stwierdza si´ progresji zmian ani pojawienia si´ nowych ognisk.
l
Stabilizacja choroby: ka˝da odpowiedê, która nie mo˝e byç zakwalifikowana
jako odpowiedê ca∏kowita, odpowiedê cz´Êciowa (t. j. <50% zmniejszenie
zmian), progresja choroby (t. j. <50% powi´kszenie zmian) lub odpowiedê
nieznana.
l
Progresja choroby: powi´kszenie zmian o 50% lub o 10 cm
2
mierzonych
ognisk lub wyraêne pogorszenie w stosunku do uprzedniej oceny
wykrywalnych zmian. Progresja obejmuje tak˝e ponowne pojawienie si´
zmian, które poczàtkowo ustàpi∏y i pojawienie si´ nowych ognisk
chorobowych.
l
Odpowiedê nieznana: klasyfikacja, którà stosuje si´, kiedy progresji choroby
nie udokumentowano albo nie oceniono >1 zmiany mierzalnej lub wykrytego
ogniska.

31
Dalsze cele badania klinicznego obejmowa∏y:
l
Ocen´ bezpieczeƒstwa i tolerancji leku Glivec
®
l
Opracowanie profilu farmakokinetycznego leku Glivec
®
w badanej grupie
pacjentów z GIST
l
Ocen´ czasu do wystàpienia progresji i ogólnej prze˝ywalnoÊci
Dodatkowo na podstawie badaƒ naukowych i obrazowania w wybranej
grupie pacjentów wyznaczono nast´pujàce cele:
l
Porównanie stanu mutacji genu c-kit z wynikiem klinicznym leczenia
l
Ocen´ dzia∏ania leku Glivec
®
na proliferacj´ komórkowà i stan fosforylacji
(aktywacji) c-kit kinazy tyrozynowej
Wyniki badania klinicznego: skutecznoÊç26
Ponad 81% pacjentów odnios∏o ogólnà korzyÊç z zastosowania leczenia za
pomocà preparatu Glivec
®
. Potwierdzonà odpowiedê cz´Êciowà, okreÊlanà
jako zmniejszenie rozmiarów guza od 50% do 99%, uzyskano u 40,1%
pacjentów z GIST (Ryc. 7). Nie wykazano statystycznej ró˝nicy w odsetku
odpowiedzi mi´dzy grupami przyjmujàcymi dawk´ 400 mg i 600 mg leku.
Dodatkowo u 41,5% pacjentów nastàpi∏a stabilizacja choroby. Z grupy 61
pacjentów, u których najlepszà odpowiedê stanowi∏a potwierdzona
stabilizacja choroby, 47 pacjentów (77%) wykazywa∏o albo
niepotwierdzonà odpowiedê cz´Êciowà albo regresj´ guza wynoszàcà 26%
do 49% (Ryc. 7).
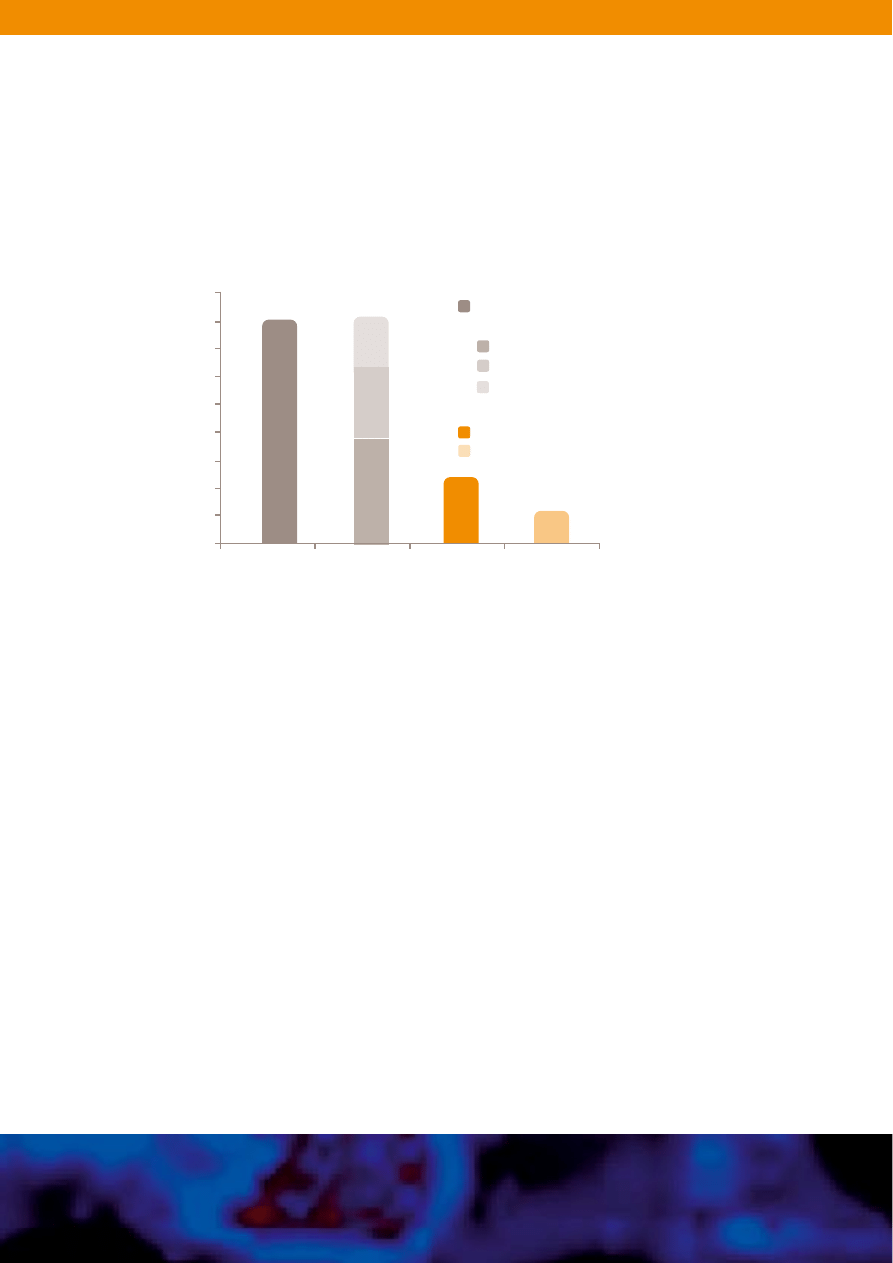
32
Progresja choroby wystàpi∏a jedynie u 12,2% pacjentów. W grupie 12
pacjentów przyjmujàcych 400 mg leku, u których zwi´kszono dawk´ do 600 mg,
u 2 chorych uzyskano potwierdzonà a u 1 niepotwierdzonà stabilizacj´ choroby.
Ryc.7. Odpowiedê na leczenie preparatem Glivec
®
u pacjentów w zaawansowanym stadium
GIST.
26
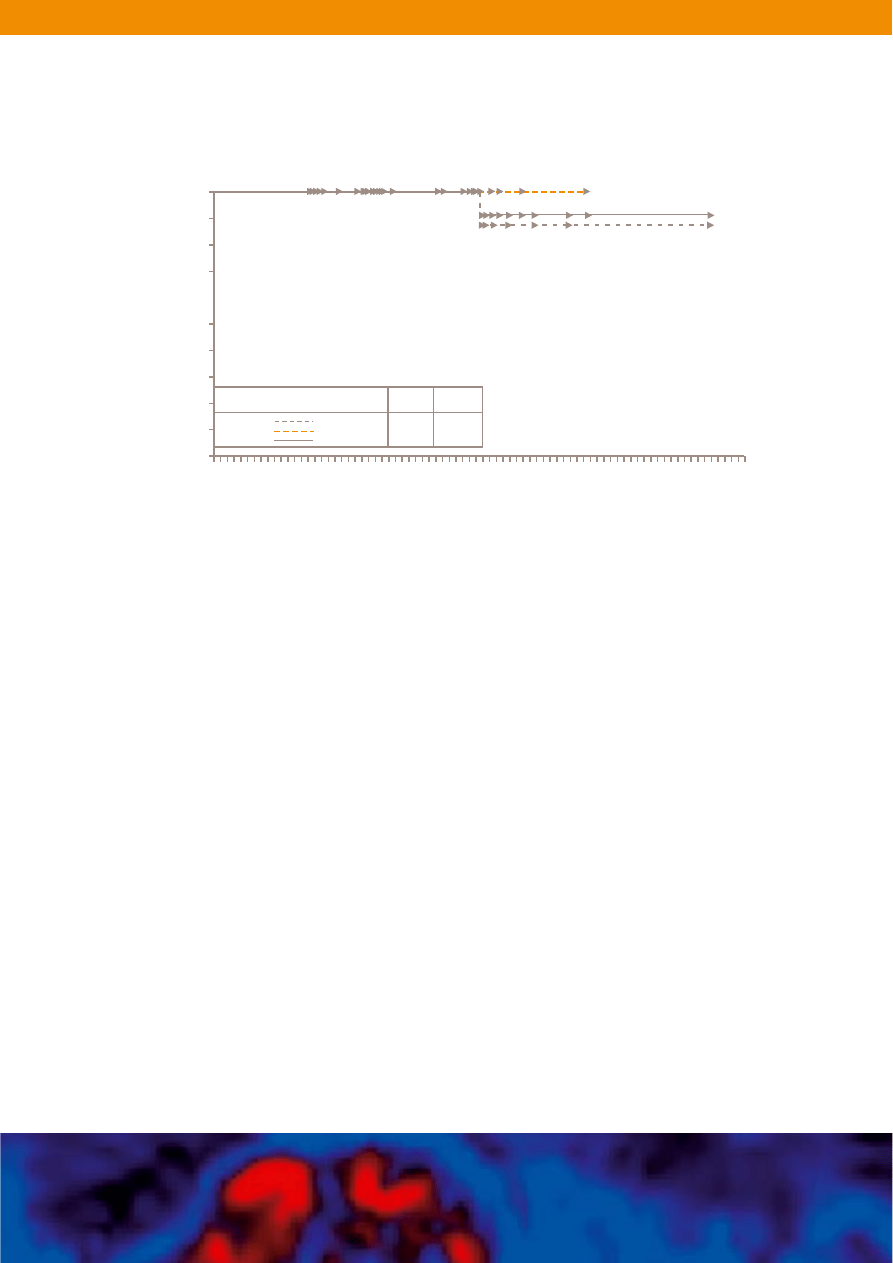
Wystàpienie odpowiedzi obserwowano cz´sto w ciàgu 4 tygodni, a mediana
czasu od rozpocz´cia leczenia do wystàpienia reakcji na leczenie wynios∏a
w badaniu 12 tygodni. Po 37 tygodniach od rozpocz´cia leczenia (zakoƒczenie
obserwacji), w badaniu klinicznym pozostawa∏o przyjmujàc nadal Glivec
®
97%
pacjentów z potwierdzonà odpowiedzià cz´Êciowà. Czas odpowiedzi waha∏ si´
od 7 do 38 tygodni a mediana czasu odpowiedzi jeszcze nie zosta∏a osiàgni´ta
(Ryc. 8). Ma∏a liczba zgonów wÊród pacjentów obj´tych badaniem nie pozwala
w chwili obecnej na obliczenie ogólnego prze˝ycia.
Ostatnie dane tego badania, ze Êrednià obserwacji ponad 9 miesi´cy,
przedstawiono na konferencji ASCO w roku 2000 (streszczenie #1608)
i opublikowano w New England Journal of Medicine. Uzyskane wyniki sugerujà,
˝e pacjenci z zaawansowanà postacià GIST odnoszà nadal korzyÊci
z kontynuowania leczenia imatinibem. W sumie 54% pacjentów uzyska∏o
cz´Êciowà odpowiedê a u 28% nastàpi∏a stabilizacja choroby. Dlatego, w miar´
otrzymywania wyników kolejnych analiz mo˝na by∏o stwierdziç, ˝e wielu
pacjentów z poczàtkowà stabilizacjà choroby uzyska∏o nast´pnie cz´Êciowà
odpowiedê. na leczenie preparatem Glivec
®
. Kontrola procesu nowotworowego
ma charakter sta∏y, przy czym mediana czasu odpowiedzi nie zosta∏a jeszcze
osiàgni´ta.
49
45
40
35
30
25
20
15
10
5
0
40
9
13
19
12
6
PR
PR - odpowiedê cz´Êciowa
Niepotwierdzona PR
Zmniejszenie guza o 26% do 49%
PD - progresja choroby
UNK - odpowiedê nieustalona
SD
PD
UNK
P
acjenci (%)
Inny rodzaj SD (zmniejszenie guza <25%,
brak zmiany, powi´kszenie guza <25%
lub ostateczna PD)
SD - stabilizacja choroby
33
Rycina 8. Ocena prawdopodobieƒstwa czasu trwania odpowiedzi na leczenie
u pacjentów otrzymujàcych dawk´ 400 mg (n=73) lub 600 mg (n=74) oraz ∏àcznie
u wszystkich pacjentów (wg Kaplana-Meiera).
26
Pacjenci z odpowiedzià obiektywnà wykazywali zmniejszenie aktywnoÊci
metabolicznej guza widocznà w tomografii
18
FDG-PET, które pozostawa∏o
w korelacji ze zmniejszeniem rozmiarów guza mierzonych w CT i MRI;
pewne zmiany w metabolizmie guza zachodzi∏y bardzo szybko
i stwierdzano je czasem ju˝ po 24 godzinach od podania pojedynczej
dawki leku Glivec
®
. I odwrotnie, zwi´kszenie aktywnoÊci metabolicznej
guza obserwowano u pacjentów z progresjà choroby.
Wyniki badania klinicznego: bezpieczeƒstwo
26
Glivec
®
by∏ z regu∏y dobrze tolerowany przez pacjentów z GIST, chocia˝
prawie u ka˝dego wyst´powa∏ przynajmniej 1 objaw niepo˝àdany (w
stopniu 1/2). Wi´kszoÊç objawów niepo˝àdanych mia∏a nasilenie oceniane
jako niewielkie lub Êrednie; natomiast powa˝ne objawy (stopieƒ 3/4)
obserwowano u 21% pacjentów. Przerwanie leczenia zwiàzane z objawami
niepo˝àdanymi nastàpi∏o jedynie u 3% pacjentów.
Do najcz´Êciej wyst´pujàcych objawów niepo˝àdanych nale˝a∏y obrz´ki
(najcz´Êciej okolicy oczodo∏ów i koƒczyn dolnych), nudnoÊci, biegunka,
kurcze mi´Êniowe, zm´czenie, wysypka i bóle brzucha. Nie obserwowano
zespo∏u litycznego guza. Nie wykazano istotnej statystycznie ró˝nicy
w ci´˝kosci objawów ubocznych mi´dzy grupami pacjentów przyjmujàcych
dawk´ 400 mg i 600 mg, chocia˝ wi´cej objawów niepo˝àdanych
towarzyszy∏o grupie chorych leczonej dawkà 600 mg (Tabela 3).
1.0
0.9
0.7
0.8
0.6
0.5
0.4
0.3
0.2
0.1
0.0
0
2
4
6
Leczenie
400mg
600mg
Pacjenci razem
Tyg:
0
26 52
27
2
0
32
1
0
59
3
0
Liczba pacjentów w okr. ryzyka
Mediana
95% przedzia∏u
LL UL
nie osiàgni´to
nie osiàgni´to
nie osiàgni´to
nie osiàgni´to
nie osiàgni´to
nie osiàgni´to
przedzia∏u
8
10
12
14
16
18
20
22
24
26
28
30
32
34
36
38
40
P
robability

34
U siedmiu pacjentów (5%) otrzymujàcych Glivec
®
wystàpi∏o masywne
krwawienie ocenione jako stopieƒ 3/4, w tym u 4 pacjentów otrzymujàcych
dawk´ 600 mg leku i u 3 przyjmujàcych dawk´ 400 mg. W grupie tej
3 pacjentów mia∏o krwawienie z przewodu pokarmowego, 3 krwawienie do
guza, a u 1 chorego wystàpi∏y obydwa rodzaje krwawienia. ˚ród∏em krwawienia
z przewodu pokarmowego mog∏y byç zmiany nowotworowe. Mo˝liwoÊç
wystàpienia tego powik∏ania sprawia, ˝e pacjenci z GIST wymagaja troskliwej
obserwacji.
Tabela 3. Objawy niepo˝adane zwiàzane ze stosowaniem leku Glivec
®
(>10% wszystkich
pacjentów w grupach ka˝dej dawki)
26
Wszystkie stopnie wg NCI CTC
Stopnie 3/4 wg CTC
Dawka poczàtkowa (mg/dzieƒ) 400mg
600mg
Obie dawki
400mg
600mg
Obie dawki
(n=73)
(n=74)
(N=147)
(n=73)
(n=74)
(N=147)
Objawy niepo˝àdane
n (%)
n (%)
N (%)
n (%)
n (%)
N (%)
NudnoÊci
39 (53.4)
42 (56.8)
81 (55.1)
2 (2.7)
2 (2.7)
4 (2.7)
Biegunka NOS
33 (45.2)
42 (56.8)
75 (51.0)
1 (1.4)
4 (5.4)
5 (3.4)
Obrz´k okolicy oczodo∏ów
32 (43.8)
37 (50.0)
69 (46.9)
0
0
0
Zm´czenie
24 (32.9)
28 (37.8)
52 (35.4)
1 (1.4)
0
1 (0.7)
Kurcze mi´Êniowe
22 (30.1)
30 (40.5)
52 (35.4)
0
0
0
Bóle g∏owy NOS
18 (24.7)
26 (35.1)
44 (29.9)
0
0
0
Bóle brzucha NOS
21 (28.8)
19 (25.7)
40 (27.2)
5 (6.8)
1 (1.4)
6 (4.1)
Zapalenie skóry NOS
14 (19.2)
25 (33.8)
39 (26.5)
1 (1.4)
2 (2.7)
3 (2.0)
Wymioty NOS
16 (21.9)
17 (23.0)
33 (22.4)
1 (1.4)
2 (2.7)
3 (2.0)
Wzd´cie brzucha, gazy
12 (16.4)
17 (23.0)
29 (19.7)
0
0
0
Obrz´k koƒczyny dolnej
19 (26.0)
9 (12.2)
28 (19.0)
0
0
0
Zapalenie nosogard∏a
9 (12.3)
10 (13.5)
19 (12.9)
0
0
0
NiedokrwistoÊç NOS
7 (9.6)
10 (13.5)
17 (11.6)
3 (4.1)
3 (4.1)
6 (4.1)
BezsennoÊç NEC
8 (11.0)
8 (10.8)
16 (10.9)
0
0
0
Obrz´k NOS
5 (6.8)
10 (13.5)
15 (10.2)
2 (2.7)
0
2 (1.4)
Bóle pleców
8 (11.0)
7 (9.5)
15 (10.2)
1 (1.4)
0
1 (0.7)
Obrz´k twarzy
6 (8.2)
9 (12.2)
15 (10.2)
1 (1.4)
0
1 (0.7)
Goràczka
9 (12.3)
4 (5.4)
13 (8.8)
0
0
0
Zwi´kszone ∏zawienie
4 (5.5)
8 (10.8)
12 (8.2)
0
0
0
Zaka˝enie górnych dróg
oddechowych NOS
4 (5.5)
8 (10.8)
12 (8.2)
0
0
0
Zaburzenia smaku
1 (1.4)
10 (13.5)
11 (7.5)
0
0
0
NOS = bli˝ej nie okreÊlone.
NEC = bli˝ej niesklasyfikowane.

35
Wnioski
W sumie ponad 81% pacientów odnios∏o korzyÊç z leczenia preparatem
Glivec
®
. Oko∏o 40% pacjentów z nieoperacyjnà lub przerzutowà postacià
GIST leczonych preparatem Glivec
®
uzyska∏o potwierdzonà odpowiedê
cz´Êciowà a dodatkowe 41% pacjentów utrzymujàcà si´ stabilizacj´
choroby. Ponadto u pacjentów z potwierdzonà odpowiedzià cz´Êciowà stan
ten utrzymywa∏ si´ a˝ do czasu zakoƒczenia obserwacji. Chocia˝ czas
obserwacji jest nadal stosunkowo krótki, wyniki do chwili obecnej na
temat czasu trwania odpowiedzi sà bardzo zach´cajàce. Glivec
®
by∏ przez
pacjentów dobrze tolerowany, a wi´kszoÊç objawów niepo˝àdanych mia∏a
niewielki lub Êredni stopieƒ ci´˝koÊci. Badanie kliniczne potwierdzi∏o
równie˝ znaczenie wykonywania
18
FDG-PET jako wa˝nego wskaênika
wczesnej odpowiedzi obiektywnej guza na leczenie.
Wyniki uzyskane z przeprowadzonej II fazy badania klinicznego
i zapotrzebowanie na leczenie w tej populacji pacjentów sprawi∏y, ˝e
Glivec
®
zosta∏ szybko zatwierdzony do rejestracji w Unii Europejskiej
i w Stanach Zjednoczonych oraz przez organizacje prawne na Êwiecie.
Ponad 81% pacjentów odnios∏o korzyÊç
z leczenia preparatem Glivec
®
.

36
B
Ba
ad
da
an
niie
e k
klliin
niic
czzn
ne
e IIIIII ffa
azzyy:: o
op
pttyym
ma
alliizza
ac
cjja
a d
da
aw
wk
kii
Badanie mi´dzyoÊrodkowe EORTC
50
Trwajàce obecnie mi´dzynarodowe badanie kliniczne prowadzone na du˝à skal´
zastosowania preparatu Glivec
®
w leczeniu zaawansowanych GIST, rozpocz´to
w marcu 2001 pod kierownictwem grupy d/s Mi´saków Tkanek Mi´kkich
i KoÊci EORTC. Badanie to prowadzone jest we wspó∏pracy z 2 dodatkowymi
grupami w 56 oÊrodkach Europy i Australii:
l
Australoazjatycka Grupa Badawcza d/s Przewodu Pokarmowego
l
W∏oska Grupa Badawcza d/s Mi´saków
PodejÊcie do leczenia w tym badaniu klinicznym jest podobne do II tego
badania i ma na celu poszerzenie wczeÊniejszych obserwacji. Przede
wszystkim, poniewa˝ optymalna dawka leku Glivec
®
w leczeniu GIST nie
zosta∏a ustalona w II fazie badania, planuje si´ obecnie porównanie wysokich
i niskich dawek leku u oko∏o 600 pacjentów z nieoperacyjnà lub przerzutowà
postacià c-kit – pozytywnych GIST. Pacjenci sà randomizowani na grupy
otrzymujàce albo 400 mg leku albo 800 mg (podawanego po 400 mg dwa
razy dziennie). W badaniu zezwala si´ na przesuni´cie pacjentów z ramienia
badawczego dawki 400 mg do ramienia 800 mg w przypadku stwierdzenia
progresji choroby. Podstawowym celem badania jest ustalenie czasu prze˝ycia
bez progresji choroby a cele dalsze obejmujà okreÊlenie ogólnego czasu
prze˝ycia, odpowiedzi obiektywnej na Glivec
®
oraz zbadanie profilu toksycznoÊci
leku podobnie, jak to przeprowadzono w fazie II badania.
Badanie Kliniczne Mi´dzygrupowe Ameryki Pó∏nocnej
51
Obecnie prowadzone jest równie˝ inne, sponsorowane przez NCI, szeroko
zakrojone badanie kliniczne III fazy Grup Badawczych Ameryki Pó∏nocnej
w po∏àczeniu ze SWOG i kilkoma wspó∏pracujàcymi gupami badawczymi, jak:
l
CALGB (Cancer and Leukemia Group B)
l
ECOG (Eastern Cooperative Oncology Group
l
NCI-Canada

37
Pacjentów kwalifikuje si´ do tego wielkiego badania klinicznego
w podobny sposób, jak do fazy II badania i fazy III EORTC Intergroup
Study. Pacjenci sà przydzielani drogà losowania do jednego lub drugiego
ramienia badawczego, otrzymujàcego codziennie albo dawk´ 400 mg albo
800 mg leku Glivec
®
. Koƒcowe cele badania to ocena odpowiedzi
obiektywnej w oparciu o monitorowanie przebiegu choroby za pomocà
konwencjonalnych technikl radiologicznych lub w wybranych przypadkach
PET, a tak˝e okreÊlenie profilu toksycznoÊci leku. Guzy nowotworowe b´dà
jednoczesnie badane za pomocà dost´pnych technik naukowych.
Bezpieczeƒstwo: podstawa wykonywanych badaƒ klinicznych
Obserwowane do chwili obecnej objawy uboczne zwiàzane
z przyjmowaniem leku obejmujà obrz´ki, nudnoÊci, biegunk´, kurcze
mi´Êniowe, zm´czenie i wysypk´ (Tabela 3). Objawy te stwierdzono
poczàtkowo przy stosowaniu preparatu Glivec
®
w leczeniu CML;
ust´powa∏y one szybko po leczeniu objawowym. PrzejÊciowà neutropeni´
w 4 stopniu ci´˝koÊci stwierdzono jedynie u 2 pacjentów. U pacjentów
z GIST neutropenia i toksyczne objawy ze strony uk∏adu krwiotwórczego
wyst´powa∏y znacznie rzadziej ni˝ u chorych na CML. Poniewa˝ czas
obserwacji pacjentów z GIST leczonych preparatem Glivec
®
jest jeszcze
stounkowo krótki, nie dysponujemy danymi odnoÊnie odleg∏ych skutków
przyjmowania leku.
Jednym z objawów ubocznych obserwowanych cz´Êciej u pacjentów
z GIST w porównaniu z chorymi na CML jest krwawienie z przewodu
pokarmowego, które nie wydaje si´ zwiàzane z dawkà leku. W II fazie
badania masywne krwawienie w stopniu 3/4 z przewodu pokarmowego
lub do guza wystàpi∏o u 5% pacjentów. Mo˝liwoÊç wystàpienia krwotoku
z przewodu pokarmowego, zagra˝ajàcego ˝yciu, stwarza koniecznoÊç
troskliwej obserwacji klinicznej chorych w kierunku objawów krwawienia
z przewodu pokarmowego, zw∏aszcza w ciàgu pierwszych kilku miesi´cy
leczenia preparatem Glivec
®
.
Glivec
®
by∏ ogólnie dobrze tolerowany we wszystkich badaniach
klinicznych GIST a stwierdzane objawy niepo˝àdane
charakteryzowa∏y si´ niewielkim lub Êrednim nasileniem.
26,28,29,42

38
U pacjentów z GIST obserwowano równie˝ objawy zatrzymywania p∏ynów
i obrz´ki. Powa˝ne obrz´ki powierzchowne (tj okolicy oczodo∏ów i koƒczyn
dolnych) oraz objawy zatrzymywania p∏ynów (jak wysi´k w op∏ucnej, obrz´k
p∏uc, p∏yn w otrzewnej) stwierdzano w 1% do 6% pacjentów z GIST
przyjmujàcych Glivec
®
.
W sumie zastosowanie preparatu Glivec
®
w leczeniu pacjentów
z nieoperacyjnym lub przerzutowym GIST po∏àczone by∏o z wyst´powaniem
niewielkich lub o Êrednim nasileniu objawów ubocznych, natomiast wiekszoÊç
chorych odczuwa∏a szybkie ustàpienie dolegliwoÊci i znacznà popraw´ jakoÊci
˝ycia.
Farmakokinetyka
U pacjentów z GIST przeprowadzono analizy farmakokinetyczne w czasie
sta∏ego podawania doustnego preparatu Glivec
®
jeden raz dziennie. Wyniki
wst´pne wykazywa∏y, ˝e profil farmakokinetyczny pacjentów z GIST by∏
podobny jak u pacjentów z CML oraz zdrowych ochotników. Glivec
®
jest szybko
wch∏aniany a Cmax wynosi 2,9 ng/mL w stanie równowagi przy podawanieu
codziennie dawki 400 mg doustnie. Okres po∏ówkowego rozpadu nast´powa∏
po 18 godzinach a po 1 miesiàcu stosowania leku obserwowano
1,5 – 2,5 – krotnà kumulacj´ leku. WartoÊci AUC0-24 wynosi∏y
24,748 ng. h/mL w stanie równowagi przy podawaniu dawki 400 mg.
26,42
Wyniki badaƒ farmakokinetycznych pozwalajà na przyjmowanie leku Glivec
®
doustnie jeden raz dziennie.
Interakcje leku 26,42
Glivec
®
jest metabolizowany w wàtrobie przez enzym CYP3A4, nale˝àcy do
rodziny enzymów cytochromu P450. Ponadto badania in vitro wykaza∏y, ˝e
Glivec
®
jest wspó∏zawodniczàcym inhibitorem enzymów CYP2C9, CYP2D6
i CYP3A4. Substancje, które hamujà aktywnoÊç izoenzymu CYP3A4
cytochromu P450 mogà zmniejszaç metabolizm i podwy˝szaç st´˝enie leku
Glivec
®
w surowicy. Podobnie leki pobudzajàce CYP3A4 mogà zwi´kszaç
metabolizm preparatu Glivec
®
i obni˝aç jego st´˝enie w surowicy. Dlatego
nale˝y zwracaç szczególnà uwag´ przy stosowaniu leku Glivec
®
z inhibitorami
lub induktorami enzymów rodziny CYP3A4 (Tabela 4).
Glivec
®
zwi´ksza ekspozycj´ na symwastatyn´ (substrat CYP3A4), co sugeruje
mo˝liwoÊç zahamowania jego metabolizmu przez izoenzym CYP3A4.

39
W zwiàzku z tym zaleca si´ szczególnà uwag´ przy ∏àczeniu leku Glivec
®
z substratami CYP3A4 o niskim indeksie terapeutycznym. Ponadto nale˝y
przestrzec pacjentów, aby unikali lub ograniczyli przyjmowanie leków
recepturowych czy znajdujàcych si´ w wolnej sprzeda˝y, które zawierajà
paracetamol, czyli acetaminophen. In vitro Glivec
®
hamuje aktywnoÊç
izoenzymu CYP2D6 cytochromu P450 w st´˝eniu zbli˝onym do tego, przy
którym hamuje aktywnoÊç CYP3A4. W zwiàzku z tym systemowa
ekspozycja na substraty CYP2D6 ulega równie˝ znacznemu zwi´kszeniu
przy jednoczesnym podawaniu leku Glivec
®
(Tabela 4).
Tabela 4. Przyk∏ady najcz´stszych leków recepturowych metabolizowanych przez
izoenzymy CYP3A4, CYP2C9 i CYP2D6: substraty, inhibitory i induktory (lista
niekompletna)
52
Substraty
Leki przeciwdepresyjne
Leki przeciwwymiotne
(np, ondansetron)
Leki antypsychotyczne
Beta-blokery
Kodeina
Dextromethorphan
Flecainide
Morphine
Blokery kana∏u wapniowego
pochodne dihydropirydyny
Kodeina
Niektóre inhibitory
reduktazy HMG-CoA
(np.statyny)
Granisetron
Modulatory immunologiczne
(np. cyklosporyna)
Doustne Êrodki antykoncepc.
Paracetamol
Warfaryna
Niektóre blokery
angiotensyny II
Diklofenak
Ibuprofen
Fenytoina
Warfaryna
Izoenzym
CYP2D6
CYP3A4
CYP2C9
Inhibitory
Celecoxib
Cymetydyna
Fluoksetyna
Paroksetyna
Chinidyna
Rytonawir
Cymetydyna
Klarytromycyna
Erytromycyna
Sok grapefruitowy
Itrakonazol
Ketokonazol
Amiodaron
Cymetydyna
Lowastatyna
Tenipozyd
Induktory
Deksametazon
Karbamazepina
Deksametazon
Fenobarbital
Fenytoina
Ryfampicyna
Dziurawiec
zwyczajny
Ryfampicyna
Sekobarbital

40
OdpornoÊç na Glivec
®®
D∏ugofalowe obserwacje pozwolà na ustalenie odsetka progresji po poczàtkowej
odpowiedzi na lek lub opornoÊci u pacjentów z GIST leczonych preparatem
Glivec
®
. Do chwili obecnej kliniczna opornoÊç na Glivec
®
, okreÊlana jako utrata
poprzednio uzyskanej odpowiedzi w czasie sta∏ego podawania leku, by∏a
obserwowana g∏ównie u pacjentów w zaawansowanej fazie CML. Ostatnio
zidentyfikowano kilka mechanizmów, które wyjaÊniajà rozwój opornoÊci
w czasie szpikowego prze∏omu blastycznego w CML
53
Nie wiemy, czy w GIST
wyst´pujà podobne mechanizmy opornoÊci.

41
Protokó∏y badawcze:
Glivec
®
w leczeniu innych guzów litych
Glivec
®
jest nie tylko silnym inhibitorem c-kit, ale ponadto hamuje równie˝
aktywnoÊç receptora p∏ytkopochodnego czynnika wzrostu (platelet-derived
growth factor receptor – PDGF-R) kinazy tyrozynowej. AktywnoÊç lecznicza
w GIST przedstawia pierwszy „dowód koncepcji „dzia∏ania preparatu
Glivec
®
dla leczenia innych guzów litych.
W tabeli 5 podano przyk∏ady z∏oÊliwych nowotworów, zwiàzanych
z zaburzeniem przekazywania sygna∏ów przez c-kit i /lub PDGF-R
Tabela 5. Wybrane z∏oÊliwe schorzenia nowotworowe, w których PDGF-R lub c-Kit
mogà mieç zwiàzek z ich patogenezà
PDGF-R
c-Kit
GIST
3
Glejak
3
?
Rak prostaty
3
?
Drobnokomórkowy rak p∏uca
3
Breast cancer
?
3
Zespo∏y mieloproliferacyjne/mielo-
-dysplastyczne t(5;X)
3
Zw∏óknienie szpiku
3
Mi´sak
3
3
Guz zarodkowy jàdra
3
Szpiczak
?
3
Czerniak
3
SCLC = small-cell lung cancer; MPD/MDS = myeloproliferative disorders/myelodysplastic syndrome.

42
Wnioski
Glivec
®
jest pierwszym naukowo opracowanym inhibitorem kinazy tyrozynowej,
który zosta∏ zatwierdzony do u˝ytku klinicznego w leczeniu
przeciwnowotworowym. Zastosowanie tego leku do leczenia GIST stanowi
przewrót w systemowej terapii guzów litych i odzwierciedla poczatkowy sukces
tego leku w leczeniu CML. WÊród guzów litych GIST stanowià szczególnie
odpowiedni cel dla dzia∏ania leku Glivec
®
z powodu niemal powszechnej
obecnoÊci c-kit. Przewa˝ajàca wi´kszoÊç komórek GIST wykazuje ekspresj´
receptora c-kit kinazy tyrozynowej i specyficzne mutacje genu c-kit sà
w znacznym stopniu zwiàzane z patogenezà i z∏oÊliwym przebiegiem tych
nowotworów.
Glivec
®
jest wybiórczym i silnym inhibitorem c-kit kinazy tyrozynowej. Glivec
®
okaza∏ si´ skuteczny w leczeniu nieoperacyjnych, przerzutowych GIST dajàc
udokumentowane trwa∏e zahamowanie choroby i mo˝liwoÊç znacznej poprawy
jakoÊci ˝ycia chorych. Badania kliniczne wykaza∏y, ˝e w sumie ponad 81%
pajentów odnios∏o korzyÊç z leczenia preparatem Glivec
®
– u ponad 40%
pacjentów uzyskano i utrzymano udokumentowanà odpowiedê cz´Êciowà
a u dodatkowych 41,5% pacjentów utrzymujacà si´ stabilizacj´ choroby.
W badaniach klinicznych Glivec
®
by∏ dobrze tolerowany wykazujàc korzystny
profil objawów ubocznych; obserwowane objawy mia∏y przewa˝nie charakter
lekki lub o Êrednim nasileniu. Jako jedyny bezpieczny i skuteczny lek stosowany
ogólnie, Glivec
®
stanowi znaczàcy post´p w zestawie leków skierowanych
przeciw guzom litym. Ponadto powy˝sze wyniki czynià wiarygodnà koncepcj´,
która zak∏ada, ˝e celowane dzia∏anie hamujàce na poziomie molekularnym
dzia∏anie czàsteczek zwiàzanych z patogenezà guzów litych mo˝e spowodowaç
remisj´ nowotworu, która nigdy przedtem nie by∏a mo˝liwa.
Zastosowanie inhibitora kinazy tyrozynowej Glivec
®
w leczeniu GIST stanowi prze∏om w systemowym leczeniu
guzów litych i powtarza poczàtkowy sukces tego leku
uzyskany w leczeniu CML.

43
PiÊmiennictwo
1. Buchdunger E, Cioffi CL, Law N, et al. Abl protein-tyrosine kinase inhibitor STI571
inhibits in vitro signal transduction mediated by c-kit and platelet-derived growth
factor receptors. J Pharmacol Exp Ther. 2000;295:139-145.
2. Heinrich MC, Griffith DJ, Druker BJ, et al. Inhibition of c-kit receptor tyrosine
kinase activity by STI 571, a selective tyrosine kinase inhibitor. Blood.
2000;96:925-932.
3. Miettinen M, Sarlomo-Rikala M, Lasota J. Gastrointestinal stromal tumors: recent
advances in understanding of their biology. Hum Pathol. 1999;30:1213-1220.
4. Miettinen M, Lasota J. Gastrointestinal stromal tumors—definition, clinical,
histological, immunohistochemical, and molecular genetic features and
differential diagnosis. Virchows Arch. 2001;438:1-12.
5. Pierie JP, Choudry U, Muzikansky A, et al. The effect of surgery and grade on
outcome of gastrointestinal stromal tumors. Arch Surg. 2001;136:383-389.
6. Plaat BE, Hollema H, Molenaar WM, et al. Soft tissue leiomyosarcomas and malignant
gastrointestinal stromal tumors: differences in clinical outcome and expression of
multidrug resistance proteins. J Clin Oncol. 2000;18:3211-3220.
7. Berman J, O'Leary TJ. Gastrointestinal stromal tumor workshop. Hum Pathol.
2001;32:578-582.
8. Nishida T, Hirota S. Biological and clinical review of stromal tumors in the
gastrointestinal tract. Histol Histopathol. 2000;15:1293-1301.
9. Pidhorecky I, Cheney RT, Kraybill WG, et al. Gastrointestinal stromal tumors:
current diagnosis, biologic behavior, and management. Ann Surg Oncol.
2000;7:705-712.
10. Chan JK. Mesenchymal tumors of the gastrointestinal tract: a paradise for acronyms
(STUMP, GIST, GANT, and now GIPACT), implication of c-kit in
genesis, and yet another of the many emerging roles of the interstitial cell of Cajal in
the pathogenesis of gastrointestinal diseases? Adv Anat Pathol. 1999;6:19-40.
11. Flanagan JG, Leder P. The kit ligand: a cell surface molecule altered in steel mutant
fibroblasts. Cell. 1990;63:185-194.
12. Williams DE, Eisenman J, Baird A, et al. Identification of a ligand for the c-kit proto-
oncogene. Cell. 1990;63:167-174.
13. Yarden Y, Kuang WJ, Yang-Feng T, et al. Human proto-oncogene
c-kit: a new cell surface receptor tyrosine kinase for an unidentified ligand.
EMBO J. 1987;6:3341-3351.
14. Matsuda R, Takahashi T, Nakamura S, et al. Expression of the c-kit protein in
human solid tumors and in corresponding fetal and adult normal tissues.
Am J Pathol. 1993;142:339-346.
15. Tsuura Y, Hiraki H, Watanabe K, et al. Preferential localization of c-kit product in
tissue mast cells, basal cells of skin, epithelial cells of breast, small cell lung
carcinoma and seminoma/dysgerminoma in human: immunohistochemical study on
formalin-fixed, paraffin-embedded tissues. Virchows Arch. 1994;424:135-141.
16. Thomsen L, Robinson TL, Lee JC, et al. Interstitial cells of Cajal generate
a rhythmic pacemaker current. Nat Med. 1998;4:848-851.
17. Sircar K, Hewlett BR, Huizinga JD, et al. Interstitial cells of Cajal as precursors of
gastrointestinal stromal tumors. Am J Surg Pathol. 1999;23:377-389.
18. Qiu FH, Ray P, Brown K, et al. Primary structure of c-kit: relationship with the CSF-
1/PDGF receptor kinase family—oncogenic activation of v-kit involves deletion of
extracellular domain and C terminus. EMBO J. 1988;7:1003-1011.

44
19. Buchdunger E, Zimmermann J, Mett H, et al. Inhibition of the Abl protein-tyrosine kinase
in vitro and in vivo by a 2-phenylaminopyrimidine derivative. Cancer Res. 1996;56:100-
104.
20. Taylor ML, Metcalfe DD. Kit signal transduction. Hematol Oncol Clin North Am.
2000;14:517-535.
21. Longley BJ, Reguera MJ, Ma Y. Classes of c-KIT activating mutations: proposed
mechanisms of action and implications for disease classification and therapy.
Leuk Res. 2001;25:571-576.
22. Hines SJ, Litz JS, Krystal GW. Coexpression of c-kit and stem cell factor in breast cancer
results in enhanced sensitivity to members of the EGF family of growth
factors. Breast Cancer Res Treat. 1999;58:1-10.
23. Ikeda H, Kanakura Y, Tamaki T, et al. Expression and functional role of the proto-oncogene
c-kit in acute myeloblastic leukemia cells. Blood. 1991;78:2962-2968.
24. Wang WL, Healy ME, Sattler M, et al. Growth inhibition and modulation of kinase
pathways of small cell lung cancer cell lines by the novel tyrosine kinase inhibitor STI 571.
Oncogene. 2000;19:3521-3528.
25. Bellone G, Carbone A, Sibona N, et al. Aberrant activation of c-kit protects
colon carcinoma cells against apoptosis and enhances their invasive potential. Cancer Res.
2001;61:2200-2206.
26. Data on file. Novartis Pharma AG, Basel, Switzerland, 2002.
27. Sarlomo-Rikala M, Kovatich AJ, Barusevicius A, et al. CD117: a sensitive
marker for gastrointestinal stromal tumors that is more specific than CD34.
Mod Pathol. 1998;11:728-734.
28. Joensuu H, Roberts PJ, Sarlomo-Rikala M, et al. Effect of the tyrosine kinase inhibitor
STI571 in a patient with a metastatic gastrointestinal stromal tumor.
N Engl J Med. 2001;344:1052-1056.
29. van Oosterom AT, Judson I, Verweij J, et al. Safety and efficacy of imatinib (STI571) in
metastatic gastrointestinal stromal tumours: a phase I study.
Lancet. 2001;358:1421-1423.
30. van den Abbeele AD, for the GIST Collaborative PET Study Group at OHSU;
Dana-Farber Cancer Institute. F18-FDG-PET provides early evidence of biological response
to STI571 in patients with malignant gastrointestinal stromal tumors (GIST). Proc Am Soc
Clin Oncol. 2001;20:362a. Poster 1444.
31. Lasota J, Jasinski M, Sarlomo-Rikala M, et al. Mutations in exon 11 of c-kit occur
preferentially in malignant versus benign gastrointestinal stromal tumors and do not occur
in leiomyomas or leiomyosarcomas. Am J Pathol. 1999;154:53-60.
32. Taniguchi M, Nishida T, Hirota S, et al. Effect of c-kit mutation on prognosis of
gastrointestinal stromal tumors. Cancer Res. 1999;59:4297-4300.
33. Hirota S, Isozaki K, Nishida T, et al. Effects of loss-of-function and gain-of-
function mutations of c-kit on the gastrointestinal tract. J Gastroenterol. 2000;35(suppl
XII):75-79.
34. Lux ML, Rubin BP, Biase TL, et al. KIT extracellular and kinase domain mutations in
gastrointestinal stromal tumors. Am J Pathol. 2000;156:791-795.
35. Hirota S, Isozaki K, Moriyama Y, et al. Gain-of-function mutations of c-kit in human
gastrointestinal stromal tumors. Science. 1998;279:577-580.
36. Nishida T, Hirota S, Taniguchi M, et al. Familial gastrointestinal stromal tumours with
germline mutation of the KIT gene. Nat Genet. 1998;19:323-324.
37. El-Rifai W, Sarlomo-Rikala M, Andersson LC, et al. DNA sequence copy number changes
in gastrointestinal stromal tumors: tumor progression and prognostic
significance. Cancer Res. 2000;60:3899-3903.

45
38. Casper ES. Gastrointestinal stromal tumors. Curr Treat Options Oncol.
2000;1:267-273.
39. Knoop M, St Friedrichs K, Dierschke J. Surgical management of gastrointestinal
stromal tumors of the stomach. Langenbecks Arch Surg. 2000;385:194-198.
40. Demetri GD. Targeting c-kit mutations in solid tumors: scientific rationale and novel
therapeutic options. Semin Oncol. 2001;28(suppl 17):19-26.
41. Joensuu H, Dimitrijevic S. Tyrosine kinase inhibitor imatinib (STI571) as an
anticancer agent for solid tumours. Ann Med. 2001;33:451-455.
42. Glivec
®
(imatinib) Summary of Product Characteristics. Novartis Pharma AG, Basel,
Switzerland, 2002.
43. Druker BJ, Tamura S, Buchdunger E, et al. Effects of a selective inhibitor
of the Abl tyrosine kinase on the growth of Bcr-Abl positive cells. Nat Med.
1996;2:561-566.
44. Schindler T, Bornmann W, Pellicena P, et al. Structural mechanism for STI-571
inhibition of abelson tyrosine kinase. Science. 2000;289:1938-1942.
45. Tuveson DA, Willis NA, Jacks T, et al. STI571 inactivation of the gastrointestinal
stromal tumor c-KIT oncoprotein: biological and clinical implications. Oncogene.
2001;20:5054-5058.
46. Therasse P, Arbuck SG, Eisenhauer EA, et al. New guidelines to evaluate the
response to treatment in solid tumors. J Natl Cancer Inst. 2000;92:205-216.
47. van Oosterom AT, Judson I, Verweij J, et al. Update of the imatinib (STI571, Glivec)
phase 1 study in gastrointestinal stromal tumours (GISTs). Proc Am Soc Clin Oncol.
2002;21:82a. Abstract 327.
48. Green S, Weiss GR. Southwest Oncology Group standard response criteria,
endpoint definitions and toxicity criteria. Invest New Drugs. 1992;10:239-253.
49. Demetri GD, von Mehren M, Blanke CD, et al. Efficacy and safety of imatinib
mesylate in advanced gastrointestinal stromal tumors. N Engl J Med.
2002;347:472-480.
50. EORTC protocol 62005. Phase III randomised, intergroup, international
trial assessing the clinical activity of STI-571 at two dose levels in
patients with unresectable or metastatic gastrointestinal stromal
tumours (GIST) expressing the KIT receptor tyrosine kinase (CD117). Available at:
http://www.eortc.be/protoc/details.asp?protocol=62005. Accessed 26 July 2002.
51. Phase III randomized study of two different doses of STI571 in patients
with CD117-expressing metastatic or unresectable gastrointestinal
stromal tumor (summary last modified 05/2002). Available at:
http://www.cancer.gov/clinical_trials/view_clinicaltrials.aspx?version=health+
professional&args=6;5f5a5130-1e57-4f7f-8312-e0290e8e28a5.
Accessed 26 July 2002.
52. Lacy CF, Armstrong LL, Goldman MP, et al. Drug Information Handbook.
9th ed. Cleveland, OH: Lexi-Comp, Inc.; 2001:1376-1384.
53. Gorre ME, Mohammed M, Ellwood K, et al. Clinical resistance to
STI-571 cancer therapy caused by BCR-ABL gene mutation or amplification.
Science. 2001;293:876-880.
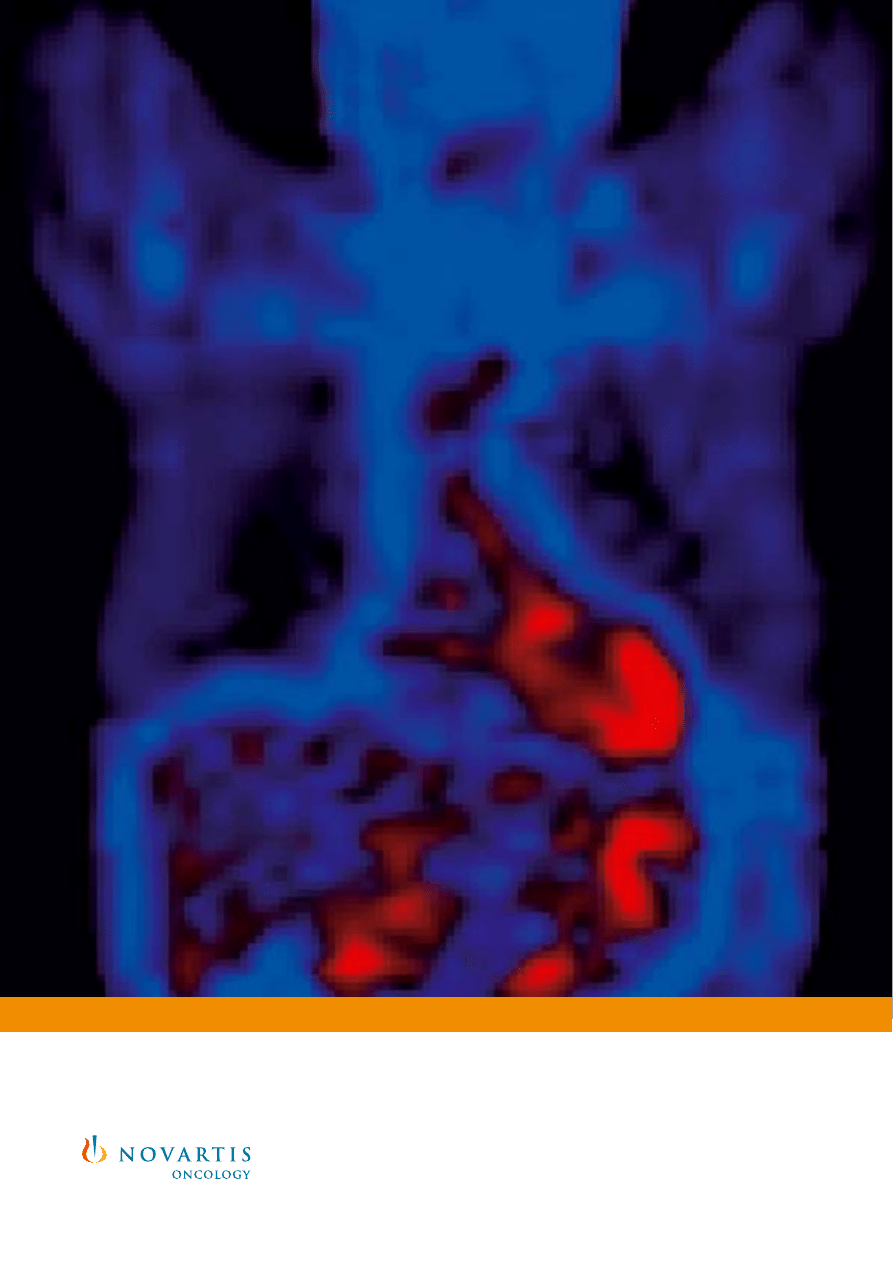
NOVARTIS POLAND Sp. z o.o., 00-710 Warszawa, Al. Witosa 31, tel. (22) 550 88 88, fax (22) 550 87 13
Wyszukiwarka
Podobne podstrony:
Nowotwory ukł pokarm
Pytania z nowotworów ukł pokarmowego
Nowotwory przewodu pokarmowego
W7 Nowotwory przewodu pokarmowego, Medycyna Ratunkowa - Ratownictwo Medyczne
Nowotwory przewodu pokarmowego ppt
Nowotwory przewodu pokarmowego 1
Nowotwory przewodu pokarmowego 3
nowotwory przewodu pokarmowego
Nowotwory przewodu pokarmowego
Skrining nowotworow przewodu pokarmowego
Nowotwory przewodu pokarmowego (2)
chemioterapia nowotworów przewodu pokarmowego
Nowotwory układu pokarmowego
chirurgia nowotwory przewodu pokarmowego
NOWOTWORY UKŁADU POKARMOWEGO
Nowotwory w układzie pokarmowym psa
Choroby przełyku, wrzodowa; Przewlekłe zapalne choroby jelit; Nowotwory przewodu pokarmowego
więcej podobnych podstron