
Biochemia
opracowanie do egzaminu
2010/2011
1 z 37

Spis treści
1. Białka ...............................................................................................................................................4
1.1 Dlaczego hemoglobina w przeciwieństwie do mioglobiny jest białkiem allosterycznym?......4
1.2 Wpływ braku heksokinazy na wiązanie tlenu w erytrocycie.....................................................5
1.3 Glikoproteiny a Proteoglikany – struktura i funkcje.................................................................5
1.4 Kolagen i kreatyna.....................................................................................................................6
1.5 Fałdowanie białek......................................................................................................................7
1.6 Co stabilizuje strukturę białek?..................................................................................................7
1.8 Białka posiadające hem jako grupę prostetyczną, funkcje........................................................7
1.9 Degradacja białek......................................................................................................................8
1.10 Sekwencjonowanie peptydów..................................................................................................8
1.11 Porównanie alfa-helisy i beta-harmonijki................................................................................9
2. Lipidy...............................................................................................................................................9
2.1 Co to jest amfipatyczność lipidów? Jakie ma biologiczne znaczenie? Jakie jest jej
praktyczne wykorzystanie? .............................................................................................................9
2.2 Lipogeneza a beta-oksydacja.....................................................................................................9
2.3 Podział lipidów........................................................................................................................10
3. Enzymy...........................................................................................................................................11
3.1 Omów enzymy reakcji oksydacyjno-redukcyjnych.................................................................11
3.2 Mechanizm regulacji allosterycznej i kowalencyjnej..............................................................11
3.3 Kompleksy wieloenzymatyczne, przykłady............................................................................12
3.4 Inhibicja kompetycyjna i niekompetycyjna.............................................................................12
3.5 Koenzym, kofaktor, kosubstrat................................................................................................12
3.6 Podział enzymów i nomenklatura............................................................................................13
3.7 Szybkość reakcji enzymatycznej.............................................................................................13
4. Metabolizm energetyczny...............................................................................................................15
4.1 Wymień pompy protonowe w łańcuchu oddechowym i wyjaśnij na czym polega proces
pompowania...................................................................................................................................15
4.2 Fosforylacja oksydacyjna. Enzym. Rozprzęganie fosforylacji................................................15
4.3 Wyjaśnij stwierdzenie „Tłuszcze spalają się w ogniu węglowodanów”.................................16
4.4 Kontrola glikogenogenezy i glikogenolizy..............................................................................17
4.5 Regulacja ketogenezy..............................................................................................................18
4.6 Kontrola lipogenezy.................................................................................................................18
4.7 Glikoliza – kluczowe reakcje i kontrola..................................................................................18
4.8 Glukoneogeneza – reakcje nieodwracalne i kontrola..............................................................18
4.9 Szlak pentozofosforanowy.......................................................................................................19
4.10 Specyfika narządowa przemian ............................................................................................19
4.11 Rola acetylo-CoA...................................................................................................................20
4.12 Cykl Corich............................................................................................................................20
4.13 Budowa mitochodnium..........................................................................................................21
4.14 Lokalizacja szlaków metabolicznych....................................................................................21
4.15 Regulacja cyklu kwasu cytrynowego. Kluczowe etapy.........................................................21
4.16 Dehydrogenaza pirogronianowa i alfa-ketoglutaranowa.......................................................21
4.17 Fosforylacja substratowa, reakcje glikolizy dostarczające ATP.............................................22
4.18 Anabolizm i katabolizm cyklu kwasu cytrynowego..............................................................22
4.19 NADPH – gdzie jest syntetyzowany i do czego zużywany...................................................23
4.20 Bilans zysków i strat metabolizmu węglowodanów..............................................................23
2 z 37

4.21 Strategie metaboliczne...........................................................................................................23
5. Metabolizm nieenergetyczny..........................................................................................................24
5.1 Jaki związek jest donorem rybozofosforanów w syntezie kwasów nukleinowych? W jakiej
reakcji on powstaje?.......................................................................................................................24
5.2 Która reakcja biosyntezy cholesterolu jest wykorzystywana w terapii arteriosklerozy? .......24
5.3 Wymień produkty degradacji szkieletów węglowych aminokwasów. Wyjaśnij pojęcie
aminokwasów gluko- i ketogennych.............................................................................................25
5.4 Aminokwasy jako prekursory związków biologicznie czynnych............................................26
5.5 Synteza i degradacja hemu......................................................................................................26
5.6 Degradacja aminokwasów.......................................................................................................27
5.7 Reakcje I fazy i ich efekty.......................................................................................................28
5.8 Reakcje drugiej fazy i ich efekty.............................................................................................28
5.9 Reakcje przeprowadzane przez CYP450.................................................................................28
5.10 Charkterystyka i znaczenie CYP450.....................................................................................29
5.11 Polimorfizm na przykładzie CYP450....................................................................................29
5.12 Znaczenie witaminy D3.........................................................................................................29
5.13 Cykl mocznikowy..................................................................................................................29
5.14 Szlaki umożliwiające współpracę narządową........................................................................30
5.15 Poliaminy...............................................................................................................................30
5.16 Glutation................................................................................................................................31
5.17 Tlenek azotu...........................................................................................................................31
6. Genetyka.........................................................................................................................................31
6.1 Polimerazy DNA u Prokaryota i Eukaryota – podobieństwa i różnice....................................31
6.2 Porównanie Polimerazy I DNA i Polimerazy RNA.................................................................33
6.3 Potranslacyjne modyfikacje białek..........................................................................................33
6.4 Modyfikacje potranskrypcyjne mRNA....................................................................................33
6.5 Składniki konieczne do inicjacji replikacji:.............................................................................34
6.6 Aminoacylotransferaza tRNA..................................................................................................34
6.7 Co wchodzi w skład kompleksu inicjującego translację u Prokaryota....................................34
6.8 Enzymy konstytutywne i indukowane.....................................................................................35
6.9 Operon lac. Na jego podstawie opisać jak działa operon. Różnica między operon
tryptofanowym...............................................................................................................................35
6.10 Czynniki transkrypcyjne........................................................................................................35
6.11 Mechanizmy kontrolujące wierną replikację.........................................................................36
6.12 Hybrydyzacja DNA...............................................................................................................36
6.13 Semikonserwatywna replikacja.............................................................................................36
6.14 Organizacja DNA u Prokariota i Eukariota...........................................................................36
6.15 Transkrypcja u Prokariota i Eukaryota..................................................................................37
3 z 37
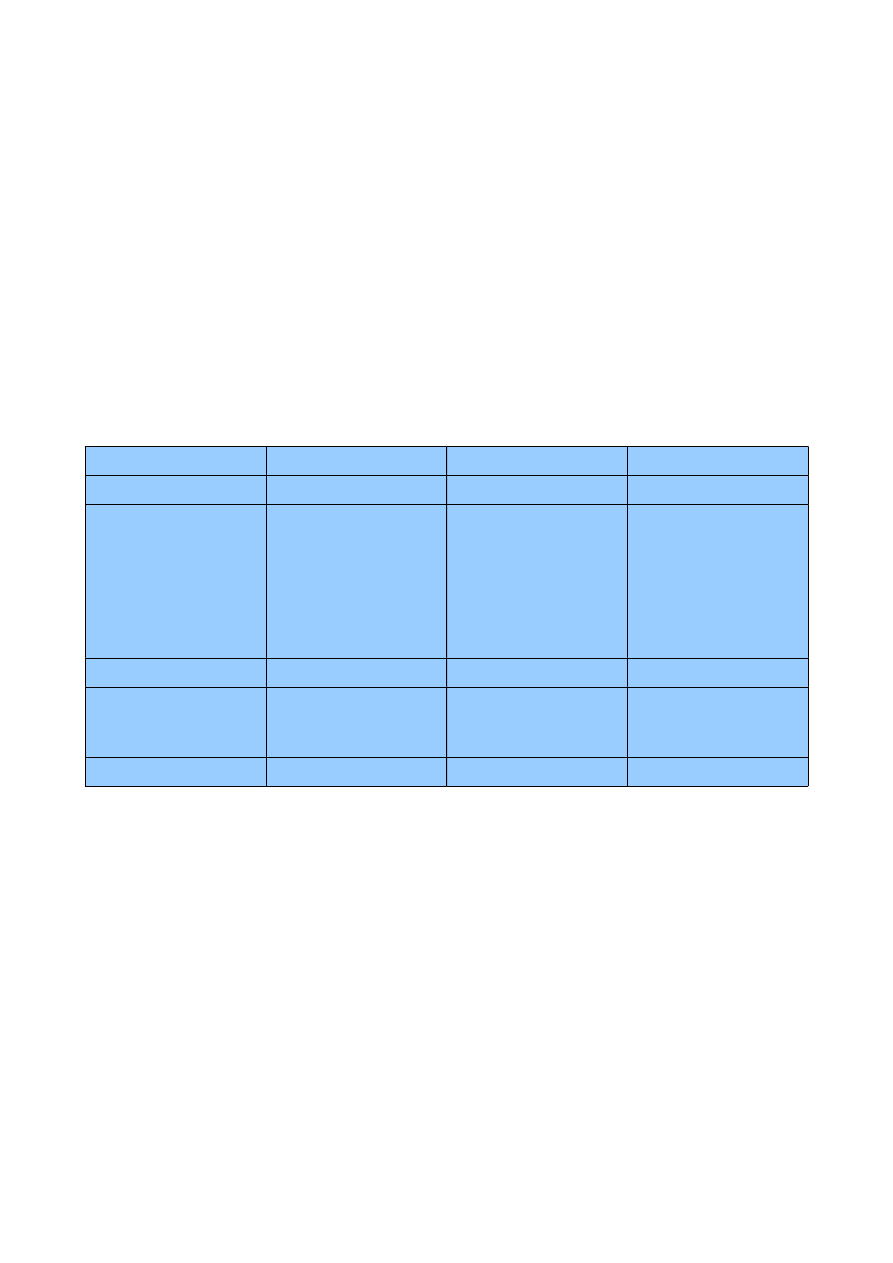
1. Białka
1.1 Dlaczego hemoglobina w przeciwieństwie do mioglobiny jest
białkiem allosterycznym?
Allosteria w hemoglobinie – jony H
+
, CO
2
a także fosforany regulują powinowactwo tlenu do
hemoglobiny poprzez wiązanie się z miejscem w białku (centrum allosteryczne) oddalonym od
miejsca wiązania tlenu,
Wpływ czynników allosterycznych:
–
obecność H
+
, CO
2
, BPG (2,3-bisfosfoglicerynian), wysoka temperatura obniża
powinowactwo hemoglobiny do tlenu,
–
obecność O
2
podnosi powinowactwo hemoglobiny do tlenu,
hemoglobina
mioglobina
grupa prostetyczna
hem
hem
struktura
- dwa łańcuchy α i dwa
β,
- zwarta, głównie α-
helisa,
- wewnątrz
aminokwasy
niepolarne, na zewnątrz
polarne (fałdowanie
białek),
łańcuchy α, β, γ i inne
zbliżone budową do
struktury mioglobiny,
allosteria
tak
nie
wiązanie tlenu
kooperatywne
niekooperatywne
mioglobina ma wieksza
powinowactwo do
tlenu,
inne substraty
H
+
, CO
2,
-
a) Hemoglobina płodowa (F) o strukturze α
2
γ
2
wykazuje większe powinowactwo do tlenu niż
hemoglobina dorosłego człowieka (A). Wyjaśnienie: Hemoglobina F słabiej wiążę BPG.
b) mechanizm wiązania kooperatywnego
–
w wyniku przyłączenia się tlenu do jednego z ugrupowań hemowych, dochodzi do zmian
strukturalnych w obrębie hemoglobiny,
–
żelazo przesuwa się do płaszczyzny porfiryny,
–
pociąga za sobą proksymalną histydynę,
–
itd.
–
w następstwie hemoglobina przyjmuje formę bardziej rozluźnioną (R-relaxed),
–
forma R wykazuje większe powinowactwo do substratu (mniejsze zawady przestrzenne?),
Mechanizm allosteryczny opiera się o stabilizację bądź destabilizację formy R hemoglobiny.
4 z 37

1.2 Wpływ braku heksokinazy na wiązanie tlenu w erytrocycie.
Heksokinaza jest enzymem katalizującym pierwszy etap glikolizy, czyli fosforylację glukozy do
glukozo-6-fosforanu. Niedobór heksokinazy, prowadzi do zahamowania glikolizy, a co za tym idzie
spadku jej intermediatów.
Jednym z takich intermediatów jest fosfodihydroksyaceton. W tym miejscu istnieje swoiste
„obejście” w szlaku glikolizy w erytrocytach. fosfodihydroksyaceton zostaje przekształcony w BPG
(2,3-bisfosfoglicerynian), pełniący funkcje regulatorowe (wpływa na fosfogliceromutazę). Okazuje
się jednak, że BPG jest także regulatorem allosterycznym hemoglobiny. BPG powoduje przejście
hemoglobiny z formy R w T, która wykazuje mniejsze powinowactwo do tlenu (uwolnienie tlenu).
Z tego względu niedobór heksokinazy a co za tym idzie niedobór BPG, powoduje zwiększenie
trwałości wiązania tlenu w erytrocycie, co jest niekorzystne dla tkanek.
1.3 Glikoproteiny a Proteoglikany – struktura i funkcje
Glikoproteiny są białkami złożonymi, do których przywiązane są kowalencyjnie proste lub
rozgałęzione łańcuchy oligosacharydowe. Zawartość elementów cukrowych waha się od 3 do ponad
50%. Glikoporoteiny wchodzą często w skład błon komórkowych i wówczas odpowiadają za
adhezję komórek, bądź też rozpoznawanie ich przez układ immunologiczny.
Proteoglikany to glikokoniugaty w których ilość elementów cukrowych przekracza 95%. W
odróżnieniu od glikoprotein proteoglikany zawierają długie nierozgałęzione łańcuchy GAG
przyłaczone do pojedynczego łańcucha polipeptydowego. Są składnikami substancji
pozakomórkowej.(GAG: kwas hialuronowy, siarczan chondroityny, siarczan heparanu, haparyna,
siarczan keratanu I i II, siarczan dermatanu,
Funkcje:
- są składnikiem macierzy pozakomórkowej,
- oddziałują z białkami adhezyjnymi takimi jak lamina
- wiążą polikationy i kationy - dochodzi do hydratacji tkanki łącznej i nadania jej odpowiedniego
napięcia,
- mają właściwości żelujące dzięki czemu jak sita wyłapują cząsteczki- uniemożliwiają poruszanie
się makrocząsteczkom przez substancje międzykomórkową,
- utrzymanie właściwej wytrzymałości i sprężystości chrząstki,
- specyficznie oddziałują z kolagenem i elastyną,
5 z 37
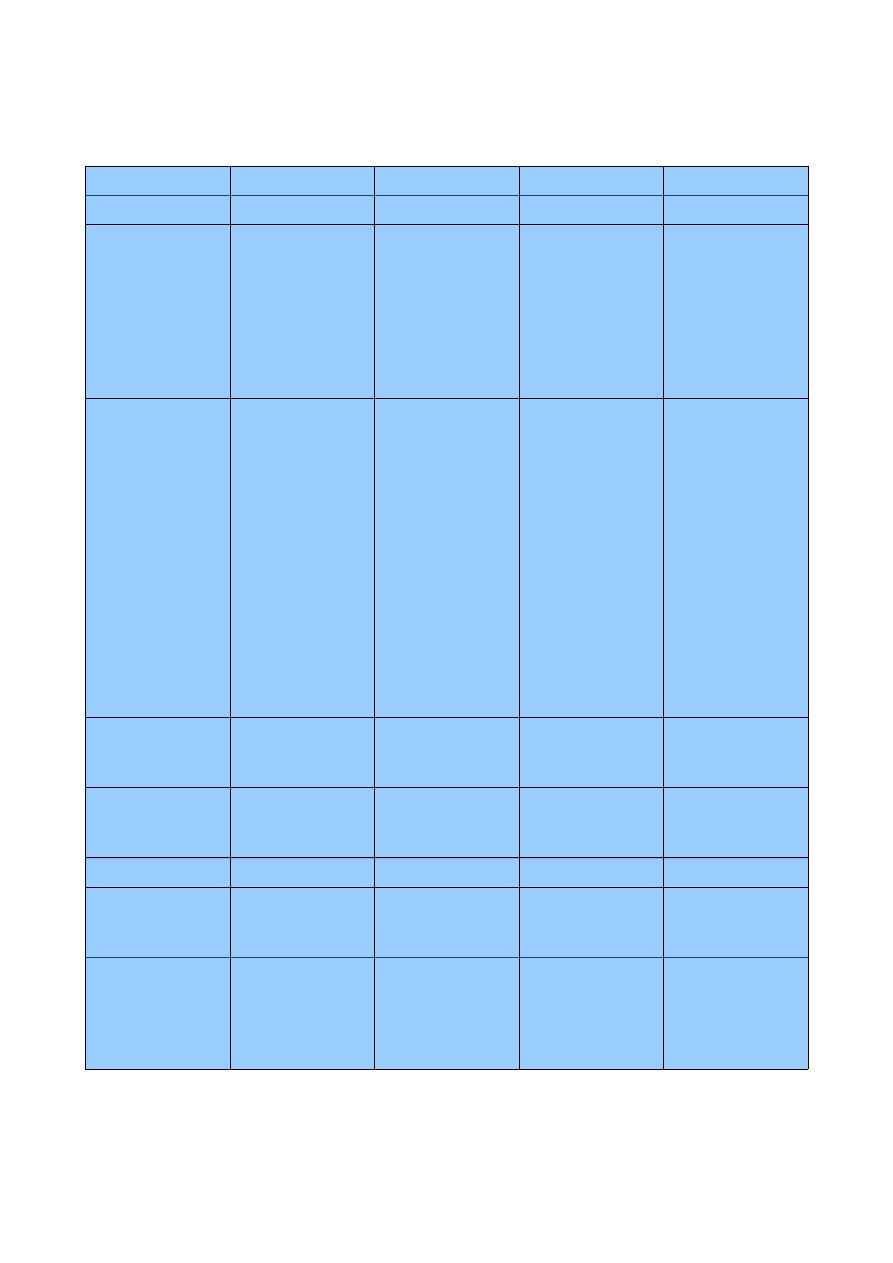
1.4 Kolagen i kreatyna
kolagen
keratyna
elastyna
fibroina
typ
fibrylarne,
fibrylarne
fibrylarne,
fibrylarne
struktura
potrójny heliks,
powtarzająca się
sekwencja Gly-X-
Y,
- alfa-helisowa
domena centralna,
N- i C- terminalna
domena
globularna,
- duża zawartość
aminokwasów
siarkowych,
- bezładne zwoje
umożliwiające
rozciąganie i
powrót do
pierwotnej
postaci,
- brak stałych
sekwencji,
antyrównoległa
beta-harmonijka,
Ala, Gly, Ser, Tyr,
stabilizacja
- tworzenie
kowalencyjnych
mostków
poprzecznych
(wiązania
aldolowe)
zarówno
wewnątrz
heliksów jak i
między nimi B
(rozciąganie),
- wiązania
wodorowe
pomiędzy
aminokwasami,
- struktura alfa-
helisowa jest
stabilizowana
wiązaniami
wodorowymi,
- domeny
globularne, a
także tworzące się
mostki siarczkowe
biorą udział w
asocjacji
łańcuchów w
dimery,
protofilamenty,
wewnątrzcząstecz
kowe poprzeczne
wiązania
desmozynowe,
wiązania
wodorowe
różnorodność
wiele różnych
typów
genetycznych ~10,
typ miękki i
twardy, ponadto
wiele izoform,
jeden typ
genetyczny
obecność
peptydów
wydłużających
- występuje w
formie pro-
nie
hydroksylizyna
tak
nie
występowanie
skóra, kości,
ścięgna, chrząstka
i inne
komórki naskórka,
wytwory skóry,
płuca, naczynia
krwionośne,
powięzi, skóra,
jedwab,
pajęczyna,
inne
asocjuje w dimery,
protofilamenty,
protofibryle,
filamenty
pośrednie,
6 z 37

1.5 Fałdowanie białek
Fałdowanie jest spontanicznym procesem przyjmowania przez białko struktury
przestrzennej. Jest ona determinowana przez strukturę liniową białka. Podstawę fałdowania
stanowią oddziaływania hydrofobowe/hydrofilowe – ugrupowania niepolarne struktury
polipeptydowej będą dążyły do tego by mieć jak najmniejszy kontakt z polarnym środowiskiem. W
związku z powyższym na powierzchni białka będą przeważały ugrupowania polarne. Dodatkowo w
procesie fałdowania tworzone są między innymi mostki disiarczkowe. Struktura przyjmowana
przez białko jest strukturą najbardziej korzystną termodynamicznie, w związku z tym białko może
przyjmować tylko jedną określoną strukturę natywną.
W warunkach in vitro fałdowanie zachodzi bez dodatkowych enzymów, co dowodzi, że jest
ono procesem samorzutnym. W warunkach in vivo udział biorą dodatkowe enzymy, przez co proces
ten jest szybszy.
1.6 Co stabilizuje strukturę białek?
a) siły elektrostatyczne
–
oddziaływania między dwoma grupami przeciwnie naładowanymi np. między grupą
aminową lizyny, a karboksylową asparaginian,
–
oddziaływania van der Waalsa – oddziaływania elektrostatyczne między trwałymi, bądź
indukowanymi dipolami,
b) wiązania wodorowe,
–
wiązania tworzące się między donorem i akceptorem protonów, jest to wiązanie
znacznie słabesze od kowalencyjnego ale znacznie silniejsze od van der Waalsa,
odgrywa istotną rolę w utrzymaniu struktury przestrzennej,
c) oddziaływania hydrofobowe
–
konkretnie unikanie kontaktu ugrupowań niepolarnych, ze środowiskiem wodnym,
stabilizują one strukturę białka w ten sposób, że wygenerowana, najbardziej korzystna
termodynamicznie struktura, zapewnia najmniejszy udział grup polarnych na
powierzchni zewnętrznej, a więc kontaktowej ze środowiskiem polarnym,
d) mostki disiarczkowe
–
wiązania kowalencyjne utworzone pomiędzy dwiema resztami cysteiny, mostki te
tworzą się w środowisku utleniającym,
kolagen (kowalencyjne wiązania poprzeczne),
keratyna (mostki disiarczkowe),
fibroina (wiązania wodorowe)
1.8 Białka posiadające hem jako grupę prostetyczną, funkcje.
a) hemoglobina – transport tlenu
b) mioglobina – magazynowanie tlenu
c) cytochrom c – transport elektronów w łańcuchu oddechowym,
d) oksydaza cytochromowa -
7 z 37

e) cytochrom P450 – metabolizm ksenobiotyków,
1.9 Degradacja białek
Część białek żyje bardzo krótko, a inne są bardziej stabilne. Największemu obrotowi są poddawane
białka sterujące metabolizmem. Ich zmiana pozwala na dostosowanie się komórki do nowych
warunków. Białka ulegają degradacji na skutek ich naturalnego zestarzenia, błędnej translacji, a
także uszkodzenia np. przez RFT.
Białka są naznaczane do degradacji poprzez ubikwityny. Ubikwityna posiada na C-końcu glicynę
która tworzy wiązanie izopeptydowe z grupą E-aminową lizyny.
Problemem pozostaje określenie czy dane białko jest odpowiednio stare by ulec degradacji.
Okazuje się, że okres półtrwania białek jest zależny od aminokwasu na N-końcu białka. Białka
zawierające metioninę żyje kilkadziesiąt godzin, a te z aminokwasami azotowymi (arginina) kilka
minut. Dodatkowo jeśli na końcu N występuje glutaminian lub asparaginian, reaguje ono z
arginylo-tRNA (przyłączona zostaje arginina, po przyłączeniu jest ono degradowane – średni czas
życia).
Białka naznaczone ubikwitynami są rozkładane przez kompleks proteazy 26S.
1.10 Sekwencjonowanie peptydów
Istnieją dwie metody sekwencjonowania peptydów:
a) reakcja Edmana,
–
I etapem jest zhydrolizowanie całego peptydu, a następnie chromatograficzne
rozdzielenie i oznaczenie powstałych aminokwasów – w ten sposób poznajemy skład
jakościowym,
–
właściwa reakcje Edmana polega na dodawaniu do r-ru peptydu fenyloizotiocyjanianiu,
który reaguje z N-końcową grupą aminową, w środowisku kwaśnym N-końcowy
aminokwas odłącza się od peptydu, tworząc z odczynnikiem swoistą pochodną,
–
otrzymaną pochodną można oznaczyć, lub porównać skład pierwotnego i wtórnego
peptydu (w ten sposób poznajemy N-końcowy aminokwas),
–
czynności należy powtarzać, aż do odczytania całej sekwencji (metoda jest przydatna
tylko do krótkocząsteczkowych peptydów, owszem peptydy można proteolitycznie
rozkładać do krótszych łańcuchów),
b) przy użyciu spektrometru MAS,
–
spektrometria MAS polega na fragmentacji cząsteczki, w przypadku peptydów, okazuje
się że najbardziej podatnym wiązaniem na rozbijanie jest wiązanie peptydowe – w ten
sposób otrzymujemy reszty aminokwasowe,
–
metoda MAS ma taką wadę, że za jej pomocą nie możliwe jest ustalenie czy dany
aminokwas jest leucyną/izoleucyną a także lizyną/glutaminą, bowiem te pary mają taką
samą masę molową,
8 z 37

1.11 Porównanie alfa-helisy i beta-harmonijki
alfa-helisa
beta-harmonijka
sposób stabilizacji
wiązanie wodorowe między
grupą CO aminokwasu n, a
grupą NH aminokwasu n+4,
należącego do tego samego
łańcucha,
wiązania wodorowe między
grupami CO i NH
aminokwasów należących do
dwóch różnych łańcuchów,
kształt
kształt cylindra, łańcuch
główny stanowi szkielet
cylindra, a łańcuchy boczne
wystają na zewnątrz, orientacja
prawoskrętna, na jeden obrót
helisy przypada 3,6 reszty
aminokwasów,
rozciągnięte łańcuchy
polipeptydowe sąsiadują ze
sobą, z powodu orientacji trans
wiązania peptydowego
struktura przypomina
harmonijkę, łańcuchy mogą
przebiegać w tym samym
(równoległa) bądź przeciwnym
kiernuku (antyrównoległa),
przykłady
keratyna, 75% mioglobiny,
miozyna, aktyna,
chymotrypsyna,
fibroina,
2. Lipidy
2.1 Co to jest amfipatyczność lipidów? Jakie ma biologiczne znaczenie? Jakie jest
jej praktyczne wykorzystanie?
Lipidy zbudowane są z apolarnego ogona i polarnej głowy. W środowisku wodnym układają się w
ten sposób aby głowy sąsiadowały ze środowiskiem polarnym, a ogony zostały od niego
odizolowane. W związku z powyższym dochodzi do uformowania dwuwarstwy, bądź też
sferycznych pęcherzyków.
W biologii opisane wyżej zjawisko umożliwia utworzenie błon komórkowych, a także struktur o
charakterze pęcherzyków (lizosomy, peroksysomy).
Z punktu widzenia praktycznego amfipatyczność lipidów wykorzystuje się do liposomów (terapia
genowa, kosmetologia, dermatologia).
2.2 Lipogeneza a beta-oksydacja
lipogeneza
beta-oksydacja
m-ce
cytozol
matrix
9 z 37
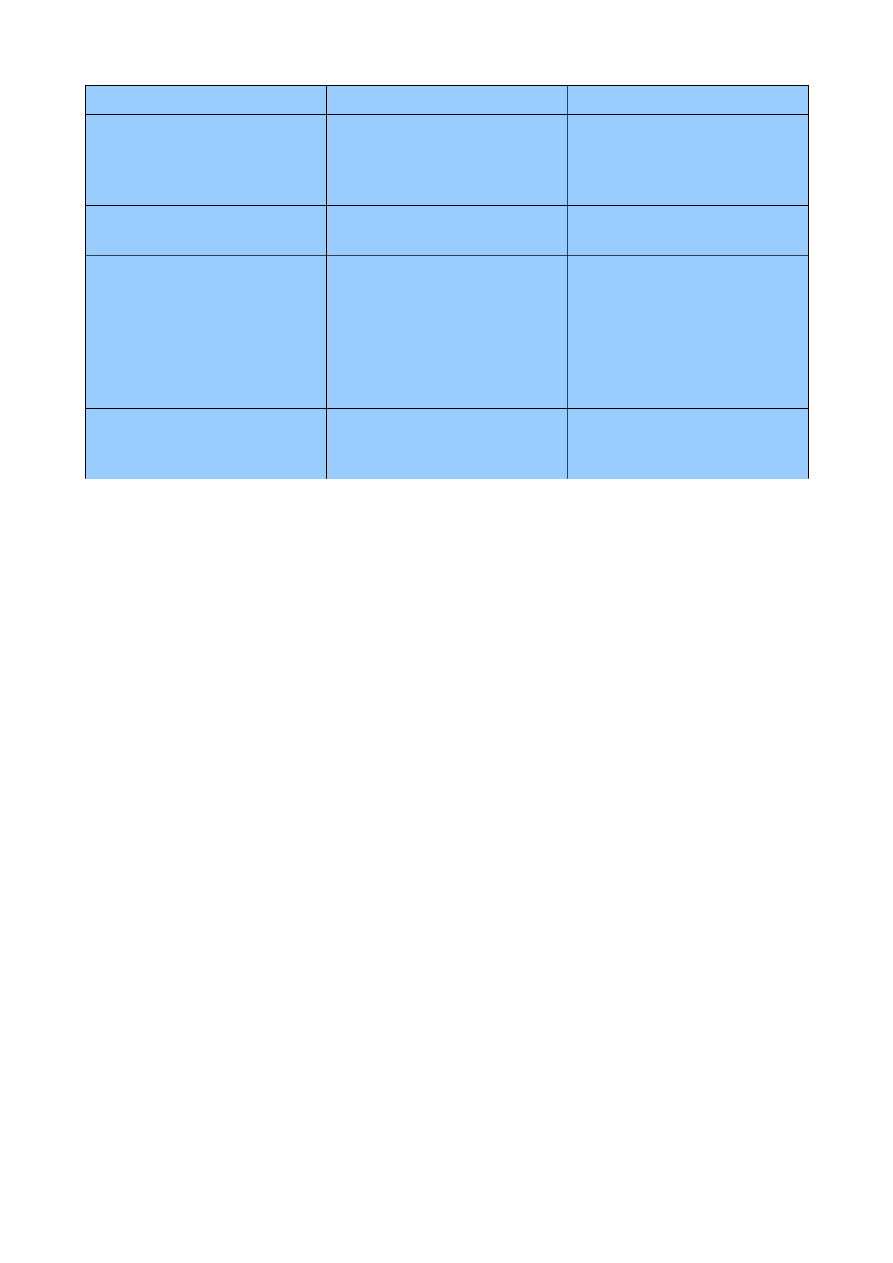
powiązanie intermediatów
kowalencyjnie z ACP,
z CoA,
organizacja enzymów
połączone w polipeptyd zwany
syntazą kwasów tłuszczowych,
nie zasocjowane,
siła red-oks
NADPH
NAD
+
, FAD
etapy
- utworzenie malonylo-CoA
(karboksylacja ac.-CoA),
- przeniesienie grup acylowych
na ACP,
- elongacja (kondensacja,
redukcja do OH, odwodnienie,
redukcja szkieletu),
- związanie z CoA,
- rozkład (utlenianie/usuniecie
wodorów, hydratacja, utlenianie
do gr. karbonylowej,
przenoszenie grupy acylowej na
CoA),
przenoszenie
grupy acylowe są przenoszone
w postaci cytrynianu do
cytozolu,
karnityna przenosi aktywowane
kw. tłuszczowe do matrix,
Długie kwasy tłuszczowe nie mogą przechodzić przez błonę, dlatego są transportowane za pomocą
karnityny:
–
acetylotransferaza karnitynowa I katalizuje przeniesienie grupy acylowej z CoA na
karnitynę (zew. powierzchnia wewnętrznej błony mitochondrialne),
–
translokacja acetylokarnityny do matrix,
–
acetylotransferaza karnitynowa II przenosi grupę acylową z powrotem na CoA,
2.3 Podział lipidów
a) lipidy proste
–
tłuszcze – mieszaniny glicerydów – estry glicerolu z kwasami tłuszczowymi,
–
woski – mieszaniny wyższych kwasów tłuszczowych i wyższych jedno- lub
dwuhydroksylowych alkocholi (wosk pszczeli, olbrot, lanolina, woski roślinne),
b) lipidy złożone
–
fosfolipidy – w swojej strukturze poza kwasami tłuszczowymi posiadają kwas
fosforowy,
–
glicerofosfolipidy – najbardziej rozpowszechnione lipidy w organizmie, wywodzą
się z kwasu fosfatydowego (glicerol acylowany w pozycji 1 i 2, w poz. 3 reszta
kwasu fosforowego)
–
grupa OH reszty kwasu fosforowego może być dodatkowo podstawiona
lecytyną, kefaliną, seryną, glicerolem, glukozą, kardiolipiną,
–
sfingofosfolipidy – pochodne ceramidu - głównie sfingomieliny
–
glikolipidy
10 z 37

–
gliceroglikolipidy
–
w pozycji 3 glicerolu przyłączone są mono- lub dicukry,
–
sfingoglikolipidy – rozp. w wodzie,
–
cerebrozydy – glikozydy ceramidu, (budują komórki nerwowe),
–
gangliozydy – do części cukrowej przyłączone reszty kwasu neuraminowego,
np. receptor gangliozydowy serotoniny, składniki błon neuronów,
3. Enzymy
3.1 Omów enzymy reakcji oksydacyjno-redukcyjnych.
Enzymami katalizującymi reakcje red-oks są oksydoreduktazy (EC1). Oksydoreduktazy dzieli się
na:
–
oksydazy
–
katalizują oderwanie protonu z substratu w reakcji, w której tlen jest jego
akceptorem,
–
wiele z nich to flawoproteiny zawierające FMN lub FAD jako grupy prostetyczne,
część wymaga metali do swojej aktywności,
–
hydroperoksydazy (katalizują reakcję rozszczepienia nadtlenku wodoru, kosztem innych
związków np. glutationu, askorbinianu),
–
peroksydazy,
–
katalazy,
–
oksygenazy (wbudowywanie tlenu w cząsteczkę – mono- lub dioksygenazy),
–
hydroksylazy (reakcja hydroksylacji),
–
dehydrogenazy
–
przenoszą wodór z jednego substratu na drugi,
–
zależne od koenzymów NAD
+
(oksydacyjne szlaki metaboliczne) lub NADP
+
(syntezy redukcyjne),
3.2 Mechanizm regulacji allosterycznej i kowalencyjnej
Regulacja allosteryczna:
Regulacja allosteryczna polega na modyfikacji aktywności katalitycznej enzymu poprzez
przyłączanie efektora allosterycznego do centrum allosterycznego. Efektor allosteryczny nie
wykazuje podobieństwa do substratu i nie wiąże się z centrum aktywnym enzymu (centrum
allosteryczne i aktywne są rozdzielone w przestrzeni). Efektor allosteryczny w wyniku związania z
centrum allosterycznym wymusza zmianę konformacji białka, w ten sposób że powinowactwo
enzymu do substratu spada (allosteria typu Km) lub spada sprawność katalityczna enzymu
11 z 37

(allosteria typu V).
Krzywa kinetyki wiązania substratu bez efektora allost. ma postać hiperboli, natomiast z efektorem
ma przebieg sigmoidalny. Przykładem może być regulacja allosteryczna aktywności hemoglobiny.
Regulacja kowalencyjna:
Regulacja kowalencyjna polega na modyfikacji aktywności enzymu w wyniku odwracalnej
modyfikacji kowalencyjnej. W przypadku bakterii jest to przyłączanie nukleotydów, a w przypadku
Eukaryota głównie przyłączanie reszt fosforanowych do grup hydroksylowych seryny, a rzadziej
tyrozyny. Fosforylację i defosforylację tych enzymów przeprowadzają odpowiednio kinazy i
fosforylazy. To czy fosforylacja prowadzi do aktywacji/deaktywacji enzymu zależy od samego
enzymu. Regulacja kowalencyjna jest często regulowana przez układ hormonalny i nerwowy.
3.3 Kompleksy wieloenzymatyczne, przykłady.
Często zdarza się, że enzymy katalizujące kolejne reakcje jakieś ciągu tworzą kompleks
wieloenzymatyczny. Taka organizacja usprawnia regulację metabolizmu. Przykładem może być
kompleks dehydrogenazy pirogronianowej będący w rzeczywistości zespołem trzech enzymów
katalizujących kolejne etapy przetworzenia pirogronianu w acetylo-CoA, a także kompleks
dehydrogenazy alfa-ketoglutaranowej (podobnej do ww. kompleksu), katlizujący przemianę alfa-
ketoglutaranu w bursztynylo-CoA.
3.4 Inhibicja kompetycyjna i niekompetycyjna.
Inhibitor kompetycyjny jest strukturalnie podobny do substratu, w związku z tym rywalizuje z nim
o centrum aktywne. Zdolność wiązania substratu i inhibitora do enzymu jest zbliżona, a więc to
który ze związków zostanie przyłączony do enzymu zależy od jego stężenia (inhibicję
kompetycyjną można znieść poprzez wzrost stężenia substratu).
Inhibicja kompetycyjna zmniejsza powinowactwo enzymu do substratu (wzrasta wartość Km),
natomiast nie wpływa na szybkość katalizowanej reakcji.
Inhibicja kompetycyjna jest często występującym motywem w metabolizmie, bowiem bardzo częst
zdarza się, że produkt zbliżony budową do substratu, hamuje reakcję, w której jest tworzony.
Przykładem są statyny.
Inhibitory niekompetycyjne nie mają zdolności wiązania się z centrum aktywnym, wiążą się z
białkiem w innym miejscu. W związku z powyższym powinowactwo enzymu do substratu nie
zmienia się (Km nie ulega zmianie). Zmniejsza się natomiast ilość obrotów enzymu, czy ilość
substratów przetworzonych w produkt w jednostce czasu ~ spada szybkość reakcji.
3.5 Koenzym, kofaktor, kosubstrat.
Większość enzymów to struktury złożone z części białkowej (apoenzym) i niebiałkowej (kofaktor).
12 z 37

Całość tworzy holoenzym.
Kofaktory dzieli się w zależności od sposobu wiązania z apoenzymem. Kofaktory ściśle związane
nazywa się grupami prostetycznymi, natomiast związane tylko w trakcie działania enzymu
koenzymami.
Koenzymy pełniące rolę substratów takie jak ATP, ADP, NADPH itd. nazywa się kosubstratami.
(Miałem wątpliwości co do tych pojęć, brak jednoznacznych informacji w Stryerze i Harperze;
źródło IUPAC Compendium of Chemical Terminology)
3.6 Podział enzymów i nomenklatura
–
EC1 – oksydoreduktazy - katalizują reakcje oksydoredukcyjne – przenoszą elektrony,
protony między substratami,
–
EC2 – transferazy – katalizują przenoszenie grup funkcyjnych między substratami
(aminowej, tiolowej, metylowej),
–
EC3 – hydrolazy – katalizują reakcje hydrolizy,
–
EC4 – liazy – katalizują reakcje rozkładu substratu bez hydrolizy,
–
EC5 – izomerazy – zmieniają położenie poszczególnych grup chemicznych,
–
EC6 – ligazy – powodują syntezę nowych cząsteczek poprzez indukowanie powstawania
nowych wiązań kowalencyjnych,
Większość enzymów nosi nazwy dwuczłonowe z których pierwszy człon określa rodzaj
katalizowanej reakcji z przyrostkiem -aza (karboksylaza, dehydrogenaza, hydroksylaza,
fosforylaza), a drugi odnosi się do substratu (pirogronianowa, glutationowa) itp.
Istnieje pewna grupa enzymów oznaczanych jednym członem np. beta-glukozydaza. Trudno podać
tutaj regułę takiego nazewnictwa.
Ogólnie zaleca się stosowanie nomenklatury systematycznej EC x.yy.zz.aa
gdzie x oznacza klasę enzymów, yy podklasę, zz podpodklasę a aa numer enzymu w danej
jednostce klasyfikacyjnej.
3.7 Szybkość reakcji enzymatycznej
Zależy od:
a) stężenia substratu – szybkość wzrasta hiperbolicznie wraz ze wzrostem stężenia substratu –
początkowo przyrost jest proporcjonalny, z czasem dochodzi jednak do wysycenia tzn. że
większość cząsteczek enzymów ma już przyłączony substrat do centrum aktywnego,
b) temperatura – szybkość reakcji wzrasta wraz ze wzrostem temperatury, aż do momentu kiedy
temperatura osiąga wartość przy której może dojść do deaktywacji enzymu np. poprzez jego
denaturację,
c) pH – prawie każdy enzym ma określoną wartość pH, przy którym działa najwydajniej, niewielkie
odchylenia prowadzą do obniżenia szybkości reakcji, natomiast przy znacznych odchyleniach
13 z 37

dochodzi do deaktywacji enzymu i zatrzymania reakcji,
14 z 37

4. Metabolizm energetyczny
4.1 Wymień pompy protonowe w łańcuchu oddechowym i wyjaśnij na
czym polega proces pompowania.
–
reduktaza NADH-Q (I)
–
napływający NADH przekazuje dwa elektrony na mononukleotyd flawinowy:
–
NADH + H
+
+ FMN → NAD
+
+ FMNH
2
–
następnie elektrony zostają przeniesione na centra żelazowo-siarkowe:
–
FMNH
2
+ utl. 4Fe-4S → FMN + red. 4Fe-4S
–
w dalszje kolejności dochodzi do redukcji ubichinonu, powstały ubichinol transportuje
elektrony do kolejnej pompy, (ubichinon jest pochodną chinonu, jego redukcja polega na
zredukowaniu grup ketonowych do hydroksylowych),
–
red. 4Fe-4S + Q → utl. 4Fe-4S + QH
2
–
reduktaza cytochromowa (III) (posiada hem, cytochrom b, c
1
, c oraz centra żelazowo-
siarkowe)
–
elektrony z ubichinolu zostają przeniesione poprzez szereg wymienionych wyżej
przekaźników na cytochrom c: cyt c (+3) → cyt c (+2)
–
oksydaza cytochromowa (IV) (posiada hem)
–
katalizuje reakcję przeniesienia elektronów i protonów na tlen:
–
4 cyt c (+2) + 4H
+
+ 2O
2
→ 4 cyt c (+3) + 2H
2
O
Podczas przepływu elektronów przez łańcuch oddechowy protony są pompowane w poprzek błony
do przestrzeni międzybłonowej. Mechanizm pompowania protonów nie jest zupełnie wyjaśniony,
aczkolwiek zapewne jest pozwiązany z reakcjami oksydoredukcyjnymi w obrębie grup
prostetycznych przenoszących elektrony.
Poza wyżej wymienionymi występuje również kompleks II – reduktaza bursztynian-Q, która nie
jest jednak pompą protonową:
- katalizuje ona przeniesienie elektronów i protonów (FADH
2
ma dwa protony w przeciwieństwie
do NADH, być może stąd różnica) na ubichinon, za pośrednictwem centrów żelazowo-siarkowych,
4.2 Fosforylacja oksydacyjna. Enzym. Rozprzęganie fosforylacji.
Fosforylacja oksydacyjna jest procesem składającym się na oddychanie tlenowe i polega na
przetworzeniu siły protonomotorycznej w energię zmagazynowaną w postaci
wysokoenergetycznych wiązaniach ATP.
15 z 37

Enzymem katalizującym fosf. oksydacyjną jest syntaza ATP. Enzym ten złożony jest z podjednostki
F
1
, złożonej z 5 łańcuchów polipeptydowych uformowanych w sferyczne struktury, oraz jednostki
F
0
.
.
Jednostka F
1
odpowiada za funkcje katalityczne, natomiast jednostka F
0
stanowi kanał dla prądu
protonowego.
Mechanizm działania:
–
mechanizm zakłada, że kluczową rolę odgrywają trzy podjednostki katalityczne beta, z
których zawsze jedna jest w formie O (open – otwartej), L (locked – luźno związanej), T
( tense – ściśle związanej),
–
podjednostka wykazuje słabe powinowactwo w formie O, a bardzo silne w formie T,
–
przyłączenie ADP i Pi do podj. L,
–
przepływ protonów powoduje zmiany konformacyjne: L->T, T->O,
–
ATP przywiązane dotychasz do T, po zmianie konformacji na O mogą uwolnić się z
połączenia,
–
w wyniku dalszego przepływu protonów dochodzi do utworzenia nowej cząstecki ATP,
protony pełnią teraz funkcję akceptora tlenu,
Rozprzęganie fosforylacji zachodzi pod wpływem działania czynników, które przenoszą protony z
powrotem do matrix (usuwają gradient protonowy, niezbędny do aktywności syntazy-ATP).
Przykładowym ksenobiotykiem rozprzęgającym fosforylację jest 2,4-dinitrofenol, a także niektóre
inne kwaśne związku aromatyczne.
Rozprzęganie fosforylacji ma jednak także znaczenie fizjologiczne i jest wykorzystywane do
wytwarzania ciepła. W tej funkcji specjalizuje się tkanka tłuszczowa brunatna. Występująca w niej
termogenina jest białkiem rozprzęgającym, stanowiącym drogę swobodnego przepływu protonów z
cytoplazmy do matrix. Rozprzęganie fosforylacji jest aktywowane przez WKT, uwalniane z
triacylogliceroli w odpowiedzi na sygnały hormonalne.
4.3 Wyjaśnij stwierdzenie „Tłuszcze spalają się w ogniu
węglowodanów”
Głównym elementem strukturalnym tłuszczy (triglicerydów) są kwasy tłuszczowe. W wyniku ich
degradacji powstaje acetylo-CoA. Jest to związek, który nie może ulegać spalaniu w inny sposób,
niż poprzez wejście do cyklu Krebsa.
Jednak do zachodzenia cyklu Krebsa niezbędna jest dostępność szczawioctanu. Szczawiooctan
powstaje z pirogronianu, a ten wytwarzany jest w wyniku glikolizy (oczywiście pirogronian i inne
intermediaty cyklu Krebsa mogą być wytworzone w wyniku degradacji szkieletów węglowych
odpowiednich aminokwasów glukogennych jednak białka nie są przeznaczone do wytwarzania
energii).
W przypadku obniżonej dostępności szczawiooctanu, acetylo-CoA zostaje przetworzony w ciała
ketonowe: aceton, 3-hydroksymaślan.
16 z 37

4.4 Kontrola glikogenogenezy i glikogenolizy
a) glikogenoliza:
*enzymy: fosforylaza glikogenowa (wiązania alfa-1,4-glikozydowe) i enzym usuwający
rozgałęzienia glikogenu (1,6-glikozydowe)
*Glukozo-1-fosforan jest przekształcany w glukozo-6-fosforan przez fosfoglukomutazę.
*Tylko w wątrobie zachodzi dalsze przekształcenie tej cząsteczki w glukozę, katalizowane przez
glukozo-6-fosfatazę, po czym glukoza przechodzi do krwi. G
fosforylaza: glikogen + Pi → glukozo-1-fosforan + glikogen'
fosforylaza a (aktywna, ufosforylowana), b (niekatywna, nieufosforylowana),
b) glikogenogeneza
*(glukozo-1-fosforan + UTP → UDP-glukoza)
* syntaza glikogenowa może tylko wydłużać łańcuch dlatego potrzebny jest enzym starterowy–
glikogenina,
* enzym rozgałęziający rozcina wiązania 1,4-glik. i przenosi na 6 hydroksyl,
syntaza glikogenowa: glikogen' + UDP-glukoza → glikogen + UDP
Kontrola:
a) allosteryczna (fosforylaza a aktywna niezależnie od allosterii, dlatego kontrola poprzez
fosforylację ważniejsza),
–
AMP - stymuluje,
–
ATP, glukozo-6-fosforan - hamuje
b) odwracalna fosforylacja seryny [aktywuje fosforylazę, deaktywuje syntazę glikogenową] (kat.
przez kinazę fosforylazową),
–
aktywacja kinazy fosforylazowej
–
adrenalina/glukagon → cAMP → PKA → aktywacja kinazy fosforylazowej,
–
poprzez jony wapnia w czasie skurczu,
dezaktywacji w wyniku defosforylacji (fosfataza-1 białek)
- aktywowana przez insuliną
Wyjątki w wątrobie:
–
AMP nie wpływa na fosforylazę b,
–
glukoza deaktywuje fosforylazę
17 z 37

4.5 Regulacja ketogenezy
Ketogeneza czyli tworzenie ciał ketonowych z acetylo-CoA jest zależne od dostępności
szczawiooctanu i w czasie jego niedoboru ketogeneza jest nasilona. Z tego powodu można mówić,
że ketogeneza jest uzależniona od stanów patologicznych – głodowanie, cukrzyca.
Poziom ketogenezy jest jednak uzależniony również od poziomu acetylo-CoA. W tk. tłuszczowej
dochodzi do lipolizy i zmobilizowania WKT, które w wątrobie zostają przekształcone do acetylo-
CoA. Okazuje się, że stężenie pierwszego ciała ketonowego acetylooctanu reguluje zwrotnie
aktywność lipolizy.
Ponadto regulacja ma również miejsce na poziomie aktywności palmitoilotransferazy karnitynowej
– bez jej aktywności nie możliwe jest przenoszenie grup acylowych do matrix, a tym samym beta-
oksydacja.
4.6 Kontrola lipogenezy
Strategicznym etapem lipogenezy jest przekształcenie acetylo-CoA w malonylo-CoA. Reakcję tą
katalizuje karboksylaza acetylo-CoA.
a) fosforylacja seryny – utrata aktywności karboksylazy
insulina i glukagon aktywują PKA – fosforylacja seryny,
insulina aktywuje fosfatazę białkową
b) allosteryczna -
cytrynian aktywuje karboksylazę acetylo-CoA, (sam jest produktem jego kondensacji ze
szczawiooctanem),
4.7 Glikoliza – kluczowe reakcje i kontrola
a) fruktozo-6-fosforan → fruktozo-1,6-bisfosforan
+ AMP, fruktozo-2,6-bisfosforan,
- ATP, cytrynian (powstaje ze szczawiooctanu i acetylo-CoA), H
+
,
b) fosfoenolopirogronian → pirogronian
+ fruktozo-1,6-bisfosforan,
- ATP, alanina,
4.8 Glukoneogeneza – reakcje nieodwracalne i kontrola
r-cje:
a) pirogronian karboksylacja do szczawiooctanu, dekarboksylacja do fosfoenolopirogronianu,
18 z 37

b) defosforylacja fruktozo-1,6-bisfosforanu do fruktozo-6-fosforanu,
c) defosforylacja glukozo-6- fosforanu do glukozy,
reakcja c
–
AMP, fruktozo-2,6-bisfosforan,
+ cytrynian,
reakcja pirogronian → szczawiooctan
–
ADP,
+ acetylo-CoA,
reakcja szczawiooctan → fosfoenolopirogronian
–
ADP
4.9 Szlak pentozofosforanowy
glukozo-6-fosforan + 2NADP
+
+ H
2
O → rybozo-5-fosforan + 2NADPH + 2H
+
+CO
2
etapy:
–
utlenienie glukozo-6-fosforanu do rybulozo-5-fosforanu z wydzieleniem CO
2
i 2NADPH
–
izomeryzacja rybulozo-5-fosforanu do rybozo-5-fosforanu,
Regulacja odpływu glukozo-6-fosforanu;
a) potrzeba o wiele więcej rybozo-5-fosforanu niż NADPH (komórki szybko dzielące się):
5 glukozo-6-fosforanu +ATP → 6 rybulozo-5-fosforanu + ADP + H+
b) równe zapotrzebowanie na rybozo-5-fosforan i NADPH
(typowy szlak pentozofosfornowy),
c) potrzeba znacznie więcej NADPH niż rybozo-5-fosforanu
–
powstający rybozo-5-fosforan jest przekształcany we fruktozo-6-fosforan i aldehyd 3-
fosfoglicerynowy (glukonegogeneza),
–
glukonegeneza tyle, że w stronę glikolizy
4.10 Specyfika narządowa przemian
- wszędzie występuje szlak pentozofosforanowy,
a) mózg
–
standardowym źródłem energi jest glukoza
–
przemiany tlen,
–
brak magazynowania glukozy, przechodzi przez barierę krew-mózg,
19 z 37

–
w stanie głodowania ciała ketonowe – mało energii,
–
kwasy tłuszczowe wiążą się z albuminami – nie przechodzą przez barierę,
b) erytrocyt
–
brak jądra i mitochodnrium – tylko przemiany beztlenowe – powstaje mleczan,
–
nasilony szlak pentozofosforanowym – potrzebne NADPH do utrzymania glutationu w
stanie zredukowanym,
–
istotne obejście glikolizy, w którym powstaje 2,3-bisfosfoglicerynian – obniża
powinowactwo tlenu do hemoglobiny – uwalnianie jej,
c) mięśnie szkieletowe, sercowy
–
przemiany tlenowe glukozy,
–
niedostatek tlenu – tworzenie mleczanu,
–
glikogeneza, glikogenoliza,
d) wątroba
–
przemiany tlenowe,
–
synteza kwasów tłuszczowych,
–
glikogeneza, glikogenoliza,
–
szlak pentozofosforanowy,
–
szlak kwasów uronowych,
–
odtwarzanie pirogornianu z mleczanu,
–
uwalnianie glukozy z glukozo-6-fosforanu,
4.11 Rola acetylo-CoA
–
synteza kwasów tłuszczowych,
–
synteza steroidów,
–
synteza aminokwasów,
–
punkt wejścia pirogronianu do cyklu Krebsa,
–
wysokie stężenie aktywuje karboksylazę pirogronianu – synteza szczawiooctanu –
aktywacja glukoneogenezy,
4.12 Cykl Corich
W warunkach obniżonego dostępu tlenu w mięśniach (ale nie tylko) zahamowany zostaje cykl
Krebsa – glukoza przekształcana jest do pirogronianu, a ten do mleczanu (odtworzenie NAD+).
Mleczan jest jednak produktem, który może być jedynie powrotnie przekształcony do pirogronianu.
Z tego powodu zostaje on usunięty z komórek do krwi, i wędruje wraz z nią do wątroby. W
wątrobie za pomocą dehydrogenazy mleczanowej zostaje ponownie odtworzony pirogronian, z
którego na drodze glukoneogenezy odtworzona zostaje glukoza. Wątroba wypuszcza glukozę do
20 z 37
krwi, a ta powrotnie wędruje do komórek np. mięśnii. W ten sposób cykl zamyka się.
4.13 Budowa mitochodnium
–
mitochondrium jest organellą komórkową otoczoną dwiema błonami: zew. i wewn., z
których błona zew. jest bardziej przepuszczalna,
–
przestrzeń między błonami,
–
wewnętrzna część mitochondrium nazywana jest matrixem,
–
w matrix znajduje się mitochondrialny DNA, który koduje niektóre białka mitochondrialne,
4.14 Lokalizacja szlaków metabolicznych
–
cytozol – glikoliza, szlak pentozofosforanowy, synteza kwasów tłuszczowych,
–
błona wewnętrzna mitochondium – fosforylacja oksydacyjna,
–
matrix – cykl kwasu cytrynowego, beta-oksydacja, tworzenie ciał ketonowych,
–
matrix/cytozol – glukoneogeneza, cykl mocznikowy,
4.15 Regulacja cyklu kwasu cytrynowego. Kluczowe etapy.
a) oksydacyjna dekarboksylacja pirogronianu do acetylo-CoA,
- fosforylacja podjednostki E
1
przez spec. kinazę
+ pirogronian – hamuje kinazę,
+defosforylacja podj. E
1
przez fosfatazę
+ Ca
2+
stymuluje fosfatazę (wazopresyna, agoniści rec. alfa1-adrenergicznych),
+ insulina,
b) synteza cytrynianu ze szczawianu i acetylo-CoA,
- ATP allosteria typu Km,
c) przekształcenie izocytrynianu w alfa-ketoglutaran,
- ATP, +ADP,
d) oksydacyjna dekarboksylacja alfa-ketoglutaranu do bursztynylo-CoA,
- bursztynylo-CoA, NADH,
4.16 Dehydrogenaza pirogronianowa i alfa-ketoglutaranowa
dehydrogenaza
pirogronianowa
dehydrogenaza alfa-
ketoglutaranowa
21 z 37
reakacja sumarycznie:
oksydacyjna dekarboksylacja
pirogronianu do acetylo-CoA,
pirogronian + CoA + NAD
+
→
CO
2
+ acetylo-CoA + NADH,
oksydacyjna dekarboksylacja
alfa-ketoglutaranu do
bursztynylo-CoA,
alfa-ketoglutaran + CoA +
NAD
+
→ CO
2
+ bursztynylo-
CoA + NADH,
kofaktory katalityczne
pirofosforan tiaminy, amid
kwasu liponowego, FAD,
pirofosforan tiaminy, amid
kwasu liponowego, FAD,
enzymy składowe
- składnik o aktywności
dehydrogenazy
pirogronianowej,
- acetylotransferaza
dihydroliponianowa,
- dehydrogenaza amidu kwasu
liponowego,
- składnik o aktywności
dehydrogenazy alfa-
ketoglutaranowej,
- bursztynylotransferaza,
- dehydrogenaza amidu kwasu
liponowego,
struktura
szereg łańcuchów
polipeptydowych każdego ze
składowych enzymu, tworzy
regularny układ przestrzenny,
szereg łańcuchów
polipeptydowych każdego ze
składowych enzymu, tworzy
regularny układ przestrzenny,
metabolity pośrednie
nieoddysocjowują od enzymu,
nieoddysocjowują od enzymu,
Niedobór tiaminy – choroba beri-beri – w wyniku niedoboru tiaminy, zahamowana zostaje
przemiana pirogronian. Ten kumuluje się w organizmie, a jako związek toksyczny uszkadza nerwy i
drobne włośniczki.
4.17 Fosforylacja substratowa, reakcje glikolizy dostarczające ATP.
a) defosforylacja 1,3-bisfosfoglicerynianu do 3-fosfoglicernianu (kinaza fosfoglicerynowa),
b) defosforylacja fosfoenolopirogronianu do pirogronianu (kinaza pirogronianowa),
Fosforylacja substratowa jest procesem wytworzenia ATP w wyniku przeniesienia reszty
fosforanowej z substratu na ADP. Reakcję tę katalizuje odpowiednia kinaza.
4.18 Anabolizm i katabolizm cyklu kwasu cytrynowego
a) anabolizm – jedyną reakcją anaboliczną jest kondensacja szczawiooctanu z grupą acetylową
acetylo-CoA do cytrynianu C4 + C2 → C6
b) reakacje kataboliczne:
–
dekarboksylacja izocytrynianu do alfa-ketoglutaranu z wydzieleniem dwutlenku węgla
(dehydrogenaza izocytrynianowa),
–
oksydacyjna dekarboksylacja alfa-ketoglutaranu do bursztynylo-CoA – również wydzielan
się dwutlenek węgla (kompleks dehydrogenazy alfa-ketoglutaranowej),
–
przetworzenie bursztynylo-CoA w bursztynian – wytworzone zostaje GTP (syntataza
22 z 37

bursztynylo-CoA),
4.19 NADPH – gdzie jest syntetyzowany i do czego zużywany
NADPH powstaje w wyniku szlaku pentozofosforanowego. NADPH jest siłą redukcyjną
wykorzystywaną w większości reakcji biosyntez, bowiem zazwyczaj produkty biosyntez są bardziej
zredukowane w stosunku do ich prekursorów. Dla przykład lipogeneza wymaga zredukowania grup
karbonylowych, po każdym dołączeniu jednostki dwuwęglowej.
4.20 Bilans zysków i strat metabolizmu węglowodanów
a) glikoliza
–
glukoza → glukozo-6-fosforan (- 1 ATP),
–
fruktozo-6-fosforan → fruktozo-1,6-bisfosforan (- 1 ATP),
–
aldehyd 3-fosfoglicerynowy → 1,3-bisfosfoglicerynian (+ 2NADH x 1,5 = + 3 ATP),
–
1,3-bisfosfoglicerynian → 3-fosfoglicerynian (+2 ATP),
–
fosfoenolopirogronian → pirogronian (+ 2 ATP),
b)
–
pirogronian → acetylo-CoA (+ 2 NADH x 2,5= +5 ATP),
c) cykle Krebsa
–
izocytrynian → alfa-ketoglutaran
–
alfa-ketoglutaran → bursztynylo-CoA
–
jabłczan → szczawiooctan (+6 NADH x 2,5 = + 15 ATP),
–
bursztynylo-CoA → bursztynian (+ 2 GTP),
–
bursztynian → fumaran (+2FADH
2
x 1,5 = +3 ATP),
4.21 Strategie metaboliczne
–
ATP stanowi element odpowiedzialny za magazynowanie i uwalnianie energi. Z uwagi na
wysoką energię wiązań fosfodiestrowych w strukturze ATP, cząsteczka ta zostaje
wykorzystywana jako uniwersalny nośnik energii. Jednocześnie wielokrotnie jest ona tym
czynnikiem, który powoduje że reakcja, która normalnie wydaje się być termodynamicznie
niekorzystna staje się korzystna.
–
Bogata pula związków biologicznie czynnych powstaje ze stosunkowo wąskiej liczby
prekursorów.
–
glukozo-6-fosforan – synteza rybozo-5-fosforanu – składnik kwasów nukleinowych,
–
fosfodichydroksyaceton – prekursor do syntezy fosfatydylocholiny, fosfoglicerydów,
23 z 37
–
pirogronian – źródło do syntezy alaniny,
–
fosfoenolopirogronian – aminokwasy aromatyczne,
–
acetylo-CoA – kwasy tłuszczowe, cholesterol, dalej steroidy,
–
bursztynylo-CoA – synteza hemu,
–
szczawiooctan – synteza asparaginianu, asparaginy,
–
ketoglutaran – synteza glutaminianu,
Jak się okazuje wszystkie wyżej wymienione prekursory są intermediatami przemian
glukozy.
–
siłę redukcyjną stanowi NADPH wytwarzany w szlaku pentozofosforanowym,
–
Szlaki biosyntez różnią się zawsze od szlaków rozkładu – przebiegają inną drogą, dzięki
temu są termodynamicznie korzystne,
5. Metabolizm nieenergetyczny
5.1 Jaki związek jest donorem rybozofosforanów w syntezie kwasów nukleinowych?
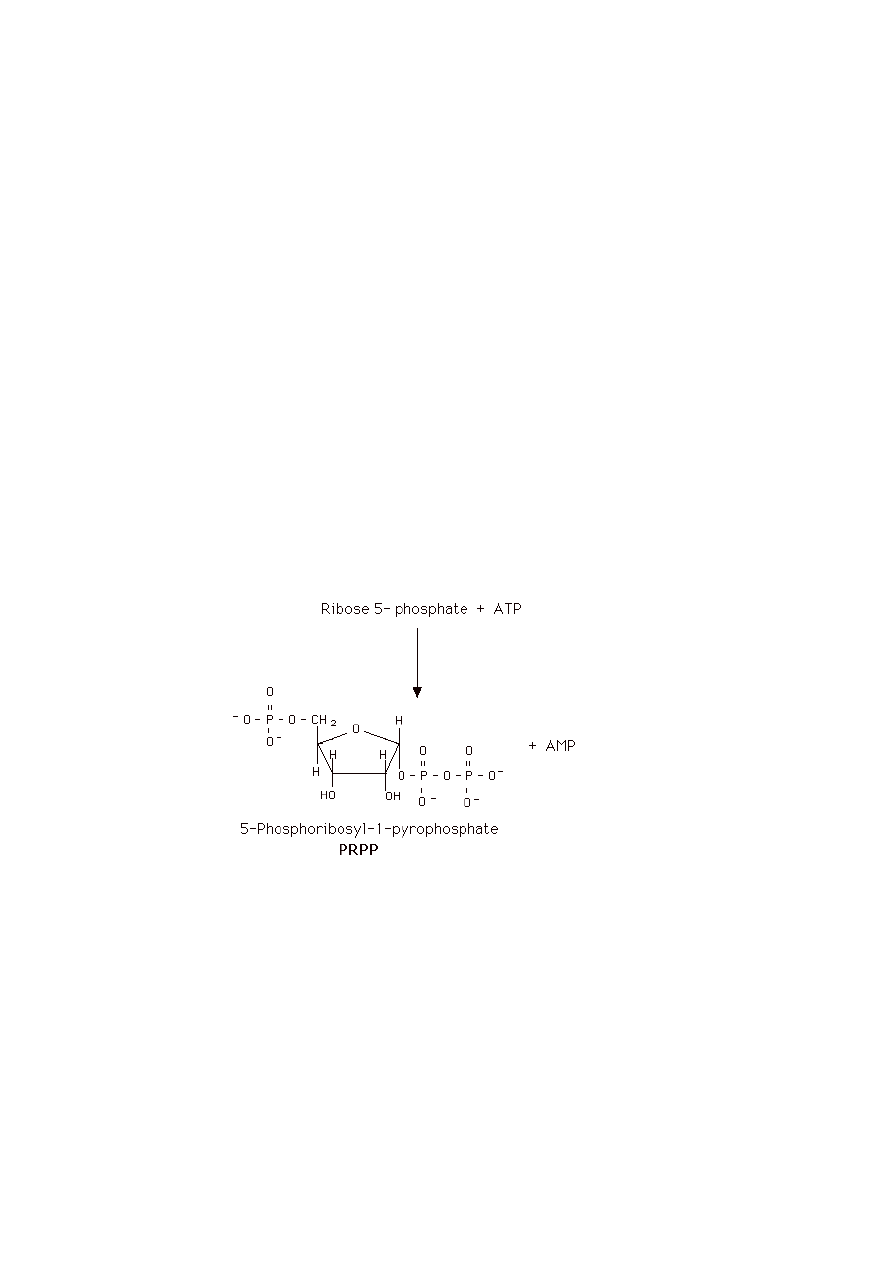
W jakiej reakcji on powstaje?
PR-PP (5-fosforybozylo-1-pirofosforan)
Powstawanie PRPP:
a) glukozo-6-fosforan + 2 NADP
+
+ H
2
O → rybozo-5-fosforan + 2 NADPH + 2 H
+
+ CO
2
b) fosforylacja rybozo-5-fosforanu przy obecności ATP, za pomocą syntetazy PRPP,
5.2 Która reakcja biosyntezy cholesterolu jest wykorzystywana w terapii
arteriosklerozy?
Redukcja 3-hydroksy-3-metyloglutarylo-CoA (HMG-CoA) do mewalonianu.
24 z 37

W terapi arteriosklerozy stosuje się inhibitory reduktazy HMG-CoA.
5.3 Wymień produkty degradacji szkieletów węglowych aminokwasów. Wyjaśnij
pojęcie aminokwasów gluko- i ketogennych.
Szkielety węglowe aminokwasów mogą być degradowane do acetylo-CoA, acetoacetylo-CoA,
pirogronianu, alfa-ketoglutaranu, bursztynylo-CoA, fumaranu, szczawiooctan.
Aminokwasy których szkielety węglowe są rozkładane do acetylo-CoA i acetoacetylo-CoA nazywa
się am. ketogennymi. Ponieważ wyżej wymienione związki kondensują do HMG-CoA, który poza
mewalonianem może być przekształcany również w aceton, acetooctan, 3-hydroksymaślan.
25 z 37

5.4 Aminokwasy jako prekursory związków biologicznie czynnych.
a) histydyna
–
(w wyniku dekarboksylacji powstaje histamina, która odgrywa rolę w reakcja alergicznych,
rozszerza naczynia krwionośne, zwiększa przepuszczalność naczyń krwionośnych),
b) tryptofan
–
zostaje przekształcony w serotoninę (zwęża naczynia krwionośne, stymuluje skurcze mięśni
gładkich, stanowi neuroprzekaźnik w OUN),
–
nikotynamidowy fragment NAD,
–
serotonina może być dalej przekształcona w melatoninę (regulacja snu i czuwania),
c) tyrozyna
–
produkcja tyroksyny i trójjodotyroniny (hormony tarczycy),
–
melanina,
–
produkcja katecholamin
–
L-Dopa
–
dopamina
–
noradrenalina
–
adrenalina
d) glutaminian
–
w wyniku dekarboksylacji powstaje kwas gamma-aminomasłowy – hamujący
neuroprzekaźnik w OUN,
–
frag. glutationu,
e) arginina
–
tlenek azotu,
f) no i oczywiście aminokwasy jako składowe biologicznie czynnych peptydów i białek (hormony,
enzymy),
5.5 Synteza i degradacja hemu
Synteza hemu
•
Biosynteza hemu zachodzi w niedojrzałych erytrocytach ( 85%), reszta w wątrobie
•
Defekty genetyczne w biosyntezie hemu→ porfirie
•
Glicyna bierze udział w biosyntezie hemu, puryn, połączeń glicynowych i kreatyny
•
Atomy węgla α i azotu glicyny biorą udział w syntezie porfirynowej części hemoglobiny
•
Atom N w pierścieniu to azot od glicyny a przylegający atom węgla –węgiel α glicyny; węgiel α jest również źródłem
atomów mostków metylenowych łączących pierścienie pirolowe
•
I ETAP- kondensacja glicyny i bursztynylo-CoA→powstaje kwas aminolewulinowy (ALA) ( enzym: syntaza ALA w
26 z 37

mitochondriach)
•
Regulacja syntezy enzymu: ┴ przez hem przez sprzężenie zwrotne
•
2 cząsteczki ALA kondensują→ porfobilinogen ( enzym: dehydrataza ALA, zw. syntazą porfobilinogenową; enzym ┴
przez ołów )
•
4 cząsteczki porfobilinogenu kondensują liniowo→ liniowy tetrapirol ( enzym: deaminaza porfobilinogenu)
•
liniowy tetrapirol związany z enzymem ulega cyklizacji→ uroporfirynogen III ( prekursor wszystkich hemów, chlorofili i
wit. B12 )
•
dalsze modyfikacje grup na zewnątrz pierścienia→ protoporfiryna IX
•
do centralnej niszy wstawiony zostaje atom Fe ( za pomocą ferrochelatazy, powstaje hem) lub Mg (powstaje chlorofil)
•
transferyna transportuje żelazo, ferrytyna magazynuje,
Degradacja hemu
•
rozpad hemu przez oksygenazę hemową
•
enzym należy do rodziny cytochromu P450, potrzebuje NADPH i O2
•
lokalizacja enzymu: śledziona, wątroba
•
oksydacyjne roszczepienie pierścienia hemowego→ zielony barwnik żłółciowy biliwerdyna ( liniowy tetrapirol )
•
przekształcenie do czerwonopomarańczowego barwnika bilirubiny ( enzym: reduktaza biliwerdynowa)
•
bilirubina- cząsteczka lipofilna transportowana jest we krwi w kompleksie z albuminą surowicy
•
w wątrobie- przyłączenie 2 cząsteczek kwasu glukuronowego→ diglukuronid bilirubiny ( ↑ rozpuszczalność w H2O)
•
wydzielany do żółci→ do jelita → metabolizm przez bakterie→ wydalanie z kałem
•
PATOLOGIA- nadmierna ilość bilirubiny powoduje kumulację w skórze i twardówce oka→ żółtaczka
•
Wskazuje to na uszkodzenie wątroby, mechaniczną niedrożność przewodu żółciowego, nadmierny rozpad erytrocytów
5.6 Degradacja aminokwasów
a) nadmiar aminokwasów jest ciągle rozkładany w wątrobie,
b)
–
transaminacja:
–
transaminazy (aminotransferazy np. alaninowa, asparginowa) katalizują przeniesienie
grupy aminowej na alfa-ketoglutaran – powstaja glutaminian,
–
grupą porstetyczną aminotransferaz jest fosforan pirydoksalu (wit. B6), w trakcie
deaminacji przechodzi on w fosforan pirydoksaminy, z fosforanu pirydoksaminy grupa
aminowa przechodzi dopiero na alfa-ketoglutaran,
–
seryna i tronina mogą być deaminowane bezpośrednio (grupa OH przy węglu beta),
–
oksydacyjna deaminacja glutaminianu (dehydrogenaza glutaminianowa)
–
odtwarza się alfa-ketoglutaran, a jon amonowy wchodzi do cyklu mocznikowego,
–
potrzebny NADPH / NADH,
–
regulacja allosteryczna – hamuje ATP, GTP,
–
metabolizm szkieletów węglowych
–
do 7 cząsteczek: pirogronian, szczawiooctan, jabłczan, fumaran, alfa-ketoglutaran,
acetylo-CoA, bursztynylo-CoA,
27 z 37

5.7 Reakcje I fazy i ich efekty
–
utlenianie,
–
redukcja,
–
hydratacja,
–
hydroliza,
–
detioacetylacja,
–
izomeryzacja
•
zmiana struktury chemicznej związku, przygotowanie go do wydalenia
;
↑ rozpuszczalności ksenobiotyku – wyjątek: sulfonamidy – sulfatiazol (ARGOSULFAN, SULFARINOL) mogą po
acylacji krystalizować w kanalikach nerkowych;
•
reakcje I fazy zwiększają reaktywność i polarność ksenobiotyku
, co powoduje ↑ jego aktywności
biologicznej (np. paracetamol → benzochinoiminę → addukty białkowe, WWA → diolepoksydy →
addukty DNA);
•
dezaktywacja leków w reakcjach I fazy
(większość);
•
aktywacja proleków
(np. kodeina → morfina, imipramina → desmetyloimipramina, α-metyldopa → α-
metylonorepinefryny);
5.8 Reakcje drugiej fazy i ich efekty
- kwasem glukuronowym - transferaza UDP-glukuronianowa
- kwasem siarkowym - sulfotransferazy
- kwasem octowym - N-acetylotransferaza (NAT)
- glutationem – S-transferazy glutationu (GST)
- aminokwasami (np. z glicyną)
- reakcje metylacji (metylotransferazy)
•
reakcje II fazy ↓ reaktywność ksenobiotyku
– wyjątek: niektóre halogenowane węglowodory, np. 1,2-
dibromoetan → sprzęganie z kw. siarkowym → jon episulfoniowy → addukty DNA
5.9 Reakcje przeprowadzane przez CYP450
hydroksylacja à np. lignokaina, pentobarbital
epoksydacja à np. benzo[a]piren
dealkilacje (N-,O-,S-) à np. BZD, kodeina, merkaptopuryna
oksydatywna deaminacja à np. amfetamina
oksydacje (N-,S-) à np. chloropromazyna
28 z 37

dehalogenacja à np. halotan
oksydacja alkoholowa à np. etanol
5.10 Charkterystyka i znaczenie CYP450
Enzym o charakterze monooksygenazy (inaczej: MFO), katalizuje reakcje związane z
metabolizmem ksenobiotyków - epoksydacji, deaminacji, dehalogenacji, dealkilacji, oksydacji i
hydroksylacji;
Wprowadza grupy -OH, -NH2, -COOH lub –SH do ksenobiotyku;
Katalizuje reakcje syntezy cholesterolu, steroidów i hormonów steroidowych oraz metabolitów
kwasu arachidonowego (eikozanoidów).
podstawowy system metabolizujący ksenobiotyki
źródło zmienności międzyosobniczej w zakresie metabolizmu i wrażliwości na leki
wyjaśnienie niektórych specyficznych efektów toksycznego działania leków
wyjaśnianie interakcji międzylekowych
5.11 Polimorfizm na przykładzie CYP450
- cecha genetyczna, obecna w populacji w przynajmniej dwóch wariantach
- warianty genetyczne występują z częstością przynajmniej 1%
- odmiany polimorficzne na ogół nie wykazują działania typowo szkodliwego (zmiany mutacyjne –
tak)
- mutacje punktowe i pojedyncze zmiany genu powodują występowanie 2 fenotypów: PM (wolno
metabolizujący ksenobiotyki) i EM (szybko metabolizujący ksenobiotyki),
CYP 2D6*
CYP 2C9*
CYP 2C19*
CYP 2B6*
5.12 Znaczenie witaminy D3
•
Pobudza wchłanianie wapnia w jelicie
•
Przyspiesza demineralizację kości, upłynniając wapń ze szkieletu
•
W ten sposób przyczynia się do zwiększenia stężenia wapnia w osoczu
•
Niedobór powoduje krzywicę u dzieci i osteomalację u dorosłych
5.13 Cykl mocznikowy
CYKL MOCZNIKOWY ( cykl ornityny)
•
Mocznik syntetyzowany jest w wątrobie w cyklu mocznikowym
•
Następnie wydzielany do krwioobiegu i wydalany z moczem
•
Reakcja cyklu
NH4 + CO2 + H2O + 3 ATP + asparaginian→ mocznik + 2ADP + AMP + 2Pi + fumaran
•
W MITOCHONDRIUM
1.
Syntetaza karbamoilofosforanowa- katalizuje aktywację i kondensację amoniaku z CO2 → powstaje
29 z 37

karbamoilofosforan;jednoczesna hydroliza 2 cząst. ATP sprawia że reakcja ta jest nieodwracalna
2.
karbamoilotransferaza ornitynowa- przenosi grupę karbamoilową z karbamoilofosforanu na
ornitynę→ powstaje aminokwas CYTRULINA; transport cytruliny z mitochondrium do cytozolu
W CYTOZOLU
3.
Kondensacja cytruliny z asparaginianem ( 2. atom azotu w moczniku) katalizowana przez syntazę
argininobursztynianową→ argininobursztynian; reakcja zachodzi dzięki hydrolizie ATP do AMP i PPi
oraz następnie hydrolizie pirofosforanu
4. Liaza argininobursztynianowa usuwa szkielet węglowy asparaginian asparaginian
arginninobursztynianu w postaci FUMARAN, pozostawiając atom azotu w drugim produkcie-
argininie ( bezpośredni prekursor mocznika)
5.
Mocznik powstaje z argininy ( enzym: arginaza); następuje jednoczesna regeneracja
ornityny→transport do mitochondrium
CYKL MOCZNIKOWY
•
Połączony z cyklem kwasu cytrynowego→ synteza fumaranu przez liazę argininobursztynianową; w cyklu
cytrynowym fumaran jest metabolitem pośrednim, po uwodnieniu tworzy jabłczan utleniany dalej do
szczawiooctanu
•
Punkt wyjścia do syntezy fosforanu kreatyny ( rezerwuar grupy fosforanowej o wysokim potencjale w
komórkach mięśniowych)→ arginina (metabolit pośredni cyklu mocznikowego) ulega kondensacji z glicyną→
guanidynooctan→ metyzacja przez S-adenozylometioninę do kreatyniny→ fosforylacja kreatyny→fosforan
kreatyny
5.14 Szlaki umożliwiające współpracę narządową
I – współpraca w sensie, że jeden narząd wykonuje za inny coś czego ten drugi nie może :P :
a) cykl Corich (komórki pracujące beztlenowo wytwarzają mleczan, wątroba odtwarza z niego
pirogronian, a dalej na drodze glukoneogenezy - glukozę)
b) w mięśniach z pirogronianu może powstawać alanina, w wątrobie jest ona powrotnie
przekształcana do pirogronianu, a dalej do glukozy,
II – współpraca w sensie, że narządy wykonują to samo działanie w celu osiągnięcia wspólnego
efektu
a) wątroba i mięśnie pod wpływem insuliny syntetyzują glikogen (glikogenogeneza),
b) wątroba i tkanka tłuszczowa pod wpływem insuliny syntetyzują kwasy tłuszczowe (lipogeneza),
5.15 Poliaminy
Synteza:
•
Prekursorzy poliamin to ornityna ( metionina )
•
I ETAP przekształcenie L-ornityny→ putrescyna ( enzym: dekarboksylaza ornitynowa) oraz powstanie
dekarboksylowanej S-adenozylometioniny ( enzym: dekarboksylaza S-adenozylometioninowa)
•
II ETAP kondensacja putrescyny i dekarboksylowanej S-adenozylometioniny→ spermidyna ( enzym: syntaza
spermidynowa)
•
Kondensacja spermidyny z kolejna cząsteczką dekarboksylowanej S-adenozylometioniny → spermina ( enzym: syntaza
sperminowa)
Funkcje:
•
Ze względu na duży ładunek (+) asocjują z polianionami jak DNA i RNA
•
Stymulują biosyntezę DNA i RNA, stabilizują DNA
Katabolizm:
30 z 37
•
KATABOLIZM POLIAMIN→ utlenianie sperminy do spermidyny przez oksydazę poliaminową ( w peroksysomach
wątroby) , a następnie spermidynę do putrescyny
•
Następnie putrescyna utlenia się do NH4(+) i CO2
•
Putrescyna i spermidyna są wydalane głównie z moczem jako koniugaty ( pochodne acetylowe)
5.16 Glutation
–
gamma-glutamylocysteinyloglicyna,
–
synteza:
–
aktywacja grupy gamma-karboksylowej glutaminianu,
–
utworzenie wiązania peptydowego między grupą gamma-karboksylową glutaminianu a
aminową cysteiny (syntetaza gamma-glutamylocysteinowa),
–
syntetaza glutationowa aktywuje grupę karboksylową cysteiny (też zużywa się ATP), a
następnie tworzy wiązanie z grupą peptydową glicyny,
–
służy jako antyutleniacz, reagując z RFT utlenia się do GSSG, rekcję tę katalizuje
peroksydaza glutationowa zależna od selenu,
–
reduktaza glutationowa przywraca formę GSH
5.17 Tlenek azotu
–
krótkożyjąca cząsteczka sygnałowa, swobodnie dyfundująca przez błony,
–
tlenek azotu jest silnym czynnikiem wazorozkurczającym, wcześniej znany jako EDRF,
–
syntetyzowana z argininy przy pomocy syntazy tlenku azotu (NOS), produktem ubocznym
reakcji jest cytrulina, synteza wymaga obecności NADPH i O
2
6. Genetyka
6.1 Polimerazy DNA u Prokaryota i Eukaryota – podobieństwa i różnice
Prokaryota
Eukaryota
replikacja
w jednym miejscu, replikacja
toczy się w przeciwne strony,
w wielu miejscach, replikacja
posuwa się w jedną stronę,
substraty
dATP, dCTP, dGTP, dTTP, Mg2+
dATP, dCTP, dGTP, dTTP,
Mg2+
produkty uboczne
pirofosforan z dwóch reszt
fosfornaowych,
pirofosforan z dwóch reszt
fosforanowych,
matryca
DNA, lub ew. RNA
DNA lub ew. RNA,
podział
I – wolniejsza od III, dodatkowo
posiada aktywność nukleazową 5'-
>3' (wycina startery RNA i
syntetyzuje w to miejsce DNA), II
jądrowe: alfa – synteza nici
opóźnionej (~I), beta –
naprawda DNA, epsillon –
sprawdzanie poprawności i
31 z 37
– odpowiada głównie za naprawę,
III – odpowiada głównie za
syntezę, odłącza się do matrycy
dopiero po zakończeniu replikacji,
naprawa DNA (~II),
delta – synteza nici wiodącej
(~III); mitochondrialne: gamma
– synteza mitochondrialnego
DNA,
aktywność polimerazowa –
synteza nici DNA
5'->3' (I, II, III)
5'->3' (I, II, III)
aktywność egzonukleazowa
– sprawdza poprawność
replikacji, w razie błędów
wycina nukleotydy,
3'->5' (I, II, III)
3'->5' (I, II, III)
32 z 37

6.2 Porównanie Polimerazy I DNA i Polimerazy RNA
polimeraza I DNA
polimeraza RNA
substraty
dATP, dCTP, dGTP,dTTP,
Mg2+,
ATP, GTP, CTP, UTP, Mg2+,
rodzaj matrycy
jednoniciowy DNA,
dwuniciowy, rzadziej
jednoniciowy DNA,
starter
łańcuch starterowy z wolną
grupą 3'-OH
nie wymaga
kierunek syntezy nici
5'->3'
5'-> 3'
metoda elongacji
nukleofilowy atak grupy 3'-OH
na alfa-fosforan dołączanego
nukleozydu,
nukleofilowy atak grupy 3'-OH
na alfa-fosforan dołączanego
nukleozydu,
aktywność nukleazowa
tak
nie
6.3 Potranslacyjne modyfikacje białek
a) nacinanie proteolityczne – np. synteza insuliny,
b) usunięcie reszt aminokwasowych z końca aminowego (aminopeptydazy),
c) kowalencyjne
–
glikozylacja,
–
N-acetylacja, N-metylacja,
–
hydroksylacja,
–
fosforylacja, defosforylacja,
–
ADP-rybozylacja,
–
ubikwitynizacja,
–
dołączenie lipidów i metali,
d) usunięcie pierwszej metioniny,
e) fałdowanie (izomerazy - tw. mostki disiarczkowej, chaperony - białka opiekuńcze)
6.4 Modyfikacje potranskrypcyjne mRNA
–
dołączenie czapeczki guanylowej na 5'-końcu mRNA – umożliwia odnalezienie „fabryki
białkowej” w cytozolu,
–
dołączenie ogona poliadenylowego na 3'-końcu, dzięki temu mRNA jest rozpoznawany jako
swój i nie zostaje niszczony,
–
splicing (usuwanie intronów),
33 z 37

–
edycja RNA,
6.5 Składniki konieczne do inicjacji replikacji:
–
dATP, dTTP, dCTP, dGTP, Mg
2+
,
–
replisom
–
matryca (DNA),
–
miejsce oriC – miejsce początku replikacji (Prokaryota), miejsca początku replikacji
(Eukaryota),
–
helikaza DNA (rozplata dwuniciową helisę),
–
polimeraza DNA,
–
białka SSB (przeciwdziałają tworzeniu się par zasad),
–
prymosom
–
białka Pri A, B, C,
–
prymaza (Prokaryota) / polimeraza alfa DNA z podj. o aktywności prymazy
(Eukaryota) syntetyzująca starter RNA, z wolną grupą 3'-OH,
6.6 Aminoacylotransferaza tRNA.
Podczas translacji pojawiają się dwa problemy:
–
aminokwasy nie są w stanie same odczytywać matrycy RNA,
–
tworzenie wiązania peptydowego między grupą aminową jednego aminokwasu a
karboksylową drugiego jest termodynamicznie niekorzystne,
Oba problemy rozwiązuje aktywacja aminokwasu poprzez przyłącenie go do tRNA, a mówiąc
ściślej estryfikacja z grupą OH 2' bądź 3' glukozy na 3' końcu tRNA. Powstający w wyniku reakcji
produkt nazywa się aminoacylo-tRNA. Reakcję katalizuje aminoacylotransferaza tRNA.
Pojęcie aminoacylotransferaza RNA jest pojęciem zbiorczym bowiem każdy aminokwas ma
przynajmniej dwie swoiste aminoacylotransferazy tRNA.
6.7 Co wchodzi w skład kompleksu inicjującego translację u Prokaryota.
–
białka stanowiące czynniki inicjujące: IF1, IF2, IF3,
–
formylometionylo-tRNA,
–
mRNA,
–
podjednostka rybosomu 30S,
–
GTP,
34 z 37

6.8 Enzymy konstytutywne i indukowane
Część enzymów występuje w mniej więcej stałej ilości w organizmie/komórce i ta część należy do
enzymów konstytutywnych. Natomiast istnieje pewna grupa enzymów, których przedstawicielem
może być bakteryjna beta-galaktozydaza, których stężenie w organizmie jest bardzo zmienne. Gdy
bakteria rośnie i odżywia się głównie laktozą ilość beta-galaktozydazy jest ogromna, natomiast gdy
przechodzi na żywienie się innymi cukrami gwałtownie spada. Okazuje się, że substrat tego
enzymu (laktoza) reguluje transkrypcję genu odpowiedzialnego za utowrzenie beta-galaktozydazy.
Regulowane w ten sposób enzymy nazywa się enzymami indukowanymi.
6.9 Operon lac. Na jego podstawie opisać jak działa operon. Różnica
między operon tryptofanowym.
Operon lac jest odcinkiem na mRNA, za genem regulatorowym licząc od 5'-końca. Operon lac
zawiera miejsce promotorowe, do którego zwykle przyłącza się formylometionino-tRNA, oraz
operator lac. Gen regulatorowy poprzedzający operon lac, wytwarza białko represorowe mogące
swobodnie wiązać się z operatorem lac (symetria cząsteczki represora odpowiada symetrii jego
miejsca wiązania na mRNA – układ palindromiczny). Przyłączenie represora do operatora lac,
uniemożliwia zachodzenie translacji, bowiem jeśli nawet inicjujący tRNA przyłączy się do
promotora, to i tak nie jest możliwa elongacja, bowiem represor „blokuje drogę”.
Okazuje się, ze istnieje białko CAP, zależne od cAMP, które znosi blokujące działanie białka
represorowego (zmniejszając jego powinowactwo do operatora lac). Regulacja poprzez cAMP, jest
o tyle, inteligentna, że cAMP jest sygnałem głodu, a więc niedostatku glukozy. Sygnalizuje więc
ono potrzebę zsyntetyzowania beta-glukozydazy, w celu rozłożenia laktozy do cukrów prostych.
Podsumowując pośrednio obecność substratu dla beta-glukozydazy jest czynnikiem stymulującym
jej produkcję.
Różnica w operonie tryptofanowym, polega na tym, że reguluje on produkcję 5 enzymów
odpowiedzialnych za syntezę tryptofanu. W związku z tym, tryptofan jest czynnikiem, który łącząc
się z białkiem represorowym hamuje syntezę tych enzymów. Natomiast samo białko represorowe,
bez obecności tryptofanu nie wykazuje takiej zdolności.
6.10 Czynniki transkrypcyjne
Czynniki transkrypcyjne oddziaływując z promotorami regulują inicjację transkrypcji.
Wyróżniamy:
a) czynniki transkrypcyjne podstawowe – niezbędne do syntezy mRNA (np. TFII), łączą się one ze
specyficzną sekwencją TATA, umożliwiając przyłączenie polimerazy RNA II do promotora,
b) czynniki nieregulowane wiążące się do sekwencji przed miejscem inicjacji, mają zdolnośc
wzmacniania bądź hamowania incjacji transkrypcji,
c) czynniki regulowane fosforylacją, bądź defosforylacją – podobnie jak poprzednie regulują
inicjację transkrypcji np. czynniki regulatorowe odpowiadające za regulację ekspresji reduktazy
35 z 37

HMG-CoA poprzez obecność steroli.
Motywy wiązania czynników transkrypcyjnych z DNA:
MOTYW HELISA-ZWROT-HELISA: składa się z dwóch helis α rozdzielonych krótką (cztery aminokwasy)
peptydową sekwencją tworzącą zwrot β.
PALCE CYNKOWE: są to pętle zbudowane z 12 aminokwasów zawierające cysteinę i dwie histydyny położone u jej
podstaw.
DOMENY ZASADOWE: bogate w aminokwasy zasadowe. Występują w czynnikach transkrypcyjnych wspólnie z
domenami odpowiedzialnymi za dimeryzację.
6.11 Mechanizmy kontrolujące wierną replikację
a) za poprawne wstawienie nukleotydów odpowiedzialne są Polimerazy I i II DNA. Polimeraza II
ma zdolność znajdowanie błędnie wstawionych nukleotydów, wycinania ich i wstawiania
prawidłwowych. Polimeraza I odpowiada tylko za naprawę.
b) Pod wpływem promieniowania ultrafioletowego często powstają dimery pirymidynowe (z grup
pirymidynowych leżących blisko siebie). Endonukleaza uvrABC wycina kilka nukleotydów
sąsiadujących z jednej i drugiej strony dimeru, a następnie polimeraza I DNA uzupełnia ubytek.
c) Cytozyna włączona do DNA ulega samoczynnej deaminacji do uracylu. Taka zmiana powoduje,
że zsyntetyzowana nić potomna będzie miała nieprawidłowo wstawioną zasadę gdyż C łączy się z
G, a U z A. Z tego powodu DNA posiada tyminę (metylowaną formę uracylu) jako jedną z
pirymidyn. Obecność tyminy pozwala na łatwą naprawę mutacji, bowiem system naprawczy
wyszukuje uracylu w strukturze DNA i usuwa go zastępując cytozyną. RNA nie ulega naprawie
dlatego, może „sobie pozwolić” na wykorzystanie uracylu, który łatwiej się syntetyzuje.
6.12 Hybrydyzacja DNA
Hybrydyzacja DNA jest procesem polegającym na samorzutnej renaturacji dwuniciowej struktury
DNA o ile pojedyncze łańcuchy są do siebie komplementarne.
Zjawisko zauważa się w sytuacji gdy dwuniciowy ulega denaturacji pod wpływem podwyższonej
temperatury bądź czynników chemicznych jak na przykład mocznik.
Okazuje się, że obniżenie temperatury albo usunięcie czynników chemicznych doprowadza do
odtworzenie dwuniciowej struktury DNA.
6.13 Semikonserwatywna replikacja
Określenie, że replikacja jest semikonserwatywna oznacza, że nowozsyntetyzowany dwuniciowy
DNA zawiera jedną nić rodzicielską i jedną potomną, które są do siebie komplementarne.
6.14 Organizacja DNA u Prokariota i Eukariota
Eukaryota
DNA Eukariotyczny jest związany z dużą ilością białek zasadowych – histonów oraz mniejszą
ilością białek niezasadowych. DNA u Eukaryotów w przeciwieństwie do Prokaryotów nie tworzy
36 z 37

struktury kolistej tylko długą, łatworozrywalną formę liniową. W związku z powyższym istnieje
konieczność stabilizacji tej nici. DNA nawinięty na zespół białek histonowych tworzy tzw.
nukleosom
6.15 Transkrypcja u Prokariota i Eukaryota
Prokaryota:
–
polimeraza luźno asocjuje z cząsteczką DNA,
–
przesuwając się ruchem ślizgowym po DNA wyszukuje sekwencji TATAAT, znajdującej się
w jednym z dwóch regionów promotora,
–
następnie dochodzi do rozplecenia nici DNA,
–
synteza RNA komplementarnego do jednej z nici,
–
transkrypcja kończy się w momencie dojścia do sekwencji terminalnych – transkrypcja tej
sekwencji prowadzi utworzenia z mRNA struktury spinki do włosów – determinuje to
zakończenie transkrypcji,
–
jako, że u Prokaryota transkrypcja nie jest rozdzielona translacją, rybosomy mogą
przyłączać się do mRNA i prow. translację już w trakcie trwania transkrypcji,
Eukaryota:
–
transkrypcję prowadzą cztery klasy polimeraz RNA, zwanych transkryptazami, różniących
się wrażliwością na amanitynę (klasa I – syntezuje rRNA, II – mRNA, snRNA, III 5S
rRNA, tRNA, mitochodnrialna mtDNA),
–
przyłączenie czynników transkrypcyjnych TFII do promotora (TFII D, TFII B, TFIIE,
TFIIF),
–
przyłączenie polimerazy RNAII do kasety TATA promotora,
–
przyłączenie cap do 5'
–
elongacja,
–
terminacja zależna jest od pojawienia się w strukturze „spinki do włosów”
–
przyłączenie poliA,
37 z 37
Document Outline
- 1. Białka
- 1.1 Dlaczego hemoglobina w przeciwieństwie do mioglobiny jest białkiem allosterycznym?
- 1.2 Wpływ braku heksokinazy na wiązanie tlenu w erytrocycie.
- 1.3 Glikoproteiny a Proteoglikany – struktura i funkcje
- 1.4 Kolagen i kreatyna
- 1.5 Fałdowanie białek
- 1.6 Co stabilizuje strukturę białek?
- 1.8 Białka posiadające hem jako grupę prostetyczną, funkcje.
- 1.9 Degradacja białek
- 1.10 Sekwencjonowanie peptydów
- 1.11 Porównanie alfa-helisy i beta-harmonijki
- 2. Lipidy
- 3. Enzymy
- 4. Metabolizm energetyczny
- 4.1 Wymień pompy protonowe w łańcuchu oddechowym i wyjaśnij na czym polega proces pompowania.
- 4.2 Fosforylacja oksydacyjna. Enzym. Rozprzęganie fosforylacji.
- 4.3 Wyjaśnij stwierdzenie „Tłuszcze spalają się w ogniu węglowodanów”
- 4.4 Kontrola glikogenogenezy i glikogenolizy
- 4.5 Regulacja ketogenezy
- 4.6 Kontrola lipogenezy
- 4.7 Glikoliza – kluczowe reakcje i kontrola
- 4.8 Glukoneogeneza – reakcje nieodwracalne i kontrola
- 4.9 Szlak pentozofosforanowy
- 4.10 Specyfika narządowa przemian
- 4.11 Rola acetylo-CoA
- 4.12 Cykl Corich
- 4.13 Budowa mitochodnium
- 4.14 Lokalizacja szlaków metabolicznych
- 4.15 Regulacja cyklu kwasu cytrynowego. Kluczowe etapy.
- 4.16 Dehydrogenaza pirogronianowa i alfa-ketoglutaranowa
- 4.17 Fosforylacja substratowa, reakcje glikolizy dostarczające ATP.
- 4.18 Anabolizm i katabolizm cyklu kwasu cytrynowego
- 4.19 NADPH – gdzie jest syntetyzowany i do czego zużywany
- 4.20 Bilans zysków i strat metabolizmu węglowodanów
- 4.21 Strategie metaboliczne
- 5. Metabolizm nieenergetyczny
- 5.1 Jaki związek jest donorem rybozofosforanów w syntezie kwasów nukleinowych? W jakiej reakcji on powstaje?
- 5.2 Która reakcja biosyntezy cholesterolu jest wykorzystywana w terapii arteriosklerozy?
- 5.3 Wymień produkty degradacji szkieletów węglowych aminokwasów. Wyjaśnij pojęcie aminokwasów gluko- i ketogennych.
- 5.4 Aminokwasy jako prekursory związków biologicznie czynnych.
- 5.5 Synteza i degradacja hemu
- 5.6 Degradacja aminokwasów
- 5.7 Reakcje I fazy i ich efekty
- 5.8 Reakcje drugiej fazy i ich efekty
- 5.9 Reakcje przeprowadzane przez CYP450
- 5.10 Charkterystyka i znaczenie CYP450
- 5.11 Polimorfizm na przykładzie CYP450
- 5.12 Znaczenie witaminy D3
- 5.13 Cykl mocznikowy
- 5.14 Szlaki umożliwiające współpracę narządową
- 5.15 Poliaminy
- 5.16 Glutation
- 5.17 Tlenek azotu
- 6. Genetyka
- 6.1 Polimerazy DNA u Prokaryota i Eukaryota – podobieństwa i różnice
- 6.2 Porównanie Polimerazy I DNA i Polimerazy RNA
- 6.3 Potranslacyjne modyfikacje białek
- 6.4 Modyfikacje potranskrypcyjne mRNA
- 6.5 Składniki konieczne do inicjacji replikacji:
- 6.6 Aminoacylotransferaza tRNA.
- 6.7 Co wchodzi w skład kompleksu inicjującego translację u Prokaryota.
- 6.8 Enzymy konstytutywne i indukowane
- 6.9 Operon lac. Na jego podstawie opisać jak działa operon. Różnica między operon tryptofanowym.
- 6.10 Czynniki transkrypcyjne
- 6.11 Mechanizmy kontrolujące wierną replikację
- 6.12 Hybrydyzacja DNA
- 6.13 Semikonserwatywna replikacja
- 6.14 Organizacja DNA u Prokariota i Eukariota
- 6.15 Transkrypcja u Prokariota i Eukaryota
Wyszukiwarka
Podobne podstrony:
Maszyny Elektryczne Opracowanie Pytań Na Egzamin
pytania egz ekonimak II, OPRACOWANIE PYTAŃ NA EGZAMIN
opracowane zestawy, OPRACOWANIE PYTAŃ NA EGZAMIN
instalacje i oświetlenie elektryczne opracowanie pytań na egzamin
Pytania na egz z Ekonomiki, OPRACOWANIE PYTAŃ NA EGZAMIN
Opracowanie pytań na egzamin z Systemów Sterowania Maszyn i Robotów u Salamandry
Pytania z egzaminu ekonomika KTZ ORO 2010, OPRACOWANIE PYTAŃ NA EGZAMIN
Pytania z egzaminu ekonomika KTZ ORO, OPRACOWANIE PYTAŃ NA EGZAMIN
Edukacja wczesnoszkolna pytania opracowanie pytań na egzamin
Ekonomika wziwa, OPRACOWANIE PYTAŃ NA EGZAMIN
Część opracowanych pytań na egzamin
egzamekonomika, OPRACOWANIE PYTAŃ NA EGZAMIN
badziewne Opracowanie na egzamin dyplomowy[1], Opracowanie pytań na egzamin dyplomowy
Opracowanie pytań na egzamin z materiałoznawstwa , Ad29 Przemiana martenzytyczna jest przemianą bezd
Opracowanie pytań na egzamin z materiałoznawstwa
Opracowanie pytań na egzamin, AGH, WIMiC, Technologia Chemiczna, Fizyka
Opracowanie pytań na egzamin
pytania egz ekonimak, OPRACOWANIE PYTAŃ NA EGZAMIN
więcej podobnych podstron