Ćwiczenie 12 „BILANS CIEPLNY”
Temat: Wymiana ciepła i równowaga cieplna.
Cel: Wyznaczenie ciepła właściwego metalu.
Przyrządy: Kalorymetr, termometry, waga laboratoryjna, ogrzewacz elektryczny, kolba kulista, lejek.
Literatura: R. Resnick, D. Halliday, FIZYKA, t. 1., § 22-2
D. Halliday, R. Resnick, J. Walker, PODSTAWY FIZYKI, t. 2., § 19.6, 19.7
I. Metoda pomiaru
W trakcie wymiany ciepła z otoczeniem ciało może zmieniać temperaturę od początkowej tp do
końcowej tk. Niech m oznacza masę ciała. Jeżeli różnica temperatur |tk - tp| nie przekracza kilkudziesięciu stopni Celsjusza, to wymienione ciepło można wyrazić wzorem:
Q = m·c·(tk - tp) (*)
Wielkość c jest stałym współczynnikiem. Nosi on nazwę ciepła właściwego materiału danego ciała. Podany wzór można napisać w postaci ![]()
. Wynika stąd, ciepło właściwe materiału jest liczbowo równe ciepłu, pobranemu przez jednostkową masę tego materiału, przy ogrzewaniu tej masy
o jednostkę temperatury. Ze wzoru (*) wynika konwencja znaków dla wymiany ciepła:
ciepło pobierane ⇒ wzrost temperatury ⇒ tk > tp ⇒ tk − tp > 0 czyli Q > 0
ciepło oddawane ⇒ spadek temperatury ⇒ tk < tp ⇒ tk − tp < 0 czyli Q < 0
Gdy wymiana ciepła zachodzi w układzie n ciał, izolowanym cieplnie od otoczenia, to w końcowym stanie równowagi termodynamicznej wszystkie ciała układu mają tę samą temperaturę tk. Ponieważ układ jest izolowany cieplnie, więc z I zasady termodynamiki wynika, że całkowite ciepło, wymieniane przez składniki układu przy jego dochodzeniu do stanu równowagi termodynamicznej równe jest zero:
Q1 + Q2 + ... + Qn = 0
Równanie to nosi nazwę bilansu cieplnego. Oznaczamy masy składników układu przez m1, m2, ..., mn, ich ciepła właściwe przez c1, c2, ..., cn oraz ich temperatury początkowe przez t1, t2, ..., tn. Zakładamy, że nie zachodzą zmiany stanu skupienia ciał. Równanie bilansu cieplnego ma w tym przypadku postać:
m1·c1·(tk - t1) + m2·c2·(tk - t2) + ... + mn·cn·(tk - tn) = 0
Ciepło właściwe nieznanego materiału można wyznaczyć z równania bilansu cieplnego, analizując wymianę ciepła tego materiału z ciałami o znanych parametrach c, m i tp, jeżeli znana jest masa tego materiału, jego temperatura początkowa oraz końcowa temperatura układu tk. Stosunkowo nietrudno wyznacza się ciepło właściwe metalu przy pomocy kalorymetru, wykonanego ze znanego metalu, oraz wody. Ponieważ metale mają z reguły małe ciepła właściwe a woda duże, zatem celowe jest użycie względnie dużej masy badanego metalu w postaci ścinków oraz małej masy wody, tak, aby tylko zalać metalowe ścinki. Powyższe uwagi są słuszne także w przypadku badania innych ciał stałych o gęstości większej niż woda, jeżeli w trakcie wymiany ciepła nie zmieniają stanu skupienia. Schemat układu do pomiaru ciepła właściwego przedstawia rysunek.
termometr
kolba
kulista
z wodą uszczelka
ogrzewacz naczynie wewnętrzne
z pokrywką
naczynie zewnętrzne woda ze ścinkami
badanego metalu
izolacja termiczna kalorymetr
II. Wykonanie i opracowanie ćwiczenia
UWAGA! Przebieg wykonania ćwiczenia określa osoba prowadząca. Nie wolno włączać żadnej
aparatury elektrycznej bez zgody osoby prowadzącej!
1. Wyznaczyć masę m1 wewnętrznego naczynia kalorymetru wraz z pokrywką.
2. Wsypać do wewnętrznego zbiornika ścinki badanego metalu do ok. połowy wysokości naczynia.
3. Wyznaczyć masę mx ścinków metalu.
4. Wewnętrzne naczynie kalorymetru przykryć pokrywką i umieścić w naczyniu zewnętrznym.
5. Przez otwór w pokrywce wsunąć termometr i zmierzyć temperaturę początkową t1 kalorymetru
ze ścinkami metalu.
6. W otworze pokrywki umieścić gumową uszczelkę i wsunąć koniec lejka. Termometr umocować
tak, aby bańka z rtęcią znalazła się w lejku w strumieniu wody wlewanej do kalorymetru.
7. Wlać do kolby kulistej ok. 100 ml wody.
8. Szyjkę kolby ostrożnie zacisnąć w chwytaku laboratoryjnym. Kolbę umieścić w ogrzewaczu.
9. Włączyć ogrzewacz i doprowadzić wodę w kolbie do wrzenia.
UWAGA! Następne czynności należy wykonywać ze szczególną ostrożnością. Ze względu
na wysoką temperaturę należy stosować ochronne rękawice, a kolbę z gorącą
wodą wolno przenosić tylko przy pomocy chwytaka laboratoryjnego.
10. Ostrożnie wlać wodę przez lejek do wewnętrznego naczynia kalorymetru. Odczytać początkową
temperaturę wlewanej wody t2 termometrem umieszczonym uprzednio w lejku.
11. Po wlaniu wody szybko usunąć lejek a w otworze pokrywki umieścić drugi termometr.
Kalorymetr przykryć tekstolitowymi półpokrywami.
12. Odczytywać co pół minuty temperaturę w kalorymetrze. Jako temperaturę końcową tk należy
przyjąć największa odczytaną wartość.
13. Zważyć wewnętrzne naczynie kalorymetru, wypełnione ścinkami nieznanego metalu i wodą wraz
z pokrywką. Wyjąć uprzednio termometr z uszczelką. Wyznaczyć masę wody m2.
14. Obliczyć nieznane ciepło właściwe z równania bilansu cieplnego, które ma postać:
m1·c1·(tk - t1) + m2·c2·(tk - t2) + mx·cx·(tk - t1) = 0
gdzie cx - nieznane ciepło właściwe, ciepło właściwe glinu c1 = 0,896kJ/kg·K, ciepło właściwe
wody c2 = 4,186kJ/kg·K
15. Obliczyć niepewność u(cx):
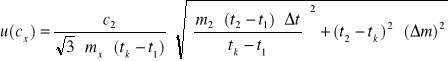
![]()
Dla uproszczenia rachunków uwzględniono tylko niepewność wyznaczenia masy wody, którą można
przyjąć m = 1g oraz niepewność wyznaczenia temperatury końcowej, którą przyjmujemy t = 1oC.
III. Wnioski
1. Przedstawić w poprawnej formie wynik pomiaru ciepła właściwego.
2. Porównać wartość cx z wartościami w tablicach. Określić na tej podstawie badany metal.
3. Wymienić przyczyny największych niepewności pomiarowych. Jakich niedokładności nie
uwzględnia wzór na u(cx)?
IV. Pytania kontrolne
1. Od czego zależy ciepło wymieniane przez ciało z otoczeniem przy zmianie temperatury ciała?
2. Podać interpretację ciepła właściwego.
3. Czym różnią się ciała o małym cieple właściwym od ciał o dużym cieple właściwym?
4. Dlaczego woda nagrzewa się szybciej niż np. piasek?
5. Na czym polega równowaga termodynamiczna układu?
6. O czym mówi I zasada termodynamiki?
7. Co to jest równanie bilansu cieplnego?
8. Jaki wpływ na wynik pomiaru ma niedoskonała izolacja termiczna kalorymetru?
Wyszukiwarka
Podobne podstrony:
INSTRUKCJE, Ćw nr 11. Przewodnictwo cieplne, WSB
Ćw nr 11. Przewodnictwo cieplne, WSB
Cw nr 12
Dok cw nr 12 RPiS id 139083 Nieznany
Cw nr 2, Instytut Techniki Cieplnej i Mechaniki Płynów
Cw nr 12 Elektropneumatyczne sterowanie
Cw nr 12, fizyka labo
Ćw nr 12 Techniczne pomiary impedancji doc
Ćw nr 12 Rezonans napięć w szeregowym obwodzie RLC doc
Ćw nr 1. Sprężyna, Instrukcja wykonawcza
Ćw nr 3. Gęstość, Instrukcja wykonawcza
instrukcja do cw nr 6 obrobka cieplno plastyczna
Ćw nr 4. Lepkość, Instrukcja wykonawcza
Instrukcja wykonania ćw HP2
Biofizyka instrukcja do cw nr 23
Biofizyka instrukcja do cw nr 0 Nieznany (2)
Biofizyka instrukcja do cw nr 09
więcej podobnych podstron