Zakład Chemii Fizycznej
Laboratorium Studenckie
SPRAWOZDANIE
ĆWICZENIE 19
WYZNACZANIE CIEPŁA REAKCJI ZOBOJĘTNIANIA KWASU SIARKOWEGO WODOROTLENKIEM SODOWYM W ROZTWORZE WODNYM
WYKONALI:
Kozieł Urszula
Piotr Gawroński
Technologia Chemiczna
rok III grupa II
SZCZECIN 2002
CEL ĆWICZENIA:
Celem ćwiczenia jest wyznaczenie metodą kalorymetryczną ciepła zobojętniania kwasu siarkowego wodorotlenkiem sodowym w roztworze wodnym.
WSTĘP:
Reakcję zobojętniania mocnego kwasu mocną zasadą, można zapisać następująco:
H2SO4 + 2NaOH = Na2SO4 + 2H2O
Jeżeli przyjąć, że roztwór 2 moli NaOH w 100 g wody zobojętniono za pomocą roztworu 1 mola H2SO4 w 200 g wody, to powyższe równanie przyjmuje postać:
2NaOH · 100 H2O(c) + H2SO4 · 200 H2O(c) = Na2SO4 · 402 H2O(c)
Proces ten charakteryzuje się określonym efektem cieplnym, będącym głównym tematem rozważań.
Badanie polegało na przeprowadzeniu reakcji 450 cm3 NaOH z 25 cm3 H2SO4. Takie proporcje są wystarczające do całkowitego zobojętnienia substancji. Reakcję przeprowadzono w kalorymetrze cieczowym zaopatrzonym w termometr Beckmanna, a także w mieszadło i grzałkę o dokładnie znanym oporze.
Pomiarów temperatury dokonano według instrukcji wykonania ćwiczenia, a uzyskane wyniki przedstawione zostały w tabeli.
Lp. |
Czas [s] |
T [0C] |
Początkowy bieg kalorymetru(pomiar co 1 min) |
||
1 |
0 |
0,1 |
2 |
60 |
0,12 |
3 |
120 |
0,14 |
4 |
180 |
0,15 |
5 |
240 |
0,16 |
6 |
300 |
0,17 |
7 |
360 |
0,18 |
Główny bieg kalorymetru (pomiar co 30 s) |
||
1 |
390 |
1,44 |
2 |
420 |
1,44 |
3 |
450 |
1,44 |
4 |
480 |
1,44 |
5 |
510 |
1,44 |
6 |
540 |
1,44 |
7 |
570 |
1,45 |
8 |
600 |
1,45 |
9 |
630 |
1,46 |
10 |
660 |
1,475 |
11 |
690 |
1,48 |
12 |
720 |
1,49 |
13 |
750 |
1,5 |
14 |
780 |
1,51 |
15 |
810 |
1,52 |
16 |
840 |
1,53 |
17 |
870 |
1,54 |
18 |
900 |
1,545 |
19 |
930 |
1,55 |
20 |
960 |
1,56 |
21 |
990 |
1,57 |
22 |
1020 |
1,58 |
23 |
1050 |
1,59 |
24 |
1080 |
1,595 |
25 |
1110 |
1,6 |
26 |
1140 |
1,61 |
27 |
1170 |
1,615 |
28 |
1200 |
1,62 |
29 |
1230 |
1,63 |
30 |
1260 |
1,64 |
31 |
1290 |
1,645 |
32 |
1320 |
1,65 |
33 |
1350 |
1,66 |
34 |
1380 |
1,665 |
35 |
1410 |
1,67 |
36 |
1440 |
1,675 |
37 |
1470 |
1,68 |
38 |
1500 |
1,69 |
39 |
1530 |
1,695 |
40 |
1560 |
1,7 |
41 |
1580 |
1,71 |
42 |
1620 |
1,715 |
43 |
1650 |
1,72 |
Po ustaleniu się biegu kalorymetru (pomiar co 1 min) |
||
1 |
1710 |
1,73 |
2 |
1770 |
1,73 |
3 |
1830 |
1,74 |
4 |
1890 |
1,74 |
5 |
1950 |
1,745 |
6 |
2010 |
1,75 |
7 |
2070 |
1,755 |
8 |
2130 |
1,76 |
Włączenie grzałki (pomiar co 1 min) |
||
1 |
2190 |
1,86 |
2 |
2250 |
1,92 |
3 |
2310 |
1,98 |
4 |
2370 |
2,04 |
5 |
2430 |
2,1 |
6 |
2490 |
2,16 |
7 |
2550 |
2,21 |
8 |
2610 |
2,27 |
9 |
2670 |
2,33 |
10 |
2730 |
2,39 |
11 |
2790 |
2,44 |
12 |
2850 |
2,5 |
13 |
2910 |
2,56 |
14 |
2970 |
2,61 |
15 |
3030 |
2,67 |
16 |
3090 |
2,73 |
17 |
3150 |
2,76 |
Wyłączenie grzałki (pomiar co 1 min) |
||
1 |
3210 |
2,79 |
2 |
3270 |
2,79 |
3 |
3330 |
2,79 |
4 |
3390 |
2,8 |
5 |
3450 |
2,8 |
6 |
3510 |
2,81 |
7 |
3570 |
2,81 |
8 |
3630 |
2,82 |
9 |
3690 |
2,82 |
10 |
3750 |
2,82 |
OPRACOWANIE WYNIKÓW POMIARÓW:
1. Na podstawie wyników pomiarów zestawionych w tabeli sporządzono wykres biegu kalorymetru: T = f(t)
2. Z wykresu wyznaczono wartości przyrostów temperatury ΔT i ΔTel
Wyniosły odpowiednio: ΔT= 1,24 i ΔTel = 0,88
3. Z równania
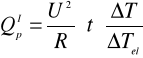
gdzie:
U = 40 [V]
R = 934 [Ω]
t= 1020 [s]
ΔT= 1,24
ΔTel = 0,88
obliczono ciepło reakcji zobojętniania:
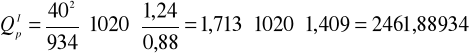
[V·A·s]=[J]
![]()
=2,46188934 [kJ]
4. Obliczamy zmianę entalpii dla reakcji zobojętniania ΔH odniesioną o 1 mola NaOH:
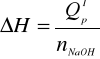
gdzie:
nNaOH = VNaOH · cNaOH = 450 ·10-3 dm3 · 0,1 mol/dm3 = 4,5 · 10-2
więc:
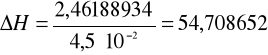
[kJ/mol]
jeżeli 1 kcal = 4,1868 kJ to:
ΔH = 13,06693704 [kcal/mol]
5. W procesie zobojętniania mocnego kwasu mocną zasadą, nie biorą udziału aniony kwasu i kationy zasady, a obserwowane ciepło reakcji wywiązuje się w wyniku powstawania cząsteczki wody:
H3O+ + OH- = 2 H2O
Ciepło neutralizacji mocnych kwasów za pomocą mocnych zasad jest praktycznie niezależne od rodzaju kwasu i zasady i w temperaturze 298 K wynosi 13,33 kcal/mol (55,81 kJ/mol). Porównując otrzymane wyniki można stwierdzić, iż ciepło neutralizacji badanej reakcji pozostaje w bardzo dobrej zgodności z podanymi wartościami.
L.Sobczyk, A.Kisza, K.Gatner, A.Koll:Eksperymentalna Chemia Fizyczna, PWN, W-wa 1982 str 205
Wyszukiwarka
Podobne podstrony:
Prawo inżynierskie i ochrona własności intelektualnych. Wykład 3, Studia, Politechnika Łódzka - Pend
Testy biodegradacji, Studia, Politechnika
Chf9, Studia, Politechnika
Wyznaczanie stałej reakcji szybkości zmydlania estru, Studia, Politechnika
CH.F.L9, Studia, Politechnika
ZAKAAD CHEMI FIZYCZNEJ, Studia, Politechnika
C15, Studia, Politechnika
podstawowe informacje o ochronie prawnej wzorów przemysłowych, Studia - Politechnika Śląska, Zarządz
Sprawko spawalnictwo 1, studia, studia Politechnika Poznańska - BMiZ - Mechatronika, 2 semestr, obro
dziadek25, Studia, Politechnika
4 2 vademecum echosondy (w tym przykładzie wodnej), studia, studia Politechnika Poznańska - BMiZ - M
LABORKA7, Studia, Politechnika
Wyznaczanie stopnia asocjacji kwasu octowego w rozpuszczalni, Studia, Politechnika
deacon1, Studia, Politechnika
Destylacja wojtek, Studia Politechnika Poznańska, Semestr I, Chemia, Chemia laboratoria, Destylacja
Liczby przenoszenia jonów, Studia, Politechnika
103, Studia Politechnika Poznańska, Semestr II, I pracownia fizyczna, LABORKI WSZYSTKIE, FIZYKA 2, F
poprawione7, Studia, Politechnika
CHEMIA~7, Studia, Politechnika
więcej podobnych podstron