Wykonały : Klimach Justyna
Gałka Anna
POLITECHNIKA SZCZECIŃSKA
ZAKŁAD CHEMII FIZYCZNEJ
Laboratorium studenckie

Sprawozdanie z wykonania ćwiczenia nr 30:
„Równowaga fazowa ciecz - para dla układu dwuskładnikowego.”
Wyznaczanie współczynnika aktywności.
Podstawową doświadczalną dla współczynników aktywności ciekłych roztworów nie elektrolitów są głównie badania równowagi międzyfazowej ciecz-para. Poniżej przedstawione zostały podstawowe zależności termodynamiczne stosowane do opisu danych doświadczalnych.
Cząstkowa molowa entalpia swobodna składnika „i” roztworu doskonałego wyraża się wzorem:
)
gdzie: Xi -ułamek molowy składnika „i” w roztworze,
Goi -molowa entalpia swobodna czystego składnika.
Dla roztworu rzeczywistego zaś mamy:
gdzie: ai -aktywność wyprowadzona z ułamka molowego
ai=xi*γi
γi - współczynnik aktywności
Do opisu termodynamicznego roztworów rzeczywistych używa się między innymi termodynamicznych funkcji nadmiaru (ekscesu) - zE. Charakteryzują one odchylenia danego roztworu od roztworu doskonałego:
zE=z-zd
gdzie: z-wartość danej funkcji termodynamicznej dla roztworu rzeczywistego, zd -wartość tej samej funkcji dla roztworu traktowanego jako doskonały.
Stąd cząstkową, molową nadmiarową entalpię swobodną dla składnika „i” można przedstawić następująco:
Gei=Gi-Gdi=RT ln γi
Nadmiarowa entalpia swobodna odniesiona do jednego mola roztworu wynosi:
Do obliczenia nadmiarowej molowej entalpii swobodnej roztworu potrzebna jest znajomość współczynników aktywności poszczególnych składników. Można je wyznaczyć na podstawie badań poszczególnych składników. Można je wyznaczyć na podstawie badań równowagi ciecz-para, oznaczając w warunkach T,p.=const składy równowagowe fazy ciekłej i gazowej.
Ciśnienie cząstkowe (prężność) składnika „i” nad roztworem doskonałym można obliczyć z prawa Routa:
pi=poi*xi
gdzie: pi - prężność cząstkowa składnika „i” w fazie gazowej,
poi -ciśnienie pary nasyconej nad czystym składnikiem „i” w temperaturze układu,
Prężność cząstkową składnika „i” w fazie gazowej możemy też obliczyć z zależności:
pi=p.*yi
gdzie: yi- ułamek molowy składnika „i” w fazie gazowej,
p.-ciśnienie całkowite.
Porównanie wzorów prowadzi do następującej zależności pomiędzy składem cieczy i pary nad roztworem doskonałym:
p.*yi=poi*xi
Prawo Raoulta jest prawem granicznym, słusznym dla układów doskonałych. Większość układów rzeczywistych wykazuje bądź dodatnie, bądź ujemne odchylenia od prawa Raoulta.
Przyjmowaną obecnie fizyczną interpretację odchyleń od doskonałości zaproponował Van Laar. Według tej interpretacji odchylenia od doskonałości są wywołane istnieniem oddziaływań między cząsteczkami natury nie chemicznej, pod wpływem sił Van der Vaalsa.
Jeżeli ciśnienie pary nasyconej zarówno nad czystym składnikiem, jak i nad roztworem nie jest zbyt duże to odchylenia od stano doskonałego w formie gazowej można pominąć. Równanie równowagi destylacyjnej, z uwzględnieniem niedoskonałości fazy ciekłej, przybiera w tym przypadku postać:
p.*yi=poi*ai=poi*xi*γi
gdzie: ai -aktywność składnika „i” w fazie ciekłej, γi-współczynnik aktywności.
Wartości współczynników aktywności poszczególnych składników roztworów ciekłego możemy zatem wyznaczyć z zależności:
Pomiaru temperatury wrzenia zarówno czystych cieczy, jak i roztworów, dokonujemy za pomocą przyrządów zwanych ebuliometrami.
Ebuliometr Świętosławskiego jest to szklany przyrząd składający się z głównej bańki, w której znajduje się badana ciecz, przegrzewacza, gniazdka termometrycznego, chłodnicy i kroplomierza. Ogrzewając przegrzewacz spiralą oporową wywołujemy krążenie wrzącej cieczy, która omywa gniazdko termometryczne. W gniazdku tym ustala się stała temperatura równa temperaturze wrzenia danej cieczy.
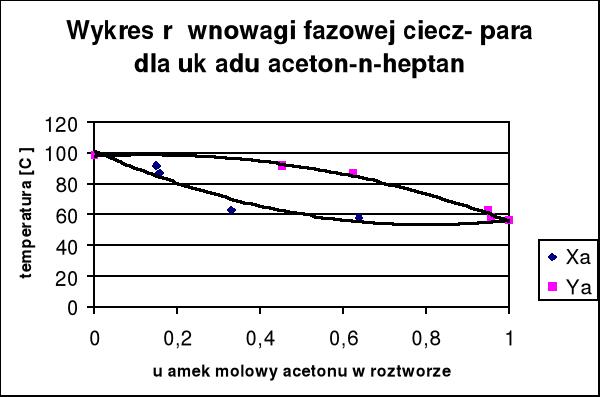
Kiedy skład pary jest różny od składu cieczy to rozdzielenie mieszanin może następować na drodze destylacji. Wtedy kiedy zastosowanie destylacji prostej jest niemożliwe stosuje się destylację na kolumnach zwaną rektyfikacją. Kolumna destylacyjna składa się z szeregu półek umieszczonych jedna nad drugą w odpowiedniej rurze w zbiorniku nad wrzącą cieczą. Ciecz parująca z jednej półki skrapla się na następnej, z której ponownie paruje. Na każdej półce następuje niejako destylacja prosta i ustala się równowaga między cieczą a parą. Płynąca w górę para wzbogaca się w składnik bardziej lotny, a ściekająca w dół ciecz - w skladnik mniej lotny.
Celem ćwiczenia jest wyznaczanie współczynników aktywności acetonu i n-heptanu na podstawowe badań równowagi ciecz-para tego układu i obliczenie, na podstawie uzyskanych wyników współczynników A i B równań van Laara oraz nadmiarowej molowej entalpii swobodnej.
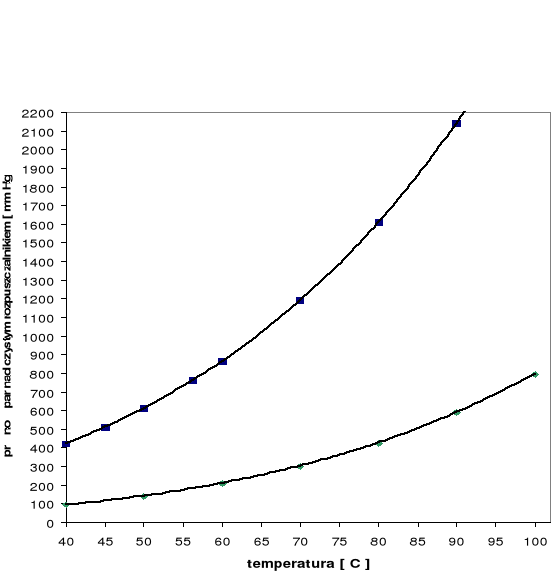
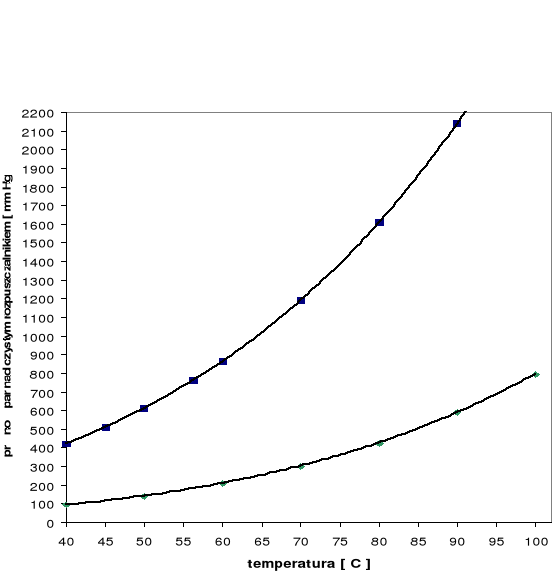
Zależność prężności pary od temperatury
Temperatura T [oC] |
Prężność par acetonu poA [mm Hg] |
Prężność par n-heptanu poH [mm Hg] |
40 |
421,5 |
92,05 |
45 |
510,5 |
|
50 |
612,5 |
140,9 |
56,3 |
760,0 |
|
60 |
860,6 |
208,9 |
70 |
1190 |
302,3 |
80 |
1611 |
426,6 |
90 |
2142 |
588,8 |
100 |
|
795,2 |
Wykres zależności prężności pary nad czystym rozpuszczalnikiem od temperatury.
Zależność współczynnika załamania światła od ułamka molowego acetonu nD= f(xA)
xA |
nD |
0 |
1,3950 |
0,1 |
1,3947 |
0,2 |
1,3956 |
0,4 |
1,3877 |
0,5 |
1,3835 |
0,6 |
1,3810 |
0,7 |
1,3772 |
1 |
1,3665 |
Wyniki pomiarów:
Lp. |
Skład roztworu wyjściowego xA |
Temperatura wrzenia [ 0C] |
Współczynnik załamania światła nD |
Stężenie acetonu [%] |
Stężenie n-heptanu [%] |
||||
|
|
|
Faza ciekła |
Faza gazowa |
Faza ciekła xA |
Faza gazowa yA |
Faza ciekła xH |
Faza gazowa yH |
|
1 |
Aceton |
56,3 |
1,3650 |
1,3891 |
1 |
0 |
- |
- |
|
2 |
n-heptan |
98,4 |
1,3950 |
1,3560 |
- |
- |
1 |
0 |
|
3 |
0,1 |
91,6 |
1,3938 |
1,3839 |
0,151 |
0,452 |
0,849 |
0,548 |
|
4 |
0,2 |
86,7 |
1,3929 |
1,3791 |
0,159 |
0,623 |
0,841 |
0,377 |
|
5 |
0,4 |
62,9 |
1,3882 |
1,3691 |
0,331 |
0,950 |
0,669 |
0,050 |
|
6 |
0,6 |
57,8 |
1,3790 |
1,3681 |
0,639 |
0,958 |
0,361 |
0,042 |
|
Obliczamy współczynnik aktywności acetonu i n-heptanu korzystając ze wzoru :
![]()
p= 768 mmHg
gdzie :
p - ciśnienie barometryczne
poi -prężność czystych składników ( tzn. acetonu i n - heptanu ) w temperaturze wrzenia
poszczególnych roztworów
yi i xi - ułamek molowy składnika i - ( tzn. odpowiednio acetonu i n- heptanu ) w fazie gazowej i
ciekłej
Współczynniki aktywności dla acetonu :

Współczynnik aktywności dla n - heptanu

Współczynniki aktywności dla acetonu wykazują głównie dodatnie odchylenia od prawa Raulta, współczynniki aktywności n-heptanu - ujemne odchylenia .
Obliczanie parametrów A , B z równania van Laara :
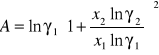

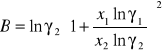

Obliczam nadmiarową molową entalpię swobodną :
T = [ K ]
R = 8, 3143 [ J/mol ⋅ K ]
![]()
GE = 8,3143⋅ 365,1 ( 0,151 ⋅ ln 1,0717 + 0,849 ⋅ ln 0,7995 ) = -544,952 [ J/mol ]
GE = 8,3143 ⋅360,2 ( 0,159 ⋅ ln 1,5527 + 0,841 ⋅ ln 0,5935 ) = -1104,503[ J/mol ]
GE = 8,3143 ⋅336,4 ( 0,331 ⋅ ln 2,6750 + 0,669 ⋅ ln 0,2268 ) = -1865,270[ J/mol ]
GE = 8,3143 ⋅331,3 ( 0,639 ⋅ ln 1,5393 + 0,361 ⋅ ln 0,5019 ) = 321,174 [ J/mol ]
Wyszukiwarka
Podobne podstrony:
Prawo inżynierskie i ochrona własności intelektualnych. Wykład 3, Studia, Politechnika Łódzka - Pend
Testy biodegradacji, Studia, Politechnika
Chf9, Studia, Politechnika
Wyznaczanie stałej reakcji szybkości zmydlania estru, Studia, Politechnika
CH.F.L9, Studia, Politechnika
ZAKAAD CHEMI FIZYCZNEJ, Studia, Politechnika
C15, Studia, Politechnika
podstawowe informacje o ochronie prawnej wzorów przemysłowych, Studia - Politechnika Śląska, Zarządz
Sprawko spawalnictwo 1, studia, studia Politechnika Poznańska - BMiZ - Mechatronika, 2 semestr, obro
dziadek25, Studia, Politechnika
4 2 vademecum echosondy (w tym przykładzie wodnej), studia, studia Politechnika Poznańska - BMiZ - M
LABORKA7, Studia, Politechnika
Wyznaczanie stopnia asocjacji kwasu octowego w rozpuszczalni, Studia, Politechnika
deacon1, Studia, Politechnika
Destylacja wojtek, Studia Politechnika Poznańska, Semestr I, Chemia, Chemia laboratoria, Destylacja
Liczby przenoszenia jonów, Studia, Politechnika
103, Studia Politechnika Poznańska, Semestr II, I pracownia fizyczna, LABORKI WSZYSTKIE, FIZYKA 2, F
poprawione7, Studia, Politechnika
CHEMIA~7, Studia, Politechnika
chemfiz.24, Studia, Politechnika
więcej podobnych podstron