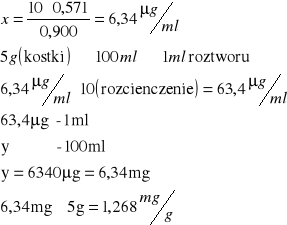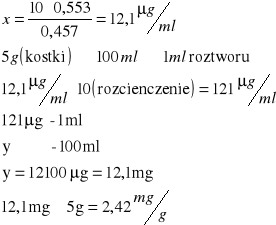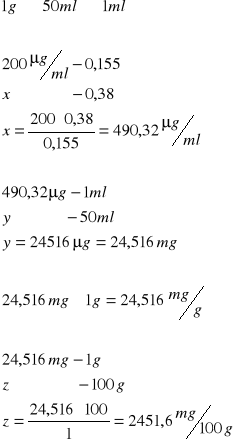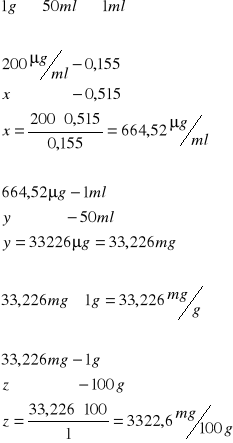Technologia Żywności i Żywienie Człowieka
Sem. V gr. 3
Czwartek 1215-1600
Laboratorium z Biochemii
Ćwiczenie nr 4
KWASY NUKLEINOWE
Wstęp teoretyczny
Kwasy nukleinowe to związki wielkocząsteczkowe, które występują we wszystkich żywych komórkach głównie w postaci nukleoprotein (białka złożonego). Odgrywają one zasadniczą rolę w przekazywaniu cech dziedzicznych i kierowaniu syntezą białek, czyli reakcji podczas której następuje łączenie się prostych substratów, z których powstaje jeden bardziej złożony produkt główny.
Kwasy nukleinowe wywodzą swoją nazwę od łacińskiej nazwy jądra komórkowego - nucleus, gdzie po raz pierwszy stwierdzono ich obecność. W 1869 roku został odkryty przez Mieschera kwas deoksyrybonukleinowy (DNA) w plemnikach łososia. Ogromny postęp badań nad kwasami nukleinowymi datuje się dopiero od połowy XX wieku, kiedy w 1944 roku Avery, MacLeod i McCarty wykazali po raz pierwszy, że DNA zawiera informację genetyczną. W 1952 roku Brown i Todd określili sposób powiązania nukleotydów w cząsteczce, a w 1953 roku Watson i Crick zaproponowali model DNA. W ciągu ostatnich 40 lat dokonano wielu odkryć w zakresie budowy i funkcji kwasów nukleinowych, jak również przeprowadzono wiele syntez fragmentów DNA. Badania te przyczyniły się do rozwoju takich dyscyplin naukowych, jak: genetyka, wirusologia, bakteriologia i wielu innych.
Kwasy nukleinowe to jedne z najważniejszych związków chemicznych w organizmach żywych. Zasadniczo są dwa rodzaje kwasów nukleinowych: kwas rybonukleinowy (RNA) oraz kwas deoksyrybonukleinowy (DNA). Oba mogą występować pod postacią zarówno pojedynczej jak i podwójnej nici, przy czym zazwyczaj DNA tworzy nić podwójną, a RNA pojedynczą. Kwasy nukleinowe przechowują informację genetyczną organizmu oraz pośredniczą w produkcji białek zgodnie z zasadami kodu genetycznego. Kwas DNA jest substancją, w której jest zapisana substancja genetyczna. Na terenie komórki występuje głównie w jądrze, ale również w chromosomach, chloroplastach i mitochondriach, natomiast kwas RNA znajduje się w cytoplazmie, rybosomach i w jąderku - bierze udział w „tłumaczeniu” informacji genetycznych na język białek.
Monomer kwasu nukleinowego składa się z cząsteczki pentozy, dla RNA rybozy, dla DNA deoksyrybozy, zasady purynowej lub pirymidynowej przyłączonej do pierwszego atomu węgla pentozy, oraz reszty fosforanowej, przyłączonej do trzeciego oraz piątego atomu węgla dwóch sąsiednich pentoz polimeru.
Pentozy
Obecność cukrów w kwasach nukleinowych stwierdzono bardzo dawno. W roku 1909 w pracowni Levena w Nowym Yorku znaleziono w kwasie nukleinowym otrzymanym z drożdży cukier D-rybozę. Tamże w kilkanaście lat po tym odkryciu ustalono, że kwas deoksyrybonukleinowy zawiera 2-deoksyrybozę. Obie odmiany pentoz występują w kwasach nukleinowych w postaci β-furanozowej. Atomy węgla wchodzące w skład pierścienia pentozy numerowane są cyframi ze znaczkiem ` (prim) dla odróżnienia od numeracji atomów w zasadach purynowych i pirymidynowych.
D-ryboza posiada grupę hydroksylową przy drugim atomie węgla, natomiast 2-deoksyryboza nie posiada takiej grupy przy tym atomie węgla.
W kwasach nukleinowych, podobnie jak w białkach wyróżniamy strukturę pierwszorzędową, czyli sekwencję wymienionych wyżej zasad heterocyklicznych.
Kształt łańcuchów polinukleidowych i ich wzajemne usytuowanie to struktura drugorzędowa. W DNA dwa identyczne łańcuchy w postaci prawoskrętnych spirali (heliksów), zawierające 10 zasad na każdy skręt heliksu, są ułożone jeden wokół drugiego w przeciwnych kierunkach, tworząc nić o średnicy około 2 nm. Heliksy łączą się między sobą wiązaniami wodorowymi występującymi między zasadami każdego z heliksów składowych. Wielkości cząsteczek sugerują, że wiązania te mogą występować jedynie w parach adenina-tymina (A...T) i guanina-cytozyna (G...C).
|
|
Zasady purynowe
W skład kwasów nukleinowych wchodzą heterocykliczne związki dwupierścieniowe. Fisher nazwał te związki „ciałami purynowymi” (po niemiecku purinkörper od łacińskiego purum unicum: acidum unicum to łacińska nazwa kwasu moczowego). W purynie, podstawowym związku tego typu można wyróżnić pierścień pirymidynowy i imidazolowy:
Puryna pirymidyna imidazol
Wolnej puryny w przyrodzie nie znaleziono, znane są natomiast pochodne aminowe i hydroksylowe puryny:: 6-aminopuryna nazywana adeniną, otrzymana po raz pierwszy z trzustki przez Koszela oraz 2-amino-6-hydroksypuryna nosząca nazwę guaniny, znaleziona już w 1844 roku w guanie, naturalnym nawozie powstałym głównie z ptasich ekskrementów. Stąd pochodzi nazwa guaniny.
Adenina Guanina
Zasady pirymidynowe
W kwasach nukleinowych występują głównie trzy zasady pirymidynowe. Są to: cytozyna, czyli 2-hydroksy-4-aminopirymidyna, występująca w obu odmianach kwasów nukleinowych, uracyl, będący 2,4-dihydroksypirymidyną, składnik RNA oraz tymina, czyli 5-metylouracyl, występująca tylko w DNA.
Cytozyna uracyl tymina
Charakterystyczną cechą tych heterocyklicznych zasad, zarówno purynowych jak i pirymidynowych, jest ich silna absorpcja promieniowania w ultrafiolecie.
Nukleozydy
Są to N-glikozydy omówionych wyżej zasad purynowych i pirymidynowych z rybozą
lub deoksyrybozą. W pracowni Aleksandra Todda w Cambridge ustalono, że wiązanie glikozydowe w nukleozydach łączy pierwszy atom węgla (C-1') β-furanozowej odmiany rybozy (deoksyrybozy) z atomem N-1 zasady pirymidynowej lub atomem N-9 zasady purynowej. Nazwy nukleozydów są tworzone w zależności od rodzaju występujących w nich zasad. I tak nazwy nukleozydów purynowych powstają przez zastąpienie w nazwie zasady końcówki -ina końcówką -ozyna.
Adenozyna guanozyna
Urydyna cytozyna tymidyna
Nukleotyd
Są to estry kwasu ortofosforowego i nukleozydów. Kwas ortofosforowy związany jest z jedną z grup OH rybozy lub deoksyrybozy. W rybozydach są trzy wolne grupy wodorotlenowe przy atomach C-2'. C-3' i C-5', a w deoksynukleozydach dwie przy atomach C-3' i C-5'. Każda z tych grup może być zestryfikowana kwasem fosforowym. Wyizolowano i otrzymano syntetycznie wszystkie izomeryczne pochodne fosforanowe odpowiednich nukleozydów. Nazwy tych związków urabiane są od nazw nukleozydów, natomiast potocznie nazywane są kwasami.
Adenozyno-5'-fosforan adenozyno-3'-fosforan
Guanozyno-5'-fosforan urydyno-5'-fosforan
Cytydyno-5'-fosforan tymidyno-5'-fosforan
Rozpuszczalność kwasów nukleinowych.
Do 0,5ml roztworów RNA i DNA dodałyśmy kroplami 1N HCl. Wytrącił się biały osad. Po dodaniu roztworu NaOH osad uległ rozpuszczeniu.
Wnioski: DNA i RNA to kwasy nukleinowe po dodaniu kwasy solnego wytrącił się osad, co świadczy o tym, że DNA i RNA nie rozpuszczają się w kwasach. A po dodaniu NaOH osad uległ rozpuszczeniu, czyli kwasy dobrze rozpuszczają się w zasadach.
Do 1ml 0,1% roztworów DNA i RNA dodałyśmy podwójną objętość 96% etanolu. Pojawił się osad.
Wnioski: Po dodaniu etanolu do kwasów nukleinowych pojawił się osad, świadczy to o tym, że kwasy nukleinowe dobrze wytrącają się w obecności alkoholu, jakim jest etanol.
Kwaśna hydroliza kwasów nukleinowych. Przygotowanie hydrolizatu.
Pobrałyśmy 2,5ml 1% roztworów kwasów nukleinowych i ogrzewałyśmy we wrzącej łaźni wodnej z 2,5ml 10% H2SO4 w ciągu godziny.
Wnioski: Kwasy nukleinowe: DNA i RNA pod wpływem ogrzewania z kwasem siarkowym (VI) ulegają hydrolizie do wolnych zasad purynowych i nukleotydów pirymidynowych.
Wykrywanie pentoz w hydrolizatach kwasowych.
Reakcja orcynolowa.
Do probówek zawierających po 1ml:
hydrolizatu RNA
hydrolizatu DNA
0,1% roztworu RNA
0,1% roztworu DNA
1% roztworu rybozy
1% roztworu deoksyrybozy
dodałyśmy po 1ml odczynnik orcynolowego i umieściłyśmy we wrzącej łaźni wodnej na 15 minut.
Wnioski: Wszystkie próby zabarwiły się na zielono, wynika to z tego, że pentozy wolne (ryboza i deoksyryboza) oraz związane w nukleozydach (RNA i DNA) pod wpływem ogrzewania ze stężonym HCl przechodzą w furfural, który z orcyną oraz jonami Fe3+ tworzy trwały kompleks o zielonej barwie.
Reakcja Dischego.
Do probówek zawierających po 1ml:
hydrolizatu RNA
hydrolizatu DNA
0,1% roztworu RNA
0,1% roztworu DNA
1% roztworu rybozy
1% roztworu deoksyrybozy
dodałyśmy po 2ml odczynnika difenyloaminowego, a następnie umieściłyśmy we wrzącej łaźni wodnej na 10 minut.
Wnioski: Niebieskie zabarwienie pojawiło się tam gdzie w próbie znajdowała się deoksyryboza (w próbach: 2,4,6). W próbkach, gdzie było DNA również pojawiło się zabarwienie, ponieważ w DNA występuje między innymi deoksyryboza.
Wykrywanie kwasu fosforowego.
Do 0,5ml hydrolizatu kwasu nukleinowego (DNA, RNA) dodałyśmy 3 krople roztworu amoniaku, żeby zobojętnić hydrolizat kwasu nukleinowego. Następnie dodałyśmy 0,5ml stężonego roztworu HNO3 i 2ml roztworu molibdenianu amonowego. Później ogrzewałyśmy do wrzenia.
Wnioski: Po ogrzaniu probówek zaobserwowałyśmy wytrącenie się żółtego osadu, co świadczy o obecności fosforanów badanej próbie.
Wykrywanie zasad purynowych.
Do 1ml hydrolizatu kwasu nukleinowego (DNA, RNA) dodałyśmy 6 kropli stężonego amoniaku i 3ml amoniakalnego roztworu wodorotlenku srebra.
Wnioski: Wytrącił się biały osad soli srebrowych purynu, który jest nierozpuszczalny w amoniaku.
Oznaczanie zawartości zasad purynowych metodą spektrofotometryczną.
Przygotowanie surowca do pomiaru spektrofotometrycznego:
Do 5g kostki bulionowej dodałyśmy ok. 75ml wody destylowanej, gotowałyśmy e wrzącej łaźni wodnej przez 10 minut, a następnie po przestudzeniu przesączyłyśmy do kolby miarowej o pojemności 100ml przez gazę młyńską i uzupełniłyśmy do kreski wodą destylowaną. Po wymieszaniu roztwór jeszcze raz przesączyłyśmy, przez sączek bibułowy. Do pomiaru spektrofotometrycznego badany roztwór rozcieńczyłyśmy 10-krotnie 0,1N HCl. Pomiar absorbancji wykonany został przy dwóch długościach fali: maksymalnego pochłaniania i przy 290nm (dla adeniny przy 262nm i 290nm; dla guaniny przy 249nm i 290nm).
Produkt |
E249 |
E262 |
E290 |
1) Bulion grzybowy Knorr |
0,862 |
0,880 |
0,309 |
2) Bulion grzybowy Winiary |
1,236 |
1,253 |
0,497 |
3) Rosół z kury Knorr |
0,468 |
0,357 |
0,145 |
4) Rosół z kury Knorr |
0,421 |
0,406 |
0,023 |
5) Rosół drobiowy Winiary |
1,015 |
1,046 |
0,089 |
6) Bulion wołowy Knorr |
1,509 |
1,461 |
0,005 |
7) Bulion wołowy Winiary |
1,086 |
1,041 |
0,563 |
8) Bulion wołowy Kucharek |
1,004 |
0,868 |
0,362 |
OBLICZENIA:
Adenina ΔE262-292 = 0,900
Guanina ΔE249-292 = 0,475
Przykład obliczeń dla 1)
Bulion grzybowy Knorr:
Dla adeniny:
ΔE262-292 = 0,571
10µg/ml - 0,900 x - 0,571
|
Dla guaniny:
ΔE249-292 = 0,553
10µg/ml - 0,457 x - 0,553
|
Tabela wyników:
Produkt |
adenina |
guanina |
||
|
ΔE262-292 |
Zawartość [mg/g] |
ΔE249-292 |
Zawartość [mg/g] |
1) Bulion grzybowy Knorr |
0,571 |
1,268 |
0,553 |
2,42 |
2) Bulion grzybowy Winiary |
0,756 |
1,68 |
0,739 |
3,23 |
3) Rosół z kury Knorr |
0,212 |
0,471 |
0,323 |
1,41 |
4) Rosół z kury Knorr |
0,383 |
0,851 |
0,398 |
1,74 |
5) Rosół drobiowy Winiary |
0,957 |
2,127 |
0,926 |
4,05 |
6) Bulion wołowy Knorr |
1,456 |
3,236 |
1,504 |
6,58 |
7) Bulion wołowy Winiary |
0,478 |
1,062 |
0,523 |
2,29 |
8) Bulion wołowy Kucharek |
0,506 |
1,124 |
0,642 |
2,81 |
Wnioski: Bulion rosołowy z kury firmy Knorr jest najlepszy, ponieważ zawiera najmniej adeniny i guaniny. Bulion wołowy firmy Knorr jest najgorszy, gdyż zawiera najwięcej tych związków. Buliony firmy Knorr (oprócz bulionu wołowego) są lepsze od kostek bulionowych innych firm. Wśród bulionów wołowych najlepszy jest bulion Winiary, grzybowy - Knorr, drobiowy - Knorr.
Oznaczanie zawartości DNA metodą difenyloaminową.
Ekstrakcja kwasów nukleinowych.
10g tkanki zwierzęcej (wątroba),
1g mleczu z ryb,
homogenizowałyśmy z 50ml zimnego 10% kwasu trójchlorooctowego. Homogenat odwirowałyśmy. Kwas trójclorooctowy ekstrahuje niskocząsteczkowe związki kwasorozpuszczalne (nukleotydy, aminokwasy, estry fosforanowe). W osadzie pozostają białka, polisacharydy i kwasy nukleinowe. Superntant (ciecz nadosadowa) usunęłyśmy, a do osadu dodałyśmy 30ml 0,6M roztworu kwasu nadchlorowego i ogrzewałyśmy mieszaninę w ciągu 15 minut w łaźni wodnej o temperaturze 90oC stale mieszając. W wyniku ogrzewania z roztworem HClO4 kwasy nukleinowe zostają uwolnione od białka, ulegają hydrolizie do związków kwasorozpuszczalnych i przechodzą do roztworu. Po ostudzeniu odwirowałyśmy osad zawierający białko, a supernatant przeniosłyśmy ilościowo do kolby miarowej o pojemności 50ml. Zawartość kolby uzupełniłyśmy kwasem nadchlorowym do kreski i dokładnie wymieszałyśmy.
Oznaczanie zawartości DNA metodą difenyloaminową.
1ml ekstraktu kwasów nukleinowych i 1ml wody destylowanej (próba badana)
1ml wzorcowego DNA (o stężeniu 200µg/ml) i 1ml wody destylowanej (próba wzorcowa)
2ml wody destylowanej (próba odczynnikowa)
do każdej dodałyśmy po 4ml odczynnika difenyloaminowego. Wszystkie próby jednocześnie wstawiłyśmy do wrzącej łaźni wodnej i inkubowałyśmy w ciągu 10 minut. Ochłodziłyśmy próby i zmierzyłyśmy absorbancję prób badanych i wzorcowej wobec próby odczynnikowej na spektrokolorymetze przy długości fali 600nm.
OBLICZENIA:
Wzorcowa próba kwasu DNA
![]()
Wątroba:
odczytana absorbancja - 0,45
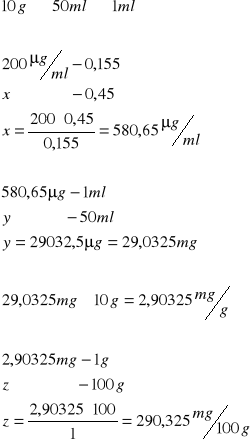
Śledź:
Odczytana absorbancja
0,38
0,515
Śledź I)
|
Śledź II)
|
Wnioski: W śledziu jest dużo więcej kwasu DNA niż w wątrobie.
Wyszukiwarka