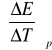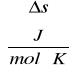ZAKŁAD CHEMII FIZYCZNEJ
Laboratorium studenckie
Sprawozdanie z wykonania ćwiczenia nr 26:
„Wyznaczenie SEM ogniwa w zależności od temperatury.”
WYKONANIE:
W ogniwie chemicznym o budowie:
![]()
zachodzą procesy:
na anodzie: 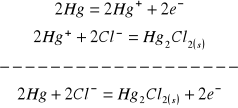
na katodzie: ![]()
co sumarycznie daje: ![]()
Równanie Nernsta dla SEM :
![]()
gdzie:
![]()
potencjał elektrody w roztworze
![]()
potencjał normalny elektrody, jest to wielkość stała dla danego metalu elektrody w danej temp.
R- stała gazowa R=8,314J/mol
T- temperatura w K
z-liczba elektronów biorących udział w reakcji ogniwa
F- stała Faradaya F=9,6464*10^4 Coulomb/mol
a- aktywność reagentów
Dane z literatury :
Dla anody -![]()
Dla katody-![]()
Na podstawie pomiaru siły elektromotorycznej ogniwa oraz jej zmiany z temperaturą można oznaczyć entalpię swobodną, entropię oraz entalpię opisanej reakcji. Podczas pracy ogniwa odwracalnego w stałej temperaturze i pod stałym ciśnieniem:
![]()
gdzie: ![]()
- potencjał termodynamiczny
![]()
- liczba moli elektronów wymieniona w reakcji (tu: z = 2)
![]()
- siła elektromotoryczna
![]()
- stała Faradaya
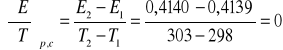
Z równania Gibbsa-Helmholtza:
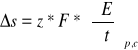
np.
![]()
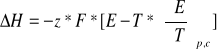
np.
![]()
Znając ![]()
oraz ![]()
można obliczyć ![]()
na podstawie równania:
![]()
np.
![]()
Z powyższych wzorów wyliczam ![]()
wyniki umieszczone są w tabeli:
Temperatura [°K] |
SEM |
|
|
|
|
298 |
0,4140 |
- |
-79872,2 |
0 |
-79872,2 |
303
|
0,4139 |
-2*10^-5 |
-79852,9 |
-0,00002 |
-81022 |
308 |
0,4121 |
-1,9*10^-4 |
-79505,6 |
-0,00019 |
-90795,8 |
313 |
0,4065 |
-5*10^-4 |
-78425,2 |
-0,0005 |
-108618 |
318 |
0,4020 |
-6*10^-4 |
-77557,1 |
-0,0006 |
-114368 |
Jednostki:
Rys. Wykres zależności siły elektromotorycznej (SEM) od temperatury (K).
2
Wyszukiwarka
Podobne podstrony:
SEM 2, Studia POLSL, STUDIA, Fizyka, laboratoria, SEM
Elementy RLC w obwodzie prądu sinusoidalnie zmiennego, Studia, Fizyka Laboratoryjna, pracownia fizyc
Fizyka - Laboratorium Nr 1 - Mostek Wheatstone'a, Studia, Sem I OiO, Fizyka, Labki, Mostek Wheatston
Fizyka - Laboratorium Nr 2 - Busola Stycznych, Studia, Sem I OiO, Fizyka, Labki, Busola Stycznych
Sprawozdanie nr.1, Politechnika Lubelska, Studia, ELEKTROTECHNIKA LABORATORIUM, Laboratoria z elektr
Sprawozdanie nr 4, Politechnika Lubelska, Studia, ELEKTROTECHNIKA LABORATORIUM, Laboratoria z elektr
protokół 5, Politechnika Lubelska, Studia, ELEKTROTECHNIKA LABORATORIUM, Laboratoria z elektrotechni
mag, Politechnika Lubelska, Studia, ELEKTROTECHNIKA LABORATORIUM, Laboratoria z elektrotechniki sem.
Wyk1FXN, szkola, szkola, sem 3, MARCIN STUDIA, Fizyka budowli
100t, Polibuda, studia, S12, Fiza, Lab, Fizyka- laboratoria, Laborki- inne2
F10- sprawozdanie Wojtka, STUDIA (ochrona), ROK I, Fizyka, laboratoria
Cwiczenie 53c, Akademia Górniczo - Hutnicza, Technologia Chemiczna, Studia stacjonarne I stopnia, SE
Cwiczenie 11i, Akademia Górniczo - Hutnicza, Technologia Chemiczna, Studia stacjonarne I stopnia, SE
t2, Studia weeia pł, fizyka laboratorium
303b, Studia, ROK I, 1 semestr, Fizyka, LABKI z FIZ, Sprawozdania, fizyka lab sprawka, Fizyka- labor
więcej podobnych podstron