Ćwiczenie E. Wpływ temperatury na aktywność enzymów
Cele ćwiczenia:
Poznawczy: Zbadanie wpływu temperatury na aktywność enzymów na przykładzie reakcji hydrolizy sacharozy przez inwertazę zawartą w wyciągu drożdżowym.
Metodyczny: Zapoznanie się z jedną z metod oznaczania stężenia cukrów redukujących - metodą Nelsona.
Nr |
V odczynnika miedziowego [ml] |
V standardu glukozy [ml] |
V H2O [ml] |
Próby E+S przygot. wg Tabeli 2. |
V odczynnika arseno-molibdenowego [ml] |
A660 |
A660/kor/ |
|
próbki |
|
|
|
|
|
|
|
|
1 |
0,5 |
- |
0,5 |
|
0,5 |
0 |
- |
|
2 |
0,5 |
0,1 |
0,4 |
|
0,5 |
0,197 |
- |
|
3 |
0,5 |
0,2 |
0,3 |
|
0,5 |
0,329 |
- |
|
4 |
0,5 |
0,3 |
0,2 |
|
0,5 |
0,415 |
- |
|
5 |
0,5 |
0,4 |
0,1 |
|
0,5 |
0,615 |
- |
|
6 |
0,5 |
0,5 |
- |
Nr |
V [ml] |
0,5 |
0,788 |
- |
7 |
0,5 |
- |
0,4 |
12 |
0,1 |
0,5 |
0,343 |
0,212 |
7' |
0,5 |
- |
0,4 |
12' |
0,1 |
0,5 |
0,131 |
- |
8 |
0,5 |
- |
0,4 |
13 |
0,1 |
0,5 |
0,802 |
0,646 |
8' |
0,5 |
- |
0,4 |
13' |
0,1 |
0,5 |
0,156 |
- |
9 |
0,5 |
- |
0,4 |
14 |
0,1 |
0,5 |
1,141 |
0,945 |
9' |
0,5 |
- |
0,4 |
14' |
0,1 |
0,5 |
0,196 |
- |
10 |
0,5 |
- |
0,4 |
15 |
0,1 |
0,5 |
1,439 |
1,312 |
10' |
0,5 |
- |
0,4 |
15' |
0,1 |
0,5 |
0,127 |
- |
11 |
0,5 |
- |
0,4 |
16 |
0,1 |
0,5 |
0,149 |
-0,005 |
11' |
0,5 |
- |
0,4 |
16' |
0,1 |
0,5 |
0,154 |
- |
TABELA 1
Opracowanie wyników
1). Obliczenie stężenia masowego standardu glukozy CG,stand.[mg/ml]. Zakładamy, że jego gęstość jest równa gęstości wody.
Dla próbki numer 2:
![]()
![]()
gdzie ![]()
![]()
2). Obliczenie masy glukozy mG,stand. [μg] w próbkach 1-6 służących do wykonania krzywej standardowej.
Dla próbki numer 2:
Wychodzimy ze wzoru z punktu 1). i liczymy dalej
![]()
[μg]
3). Wykres 1: Zależność absorbancji A660 w funkcji masy glukozy mG,stand.
Równanie linii trendu: y=0,3091x a stąd wynika, że: A=0,3091*m
4). Obliczenie absorbancji opisującej ilość glukozy powstałej w reakcji enzymatycznej ΔA660/kor/ dla próbek 7-11.
Korzystamy z równania: ΔA660/kor/ = A660 - A'660
A660 - pomiar absorbancji roztworów „nieprimowanych”
A'660 - pomiar absorbancji roztworów „primowanych” - absorbancja wynikająca z nieenzymatycznej hydrolizy sacharozy
Np. dla próbki 7 i 7': ΔA660/kor/ = 0,343 - 0,131 = 0,212
5). Obliczenie masy glukozy mG,P [μg]powstałej w reakcji enzymatycznej w próbkach 7-11.
A=0,3091*m m = A / 0,3091
Np. dla próbek 7 (7'): ![]()
6). Obliczenie masy glukozy ![]()
zawartej w 6 ml mieszaniny reakcyjnej (próbki 12-16).
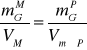
VM = 6 ml VMP = 0,1 ml
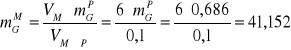
[μg]
7). Obliczenie liczności glukozy nG,M [μmol] w mieszaninach reakcyjnych.
MG = 180 g/mol = 180 μg/μmol
n = m/M nG,M = 41,125 / 180 = 0,229 μmol
8). Obliczenie aktywności inwertazy Aktinwertazy[U/ml].
Miarą aktywności enzymu jest liczność substratu, jaka zostaje przekształcona przez enzym w produkt w ciągu 1 minuty
![]()
Jednostką aktywności enzymatycznej jest U (unit) podawana jako ilość enzymu, która w optymalnych warunkach pH i temperatury oraz przy wysycającym stężeniu substratu przekształca 1 μmol substratu w produkt w ciągu 1 minuty.
W przeliczeniu na 1 ml enzymu, aktywność enzymatyczna liczona była zgodnie ze wzorem:
![]()
gdzie VE - objętość enzymu dodana do mieszaniny reakcyjnej (0,5ml)\
Czas reakcji - 10 minut
nsubstratu - z poprzedniego punktu
![]()
dla próbki 12
9). Wyniki obliczeń - Tabela 2
Treakcji [st.C] |
A660/kor/ |
mG,P [μg] |
mG,M [μg] |
nG,M [μmol] |
Aktinwertazy [U/ml] |
4 |
0,212 |
0,686 |
41,152 |
0,229 |
0,0457 |
20 |
0,646 |
2,090 |
125,396 |
0,697 |
0,1393 |
40 |
0,945 |
3,057 |
183,436 |
1,019 |
0,2038 |
55 |
1,312 |
4,245 |
254,675 |
1,415 |
0,2830 |
100 |
- |
- |
- |
- |
0 |
10). Wykres 2: Zależność aktywności enzymu inwertazy od temperatury
11). i 12). Interpretacja wyników i wnioski
Wyniki doświadczenia wskazują na to, iż optymalna temperatura działania badanego roztworu inwertazy z wyciągu drożdżowego wynosi blisko 55 st.C. Według danych literaturowych temperatura ta wynosi ok.60 st.C.
Najniższa aktywność w temp. 4 st.C.
13). Inwertaza sacharozy cechuje się wysoką aktywnością w przedziale temperatur 48-56 st.C. Zakres ten można ocenić jako typowy dla enzymów glikolitycznych. W podobnym zakresie temperatur dużą aktywność wykazują inne enzymy amylolityczne (np.alfa-amylaza najaktywniejsza w temp. między 45-55 st.C).
14). Krzywa standardowa określa zależność pomiędzy masą substratu cukrowego, powstałego podczas enzymatycznej inwersji sacharozy, a jego zdolnością do pochłaniania światła. Szybkość zamiany absorbancji jest wprost proporcjonalna do aktywności enzymu, wyrażonej w molach substratu (lub produktu).
Krzywą standardową wyznaczono na podstawie pomiaru absorbancji prób zawierających znaną ilość glukozy. Dzięki temu możliwe było wyznaczenie ilości wytworzonego produktu (glukozy) podczas reakcji enzymatycznej zachodzącej w różnych temperaturach.
15). Wykonanie doświadczenia pozwoliło na zbadanie wpływu temperatury na aktywność inwertazy (z wyciągu drożdżowego) oraz poznanie metody Nelsona, wykorzystywanej do oznaczania stężenia cukrów redukujących.
Wyszukiwarka
Podobne podstrony:
biochemia sprawozdanie O (4), biochemia laboratorium, O (moje)
ćw. H wykres, biochemia laboratorium, H (moje)
II O- Biochemia cwiczenie 5, Politechnika Wrocławska - ochrona środowiska, biochemia - laboratorium
II O- Biochemia cwiczenie 1, Politechnika Wrocławska - ochrona środowiska, biochemia - laboratorium
II O- Biochemia cwiczenie 4, Politechnika Wrocławska - ochrona środowiska, biochemia - laboratorium
II O- Biochemia cwiczenie 3, Politechnika Wrocławska - ochrona środowiska, biochemia - laboratorium
II O- Biochemia cwiczenie 2, Politechnika Wrocławska - ochrona środowiska, biochemia - laboratorium
II O- Biochemia cwiczenie 7, Politechnika Wrocławska - ochrona środowiska, biochemia - laboratorium
Cwiczenie 2 - Regulatory dwustawne moje, Szkoła, Semestr 5, Podstawy Automatyki - laboratoria, Autom
II O- Biochemia cwiczenie 5, Politechnika Wrocławska - ochrona środowiska, biochemia - laboratorium
II O- Biochemia cwiczenie 1, Politechnika Wrocławska - ochrona środowiska, biochemia - laboratorium
Plan ćwiczeń biochemia
zabawy i cwiczenia relaks 4, Praktyki moje dokumenty
Ćwiczenie nr 12 moje sprawko, MIBM WIP PW, fizyka 2, FIZ 2, 12, sprawko nr 12
SPRAWOZDANIE NR 4 - Michał, pwr-eit, FIZYKA, LABORATORIUM[moje], Sprawozdania
Materialy do cwiczen, biochemia
SprawkoA B, biochemia laboratorium, Biochemia - sprawozdania inne
01, Cwiczenie 01 g, Laboratorium z fizyki
DIAGNOSTYKA - CWICZENIA5, Diagnostyka Laboratoryjna V WL
więcej podobnych podstron