Zakład Chemii Fizycznej
Laboratorium Studenckie
ĆWICZENIE nr 24
TEMAT:
WYZNACZANIE POWIERZCHNI WŁAŚCIWEJ
WĘGLA AKTYWNEGO.
Aleksander Skrzypczak
Jacek Zdyb
Inżynieria chemiczna
Grupa III Rok II
Wstęp
Zjawisko występujące na granicy dwóch faz , polegające na powstawaniu różnic pomiędzy przeciętnym składem wnętrza faz , a składem warstw przylegających do powierzchni rozdziału , nazywamy adsorpcją. Zachodzi ono prawie zawsze w przypadku zetknięcia się gazów lub cieczy (adsorbat) z fazą stałą. W wyniku procesu adsorpcji cząsteczki adsorbentu na powierzchni ciała stałego zwanego adsorbentem tracą swobodę ruchu. W zależności od sił działających na cząsteczki fazy ciekłej lub gazowej w warstwie przylegającej do adsorbentu , adsorpcja może mieć charakter fizyczny lub chemiczny.
Cząsteczki i atomy mogą przyłączać się do powierzchni na dwa sposoby. W procesie fizysorpcji (adsorpcji fizycznej) pomiędzy adsorbatem i adsorbentem istnieją oddziaływania van der Waalsa (np. siły dyspersyjne lub oddziaływania dipolowe). Siły van der Waalsa mają długi zasięg, lecz są słabe, zatem energia uwolniona w trakcie fizysorpcji cząsteczki jest tego samego rzędu, co entalpia kondensacji. Taka niewielka ilość energii może być z łatwością pochłonięta przez drgania sieciowe i ulec dysypacji
w postaci ruchów termicznych, przeto cząsteczka, skacząc po powierzchni, stopniowo wytraca swą energię, by w końcu ulec adsorpcji w procesie zwanym akomodacją.
Entalpię adsorpcji fizycznej można wyznaczyć, mierząc wzrost temperatury próbki o znanej pojemności cieplnej. Typowe jej wartości wynoszą około 20 kJ mol-1 . Tak niewielka zmiana entalpii najczęściej nie wystarcza do zerwania wiązania, zatem zaadsorbowana fizycznie cząsteczka zachowuje swą tożsamość, choć obecność powierzchni może powodować jej odkształcenie.
W procesie chemisorpcji (adsorpcji chemicznej) cząsteczki (lub atomy) łączą się z powierzchnią, tworząc wiązania chemiczne (najczęściej kowalencyjne), dążąc przy tym do największej liczby koordynacyjnej na powierzchni. Entalpia chemisorpcji jest dużo większa niż fizysorpcji. a typowe jej wartości wynoszą około 200 k] • mol-1 . Również odległość pomiędzy powierzchnią i najbliższymi atomami adsorbatu jest zazwyczaj mniejsza w przypadku chemisorpcji niż adsorpcji fizycznej.
Zaadsorbowana chemicznie cząsteczka może ulec rozpadowi w wyniku działania niewysyconych walencyjnie atomów powierzchniowych. Fragmentacja cząsteczek na powierzchni pod wpływem chemisorpcji jest jedną z przyczyn tego, że powierzchnie ciał stałych katalizują reakcje chemiczne.
Z wyjątkiem szczególnych przypadków, chemisorpcja jest procesem egzotermicznym. Podstawowym testem umożliwiającym rozróżnienie chemisorpcji od fizysorpcji był niegdyś pomiar entalpii adsorpcji. Wartości powyżej —25 kJ • mol-1 przypisywano adsorpcji fizycznej, a poniżej ok. —40 kJ mol-1 — adsorpcji chemicznej. Takie kryterium nie stanowi jednak żadnego dowodu i obecnie w tym celu raczej stosuje się metody spektroskopowe.
Według modelu adsorpcji Langmuira szybkość procesu adsorpcji można wyrazić następująco
![]()
![]()
(1)
a szybkość desorpcji
![]()
(2)
Z równania (1) wynika , że szybkość adsorpcji zależy od niepokrytej (wolnej) powierzchni (1-Θ) i od ciśnienia gazu p (lub stężenia). W stanie równowagi następuje zrównanie się szybkości va = vd , czyli że
![]()
(3)
a stąd po przekształceniu
![]()
(4)
gdzie K = ka/kd jest określany jako współczynnik adsorpcji.
Wyrażenie (4) jest równaniem izotermy adsorpcji Langmuira. W przypadku adsorpcji z roztworu równanie izotermy Langmuira przyjmuje postać:
![]()
(5)
Równanie izotermy adsorpcji Langmuira można sprowadzić do postaci liniowej
![]()
(6)
Jeżeli stopień pokrycia wyrazimy ilością moli adsorbatu odniesioną do 1 g adsorbentu
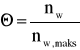
(7)
to równanie izotermy adsorpcji przyjmie postać
![]()
![]()
![]()
(8)
lub po przekształceniu
![]()
(9)
Zależność (9) jest równaniem prostej o parametrach 1/nw,maks i 1/(nw,maksK). Za pomocą tego równania można wyznaczyć stałe K i nw,maks ze współczynnika kierunkowego prostej 1/nw,maks i z rzędnej 1/(nw,maksK). Znając wartość nw,maks możemy wyliczyć powierzchnię właściwą przypadającą na określoną ilość adsorbenta A , jeżeli znana jest powierzchnia S zajmowana przez cząsteczką w monowarstwie
![]()
(10)
Opracowanie wyników
1. Zestawienie danych uzyskanych w trakcie wykonywania doświadczenia :
L.P. |
Stężenie początkowe 50 cm3 kw. octowego przed adsorpcją [mol/dm3] |
Objętość 0,1 molowego roztworu NaOH zużytego do miareczkowania [cm3] |
Objętość 0,1 molowego roztworu NaOH zużytego do miareczkowania [dm3] |
1. |
0,15 |
28 |
0,028 |
2. |
0,12 |
21,6 |
0,0216 |
3. |
0,09 |
18,8 |
0,0188 |
4. |
0,06 |
12,4 |
0,0124 |
5. |
0,03 |
6,1 |
0,0061 |
6. |
0,015 |
2,8 |
0,0028 |
- Przykładowe obliczenia :
Obliczanie liczby moli kwasu octowego zawartych w 50 cm3 (0,05 dm3 ) roztworu przed adsorpcją :
n1 = ckw. octowego · Vkw. octowego
![]()
![]()
Obliczanie liczby moli kwasu octowego zawartych w 50 cm3 roztworu po adsorpcji :
( K - współczynnik zależny od objętości próbki pobranej do miareczkowania , dla pierwszych
dwóch próbek K=2,5 a dla pozostałych czterech K=2 ) .
n2 = cNaOH VNaOH·K
![]()
![]()
Obliczanie stężenia równowagowego kwasu octowego :
![]()
![]()
![]()
Obliczanie całkowitej ilości moli kwasu octowego, która uległa zaadsorbowaniu :
n = n1 - n2
0,0075 - 0,007 = 0,0005 [mol]
Obliczanie ilości moli kwasu octowego, która została zaadsorbowana na 1g węgla aktywnego :
![]()
![]()
![]()
2. Zestawienie uzyskanych wyników z obliczeń :
Ilość moli kwasu octowego w 50 cm3 roztworu przed adsorpcją n1[mol] |
Ilość gramów użytego węgla aktywnego m[g] |
Ilość moli kwasu octowego w 50 cm3 roztworu po adsorpcji n2[mol] |
Stężenie równowagowe kwasu octowego c[mol/dm3] |
Całkowita ilość moli kwasu octowego która uległa zaadsorbowaniu n=n1-n2[mol] |
Ilość moli kwasu octowego która została zaadsorbowana na 1g węgla aktywnego nw=n/m[mol/g] |
0,0075 |
1,0159 |
0,007 |
0,14 |
0,0005 |
0,000492 |
0,006 |
1,0048 |
0,0054 |
0,108 |
0,0006 |
0,000597 |
0,0045 |
1,00225 |
0,00376 |
0,0752 |
0,00074 |
0,000738 |
0,003 |
1,0206 |
0,00248 |
0,0496 |
0,00052 |
0,000509 |
0,0015 |
0,9998 |
0,00122 |
0,0244 |
0,00028 |
0,00028 |
0,00075 |
1,04085 |
0,00056 |
0,0112 |
0,00019 |
0,000182 |
3. Na podstawie uzyskanych wyników wykreślono krzywą izotermy adsorpcji :
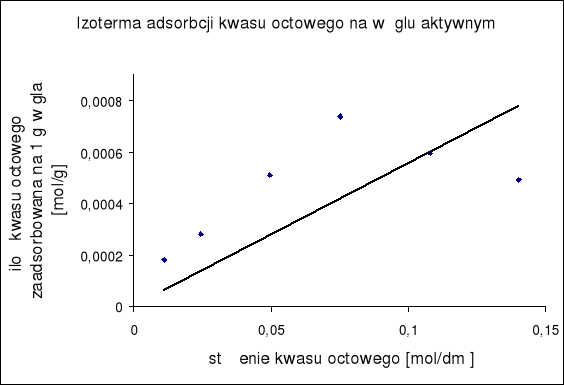
4. Na podstawie równania (9) wykreślono zależność c/nw = f(c)
oraz obliczono liczbę moli kwasu octowego potrzebną do pokrycia powierzchni 1 g węgla aktywnego monomolekularną warstewką ( nw,maks).
Wartość tą wyznaczono na podstawie wyznaczenia współczynnika kierunkowego wykreślonej uprzednio prostej b = 1 / nw,maks
a) metoda graficzna
Wybieramy dwa punkty z powyższego wykresu i przy pomocy ich współrzędnych położenia korzystając z równania obliczamy współczynnik kierunkowy prostej :
![]()
współrzędne punktów : x1 = 0,02 ; y1 = 60
x2 = 0,12 ; y2 = 220
a = 1600
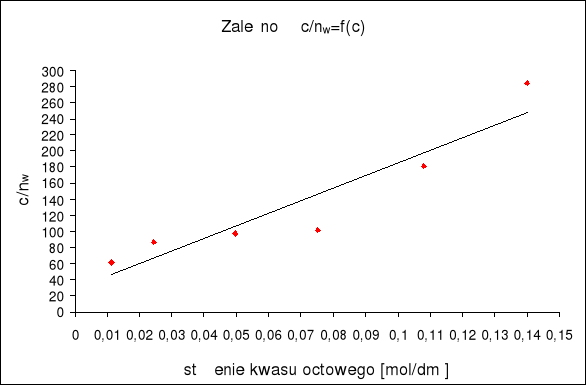
b) metoda najmniejszych kwadratów
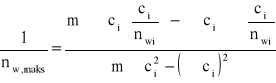
c/nw |
c·(c/nw) |
c |
c2 |
284,452 |
39,82328 |
0,14 |
0,0196 |
180,864 |
19,53331 |
0,108 |
0,011664 |
101,8503 |
7,65914 |
0,0752 |
0,005655 |
97,34954 |
4,828537 |
0,0496 |
0,00246 |
87,12543 |
2,12586 |
0,0244 |
0,000595 |
61,35537 |
0,68718 |
0,0112 |
0,000125 |
812,9966 |
74,65731 |
0,4084 |
0,0401 |
suma
(∑ci)2 = 0,166791
liczba pomiarów m = 6
a = ![]()
![]()
![]()
4. Zakładając , że S = 21·10-20 obliczamy za pomocą równania (10) powierzchnię właściwą węgla aktywnego A korzystając z wartości uzyskanych z metody najmniejszych kwadratów :
A = nw,maksNAS = 0,00063674·6,025·1023·21·10-20 = 80,5635 ![]()
Wyszukiwarka
Podobne podstrony:
Prawo inżynierskie i ochrona własności intelektualnych. Wykład 3, Studia, Politechnika Łódzka - Pend
Testy biodegradacji, Studia, Politechnika
Chf9, Studia, Politechnika
Wyznaczanie stałej reakcji szybkości zmydlania estru, Studia, Politechnika
CH.F.L9, Studia, Politechnika
ZAKAAD CHEMI FIZYCZNEJ, Studia, Politechnika
C15, Studia, Politechnika
podstawowe informacje o ochronie prawnej wzorów przemysłowych, Studia - Politechnika Śląska, Zarządz
Sprawko spawalnictwo 1, studia, studia Politechnika Poznańska - BMiZ - Mechatronika, 2 semestr, obro
dziadek25, Studia, Politechnika
4 2 vademecum echosondy (w tym przykładzie wodnej), studia, studia Politechnika Poznańska - BMiZ - M
LABORKA7, Studia, Politechnika
Wyznaczanie stopnia asocjacji kwasu octowego w rozpuszczalni, Studia, Politechnika
deacon1, Studia, Politechnika
Destylacja wojtek, Studia Politechnika Poznańska, Semestr I, Chemia, Chemia laboratoria, Destylacja
Liczby przenoszenia jonów, Studia, Politechnika
103, Studia Politechnika Poznańska, Semestr II, I pracownia fizyczna, LABORKI WSZYSTKIE, FIZYKA 2, F
poprawione7, Studia, Politechnika
CHEMIA~7, Studia, Politechnika
więcej podobnych podstron