Cel ćwiczenia
Celem ćwiczenia jest wyznaczenie rozpuszczalności soli trudnorozpuszczalnej i obliczenie iloczynu rozpuszczalności tej soli w wodzie.
Wstęp teoretyczny
Jedną, z charakterystycznych właściwości elektrolitów jest zdolność do przewodzenia prądu przez ich roztwory lub stopione elektrolity jonoforowe. Przewodnictwo elektryczne ![]()
można zdefiniować jako odwrotność oporu stawianego przez roztwór elektrolitu. Jednostką przewodnictwa jest simens, S.
Do pomiarów przewodnictwa, używa się specjalnego naczyńka nazywanego naczyńkiem konduktometrycznym. Przewodnictwo ![]()
mierzy się za pomocą przyrządu zwanego konduktometrem. Jest to zmodyfikowany mostek Wheastone'a. Jego schemat jest przedstawiony na rysunku:
gdzie:
Det - galwanometr
Rx - opór omowy naczyńka konduktometrycznego
Cx - opór pojemnościowy naczyńka
R1 - dobierany równoważący opór omowy
C1 - opór pojemnościowy, równoważący opór naczyńka
R2 i R3 - ustalone opory bocznikujące
Pomiar przewodnictwa polega na takim dobraniu oporów R1, R2 oraz R3, aby zrównoważyć nieznany opór omowy Rx stawiany przez roztwór elektrolitu w naczyńku. Gdy mostek jest zrównoważony, przez galwanometr nie płynie prąd, ![]()
. Oznacza to, że potencjały w punktach C i D są sobie równe, a więc spełnione są następujące zależności:
![]()
![]()
Dzieląc stronami równania, otrzymujemy:
![]()
Potencjały w punktach C i D są równe, a zatem:
![]()
![]()
Zatem:
![]()
Przewodnictwo elektryczne roztworu ![]()
w naczyńku konduktometrycznym jest wprost proporcjonalne do efektywnej powierzchni elektrody s oraz odwrotnie proporcjonalne do odległości pomiędzy elektrodami l i zależy od przewodnictwa właściwego elektrolitu ![]()
:
![]()
Dla każdego naczyńka konduktometrycznego stosunek odległości pomiędzy elektrodami l do efektywnej powierzchni elektrody s jest wielkością stałą i nazywamy go stałą naczyńka k. Stałą naczyńka k wyznacza się doświadczalnie, mierząc przewodnictwo ![]()
dla roztworu wzorcowego o znanym przewodnictwie właściwym ![]()
. Najczęściej stosowanym wzorcem są roztwory KCl.
Przewodnictwem właściwym elektrolitu ![]()
nazywamy zdolność przewodzenia prądu przez jednostkową objętość roztworu umieszczoną pomiędzy elektrodami o jednostkowej powierzchni efektywnej. Przewodnictwo właściwe roztworu zależy od liczby jonów zawartych w jednostkowej objętości, a więc silnie zależy od stężenia roztworu elektrolitu.
Przewodnictwo molowe ![]()
, to przewodnictwo słupa roztworu, znajdującego się pomiędzy elektrodami o jednostkowej powierzchni efektywnej, która zawierz 1 mol ładunków dowolnego znaku, dodatnich lub ujemnych.
Przewodnictwo molowe ![]()
można obliczyć dzieląc przewodnictwo właściwe ![]()
przez stężenie ładunków dowolnego znaku c:
![]()
Współczynnik ![]()
w powyższym równaniu wynika z przeliczenia jednostek przewodnictwa właściwego, ![]()
i stężenia ![]()
.
Przewodnictwo molowe ![]()
zależy od stężenia ładunków c. Dla elektrolitów jonoforowych wpływ stężenia na przewodnictwo molowe opisuje doświadczalna zależność Kohlrauscha:
![]()
![]()
- molowe przewodnictwo graniczne, czyli przewodnictwo 1 mola ładunków dowolnego znaku w roztworze nieskończenie rozcieńczonym:
![]()
Molowe przewodnictwo graniczne dla elektrolitów jonoforowych można wyznaczyć przez ekstrapolację doświadczalnej zależności ![]()
. Dla wszystkich elektrolitów, jonoforowych i jonogennych, przewodnictwo graniczne można obliczyć z prawa niezależnej wędrówki jonów sformułowanego przez Kohlrauscha:
![]()
Rozpuszczalność soli trudnorozpuszczalnej, czyli stężenie roztworu nasyconego, można wyznaczyć mierząc przewodnictwo właściwe tego roztworu. Należy jednak pamiętać, że mierzone doświadczalnie przewodnictwo właściwe roztworu ![]()
jest sumą przewodnictw wszystkich składników roztworu, soli ![]()
i rozpuszczalnika ![]()
:
![]()
.
Jeśli stężenie soli jest duże, przewodnictwo właściwe rozpuszczalnika jest znacznie mniejsze od przewodnictwa soli i dlatego jest pomijane w obliczeniach. Ponieważ stężenie soli trudnorozpuszczalnej jest bardzo małe, przewodnictwa właściwego rozpuszczalnika nie można pominąć.
Stężenie roztworu nasyconego soli trudnorozpuszczalnej można obliczyć zakładając, że przewodnictwo molowe tego roztworu jest równe przewodnictwu granicznemu. Przyjmując to założenie można napisać:
![]()
Opis metody pomiarowej
Najpierw pobiera się z pokoju laboratoryjnego: zanurzeniowe naczyńko konduktometryczne, wzorcowy roztwór KCl, sól trudnorozpuszczalną i specjalnie przygotowaną wodę destylowaną. Następnie naczyńko konduktometryczne przepłukuje się kilkakrotnie wodą destylowaną, zanurza w tej wodzie i umieszcza w termostacie. Przewodnictwo wody mierzy się po około 10 minutach termostatowania. Pomiary powtarza się trzykrotnie w pięciominutowych odstępach. Po wykonaniu pomiarów dla wody, przepłukuje się naczyńko nasyconym roztworem soli trudnorozpuszczalnej. Pomiary wykonuje się w sposób analogiczny, jak w przypadku wody. To samo dotyczy pomiarów dla roztworu wzorcowego - KCl, których dokonuje się na samym końcu ćwiczenia. Podczas sczytywania pomiarów z konduktometru, powinno się ustawiać taki zakres dokładności, aby w odczytać jak najwięcej cyfr znaczących.
4. Pomiary i obliczenia
Tabela pomiarowa
Badana ciecz |
Przewodnictwo |
|
|||
|
|
|
|
|
|
woda |
5,68E-06 |
5,73E-06 |
5,78E-06 |
5,73E-06 |
2,96E-06 |
roztwór soli |
7,16E-06 |
7,27E-06 |
7,31E-06 |
7,25E-06 |
3,74E-06 |
wzorcowy roztwór KCl |
2,72E-03 |
2,74E-03 |
2,75E-03 |
2,74E-03 |
0,001413 |
b) Obliczam stałą naczyńka konduktometrycznego:
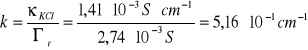
c) Obliczam przewodnictwa właściwe roztworu soli ![]()
i wody ![]()
z zależności:
![]()
![]()
Rozpuszczalność soli trudnorozpuszczalnej obliczam z zależności:
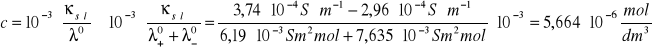
Iloczyn rozpuszczalności soli trudnorozpuszczalnej obliczam z następującej zależności:
![]()
![]()
oraz ![]()
oznaczają współczynniki stechiometryczne dla danej soli.
Wartość teoretyczna iloczynu rozpuszczalności
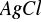
wynosi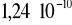
.
Stąd obliczam błąd względny:
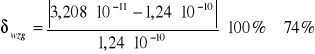
Wnioski
Woda destylowana teoretycznie nie powinna wykazywać przewodnictwa. W rzeczywistości jest jednak inaczej, gdyż uzyskanie wody idealnie wolnej od jonów jest niemal niemożliwe. Jednakże mimo wszystko, pomiar dla wody wskazuje na najmniejsze przewodnictwo wśród przebadanych substancji.
Roztwór wzorcowy chlorku potasu charakteryzuje się największym przewodnictwem z przebadanych substancji. Dzięki pomiarom przewodnictwa jest możliwe dość dokładne wyznaczenie stałej naczynka konduktometrycznego.
Wartość iloczynu rozpuszczalności soli trudnorozpuszczalnej - chlorku srebra obliczona przeze mnie różni się dość znacznie od wartości tablicowej. Wszak jest między tymi wartościami różnica jednego rzędu wielkości. Błąd względny wynosi 74%. Mógł on być spowodowany błędami w przygotowaniu roztworu, niewystarczającą czułością urządzenia pomiarowego lub niedokładnym oczyszczeniem naczyńka konduktometrycznego.
4
Wyszukiwarka
Podobne podstrony:
5431
5431
5431
5431
narodowe sily zbrojne 1942, 1946 5431
więcej podobnych podstron