ZESTAW I
1.TRIPEPTYD I WIĄZANIE PEPTYDOWE
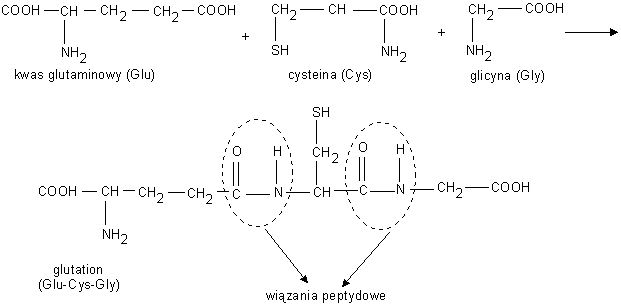
Wiązanie peptydowe - jest wiązaniem kowalencyjnym, między grupą α - aminową jednego aminokwasu i grupą α-karboksylową innego.
Wiązanie peptydowe ma charakter wiązania podwójnego podwójnego prawie zawsze występuje w konformacji trans.
Z powodu charakteru podwójnego wiązania , wiązanie C-N jest także krótsze niż zwykle pojedyncze wiązanie C-N. W związku z tym grupa peptydowa zbudowana z atomów CO-NH jest stosunkowo sztywna i płaska, ale możliwa jest rotacja wokół wiązań Cα-N i Cα- C.
2.AKTYWACJA AMINOKWASU CZYLI DOJRZEWANIE aat-RNA
Aktywacja aminokwasu - w procesie biosyntezy białek to proces powstawania kompleksu tRNA-aminokwas (aminoacylo-tRNA). Aktywacja aminokwasu zachodzi dwuetapowo i wymaga nakładu energii z ATP.
I etap: aminokwas + ATP- aktywowany aminokwas + 2P/ aktywacji ulega grupa karboksylowa
II etap: aktywny aminokwas + tRNA- aminoacylo-tRNA + AMP
Każda cząsteczka tRNA ma drugorzędną strukturę w formie liścia koniczyny. Składa się z 3 pętli , z których jedna na swym końcu ma antykodon. Aminokwas jest wiązany kowalencyjnie przez syntetazę aminoacyli - tRNA, z grupą 3'OH przy końcu 3'tRNA tworząc aminoacylo tRNA.
Wiązanie utworzone między aminokwasem i tRNA zawiera dużą ilość energii, która umożliwia oddziaływanie aminokwasu z końcem rosnącego łańcucha polipeptydowego i utworzenie w tym samym miejscu wiązania peptydowego.
3.BILANS ENERGETYCZNY
glikoliza = powstają 2 cząsteczki ATP ( -1 cząsteczka ATP w fosforyzacji glukozy,
-1 cząst. ATP w fosforyzacji fruktozo- 6- fosforanu
+2 cząst. ATP defosforylacji fosfoenylopirogronianu
+2 cząst. ATP defosforylacja 1,3 BPG)
utlenienie 2 cząst. Aldehydu 3-fosfoglicerynowego daje 2 cząst. NADH
oksydacyjna e\dekarboksylacja pirogronianu - powstaja 2 cząśt. NADH
cykl Krebsa = powstanie 2 cząstaczek guanozynotrifosforanu GTP z 2 cząst. Bursztynylo - COA
-przy utlenieniu 2 cząst. Izocytrynianu, α - ketaglutaranu i jabłcznu powstaje 6 cząst NADH
- przy utlenieniu 2 cząst. Bursztynianu powstają 2 cząst. FACH
fosforyzacja oksydacyjna (łańcuch oddechowy)
-każda z wytworzonych wytworzonych czasie glikolizy cząsteczek NADH daje 1,5 cząst. ATP
-każda z cząst. Wytworzonych Wytworzonych czasieoksydacyjnej dekarboksylacji daje 2,5 cząst. ATP
- 2 cząst. FACH utworzone w czasie cyklu kresa dają po 1,5 ATP
- 6 cząst. NADH wytworzonych podczas cyklu krebsa daje po 2,5 ATP
czyli razem 30 ATP
ZESTAW II
1.BUDOWA ENZYMÓW , KOENZYM OPISAĆ NA PODSTAWIE TRANSFERAZ
Enzymy - budowa, działanie, regulacja
Enzymy to białka o własnościach katalitycznych, które posiadają zdolność zwiększania szybkości reakcji chemicznej. Obniżają energię aktywacji, same jednak nie ulegają przemianie, dlatego nie zużywają się bezpośrednio w wyniku reakcji. …Większość enzymów składa się z:*części białkowej, czyli apoenzymu, *części niebiałkowej, czyli grupy prostetycznej lub koenzymu.
Koenzymy - małocząsteczkowe, niebiałkowe związki organiczne decydujące o aktywności katalitycznej pewnych enzymów.
Biorą udział w reakcjach przez oddawanie lub przyłączanie pewnych reagentów (atomów, grup atomów lub elektronów). Pozostają luźno związane z właściwym enzymem. Jako koenzymy funkcjonują w większości witaminy lub jony połączone odwracalnie z apoenzymem. Koenzymy pod względem chemicznym są nukleotydami, czyli związkami, które składają się z cukru (pentoza: ryboza, deoksyryboza), zasady azotowe
Transferazy - klasa enzymów katalizujących reakcję przeniesienia grupy chemicznej (np. tiolowej (SH2), aminowej, metylowej czy fosforanowej) lub atomu z jednej cząsteczki (donora) na drugą (akceptora), co można zobrazować: AB + C → A + BC. w zależności od grupy chemicznej, przenoszonej przez dany enzym.
Transferazy dzielą się na dziewięć podklas: (w zależności od grupy chemicznej, przenoszonej przez dany enzym)
- przenoszą fragmenty jednowęglowe
Metylotransferazy
Karboksylo- i karboksymoilo- transferazy
Amidynotransferazy
- przenoszą fragmenty cząsteczek z grupami aldehydowymi lub ketonowymi
- Acylotransferazy - przenoszą reszty kwasowe
- Glukozylotransferazy - przenoszą reszty cukrowe
- przenoszą grupy alkilowe lub arylowe (z wyjątkiem metylowych)
- Aminotransferazy - przenoszą grupy azotowe
- przenoszą reszty fosforanowe
Fosfotransferazy
Kinazy
- przenoszą grupy zawierające siarkę
- Selenotransferazy - przenoszą grupy zawierające selen
2.transkrypcja u prokariota i eukariota. mRNA u obu
Inicjacja transkrypcji u prokariotów polega na związaniu się polimerazy RNA z odpowiednim odcinkiem pasma matrycowego DNA - tzw. promotorem. Polimeraza rozpoznaje sekwencje -35 i -10 promotora (a transkrypcja zaczyna się od nukleotydu +1). Specyficzność wiązania zapewnia czynnik σ (sigma). Rozsunięcie nici DNA na odcinku kilkunastu nukleotydów (czyli powstanie tzw. kompleksu otwartego) umożliwia wstawianie (włączenie) kolejnych, odpowiednich nukleotydów. Substratami są trifosforany rybonukleozydów (ATP, GTP, CTP i UTP). Transkrypcja zaczyna się od produkcji kilku krótkich (kilka nukleotydów) transkryptów. Dopiero po oddysocjowaniu czynnika σ może rozpocząć się kolejny etap - elongacja transkrypcji (wydłużanie RNA). Polimeraza RNA przesuwa się systematycznie wzdłuż helisy DNA, rozplatając ją (na odcinku kilkunastu par zasad) i wydłużając łańcuch RNA, przy czym nukleotydy włączane są zgodnie z zasadą komplementarności. Powyżej aktualnego miejsca syntezy powstający hybrydowy kompleks DNA - RNA ulega rozpadowi, DNA powraca do swojej pierwotnej dwuniciowej struktury, a łańcuch powstającego mRNA oddziela się. Etap elongacji kończy się, gdy polimeraza RNA dotrze do terminatora - sekwencji kończącej, wyznaczającej miejsce terminacji (zakończenia) transkrypcji. Sekwencja taka tworzy strukturę szpilki do włosów (hairpin), która zatrzymuje polimerazę RNA, co powoduje rozpad kompleksu enzym - DNA - RNA. Drugim mechanizmem terminacji wykorzystywanym przez bakterie jest terminacja rho-zależna, gdzie do terminacji transkrypcji potrzebne jest działanie czynnika rho (ρ). Transkrypt prokariotyczny nie wymaga dalszej obróbki, a translacja rozpoczyna się, zanim transkrypcja dobiegnie końca.
U eukariotów występuje kilka rodzajów polimeraz RNA, w tym zbudowane z wielu podjednostek polimerazy RNA działające w jądrze komórkowym oraz specyficzne dla mitochondriów i chloroplastów polimerazy RNA, które budową przypominają polimerazy RNA prokariontów. Różne jądrowe polimerazy RNA biorą udział w transkrypcji różnych klas RNA. Polimeraza RNA II (Pol II) syntetyzuje pre-mRNA i większość snRNA, polimeraza RNA I (Pol I) transkrybuje część rRNA, a polimeraza RNA III (Pol III) odpowiada za syntezę tRNA, 5S rRNA i innych małych jądrowych RNA.
W przeciwieństwie do polimerazy RNA bakterii, jądrowe polimerazy RNA organizmów eukariotycznych potrzebują do rozpoczęcia transkrypcji zestawu właściwych dla danej polimerazy podstawowych czynników transkrypcyjnych, ponieważ rozpoznają nie sekwencję promotora, ale kompleks kwas nukleinowy-białko. Sterowanie transkrypcją - przez związanie czynników białkowych czy hormonalnych - może odbywać się z różnych miejsc na DNA. Miejsca te mogą leżeć w obrębie genów (promotory), lub też w odległości kilku tysięcy nukleotydów (enhancery, silencery). Pierwszym etapem transkrypcji jest powstanie kompleksu preinicjacyjnego (PIC) składającego się z ogólnych czynników transkrypcyjnych, który wiąże się z sekwencją promotora. Na dostępność miejsc wiązania się czynników transkrypcyjnych wpływa struktura (upakowanie) chromatyny. Należy jednak zaznaczyć, że białka remodelujące chromatynę mogą wpływać na jej strukturę przed, w trakcie i po powstaniu PIC.
Wiele promotorów genów transkrybowanych przez jądrową polimerazę RNA II zawiera sekwencję TATA (ang. TATA box) położoną ok. 25 par zasad przed miejscem rozpoczęcia transkrypcji. Sekwencja ta jest rozpoznawana przez białko TBP (ang. TATA-box binding protein), które staje się zalążkiem kompleksu preinicjacyjnego. Drugą sekwencją rozpoznawaną przez ogólne czynniki transkrypcyjne jest sekwencja otaczająca miejsce startu transkrypcji (+1). Polimeraza RNA II wiąże się do kompleksu preinicjacyjnego i rozpoczyna transkrypcję. Do inicjacji transkrypcji przez polimerazę RNA II in vivo konieczny jest też kompleks białkowy zwany Mediatorem. W regulacji transkrypcji u eukariontów mogą brać udział także inne czynniki transkrypcyjne wiążące się z sekwencjami enhancerów i silencerów, często położone w znacznej odległości od miejsca inicjacji transkrypcji. Do rozpoczęcia transkrypcji przez polimerazę RNA I i III potrzebne są inne sekwencje oraz zestaw ogólnych czynników transkrypcyjnych specyficznych dla tych polimeraz.
Następny etap transkrypcji to elongacja. Polimeraza RNA przesuwa się dalej, a ogólne czynniki transkrypcyjne są uwalniane. Terminacja transkrypcji nie wymaga białek uwalniających, a jej sygnały są inne, niż u prokariontów. Zaproponowano dwa modele terminacji transkrypcji u eukariotów. Według pierwszego po transkrypcji miejsca poliadenylacji w polimerazie zachodzi zmiana konformacji, która ułatwia terminację transkrypcji. Według drugiego modelu w terminacji transkrypcji bierze udział trawiąca RNA egzonukleaza, która przecina cząsteczkę mRNA, a następnie niszczy ten fragment RNA, który ciągle jest związany z polimerazą.
Transkrypt jest komplementarny do nici matrycowej i homologiczny z nicią kodującą. Należy jednak pamiętać, że jakkolwiek homologami G, C i A w pre-mRNA są rybonukleotydy niosące te same zasady azotowe, to homologiem T jest rybonukleotyd zawierający uracyl (U) a nie tyminę.
Porównanie sekwencji pre-mRNA z sekwencjami nici kodującej i matrycowej genu:
1) 5'- A A T C G G C A T G C C A T G G C C T T G C G C T A - 3' Gen
2) 3'- T T A G C C G T A C G G T A C C G G A A C G C G A T - 5'
3) 5'- A A U C G G C A U G C C A U G G C C U U G C G C U A - 3' pre-mRNA
1 - nić kodującą 2 - nić matrycową 3 - transkrypt
Należy pamiętać, że informacje o strukturze (budowie) kodowanego białka zawarte są jedynie we fragmentach genu zwanych eksonami, natomiast introny to fragmenty będące najczęściej nic nie znaczącymi wtrętami (są usuwane przed zajściem translacji).
mRNA u prokariotów ma od końca 5' niekodujące sekwencje liderowe (mogące brać udział w regulacji ekspresji genów), kodon AUG (metionina- aminokwas zapoczątkowujący każdą biosyntezę białka), inicjujący syntezę białek, a następnie rejon kodujący (kodony) zakończony kodonem terminacyjnym STOP (UAA, UAG, UGA - nie kodują żadnego aminokwasu).
mRNA u eukariotów powstaje podczas transkrypcji jako heterogenne hnRNA (pre-mRNA), a następnie ulega obróbce posttranskrypcyjnej, podczas której dodawana jest czapeczka, wycinane są introny (splicing), i dodawany jest ogon poli-A. Dojrzała cząsteczka mRNA składa się zatem z czapeczki na 5'-końcu, 5'-obszaru nieulegającego translacji (5'UTR), sekwencji kodującej, 3'-obszaru nieulegającego translacji (3'UTR) i ogona poli-A.
3.losy pirogronianu w war. Tlenowych i beztlenowych
W warunkach tlenowych pirogronian, otrzymany w wyniku glikolizy pobierany jest przez mitochondria, w których po przekształceniu do acetylo-CoA (reakcja ta katalizowana jest przez wieloenzymatyczny kompleks dehydrogenazy pirogronianowej, do której działania niezbędna staje się difosfotiamina - pochodna witaminy B1), zostaje utleniony do dwutlenku węgla w cyklu Krebsa. Powstałe w glikolizie równoważniki redukujące są przenoszone zaś z NADH+H+ do wnętrza mitochondriów.
Arsenian, jony rtęciowe oraz niedobór tiaminy w diecie powodują nagromadzanie się pirogronianu w komórkach i doprowadzają do szybkiej kwasicy mleczanowej, będącej objawem niedoboru dehydrogenazy mleczanowej - prowadzi to u człowieka do zaburzeń neurologicznych poprzez zakłócenie podstawowych funkcji mózgu. Glikolizie tlenowej towarzyszy wytworzenie ok. 38 moli ATP.
Jeśli przeważają warunki beztlenowe, uniemożliwiona staje się reoksydacja NADH w łańcuchu oddechowym przez przeniesienie równoważników redukujących na tlen. Pirogronian ulega redukcji przez NADH do mleczanu w reakcji katalizowanej przez dehydrogenazę mleczanową. Reoksydacja NADH w reakcji powstawania mleczanu przez odtworzenie NAD potrzebnego w następnym cyklu reakcji umożliwia dalszy przebieg glikolizy w przypadku nieobecności tlenu.
Przykładem komórek, które przeprowadzają wyłącznie glikolizę beztlenową są erytrocyty, ze względu na brak mitochondriów, niezbędnych do przeprowadzanie reakcji łańcucha oddechowego. Jednak w przypadku krwinek czerwonych glikoliza zachodzi z ominięciem reakcji katalizowanej przez kinazę fosfoglicerynianową. Dodatkowy enzym, jakim jest mutaza bisfosfoglicerynianowa katalizuje przekształcenie 1,3-BPG w 2,3-BPG, który ostatecznie ulega przemianie do 3-fosfoglicerynianu przy udziale fosfatazy 2,3-bisfosfoglicerynianowej.
ZESTAW III
1.wypisać i opisać wiązania w białku
2.5.5. Stabilność białek
Budowa przestrzenna białka utrzymywana jest przez zestaw wiązań nie kowalencyjnych (siły elektrostatyczne, wiązania wodorowe, oddziaływania hydrofobowe) oraz wiązania kowalencyjne czyli wiązania disiarczkowe i wiązania peptydowe pomiędzy kolejnymi aminokwasami.
Siły elektrostatyczne
Są to oddziaływania pomiędzy dwoma grupami jonowymi o przeciwstawnym ładunku. Tego typu oddziaływanie zachodzi między grupą aminową lizyny i grupą karboksylową asparaginy. Do tego typu oddziaływań zalicza się też nie kowalencyjne połączenia pomiędzy elektrycznie obojętnymi cząsteczkami określane terminem oddziaływania Van der Walsa. Polegają one na oddziaływaniach elektrostatycznych między trwałymi lub indukowanymi dipolami grup karbonylowych w wiązaniach peptydowych.
Wiązania wodorowe
To oddziaływania elektrostatyczne pomiędzy grupą donorową będącą słabym kwasem oraz akceptorem, atomem posiadającym wolną parę elektronową i posiadającym dzięki temu ładunek ujemny, co przyciąga atom wodoru. Długość wiązań wodorowych wynosi 0,27-0,31 nm. Akceptorem atomów wodorów jest przeważnie atom tlenu lub azotu. Wiązania te są silniejsze niż siły Van der Walsa, ale słabsze niż wiązania kowalencyjne.
Oddziaływania hydrofobowe
Są to oddziaływania odpowiedzialne za minimalizowanie powierzchni kontaktu niepolarnych cząsteczek z otaczającą je wodą. Można je łatwo zaobserwować w przypadku cząsteczek amfipatycznych, takie jak lipidy i detergenty. W procesie powstawania struktury przestrzennej białka dochodzi do eliminowania kontaktu pomiędzy niepolarnymi łańcuchami bocznymi i roztworem wody. Oddziaływania te są istotne przy tworzeniu struktury białka i utrzymania ich stabilności.
2. dekarboksylacja oksydacyjna pirogronianu
Oksydacyjna dekarboksylacja pirogronianiu
Oksydacyjna dekarboksylacja pirogronianu jest katalizowana przez kompleks wieloenzymatyczny, zwany dehydrogenazą pirogronianową, zlokalizowaną w macierzy mitochondrialnej. W przebiegu tego procesu pirogronian ulega dekarboksylacji (odłącza CO2), a pozostający fragment dwuwęglowy utlenia się do acetylo-S-CoA. Nieodwracalność procesu sprawia, iż pirogronian nie może odtwarzać się z acetylo-S-CoA, dlatego acetylo-S-CoA nie może być substratem w procesie glukoneogenezy.
Kw. Pirogronowy jest transportowany z cytoplazmy do mitochondrium gdzie ulega dalszym przemianom.
Transport kwasu przez błonę wewnętrzną odbywa się z udziałem specyficznego biaka nośnikowego.
nośnikowego matriks przebiega oksydacyjna dekarboks. Kw. Pirogronowego Pirogronowego udziałem NAD, koenzymu A i kompleksu enzymatycznego zwanego dehydrogenazą pirogronową. Od kwasu odczepia się CO2, powstały aldehyd octowy zostaje utleniony do octanu, a NAD ulega redukcji do NADH. Reszta acetylowi przyłącza się do koenzymu A i powstaje acetylo -COA.
3.dojrzewanie pre-mRNA u eukariotów
Obróbka posttranskrypcyjna - obróbka, dzięki której z uzyskanego w procesie transkrypcji pre-mRNA powstaje dojrzały mRNA.
Obróbka posttranskrypcyjna polega na:
Dołączeniu czapeczki guanylowej na 5'-końcu pre-mRNA. Ten etap obróbki odbywa się równocześnie z transkrypcją. Czapeczka guanylowa to nietypowy nukleotyd (7-metyloguanozyna). Chroni mRNA przed nukleazami w cytoplazmie i umożliwia rozpoznawanie mRNA przez rybosomy.
Dołączeniu ogonka poliA na 3'-końcu mRNA. Ogonek poliA jest krótką nicią złożoną z kilkudziesięciu nukleotydów z adeniną. Zabieg ten zabezpiecza cząsteczkę mRNA eukariontów przed degradacją, zanim zdąży ona opuścić jądro komórkowe. Ponadto transkrypt z ogonem poli-A jest wydajniejszą matrycą w trakcie translacji. Niektóre wirusy, np. wirus grypy potrafią dołączać do swoich nici mRNA ogonek poliA, przez co nie są rozpoznawane przez nukleazy komórkowe.
Edycji RNA, czyli zmianie informacji w transkrypcie RNA przez reakcję chemiczną powodującą zmianę jednej zasady azotowej w inną. Powoduje to, że sekwencja aminokwasowa kodowanego przez transkrypt białka jest inna, niż wynika to z sekwencji kodującego je genu. Edytowane transkrypty stanowią mniejszość mRNA.
ZESTAW IV
1.opisać łańcuch polipeptydowy helisy alfa
Helisa alfa to struktura drugorzędowa białka (tak jak i harmonijka beta), stabilizowana przez wiązania wodorowe. Kształtem przypomina cylinder, tworzony przez ciasno, prawoskrętnie skręconą sprężynę. Ściany cylindra tworzy łańcuch polipeptydowy, a łańcuchy boczne (podstawniki) wystają na zewnątrz. Co cztery aminokwasy w łańcuchu polipeptydowym tworzone jest wiązanie wodorowe pomiędzy grupą karboksylową jednego aminokwasu, a grupą aminową drugiego. Skok helisy następuje co 0,54 nm.
Tego rodzaju α heliks przeważa np. w hemoglobinie i mioglobinie.
Aminokwasy stabilizujące ; alanina, fenyloalanina,aspargina, glutan\mina,histydyna , metionina,tryptofan
Aminokwasy destabilizujące ; walina, izoleucyna, seryna, treonina,pralina, hyroksyprolina
2.opisać kompleks 70s i wymienić czynniki
U prokariotów występują rybosomy 70S. Duża podjednostka (50S) zawiera 34 białka i dwie cząsteczki rRNA (5S rRNA i 23S rRNA), a mała podjednostka (30S) zawiera 21 białek i jedną cząsteczkę rRNA.
U prokariontów występują trzy czynniki inicjacji translacji: IF-1, IF-2 i IF-3. IF-1 wiąże się z małą podjednostką rybosomu (30S) i blokuje wiązanie się dużej podjednostki oraz wejście do rybosomu aminoacylo-tRNA. Związany z GTP IF-2 wiąże się z małą podjednostką rybosomu, a następnie z inicjatorowym tRNA (fMet-tRNA) i pomaga mu związać się z małą podjednostką rybosomu. IF-3 wiąże się z małą podjednostką rybosomu i umożliwia jej związanie się z mRNA. Związaniu się dużej podjednostki towarzyszy uwolnienie IF-2 i IF-3.
3.wymienić i opisać rodzaje fosforyzacji
Fosforylacja substratowa - reakcja chemiczna, która ma miejsce, gdy reszta fosforanowa zostanie przeniesiona ze związku ufosforylowanego - substratu - bezpośrednio na ADP przez enzymy, najczęściej z grupy kinaz. Ten sposób wytwarzania ATP nie wymaga udziału tlenu i zachodzi np. w glikolizie oraz cyklu Krebsa. Ten sposób wytwarzania ATP jest ewolucyjnie najstarszy, jednak ilość związków, które mogą wejść w reakcję fosforylacji substratowej jest ograniczona. Fosforylacja ta pozwala, np. mięśniom szkieletowym funkcjonować sprawnie podczas dużego wysiłku fizycznego przy niedostatecznym dopływie tlenu. Jest to proces o bardzo niskiej wydajności w porównaniu z fosforylacją oksydacyjną.
Substrat wysokoenergetyczny(ufosforylowany) + ADP → produkt niskoenergetyczny + ATP
Fosforylacja oksydacyjna - jest szlakiem metabolicznym, w którego wyniku energia uwalniana podczas utleniania zredukowanych nukleotydów przekształcana jest w energię ATP. Organizmy żywe wykorzystują wiele różnych związków organicznych, jednak aby wytworzyć z nich energią przydatną metabolicznie, cząsteczki ATP, w większości przeprowadzają fosforylację oksydacyjną. Szlak ten jest dominujący ze względu na wysoką efektywność w porównaniu do alternatywnych sposobów syntezy ATP, czyli fermentacji
Podczas fosforylacji oksydacyjnej, w wyniku szeregu reakcji redoks, elektrony przenoszone są ze zredukowanych nukleotydów, NADH i FADH2, na pełniący funkcję akceptora elektronów tlen. Zachodzące reakcje prowadzą do zmagazynowania energii, służącej następnie do syntezy ATP. W komórkach eukariotycznych, szereg reakcji redoks zachodzi na kompleksach białkowych znajdujących się w mitochondriach. W komórkach prokariotycznych kompleksy białkowe zlokalizowane są w błonach komórkowych. Zestaw enzymów biorących udział w przenoszeniu elektronów określa się jako łańcuch oddechowy. U eukariotów składa się on z pięciu głównych enzymów, u prokariotów odnaleziono wiele różnych enzymów pełniących funkcję donorów i akceptorów elektronów.
Energia uwalniana podczas transportu elektronów w łańcuchu oddechowym zużywana jest do przenoszenia protonów przez wewnętrzną błonę mitochondrialną, proces ten przez jego odkrywcę został nazwany chemiosmozą. Energia potencjalna gromadzona jest w postaci gradientu pH i potencjału elektrycznego w poprzek błony. Zgromadzona w tej formie energia wykorzystywana jest przez kompleks enzymatyczny syntazy ATP, który pozwala protonom przejść przez błonę zgodnie z gradientem stężeń. Enzym ten zamienia jednocześnie energię gradientu pH i elektrycznego na energię wiązań chemicznych ATP, wytwarzanego przez przyłączenie do ADP reszty kwasu ortofosforowego, czyli reakcji fosforylacji. Niezwykłość reakcji syntezy ATP związana jest z obracaniem się części enzymu napędzanej przepływającymi protonami, przypominając działanie silnika elektrycznego. Obrót części enzymu odłącza wytworzoną cząsteczkę ATP.
Fosforylacja oksydacyjna jest ważnym procesem metabolicznym, jednak jej zachodzenie prowadzi do powstawania reaktywnych form tlenu, takich jak nadtlenek wodoru oraz wolnych rodników, niszczących komórki, a w efekcie powodujących choroby i prawdopodobnie przyspieszających starzenie się. Enzymy przeprowadzające ten szlak metaboliczny są wrażliwe na wiele leków i trucizn, takich jak cyjanek.
Wyszukiwarka
Podobne podstrony:
Biochemia pytania kolokwia, biologia, biochemia1
Pytania biochemia OS 11
defekty enzymatyczne pytania biochem
pytania biochemia - egz, UR, Biochemia, biochemia semestr 2, biochemia semestr 2
Pytania z biochemii, zchomikowane
Pytania z biochemii, wsr, Biochemia.wsr
dyskusja pytania biochem
pytania biochemia egzamin 12 I termin (1)
pytania biochemia 11
Pytania biochemia
Pytania z biochemii, Prywatne, Studia
biochemiawykady, pytania biochemia
Pytania biochemia 2004-2005, Materiały Farmacja II rok
pytania biochemia I
więcej podobnych podstron