KOROZJA GAZOWA Procesy korozji chemicznej polegają na niszczeniu metali i stopów w wyniku reakcji chemicznych Korozja chemiczna przebiega na sucho, bez udziału elektrolitu. Podstawowym typem reakcji powodującej korozję gazową jest reakcja chemiczna utleniania, którą dla najprostszego przypadku utleniania czystego metalu dwuwartościowego można przedstawić następująco: M+1/2X2→MX gdzie M-metal, X2-utleniacz. Reakcja chemiczna utleniania metalu jest złożona ze sprzężonych ze sobą kilku lub wszystkich elementarnych procesów cząstkowych do których należą: 1-adsorpcja i chemisorpcja gazu utleniającego na powierzchni ciągłej i cienkiej warstwy produktu utleniania powstałej w początkowej fazie procesu, 2-powstawanie jonów utleniacza na powierzchni adsorbującej warstwy zgorzeliny i wbudowywanie się ich w sieć krystaliczną zgorzeliny, 3-dyfuzja jonów metalu z równoważną liczbą elektronów z fazy metalicznej do zgorzeliny, 4-dyfuzja odrdzeniowa jonów metalu i elektronów od granicy faz rdzeń metalowy- zgorzelina do powierzchni warstwy przez defekty sieci krystalicznej w niej występujące, 5-dyfuzja dordzeniowa jonów utleniacza do granicy faz utleniacz- zgorzelina do granicy zgorzelina- rdzeń metalowy, połączona z dyfuzją elektronów w kierunku przeciwnym, 6- jednoczesna dyfuzja jonów metalu oraz jonów utleniacza w przeciwnych kierunkach połączona z odpowiednią dyfuzją elektronów, 7-dyfuzja metalu, a szczególnie utleniacza- w postaci jonów, atomów lub cząsteczek -wzdłuż granic ziarn w zgorzelinie oraz metalu. Czynniki wpływające na korozję gazową. 1-stan powierzchni (obróbka mechaniczna, obróbka chemiczna i elektroerozyjna, uprzywilejowana orientacja krystalograficzna powierzchni metalu narażonej na działania atmosfery utleniającej, 2-skład chemiczny atmosfery korozyjnej.
KINETYKA UTLENIANIA METALI I STOPÓW
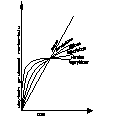
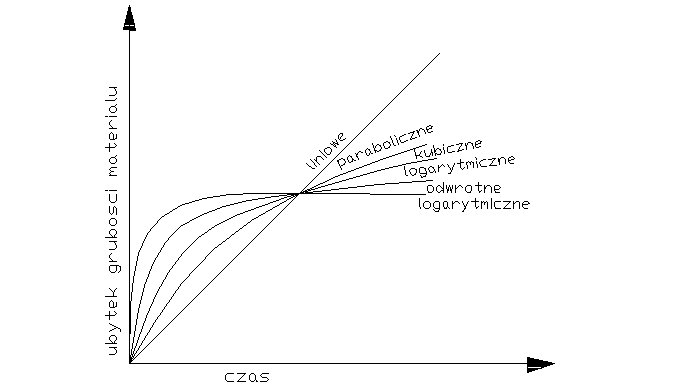
Decydujący wpływ na przebieg utleniania metalu wywiera stan skupienia produktu reakcji. Jeżeli produkt jest lotny, lub ciekły wówczas opuszcza on powierzchnię atakowanego materiału w czasie trwania procesu, i bezpośredni kontakt między fazą metaliczną, a środowiskiem nie zostaje przerwany. Proces utleniania może przebiegać według prawa liniowego, dw/dt=kt po scałkowaniu w=kl*l+c, kt-liniowa stała szybkości korozji, t-czas reakcji, w-ubytek grubości metalu, c- stała całkowania. Przebieg korozji jest liniowy gdy produkt utleniania jest stały, lecz występują w nim makronieciągłości,- dopływ atakującego gazu do powierzchni fazy metalicznej zachodzi z duża prędkością, Najwolniejszym procesem cząstkowym określającym szybkość korozji jest reakcja chemiczna tworzenie się produktu reakcji. Gdy powstająca zgorzelina jest zwarta w sensie mikroskopowym substraty od pierwszej chwili trwania procesu zostają oddzielone ciągłą warstwą produktu. Dzięki dyfuzji jednego lub obu reagentów przez zgorzelinę w odpowiednio wysokich temp. Utlenianie metalu morze przebiegać dalej nawet ze znaczne szybkością. W miare narastania zgorzel. Drogi transportu materii wydłużają się i szybkość dyfuzji maleje W zakresie wysokich temp. przebieg ten ma najczęściej charakter paraboliczny można go opisać rów.: dw/dt=kp/W po scałkowaniu: W2=2kpt+C, kp= -paraboliczna stała szybkości korozji
Ubytek grubości metalu jest wprost proporcjonalny do grubości zgorzeliny X2=2k'pt+C
Prawo paraboliczne traci sens fizyczny dla bardzo cienkich warstewek zgorzeliny. W niższych temp. proces utleniania może przebiegać wg. tzw. prawa kubicznegoąąaaa:
po scałkowaniu: x3=3k'ct+C. Powyższe równania wyrażają przypadki granicznego ogólnego prawa potęgowego, wg. którego przebiegają procesy utleniania wielu metali i stopów w szerokich granicach temperatur: Xn=nk'nt+C. Szybkość procesu utleniania w przypadku tworzenia się stałego produktu reakcji wyznacza się na podstawie pomiaru przyrostu masy. W zakresie niskich i średnich temp. proces może przebiegać wg. tzw. praw logarytmicznych. Szybkość korozji maleje gwałtownie z upływem czasu reakcji wskutek szczególnie dobrych własności ochronnych warstewek produktu reakcji. Można rozróżnić dwie graniczne zależności wykładniczego przebiegu utleniania, zwane prawem logarytmicznym: X=a*lg(bt-c), Oraz prawem odwrotnie logarytmicznym: 1/x=A-B lg t
Tak dobre własności ochronne cienkiej warstewki zgorzeliny spotyka się głównie w zakresie niskich temperaturach. Wysokich jedynie w odosobnionych przypadkach.
KOROZJA ELEKTROCHEMICZNA I JEJ MECHANIZM.
Procesy korozji mają charakter elektrochemiczny. Powierzchnię każdego metalu lub stopu można traktować jako zbiór elektrod dodatnich i ujemnych, krótko zwartych przez sam metal. Między tymi elektrodami, którymi są elementy struktury metali lub stopów, występuje różnica potencjałów. Gdy na metal działa elektrolit, którym może być woda lub roztwory wodne soli, kwasu i zasad, tworzą się lokalne mikroogniwa i następuje lokalny przepływ prądu elektrycznego. Towarzyszą temu reakcje redukcji i utleniania.
Reakcja chemiczna redukcji zachodzi na elektrodzie zwanej katodą i jest związana z przepływem umownego prądu dodatniego z roztworu elektrolitu do elektrody (czyli w rzeczywistości przepływem elektronów w kierunku przeciwnym). Na anodzie przebiega reakcja chemiczna utleniania związana z przepływem dodatnich ładunków elektrycznych z elektrody do elektrolitu. W wyniku procesów elektrochemicznych zachodzących w mikroogniwach na powierzchni metalu poddanego działaniu elektrolitu przebiega proces korozji. Korozja następuje tylko na KOROZJA GAZOWA Procesy korozji chemicznej polegają na niszczeniu metali i stopów w wyniku reakcji chemicznych Korozja chemiczna przebiega na sucho, bez udziału elektrolitu. Podstawowym typem reakcji powodującej korozję gazową jest reakcja chemiczna utleniania, którą dla najprostszego przypadku utleniania czystego metalu dwuwartościowego można przedstawić następująco: M+1/2X2→MX gdzie M-metal, X2-utleniacz. Reakcja chemiczna utleniania metalu jest złożona ze sprzężonych ze sobą kilku lub wszystkich elementarnych procesów cząstkowych do których należą: 1-adsorpcja i chemisorpcja gazu utleniającego na powierzchni ciągłej i cienkiej warstwy produktu utleniania powstałej w początkowej fazie procesu, 2-powstawanie jonów utleniacza na powierzchni adsorbującej warstwy zgorzeliny i wbudowywanie się ich w sieć krystaliczną zgorzeliny, 3-dyfuzja jonów metalu z równoważną liczbą elektronów z fazy metalicznej do zgorzeliny, 4-dyfuzja odrdzeniowa jonów metalu i elektronów od granicy faz rdzeń metalowy- zgorzelina do powierzchni warstwy przez defekty sieci krystalicznej w niej występujące, 5-dyfuzja dordzeniowa jonów utleniacza do granicy faz utleniacz- zgorzelina do granicy zgorzelina- rdzeń metalowy, połączona z dyfuzją elektronów w kierunku przeciwnym, 6- jednoczesna dyfuzja jonów metalu oraz jonów utleniacza w przeciwnych kierunkach połączona z odpowiednią dyfuzją elektronów, 7-dyfuzja metalu, a szczególnie utleniacza- w postaci jonów, atomów lub cząsteczek -wzdłuż granic ziarn w zgorzelinie oraz metalu. Czynniki wpływające na korozję gazową. 1-stan powierzchni (obróbka mechaniczna, obróbka chemiczna i elektroerozyjna, uprzywilejowana orientacja krystalograficzna powierzchni metalu narażonej na działania atmosfery utleniającej, 2-skład chemiczny atmosfery korozyjnej.
KINETYKA UTLENIANIA METALI I STOPÓW
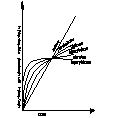
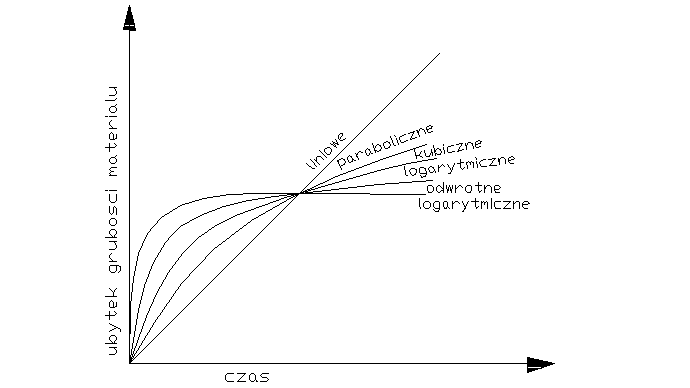
Decydujący wpływ na przebieg utleniania metalu wywiera stan skupienia produktu reakcji. Jeżeli produkt jest lotny, lub ciekły wówczas opuszcza on powierzchnię atakowanego materiału w czasie trwania procesu, i bezpośredni kontakt między fazą metaliczną, a środowiskiem nie zostaje przerwany. Proces utleniania może przebiegać według prawa liniowego, dw/dt=kt po scałkowaniu w=kl*l+c, kt-liniowa stała szybkości korozji, t-czas reakcji, w-ubytek grubości metalu, c- stała całkowania. Przebieg korozji jest liniowy gdy produkt utleniania jest stały, lecz występują w nim makronieciągłości,- dopływ atakującego gazu do powierzchni fazy metalicznej zachodzi z duża prędkością, Najwolniejszym procesem cząstkowym określającym szybkość korozji jest reakcja chemiczna tworzenie się produktu reakcji. Gdy powstająca zgorzelina jest zwarta w sensie mikroskopowym substraty od pierwszej chwili trwania procesu zostają oddzielone ciągłą warstwą produktu. Dzięki dyfuzji jednego lub obu reagentów przez zgorzelinę w odpowiednio wysokich temp. Utlenianie metalu morze przebiegać dalej nawet ze znaczne szybkością. W miare narastania zgorzel. Drogi transportu materii wydłużają się i szybkość dyfuzji maleje W zakresie wysokich temp. przebieg ten ma najczęściej charakter paraboliczny można go opisać rów.: dw/dt=kp/W po scałkowaniu: W2=2kpt+C, kp= -paraboliczna stała szybkości korozji
Ubytek grubości metalu jest wprost proporcjonalny do grubości zgorzeliny X2=2k'pt+C
Prawo paraboliczne traci sens fizyczny dla bardzo cienkich warstewek zgorzeliny. W niższych temp. proces utleniania może przebiegać wg. tzw. prawa kubicznegoąąaaa:
po scałkowaniu: x3=3k'ct+C. Powyższe równania wyrażają przypadki granicznego ogólnego prawa potęgowego, wg. którego przebiegają procesy utleniania wielu metali i stopów w szerokich granicach temperatur: Xn=nk'nt+C. Szybkość procesu utleniania w przypadku tworzenia się stałego produktu reakcji wyznacza się na podstawie pomiaru przyrostu masy. W zakresie niskich i średnich temp. proces może przebiegać wg. tzw. praw logarytmicznych. Szybkość korozji maleje gwałtownie z upływem czasu reakcji wskutek szczególnie dobrych własności ochronnych warstewek produktu reakcji. Można rozróżnić dwie graniczne zależności wykładniczego przebiegu utleniania, zwane prawem logarytmicznym: X=a*lg(bt-c), Oraz prawem odwrotnie logarytmicznym: 1/x=A-B lg t
Tak dobre własności ochronne cienkiej warstewki zgorzeliny spotyka się głównie w zakresie niskich temperaturach. Wysokich jedynie w odosobnionych przypadkach.
KOROZJA ELEKTROCHEMICZNA I JEJ MECHANIZM.
Procesy korozji mają charakter elektrochemiczny. Powierzchnię każdego metalu lub stopu można traktować jako zbiór elektrod dodatnich i ujemnych, krótko zwartych przez sam metal. Między tymi elektrodami, którymi są elementy struktury metali lub stopów, występuje różnica potencjałów. Gdy na metal działa elektrolit, którym może być woda lub roztwory wodne soli, kwasu i zasad, tworzą się lokalne mikroogniwa i następuje lokalny przepływ prądu elektrycznego. Towarzyszą temu reakcje redukcji i utleniania.
Reakcja chemiczna redukcji zachodzi na elektrodzie zwanej katodą i jest związana z przepływem umownego prądu dodatniego z roztworu elektrolitu do elektrody (czyli w rzeczywistości przepływem elektronów w kierunku przeciwnym). Na anodzie przebiega reakcja chemiczna utleniania związana z przepływem dodatnich ładunków elektrycznych z elektrody do elektrolitu. W wyniku procesów elektrochemicznych zachodzących w mikroogniwach na powierzchni metalu poddanego działaniu elektrolitu przebiega proces korozji. Korozja następuje tylko na KOROZJA GAZOWA Procesy korozji chemicznej polegają na niszczeniu metali i stopów w wyniku reakcji chemicznych Korozja chemiczna przebiega na sucho, bez udziału elektrolitu. Podstawowym typem reakcji powodującej korozję gazową jest reakcja chemiczna utleniania, którą dla najprostszego przypadku utleniania czystego metalu dwuwartościowego można przedstawić następująco: M+1/2X2→MX gdzie M-metal, X2-utleniacz. Reakcja chemiczna utleniania metalu jest złożona ze sprzężonych ze sobą kilku lub wszystkich elementarnych procesów cząstkowych do których należą: 1-adsorpcja i chemisorpcja gazu utleniającego na powierzchni ciągłej i cienkiej warstwy produktu utleniania powstałej w początkowej fazie procesu, 2-powstawanie jonów utleniacza na powierzchni adsorbującej warstwy zgorzeliny i wbudowywanie się ich w sieć krystaliczną zgorzeliny, 3-dyfuzja jonów metalu z równoważną liczbą elektronów z fazy metalicznej do zgorzeliny, 4-dyfuzja odrdzeniowa jonów metalu i elektronów od granicy faz rdzeń metalowy- zgorzelina do powierzchni warstwy przez defekty sieci krystalicznej w niej występujące, 5-dyfuzja dordzeniowa jonów utleniacza do granicy faz utleniacz- zgorzelina do granicy zgorzelina- rdzeń metalowy, połączona z dyfuzją elektronów w kierunku przeciwnym, 6- jednoczesna dyfuzja jonów metalu oraz jonów utleniacza w przeciwnych kierunkach połączona z odpowiednią dyfuzją elektronów, 7-dyfuzja metalu, a szczególnie utleniacza- w postaci jonów, atomów lub cząsteczek -wzdłuż granic ziarn w zgorzelinie oraz metalu. Czynniki wpływające na korozję gazową. 1-stan powierzchni (obróbka mechaniczna, obróbka chemiczna i elektroerozyjna, uprzywilejowana orientacja krystalograficzna powierzchni metalu narażonej na działania atmosfery utleniającej, 2-skład chemiczny atmosfery korozyjnej.
KINETYKA UTLENIANIA METALI I STOPÓW
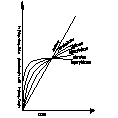
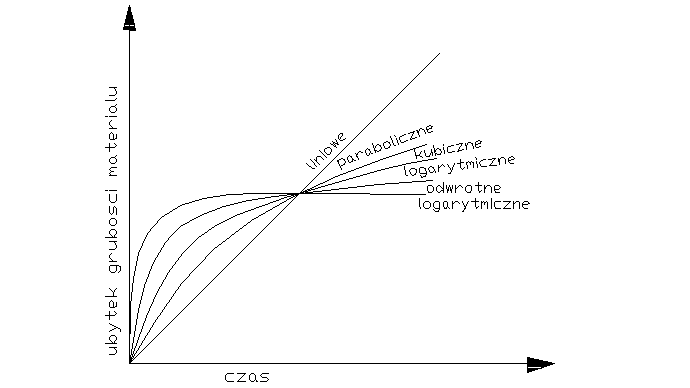
Decydujący wpływ na przebieg utleniania metalu wywiera stan skupienia produktu reakcji. Jeżeli produkt jest lotny, lub ciekły wówczas opuszcza on powierzchnię atakowanego materiału w czasie trwania procesu, i bezpośredni kontakt między fazą metaliczną, a środowiskiem nie zostaje przerwany. Proces utleniania może przebiegać według prawa liniowego, dw/dt=kt po scałkowaniu w=kl*l+c, kt-liniowa stała szybkości korozji, t-czas reakcji, w-ubytek grubości metalu, c- stała całkowania. Przebieg korozji jest liniowy gdy produkt utleniania jest stały, lecz występują w nim makronieciągłości,- dopływ atakującego gazu do powierzchni fazy metalicznej zachodzi z duża prędkością, Najwolniejszym procesem cząstkowym określającym szybkość korozji jest reakcja chemiczna tworzenie się produktu reakcji. Gdy powstająca zgorzelina jest zwarta w sensie mikroskopowym substraty od pierwszej chwili trwania procesu zostają oddzielone ciągłą warstwą produktu. Dzięki dyfuzji jednego lub obu reagentów przez zgorzelinę w odpowiednio wysokich temp. Utlenianie metalu morze przebiegać dalej nawet ze znaczne szybkością. W miare narastania zgorzel. Drogi transportu materii wydłużają się i szybkość dyfuzji maleje W zakresie wysokich temp. przebieg ten ma najczęściej charakter paraboliczny można go opisać rów.: dw/dt=kp/W po scałkowaniu: W2=2kpt+C, kp= -paraboliczna stała szybkości korozji
Ubytek grubości metalu jest wprost proporcjonalny do grubości zgorzeliny X2=2k'pt+C
Prawo paraboliczne traci sens fizyczny dla bardzo cienkich warstewek zgorzeliny. W niższych temp. proces utleniania może przebiegać wg. tzw. prawa kubicznegoąąaaa:
po scałkowaniu: x3=3k'ct+C. Powyższe równania wyrażają przypadki granicznego ogólnego prawa potęgowego, wg. którego przebiegają procesy utleniania wielu metali i stopów w szerokich granicach temperatur: Xn=nk'nt+C. Szybkość procesu utleniania w przypadku tworzenia się stałego produktu reakcji wyznacza się na podstawie pomiaru przyrostu masy. W zakresie niskich i średnich temp. proces może przebiegać wg. tzw. praw logarytmicznych. Szybkość korozji maleje gwałtownie z upływem czasu reakcji wskutek szczególnie dobrych własności ochronnych warstewek produktu reakcji. Można rozróżnić dwie graniczne zależności wykładniczego przebiegu utleniania, zwane prawem logarytmicznym: X=a*lg(bt-c), Oraz prawem odwrotnie logarytmicznym: 1/x=A-B lg t
Tak dobre własności ochronne cienkiej warstewki zgorzeliny spotyka się głównie w zakresie niskich temperaturach. Wysokich jedynie w odosobnionych przypadkach.
KOROZJA ELEKTROCHEMICZNA I JEJ MECHANIZM.
Procesy korozji mają charakter elektrochemiczny. Powierzchnię każdego metalu lub stopu można traktować jako zbiór elektrod dodatnich i ujemnych, krótko zwartych przez sam metal. Między tymi elektrodami, którymi są elementy struktury metali lub stopów, występuje różnica potencjałów. Gdy na metal działa elektrolit, którym może być woda lub roztwory wodne soli, kwasu i zasad, tworzą się lokalne mikroogniwa i następuje lokalny przepływ prądu elektrycznego. Towarzyszą temu reakcje redukcji i utleniania.
Reakcja chemiczna redukcji zachodzi na elektrodzie zwanej katodą i jest związana z przepływem umownego prądu dodatniego z roztworu elektrolitu do elektrody (czyli w rzeczywistości przepływem elektronów w kierunku przeciwnym). Na anodzie przebiega reakcja chemiczna utleniania związana z przepływem dodatnich ładunków elektrycznych z elektrody do elektrolitu. W wyniku procesów elektrochemicznych zachodzących w mikroogniwach na powierzchni metalu poddanego działaniu elektrolitu przebiega proces korozji. Korozja następuje tylko na KOROZJA GAZOWA Procesy korozji chemicznej polegają na niszczeniu metali i stopów w wyniku reakcji chemicznych Korozja chemiczna przebiega na sucho, bez udziału elektrolitu. Podstawowym typem reakcji powodującej korozję gazową jest reakcja chemiczna utleniania, którą dla najprostszego przypadku utleniania czystego metalu dwuwartościowego można przedstawić następująco: M+1/2X2→MX gdzie M-metal, X2-utleniacz. Reakcja chemiczna utleniania metalu jest złożona ze sprzężonych ze sobą kilku lub wszystkich elementarnych procesów cząstkowych do których należą: 1-adsorpcja i chemisorpcja gazu utleniającego na powierzchni ciągłej i cienkiej warstwy produktu utleniania powstałej w początkowej fazie procesu, 2-powstawanie jonów utleniacza na powierzchni adsorbującej warstwy zgorzeliny i wbudowywanie się ich w sieć krystaliczną zgorzeliny, 3-dyfuzja jonów metalu z równoważną liczbą elektronów z fazy metalicznej do zgorzeliny, 4-dyfuzja odrdzeniowa jonów metalu i elektronów od granicy faz rdzeń metalowy- zgorzelina do powierzchni warstwy przez defekty sieci krystalicznej w niej występujące, 5-dyfuzja dordzeniowa jonów utleniacza do granicy faz utleniacz- zgorzelina do granicy zgorzelina- rdzeń metalowy, połączona z dyfuzją elektronów w kierunku przeciwnym, 6- jednoczesna dyfuzja jonów metalu oraz jonów utleniacza w przeciwnych kierunkach połączona z odpowiednią dyfuzją elektronów, 7-dyfuzja metalu, a szczególnie utleniacza- w postaci jonów, atomów lub cząsteczek -wzdłuż granic ziarn w zgorzelinie oraz metalu. Czynniki wpływające na korozję gazową. 1-stan powierzchni (obróbka mechaniczna, obróbka chemiczna i elektroerozyjna, uprzywilejowana orientacja krystalograficzna powierzchni metalu narażonej na działania atmosfery utleniającej, 2-skład chemiczny atmosfery korozyjnej.
KINETYKA UTLENIANIA METALI I STOPÓW
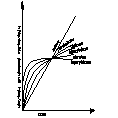
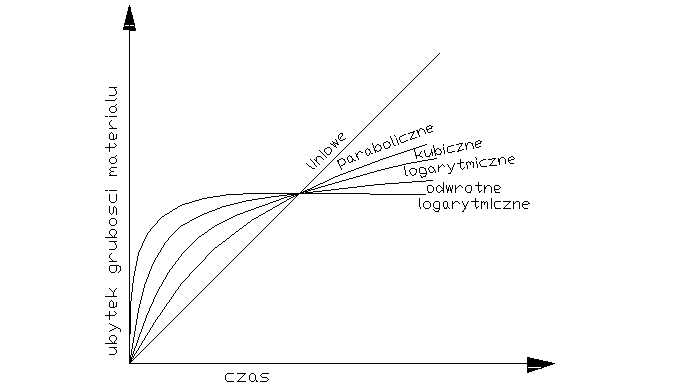
Decydujący wpływ na przebieg utleniania metalu wywiera stan skupienia produktu reakcji. Jeżeli produkt jest lotny, lub ciekły wówczas opuszcza on powierzchnię atakowanego materiału w czasie trwania procesu, i bezpośredni kontakt między fazą metaliczną, a środowiskiem nie zostaje przerwany. Proces utleniania może przebiegać według prawa liniowego, dw/dt=kt po scałkowaniu w=kl*l+c, kt-liniowa stała szybkości korozji, t-czas reakcji, w-ubytek grubości metalu, c- stała całkowania. Przebieg korozji jest liniowy gdy produkt utleniania jest stały, lecz występują w nim makronieciągłości,- dopływ atakującego gazu do powierzchni fazy metalicznej zachodzi z duża prędkością, Najwolniejszym procesem cząstkowym określającym szybkość korozji jest reakcja chemiczna tworzenie się produktu reakcji. Gdy powstająca zgorzelina jest zwarta w sensie mikroskopowym substraty od pierwszej chwili trwania procesu zostają oddzielone ciągłą warstwą produktu. Dzięki dyfuzji jednego lub obu reagentów przez zgorzelinę w odpowiednio wysokich temp. Utlenianie metalu morze przebiegać dalej nawet ze znaczne szybkością. W miare narastania zgorzel. Drogi transportu materii wydłużają się i szybkość dyfuzji maleje W zakresie wysokich temp. przebieg ten ma najczęściej charakter paraboliczny można go opisać rów.: dw/dt=kp/W po scałkowaniu: W2=2kpt+C, kp= -paraboliczna stała szybkości korozji
Ubytek grubości metalu jest wprost proporcjonalny do grubości zgorzeliny X2=2k'pt+C
Prawo paraboliczne traci sens fizyczny dla bardzo cienkich warstewek zgorzeliny. W niższych temp. proces utleniania może przebiegać wg. tzw. prawa kubicznegoąąaaa:
po scałkowaniu: x3=3k'ct+C. Powyższe równania wyrażają przypadki granicznego ogólnego prawa potęgowego, wg. którego przebiegają procesy utleniania wielu metali i stopów w szerokich granicach temperatur: Xn=nk'nt+C. Szybkość procesu utleniania w przypadku tworzenia się stałego produktu reakcji wyznacza się na podstawie pomiaru przyrostu masy. W zakresie niskich i średnich temp. proces może przebiegać wg. tzw. praw logarytmicznych. Szybkość korozji maleje gwałtownie z upływem czasu reakcji wskutek szczególnie dobrych własności ochronnych warstewek produktu reakcji. Można rozróżnić dwie graniczne zależności wykładniczego przebiegu utleniania, zwane prawem logarytmicznym: X=a*lg(bt-c), Oraz prawem odwrotnie logarytmicznym: 1/x=A-B lg t
Tak dobre własności ochronne cienkiej warstewki zgorzeliny spotyka się głównie w zakresie niskich temperaturach. Wysokich jedynie w odosobnionych przypadkach.
KOROZJA ELEKTROCHEMICZNA I JEJ MECHANIZM.
Procesy korozji mają charakter elektrochemiczny. Powierzchnię każdego metalu lub stopu można traktować jako zbiór elektrod dodatnich i ujemnych, krótko zwartych przez sam metal. Między tymi elektrodami, którymi są elementy struktury metali lub stopów, występuje różnica potencjałów. Gdy na metal działa elektrolit, którym może być woda lub roztwory wodne soli, kwasu i zasad, tworzą się lokalne mikroogniwa i następuje lokalny przepływ prądu elektrycznego. Towarzyszą temu reakcje redukcji i utleniania.
Reakcja chemiczna redukcji zachodzi na elektrodzie zwanej katodą i jest związana z przepływem umownego prądu dodatniego z roztworu elektrolitu do elektrody (czyli w rzeczywistości przepływem elektronów w kierunku przeciwnym). Na anodzie przebiega reakcja chemiczna utleniania związana z przepływem dodatnich ładunków elektrycznych z elektrody do elektrolitu. W wyniku procesów elektrochemicznych zachodzących w mikroogniwach na powierzchni metalu poddanego działaniu elektrolitu przebiega proces korozji. Korozja następuje tylko na anodach mikroogniw, gdzie zwykle tworzą się sole lub wodorotlenki metali, osadzające się na elektrodzie lub przechodzące do roztworu. Czynniki decydujące o przebiegu korozji elektrochemicznej. 1-standardowy potencjał utleniający 2-korozji elektrochemicznej ulegają również metale i stopy zakopane w glebie, nierzadko podlegające działaniu prądów błądzących. 3-polaryzacja
POWŁOKI NATRYSKIWANE - mają na celu nadanie żaroodporności. Natryskiwanie polega na nanoszeniu na powierzchnie wyrobu materiału np. proszku który w strumieniu gorącego gazu ulega rozpyleniu. Poprzez grubość powłoki ocenia się poprawność natryskiwania oglądając je. Podczas natryskiwania powstają pory - przestrzenie wypełnione gazem. Występują pory powierzchniowe i wewnętrzne. Grafit powoduje , że podczas procesu polerowania następuje wykruszanie co powoduje że powłoka jest nieszczelna wtedy staje się pod powłoką. W zależności od użytych materiałów na powłoki ochronne rozróżnia się powłoki metalowe, organiczne i nieorganiczne. Powłoki metalowe mogą być uzyskane sposobami: galwaniczne z wodnych roztworów lub roztopionych soli -chemiczne w wyniku reakcji, powłoki z naparowaniem w próżni , dyfuzyjne z proszków stopionych metali z fazy gazowej lub lotnych związków metali. Powłoki metalowe są stosowane do ochrony przed korozją elektrochemiczną i chemiczną. Opracowano nową metodę natryskiwania powłok metali innymi metalami, stopami lub materiałami nie metalicznymi za pomocą palników plazmowych. Najczęściej stosuje się chromowanie żelazowanie albo żelazowo - niklowanie. Wszystkie z wymienionych metod pozwalają na uzyskanie powłok o dużej twardości, odporności na zużycie pod warunkiem dobrania odpowiedniego składniku elektrolitu i optymalnych warunków elektrolizy.
PROCES ELEKTROLIZY
Elektroliza to proces reakcji chemicznych. Zachodzących na powirzchni elektrod zanurzonych w wodnych roztworach soli. Procesem elektrolizy rządzą, I prawo faradaya M=k*I*t [kg] Masa substancji wydzielonej na katodzie jest wprostpropolcjonalna do czasu i natężenia prądu elektrycznego k- współczynnik proporcjonalności tzw równoważnik elektrochemiczny jest to wartość ustalona dla danego pierwiastka [g/A*h] Zn k=1,219 Mi k=1,095 Cr k=0,323, II prawo faradaya K*F=E. Jednakowa ilość ładunku elektrycznego wydziela się z różnych substancji masy proporcjonalnie do ich równoważników chemicznych ( E ) E=masa/wartość jonów
F - stała Faradaya K- współczynnik proporcjonalności - równoważnik elektrochemiczny.
BUDOWA WARSTW NA STALI LAMINALNEJ- W przypadku dwuosiowego stanu naprężenia stosowane są laminaty w których włókna w przyległych warstwach są ułożone prostopadle do siebie. Włókna mogą również stanowić wiązki (roving) tkaniny lub mogą być uformowane w maty. Nowoczesne laminy lub kompozyty wielowarstwowe często mają kształt plastra miodu.
anodach mikroogniw, gdzie zwykle tworzą się sole lub wodorotlenki metali, osadzające się na elektrodzie lub przechodzące do roztworu. Czynniki decydujące o przebiegu korozji elektrochemicznej. 1-standardowy potencjał utleniający 2-korozji elektrochemicznej ulegają również metale i stopy zakopane w glebie, nierzadko podlegające działaniu prądów błądzących. 3-polaryzacja
POWŁOKI NATRYSKIWANE - mają na celu nadanie żaroodporności. Natryskiwanie polega na nanoszeniu na powierzchnie wyrobu materiału np. proszku który w strumieniu gorącego gazu ulega rozpyleniu. Poprzez grubość powłoki ocenia się poprawność natryskiwania oglądając je. Podczas natryskiwania powstają pory - przestrzenie wypełnione gazem. Występują pory powierzchniowe i wewnętrzne. Grafit powoduje , że podczas procesu polerowania następuje wykruszanie co powoduje że powłoka jest nieszczelna wtedy staje się pod powłoką. W zależności od użytych materiałów na powłoki ochronne rozróżnia się powłoki metalowe, organiczne i nieorganiczne. Powłoki metalowe mogą być uzyskane sposobami: galwaniczne z wodnych roztworów lub roztopionych soli -chemiczne w wyniku reakcji, powłoki z naparowaniem w próżni , dyfuzyjne z proszków stopionych metali z fazy gazowej lub lotnych związków metali. Powłoki metalowe są stosowane do ochrony przed korozją elektrochemiczną i chemiczną. Opracowano nową metodę natryskiwania powłok metali innymi metalami, stopami lub materiałami nie metalicznymi za pomocą palników plazmowych. Najczęściej stosuje się chromowanie żelazowanie albo żelazowo - niklowanie. Wszystkie z wymienionych metod pozwalają na uzyskanie powłok o dużej twardości, odporności na zużycie pod warunkiem dobrania odpowiedniego składniku elektrolitu i optymalnych warunków elektrolizy.
PROCES ELEKTROLIZY
Elektroliza to proces reakcji chemicznych. Zachodzących na powirzchni elektrod zanurzonych w wodnych roztworach soli. Procesem elektrolizy rządzą, I prawo faradaya M=k*I*t [kg] Masa substancji wydzielonej na katodzie jest wprostpropolcjonalna do czasu i natężenia prądu elektrycznego k- współczynnik proporcjonalności tzw równoważnik elektrochemiczny jest to wartość ustalona dla danego pierwiastka [g/A*h] Zn k=1,219 Mi k=1,095 Cr k=0,323, II prawo faradaya K*F=E. Jednakowa ilość ładunku elektrycznego wydziela się z różnych substancji masy proporcjonalnie do ich równoważników chemicznych ( E ) E=masa/wartość jonów
F - stała Faradaya K- współczynnik proporcjonalności - równoważnik elektrochemiczny.
BUDOWA WARSTW NA STALI LAMINALNEJ- W przypadku dwuosiowego stanu naprężenia stosowane są laminaty w których włókna w przyległych warstwach są ułożone prostopadle do siebie. Włókna mogą również stanowić wiązki (roving) tkaniny lub mogą być uformowane w maty. Nowoczesne laminy lub kompozyty wielowarstwowe często mają kształt plastra miodu.
anodach mikroogniw, gdzie zwykle tworzą się sole lub wodorotlenki metali, osadzające się na elektrodzie lub przechodzące do roztworu. Czynniki decydujące o przebiegu korozji elektrochemicznej. 1-standardowy potencjał utleniający 2-korozji elektrochemicznej ulegają również metale i stopy zakopane w glebie, nierzadko podlegające działaniu prądów błądzących. 3-polaryzacja
POWŁOKI NATRYSKIWANE - mają na celu nadanie żaroodporności. Natryskiwanie polega na nanoszeniu na powierzchnie wyrobu materiału np. proszku który w strumieniu gorącego gazu ulega rozpyleniu. Poprzez grubość powłoki ocenia się poprawność natryskiwania oglądając je. Podczas natryskiwania powstają pory - przestrzenie wypełnione gazem. Występują pory powierzchniowe i wewnętrzne. Grafit powoduje , że podczas procesu polerowania następuje wykruszanie co powoduje że powłoka jest nieszczelna wtedy staje się pod powłoką. W zależności od użytych materiałów na powłoki ochronne rozróżnia się powłoki metalowe, organiczne i nieorganiczne. Powłoki metalowe mogą być uzyskane sposobami: galwaniczne z wodnych roztworów lub roztopionych soli -chemiczne w wyniku reakcji, powłoki z naparowaniem w próżni , dyfuzyjne z proszków stopionych metali z fazy gazowej lub lotnych związków metali. Powłoki metalowe są stosowane do ochrony przed korozją elektrochemiczną i chemiczną. Opracowano nową metodę natryskiwania powłok metali innymi metalami, stopami lub materiałami nie metalicznymi za pomocą palników plazmowych. Najczęściej stosuje się chromowanie żelazowanie albo żelazowo - niklowanie. Wszystkie z wymienionych metod pozwalają na uzyskanie powłok o dużej twardości, odporności na zużycie pod warunkiem dobrania odpowiedniego składniku elektrolitu i optymalnych warunków elektrolizy.
PROCES ELEKTROLIZY
Elektroliza to proces reakcji chemicznych. Zachodzących na powirzchni elektrod zanurzonych w wodnych roztworach soli. Procesem elektrolizy rządzą, I prawo faradaya M=k*I*t [kg] Masa substancji wydzielonej na katodzie jest wprostpropolcjonalna do czasu i natężenia prądu elektrycznego k- współczynnik proporcjonalności tzw równoważnik elektrochemiczny jest to wartość ustalona dla danego pierwiastka [g/A*h] Zn k=1,219 Mi k=1,095 Cr k=0,323, II prawo faradaya K*F=E. Jednakowa ilość ładunku elektrycznego wydziela się z różnych substancji masy proporcjonalnie do ich równoważników chemicznych ( E ) E=masa/wartość jonów
F - stała Faradaya K- współczynnik proporcjonalności - równoważnik elektrochemiczny.
BUDOWA WARSTW NA STALI LAMINALNEJ- W przypadku dwuosiowego stanu naprężenia stosowane są laminaty w których włókna w przyległych warstwach są ułożone prostopadle do siebie. Włókna mogą również stanowić wiązki (roving) tkaniny lub mogą być uformowane w maty. Nowoczesne laminy lub kompozyty wielowarstwowe często mają kształt plastra miodu.
anodach mikroogniw, gdzie zwykle tworzą się sole lub wodorotlenki metali, osadzające się na elektrodzie lub przechodzące do roztworu. Czynniki decydujące o przebiegu korozji elektrochemicznej. 1-standardowy potencjał utleniający 2-korozji elektrochemicznej ulegają również metale i stopy zakopane w glebie, nierzadko podlegające działaniu prądów błądzących. 3-polaryzacja
POWŁOKI NATRYSKIWANE - mają na celu nadanie żaroodporności. Natryskiwanie polega na nanoszeniu na powierzchnie wyrobu materiału np. proszku który w strumieniu gorącego gazu ulega rozpyleniu. Poprzez grubość powłoki ocenia się poprawność natryskiwania oglądając je. Podczas natryskiwania powstają pory - przestrzenie wypełnione gazem. Występują pory powierzchniowe i wewnętrzne. Grafit powoduje , że podczas procesu polerowania następuje wykruszanie co powoduje że powłoka jest nieszczelna wtedy staje się pod powłoką. W zależności od użytych materiałów na powłoki ochronne rozróżnia się powłoki metalowe, organiczne i nieorganiczne. Powłoki metalowe mogą być uzyskane sposobami: galwaniczne z wodnych roztworów lub roztopionych soli -chemiczne w wyniku reakcji, powłoki z naparowaniem w próżni , dyfuzyjne z proszków stopionych metali z fazy gazowej lub lotnych związków metali. Powłoki metalowe są stosowane do ochrony przed korozją elektrochemiczną i chemiczną. Opracowano nową metodę natryskiwania powłok metali innymi metalami, stopami lub materiałami nie metalicznymi za pomocą palników plazmowych. Najczęściej stosuje się chromowanie żelazowanie albo żelazowo - niklowanie. Wszystkie z wymienionych metod pozwalają na uzyskanie powłok o dużej twardości, odporności na zużycie pod warunkiem dobrania odpowiedniego składniku elektrolitu i optymalnych warunków elektrolizy.
PROCES ELEKTROLIZY
Elektroliza to proces reakcji chemicznych. Zachodzących na powirzchni elektrod zanurzonych w wodnych roztworach soli. Procesem elektrolizy rządzą, I prawo faradaya M=k*I*t [kg] Masa substancji wydzielonej na katodzie jest wprostpropolcjonalna do czasu i natężenia prądu elektrycznego k- współczynnik proporcjonalności tzw równoważnik elektrochemiczny jest to wartość ustalona dla danego pierwiastka [g/A*h] Zn k=1,219 Mi k=1,095 Cr k=0,323, II prawo faradaya K*F=E. Jednakowa ilość ładunku elektrycznego wydziela się z różnych substancji masy proporcjonalnie do ich równoważników chemicznych ( E ) E=masa/wartość jonów
F - stała Faradaya K- współczynnik proporcjonalności - równoważnik elektrochemiczny.
BUDOWA WARSTW NA STALI LAMINALNEJ- W przypadku dwuosiowego stanu naprężenia stosowane są laminaty w których włókna w przyległych warstwach są ułożone prostopadle do siebie. Włókna mogą również stanowić wiązki (roving) tkaniny lub mogą być uformowane w maty. Nowoczesne laminy lub kompozyty wielowarstwowe często mają kształt plastra miodu.
Wyszukiwarka
Podobne podstrony:
METALE K, Studia, Materiałoznastwo, Metaloznastwo i Podstawy Obrobki Cieplnej, Meteloznastwo, Ściągi
METALE K, Studia, Materiałoznastwo, Metaloznastwo i Podstawy Obrobki Cieplnej, Meteloznastwo, Ściągi
STALE SP, Studia, Materiałoznastwo, Metaloznastwo i Podstawy Obrobki Cieplnej, Meteloznastwo, Ściągi
HEYNA, Studia, Materiałoznastwo, Metaloznastwo i Podstawy Obrobki Cieplnej, Meteloznastwo, Ściągi na
OBRÓBKA CIEPLNA, Studia, Materiałoznastwo, Metaloznastwo i Podstawy Obrobki Cieplnej, Meteloznastwo,
STAL JES, Studia, Materiałoznastwo, Metaloznastwo i Podstawy Obrobki Cieplnej, Meteloznastwo, Ściągi
HARTOWAN, Studia, Materiałoznastwo, Metaloznastwo i Podstawy Obrobki Cieplnej, Meteloznastwo, Ściągi
STALE SP, Studia, Materiałoznastwo, Metaloznastwo i Podstawy Obrobki Cieplnej, Meteloznastwo, Ściągi
Obróbka cieplna stali konstrukcyjnej, Studia, Materiałoznastwo, Metaloznastwo i Podstawy Obrobki Cie
METALE, Studia, Materiałoznastwo, Metaloznastwo i Podstawy Obrobki Cieplnej, Meteloznastwo
METALE NIEŻELAZNE, Studia, Materiałoznastwo, Metaloznastwo i Podstawy Obrobki Cieplnej, Meteloznastw
METALE I STOPY METALI, Studia, Materiałoznastwo, Metaloznastwo i Podstawy Obrobki Cieplnej, Metelozn
CERAMIKA, Studia, Materiałoznastwo, Metaloznastwo i Podstawy Obrobki Cieplnej, Meteloznastwo
więcej podobnych podstron