Wielkości ekstensywne (WE) wielkości geometryczne lub fizyczne których zasób w obszarze złożonym z sumy podobszarów równy jest sumie zasobów we wszystkich podobszarach. Energia zewnętrzna odpowiada zjawiskom makroskopowym, zależy od wielkości fenomenologicznych uśrednionych, takich jak prędkość substancjalna oraz natężenie pól dalekiego zasięgu. Składa się z trzech składników: I. Energii kinetycznej makroskopowej ruchu substancji; II. E. grawitacji pola grawitacyjnego; III. E. elektromagnetycznej pola elektromagnetycznego dalekiego zasięgu. Energia wewnętrzna U- ekstensywna funkcja stanu, której istnienie postuluje pierwsza zasada termodynamiki. Jest określona z dokładnością do stałej addytywnej, ponieważ jej zmiana ΔU w przemianie adiabatycznej jest równa pracy W wykonanej nad układem ΔU=W. Z mikroskopowego punktu widzenia e. w. jest równa sumie średnich wartości energii kinetycznej bezładnego ruchu cząstek układu oraz energii oddziaływań międzycząsteczkowych i wewnątrz cząsteczkowych. E. wewnętrzna jest funkcją stanu układu (ciała), przy czym nie zależy od parametrów określających prędkość i położenie ciała. Przyjmuje się, że zależy ona od temperatury, ciśnienia i objętości układu. Głównymi składnikami e. wewnętrznej są: 1. e. kinetyczna ruchu postępowego i rotacyjnego drobin 2. e. ruchu drgającego atomów w drobinie 3. e. potencjalna w polu wzajemnego przyciągania się drobin 4. e. chemiczna, związana z możliwością przebudowy drobin 5. e. jądrowa. Zasada ekwipartycji energii - jedno z podstawowych twierdzeń fizyki statystycznej głoszące, że w układzie nie oddziałujących cząsteczek podlegającym prawom fizyki klasycznej i znajdującym się w stanie równowagi o temperaturze bezwzględnej T, na każdy stopień swobody cząsteczki translacyjny lub rotacyjny przypada średnio energia ½ kT, a na oscylacyjny energia kT, gdzie k - stała Boltzmana. Przykładowo, średnia energia kinetyczna sferycznie symetrycznej cząsteczki gazu doskonałego (3 stopnie swobody) wynosi 3/2 kT. Zasada ekwipartycji energii umożliwia wyznaczenie energii wewnętrznej i ciepła właściwego gazów doskonały. Bilans energii wynika on z zasady zachowania energii Ed=ΔEu+Ez gdzie Ed- energia doprowadzona do układu; ΔEu- przyrost energii układu; Ez- Energi odprowadzona. ΔEu= Eu2- Eu1; Eu1- energia początkowa; Eu2-energi końcowa. Sposoby przekazywania energii w urządzeniach mechanicznych: I.Przez wykonanie pracy mechanicznej; II.Przez przepływ ciepła; III.Za pomocą strugi czynnika; IV.Za pomocą prądu elektrycznego. Osłona adiabatyczna takie ograniczenie układu, które powoduje ze zmiany dokonujące się w ciałach poza układem mogą mieć wpływ na stan układu jedynie w wyniku zmian objętości układu. Osłona diatermiczna takie ograniczenie układu, które umożliwia dojście faz nie granicznych ze sobą do równowagi termodynamicznej poprzez fazę pośrednią zdążającą do równowagi termodynamicznej ze wszystkimi fazami z nią graniczącymi. Temperatura - jedna z podstawowych w termodynamice wielkości fizycznych, będąca miarą stopnia nagrzania ciał. Temperaturę można ściśle zdefiniować tylko dla stanów równowagi termodynamicznej, z termodynamicznego bowiem punktu widzenia jest ona wielkością reprezentującą wspólną własność dwóch układów pozostających w równowadze ze sobą. Temperatura jest związana ze średnią energią kinetyczną ruchu i drgań wszystkich cząsteczek tworzących dany układ i jest miarą tej energii. Temperatura wrzenia - temperatura przy której ciśnienie powstającej pary jest równe ciśnieniu otoczenia, skutkiem czego parowanie następuje w całej objętości cieczy. Ciśnienie to wielkość skalarna określona jako wartość siły działającej prostopadle do powierzchni podzielona przez powierzchnię na jaką ona działa, co przedstawia zależność: ![]()
gdzie: p - ciśnienie (Pa), Fn - składowa siły prostopadła do powierzchni (N), S - powierzchnia (m²). Ciśnienie atmosferyczne to stosunek wartości wektora siły, z jaką słup powietrza naciska na powierzchnię ziemi do powierzchni na jaką dany słup naciska. Ciśnienie bezwzględne (absolutne) - ciśnienie wyznaczane względem próżni doskonałej, której ciśnienie wynosi 0. Ciśnienie całkowite - ciśnienie wywierane przez płyn na przeszkodę ustawioną prostopadle do strumienia w punkcie całkowitego zatrzymania. Ciśnienie krytyczne - ciśnienie pary nasyconej w temperaturze krytycznej. Podciśnienie - różnica między ciśnieniem atmosferycznym a ciśnieniem bezwzględnym w przypadku, gdy jest ono mniejsze od atmosferycznego. Nadciśnienie ciśnienie występujące w danym układzie wyższe od ciśnienia otoczenia. Ciśnienie cząstkowe (ciśnienie parcjalne) - ciśnienie, jakie wywierałby dany składnik mieszaniny gazów, gdyby w tej samej temperaturze sam zajmował tę samą objętość. Ciśnienia cząstkowe można wyliczyć wykorzystując równanie Clapeyrona (prawo stanu gazu doskonałego). Zerowa zasada termodynamiki Jeżeli dwa układy nie graniczące ze sobą znajdują się w równowadze cieplnej z trzecim układem z którym graniczą to są one również w równowadze cieplnej między sobą. I zasada termodynamiki Zmiana energii wewnętrznej układu równa jest dostarczonemu do układu ciepłu i pracy wykonanej nad układem przez siły zewnętrzne: ΔU = ΔQ + ΔW ; ΔU to przyrost energii wewnętrznej układu.; ΔQ oznacza tu ciepło dostarczone do układu z zewnątrz. Jeśli jednak układ oddaje ciepło, wówczas jego energia wewnętrzna maleje; ciepło bierzemy ze znakiem ujemnym. ΔW to praca wykonana nad układem przez siły zewnętrzne. II zasada termodynamiki Nie istnieje proces termodynamiczny, którego jedynym wynikiem byłoby pobranie ciepła ze zbiornika i całkowita zamiana tego ciepła na pracę mechaniczną. III zasada termodynamiki (zasada Nernsta) głosi, że entropia substancji tworzących doskonałe kryształy dąży do 0 gdy temperatura dąży do 0 K. Gaz - stan skupienia materii, w którym ciało fizyczne łatwo zmienia kształt i zajmuje całą dostępną mu przestrzeń. Gaz doskonały - spełnia równanie stanu Clapeyrona i jego ciepło właściwe dla stałej objętości jest stałe Cv=const. Zwany gazem idealnym jest to abstrakcyjny, matematyczny model gazu, spełniający następujące warunki: 1.brak oddziaływań międzycząsteczkowych z wyjątkiem odpychania w momencie zderzeń cząsteczek; 2.objętość cząsteczek jest znikoma w stosunku do objętości gazu; 3.zderzenia cząsteczek są doskonale sprężyste; 4.cząsteczki znajdują się w ciągłym chaotycznym ruchu. Gaz półdoskonały - gaz który spełnia równanie stanu Clapeyrona ale ciepło właściwe tego gazu dla stałej objętości da się wyrazić tylko funkcja temperatur Cv=Cv(t). Właściwości gazu- jest nieściśliwy, stan lotny, jest nielekki, między atomami gazu występują oddziaływania sprężyste, miedzy drobinami nie ma przyciągania, obj. drobin jest bardzo mała w porównaniu z naczyniem w którym się znajduje. Równanie gazu doskonałego (Clapeyrona)-to równanie stanu opisujące związek pomiędzy temperaturą, ciśnieniem i objętością gazu doskonałego, a w sposób przybliżony opisujący gazy rzeczywiste. pV=mRT; pv=RT; R-stała gazowa. Stała gazowa (uniwersalna stała gazowa)- stała fizyczna równa pracy wykonanej przez 1 mol gazu doskonałego podgrzewanego o 1 kelwin podczas przemiany izobarycznej. Parametry termodynamiczne: #Ciśnienie-siłą działająca na jednostkę powierzchni p=F/S [Pa]. #Objętość-parametr ekstensywny [V], dlatego stosujemy objętość właściwą. #Objętość właściwa-wyraża się stosunkiem objętości do masy v=V/m [m3/kg]. #Temperatura-zdolność układu do przekazywania ciepła [K, C0]. Parametry stanu są to makroskopowe wielkości fizyczne charakteryzujące dany układ, których przyrosty przy przejściu układu od jednego stanu do drugiego zależą wyłącznie od stanu początkowego i końcowego, nie zaś od sposobu przejścia. Parametry stanu, które nie są bezpośrednio mierzalne nazywamy także funkcjami stanu. Parametry stanu dzielimy na Parametry intensywne (np. ciśnienie, temperatura, gęstość, objętość właściwa) nie zależą od wielkości układu i nie zmieniają swojej wartości jeśli podzielimy jednorodny układ na części. Parametry ekstensywne (np. objętość, energia wewnętrzna, entalpia, entropia) zależą od wielkości układu i podlegają prawu sumowania. Układ termodynamiczny-część przestrzeni materialnej ograniczona powierzchniami materialnymi lub abstrakcyjnymi. Układy mogą być: Otwarte-są to układy, w których przez powierzchnię ograniczoną przepływa substancja. Zamknięte-jeśli nie przepływa substancja. Otoczenie-to część przestrzeni poza układem termodynamicznym. Czynnik termodynamiczny-substancja w postaci gazu, pary lub cieczy, biorąca udział w procesie wymiany ciepła i masy, albo pośrednicząca w przemianie ciepła na pracę mechaniczną. Przemiana termodynamiczna-zjawisko stanowiące ciągłą zmianę od punktu początkowego, poprzez nieskończoną liczbę ilość faz pośrednich, do punktu końcowego. Stan ustalony-stan układu, w którym istnieje znoszące się działanie otoczenia o charakterze przepływów. Równowaga termodynamiczna-stan, który ustala się samorzutnie i pozostaje niezmieniony, jeżeli nie oddziaływuje na niego otoczenie układu lub, gdy znoszą się działania o charakterze sił, brak działań o charakterze przepływów. Stan układu-jest opisywany jednoznacznie przez wszystkie parametry termodynamiczne. Praca-W- wielkość fizyczna skalarna związana z przemieszczaniem się ciała pod wpływem siły, określona jako iloczyn skalarny wektora tej siły F i wektora przemieszczenia r. W=F r. Występują różne rodzaje pracy: 1) praca zmiany objętości; 2) praca użyteczna; 3) praca techniczna suma prac przemian występujących w maszynie przepływowej. Pierwsza zasada termodynamiki dla układów otwartych, mówi nam że praca techniczna jest równa ciepłu dostarczanemu do układu i pomniejszona o zmianę entalpii. I można to przedstawić :L1,2 = p2V2- p1V1+Lt1,2 Całkowita praca wykonana w układzie składa się z 3 pozycji: A- praca wykonana przez gaz wchodzący do układu B- praca jaka musi być doprowadzona do układu aby gaz z niego usunąć C- praca zewnętrzna ,(praca zmiany objętości) związana ze zmianą obj. Praca zewnętrzna przemiany jest pracą makroskopowych sił zewnętrznych i jest związana ze zmianą stanu układu. Pracę zewnętrzną oddawaną do otoczenia przez układ przyjęto za dodatnią (dV>0), a pracę zewnętrzną pobieraną przez układ z otoczenia za ujemną (dV<0). W szczególnym przypadku praca zewnętrzna ogranicza się do pracy zmiany objętości, a wtedy dla przemian odwracalnych ciał prostych mamy : 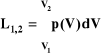
Praca zewnętrzna przemiany zależy od rodzaju przemiany, a w celu jej obliczenia należy znać charakterystyczną dla tej przemiany zależność ciśnienia od objętości. W przypadku występowania oporów wewnętrznych np. w postaci tarcia wewnętrznego praca zewnętrzna przemiany Lz1,2 różni się od pracy przemiany L1,2 o zawsze dodatnią pracę, która idzie na pokonanie oporów wewnętrznych Lw1,2, czyli L1,2 = Lz1,2 + Lw1,2 Ciepło parowania (r)- wyraża ilość ciepła, jaką trzeba doprowadzić do 1kg wrzącej cieczy, aby otrzymać z niej przy stałym ciśnieniu i temperaturze 1kg pary nasyconej suchej. r=i''-i' [J/kg]. Ciepło spalania (Qc) to ilość ciepła jaką otrzymuje się przy spalaniu całkowitym i zupełnym jednostki masy lub jednostki objętości analizowanej substancji w stałej objętości, przy czym produkty spalania oziębia się do temperatury początkowej, a para wodna zawarta w spalinach skrapla się zupełnie. Kiedy ciepło właściwe całkowite przemiany politropowej będzie ujemne. Dla 1<z<χ mamy ujemne ciepło właściwe, to znaczy c=dQ/dT<0 oznacza to, że doprowadzone do układu ciepło dQ>0 powoduje obniżenie jego temperatury. Przy ujemnym cieple właściwym (c<0) ciepło termodynamiczne wykonuje pracę pdV zarówno w wyniku doprowadzonego ciepła, jak też kosztem jego energii wewnętrznej Przenikanie ciepła - zjawisko przenoszenia ciepła z jednego ośrodka do drugiego poprzez ścianę stałą; składa się z 3 zjawisk:1)wnikanie do przegrody 2)przewodzenie 3)wnikanie z przegrody do płynu omywającego przegrodę z zewnątrz. Współczynnik przenikania ciepła. Wartość-K jest ilością ciepła mierzoną w W/m2K, która w jednostce czasu przenika przez element budowlany o powierzchni 1m2 przy różnicy temperatur 1K, zwaną też stratą ciepła przez przenikanie. Ciepło właściwe przemiany jest to stosunek ciepła przemiany do ilości substancji uczestniczącej w tej przemianie oraz do przyrostu temperatury podczas tej przemiany. Ciepło-jest to forma oddziaływania energetycznego między dwoma układami termodynamicznymi. Warunkiem niezbędnym tego oddziaływania jest różnica temperatur między układami. Energia ta może być gromadzona w układzie w postaci energii kinetycznej i potencjalnej cząstek tworzących układ termodynamiczny. Ciepło podobnie jak praca nie jest parametrem stanu, co oznacza, że zależy od zachodzących przemian. Przejmowanie ciepła-wymiana ciepła między płynem, a powierzchnią stykającego się z nim ciała stałego. Jest to przykład jednoczesnego występowania przewodzenia i konwekcji. Współczynnik przejmowania ciepła-wyraża sobą ilość ciepła przejmowaną przez jednostkę powierzchni w jednostce czasu przy różnicy temperatur wynoszącej 1K. Odwrotność współczynnika nazywana jest oporem cieplnym. Wymiennik ciepła-urządzenie umożliwiające wymianę ciepła między płynami o różnych temperaturach. Typy wymienników ciepła: #Rekuperatory-strumienie zimny i ciepły nie mieszają się. #Regeneratory-bezprzeponowe wymienniki ciepła, w którym do ogrzania okresowego powietrza lub paliwa gazowego wykorzystuje się ciepło wychodzących spalin lub innych gazów. #Mieszalniki-mieszanie płynów o różnych temperaturach. Entalpia-energia doprowadzona ze strugą [i]. funkcja stanu wprowadzona przez Gribbsa I=U+p*V; U- energia wewnętrzna układu; p- ciśnienie; V- objętość. Entalpia- to energia wewnętrzna plus praca. Jest to funkcja tych samych parametrów co energia wewnętrzna. Entalpia parowania zależy od temperatury parowania, czyli od ciśnienia nasycenia. Przyrost entalpii 1 kg substancji przy przejściu od punktu pęcherzyków do punktu rosy nazywa się entalpią parowania r: r=r''-r' Entropia -jest termodynamicznym parametrem stanu układu, której różniczka ds. w elementarnym procesie odwracalnym równa się stosunkowi nieskończenie małej ilości ciepła dostarczonej układowi do temperatury bezwzględnej układu. Ilość doprowadzonego nie powoduje wzrostu temperatury układu. [J/K]. To termodynamiczna funkcja stanu będąca miarą nie uporządkowania układów, a więc także całego wszechświata. Jednostką entropii właściwej jest [J/kg K]. Entropia zależy do temperatury i objętości. S=Cp ln(T2/T1); Cp=Cv+R Egzergia- maksymalna praca, jaką układ termodynamicznie otwarty może wykonać w procesie odwracalnym; zdolność do wykonywania pracy, jest rodzajem energii, która może służyć jako zapas energii. Przemiana izobaryczna-przemiana, w której ciśnienie pozostaje stałe. V/T=const. P izobaryczna to proces termodynamiczny, podczas którego ciśnienie układu nie ulega zmianie. Procesy izobaryczne mogą zachodzić zarówno w sposób odwracalny, jak i nieodwracalny. Odwracalny proces izobaryczny przedstawia na wykresie krzywa zwana izobarą. Praca wykonana przez układ w odwracalnym procesie izobarycznym jest równa ubytkowi (lub przyrostowi) entalpii układu. Przemiana izotermiczna - przemiana gazowa, zachodząca przy określonej, stałej temperaturze. W przemianach tych, zgodnie z prawem Boyla'a Mariott'a, w izotermicznej przemianie stałej masy gazu, ciśnienie wywierane na ścianki naczynia jest odwrotnie proporcjonalne do zajmowanej przez niego objętości, co zapisuje się jako: pV = const, Przemiana izochoryczna - przemiana gazowa zachodząca przy stałej objętości. W przemianach tych (prawo Charlesa):p/T=const. Podczas przemiany izochorycznej nie jest wykonywana żadna praca. Zmiany energii wewnętrznej układu zachodzą tylko drogą wymiany ciepła. Prawo Charlesa-w izochorycznej przemianie stałej masy gazu, ciśnienie wywierane na ścianki naczynia jest wprost proporcjonalne do temperatury. Wykładnik politropy jest równy n = (C − Cp) / (C − Cv) stały dla danego procesu politropowego, ale przyjmujący dla różnych procesów politropowych różne wartości, od minus do plus nieskończoności. Przemiany politropowe-charakteryzują się stałym ciepłem właściwym przemiany.. Przemiany te dotyczą gazów doskonałych, nie dotyczą pół doskonałych. Równanie politropy: p1v1m=p2v2m=const.; m-wykładnik poitropy Przemiana adiabatyczna (Proces adiabatyczny) - proces termodynamiczny, podczas którego wyizolowany układ nie nawiązuje wymiany ciepła, lecz całość energii dostarczana lub odbierana jest z niego jako praca. Przemiana adiabatyczna jest przemianą, w której zmieniają się trzy parametry stanu gazu: ciśnienie, objętość i temperatura. Przemiana ta nie wymaga ciepła z otoczenia, dlatego podczas sprężania rośnie jego temperatura, a podczas rozprężania temperatura maleje. Podobnie jak w przypadku sprężania izotermicznego - maleje objętość a rośnie ciśnienie, w sprężaniu adiabatycznym trzeba dodatkowo uwzględnić wzrost ciśnienia gazu (spowodowany wzrostem temperatury). Przebieg przemiany adiabatycznej określa się prawem Poissona: pVk=const. Wykładnik adiabaty, nazywamy stosunek ciepła molowego przy stałym ciśnieniu do ciepła molowego przy stałej objętości jest on równy stosunkowi pojemności cieplnej przy stałej objętości i przy stałym ciśnieniu. k=Cp/Cv. Przemiana odwracalna- zachodzi, gdy stan czynnika termodynamicznego i otoczenia po zrealizowaniu przemiany powraca do stanu początkowego. Aby przemiana miała charakter odwracalny muszą być spełnione warunki: Przepływ ciepła przy nieskończenie małej różnicy temperatur; Musi zaistnieć odpowiednia ilość źródeł ciepła; Brak tarcia. Obieg-zespół lub szereg następujących po sobie przemian, w czasie których jest doprowadzane i odprowadzane ciepło, oraz jest odbierana lub wykonywana praca, a czynnik termodynamiczny wraca do punktu wyjścia. Obieg prawostronny- obieg zgodny z ruchem wskazówek zegara, opisuje działanie silnika cieplnego.T1>T2; Qd-Qw=Lob Silnik cieplny - urządzenie pracujące wg cyklu kołowego pomiędzy dwoma źródłami ciepła: grzejnicą i chłodnicą. Różnica pomiędzy ciepłem pobranym z grzejnicy Q1 i oddanym do chłodnicy Q2 jest równa pracy użytecznej WU wykonanej przez silnik. Sprawność silnika cieplnego η to stosunek pracy użytecznej wykonanej przez silnik do ciepła pobranego z grzejnicy.
Przy aktualnych możliwościach technicznych sprawność silnika cieplnego nie może być większa niż 67• Silnik Carnota - idealny silnik cieplny o maksymalnej możliwej sprawności. Silnik Carnota nie istnieje w praktyce, wyznacza jednak pewien fizyczny, wzorcowy model, do którego mogą dążyć konstruktorzy realnych silników. Cykl składa się z 4 procesów: 1-2 - rozprężanie izotermiczne; 2-3 - rozprężanie adiabatyczne; 3-4 - sprężanie izotermiczne; 4-1 - sprężanie adiabatyczne. Sprawność idealnego silnika cieplnego η wyraża się wzorem:
T1 - temperatura grzejnicy; T2 - temperatura chłodnicy.Obieg lewostronny- obrazuje pracę urządzeń chłodniczych (lodówka, pompa ciepła). Sprawność chłodziarki. es< = >1; es=Qd/Qw-Qd. Sprawność pompy ciepła. cp>1 es=Qw/Qw-Qd. Obieg Carnota-obieg, który ma najwyższą sprawność cieplną, jest złożony z 2 przemian izotermicznych i 2 przemian adiabatycznych. W cyklu Carnota, z gazem jako ciałem roboczym, gaz rozpręża się po czym ochładza się przez adiabatyczne rozprężanie do temp. Chłodnicy T2, następnie spręża się izotermicznie oddając ciepło Q2 do chłodnicy i w czasie adiabatycznego sprężania powraca do stanu wyjściowego. Silnik cieplny pracujący na zasadzie cyklu Carnota nazywa się silnikiem Carnota. Jeżeli wszystkie przemiany w cyklu są odwracalne, to mówi się o odwracalnym cyklu Carnota i idealnym silniku Carnota. Cykl Carnota, jest procesem kołowym i odwracalnym. Do realizacji cyklu potrzebny jest czynnik termodynamiczny, który może wykonywać pracę np. gaz w naczyniu z tłokiem a także dwa nie ograniczone źródła ciepła jedno jako źródło ciepła a drugie jako chłodnica Cykl Carnota składa się z: 1. Sprężanie izotermiczne - czynnik roboczy styka się z chłodnicą, ma temperaturę chłodnicy i zostaje poddane procesowi sprężania w tej temperaturze (T2). Czynnik roboczy oddaje ciepło do chłodnicy. 2.Sprężanie adiabatyczne - czynnik roboczy nie wymienia ciepła z otoczeniem, i jest poddawany sprężaniu aż uzyska temperaturę źródła ciepła (T1). 3.Rozprężanie izotermiczne - czynnik roboczy styka się ze źródłem ciepła, ma jego temperaturę i poddawany jest rozprężaniu izotermicznemu w temperaturze (T1), podczas tego cyklu ciepło jest pobierane ze źródła ciepła. 4.Rozprężanie adiabatyczne - czynnik roboczy nie wymienia ciepła z otoczeniem i jest rozprężany aż czynnik roboczy uzyska temperaturę chłodnicy (T2). Druga zasada termodynamiki dla obiegu odwracalnego-suma ciepła zredukowanego doprowadzonego do całego obiegu odwracalnego równa jest zero. Para -substancja lotna na pograniczu przejścia ze stanu gazowego, nie podlega prawu gazu doskonałego. Para wodna w powietrzu występuje w 3 stanach skupienia: nasycona mokra, nasycona sucha, para przegrzana. Stopień suchości (x)- określa zawartość pary nasyconej suchej w 1kg pary wilgotnej i stosujemy go w celu określenia pary nasyconej mokrej: x = mp/m [kg/kg]. Powietrze wilgotne - mieszanina pary wodnej i powietrza suchego. Trzy stany powietrza wilgotnego 1)zamglone 2)nasycone 3)nienasycone; 1)suche+para wilgotna→(para nasycona sucha+mgła); 2)suche+para mokra, nasycona, sucha; 3)suche+para przesączona Parametry powietrza wilgotnego: 1)Zawartość wilgoci (wilgotność właściwa) - masa wilgoci przypadająca na 1kg powietrza suchego:x = mw/mg [kg/kg]. Zależność między zawartością wilgoci, a ciśnieniem cząstkowym: x =0,622 (pw/p-pw).2)Wilgotność bezwzględna - masa wilgoci do objętości powietrza wilgotnego:ρw = mw/V [kg/m3]. 3)Wilgotność względna - stosunek wilgotności bezwzględnej do wilgotności nasycenia w tej samej temperaturze:φ= (ρw/ ρ“w)*100%; Para wodna jako czynnik termodynamiczny. Woda przekształca się w parę wodną podczas: Zjawiska parowania powierzchniowego, Wrzenia, czyli parowania całą objętością. Przewodzenie-zjawisko polegające na przekazywaniu energii cieplnej wewnątrz jednego ciała lub z jednego do drugiego poprzez stykające się ze sobą drobiny lub cząstki, które nie wykazują większych zmian położenia. Konwekcja-zjawisko przekazywania energii występujące głównie w płynach podczas ruchu uporządkowanego nawet, jeżeli ruch wywołuje różnica temperatur. Gradient funkcji skalarnej pokazuje nam kierunek najszybszego wzrostu tej funkcji skalarnej. Jeżeli w przestrzeni jakieś powierzchnie mają stałe temperatury i uda się znaleźć ta funkcję to gradient będzie prostopadły do tej powierzchni. Gradient temperatury-temperatura ciała zmienia się jedynie w kierunkach przecinających powierzchnie izotermiczne. Największa zmiana występuje wzdłuż normalnych do powierzchni izotermicznych. Jej wzrost i kierunek określa gradient temperatury. Prawo Fouriera- (prawo przewodzenia ciepła) jest to równanie opisujące przepływ ciepła mechanizmem przewodzenia, i mówi ono, ze strumień ciepła jest wprost proporcjonalny do gradientu temperatury i pola powierzchni prostopadłej do kierunku rozchodzenia się ciepła.![]()
Współczynnik lambda () wyraża sobą ilość energii, jaka przepływa w jednostce czasu, przez ścianę o powierzchni 1m2 i grubości 1m, gdy różnica temperatur obu powierzchni wynosi 1K.. STAN CZYNNIKA TERMODYNAMICZNEGO określają prawa Prawo Boyla-Mariota: przy stałej temperaturze. Jest to stosunek iloczynu ciśnienia i objętości w dwóch różnych stanach. p1V1=p2V2 Prawo Charlesa przy stałej objętości: jest to stosunek ciśnienia w dwóch różnych stanach p1/p2=T1/T2 Prawo Avogadra (6,02*1023 w 1 molu) Gazy doskonałe znajdujące się w tej samej temperaturze i pod tym samym ciśnieniem, zawierają w tej samej objętości jednakową liczbę cząstek. Prawo Gay- Lussaca Przy stałym ciśnieniu: objętość danej masy gazu jest wprost proporcjonalna do temperatury V1/V2=T1/T2. Odwracalność przemian - Aby ona nastąpiła musi być: - brak tarcia; - równowaga sił ; - bardzo małe prędkości; - transport ciała odbywa się przy nieskończenie małych różnicach temperatur. Prawo Daltona- każdy ze składników mieszaniny gazowej zachowuje się tak jakby sam znajdował się w tej przestrzeni zajmowanej przez gaz. Każdy ze składników ma swoje ciśnienie cząstkowe. Paliwa naturalne-nagromadzona w jednym miejscu energia słońca przez setki tysięcy lat. Paliwa załamują równowagę ekologiczna atmosfery; powodują zapylenie; Za jednos paliwa stałego przyjmuje się 1kg paliwa wilgotnego w stanie surowym. Spalanie - reakcja chemiczna polegająca na szybkim łączeniu cząstek tlenem przy równoczesnym wydzielaniu dużych ilości ciepła. Skład paliwa: A)paliwa stałe ( udziały gramowe) C+H+S+O+N+W+P=1 KG. B)paliwa gazowe ( udziały objętościowe). Wartość opałowa - ilość ciepła, którą uzyskujemy przy spalaniu 1kg paliwa w suchym powietrzu lub tlenie, gdy spełnione są warunki: >spalanie jest zupełne i całkowite; >produkty spalania są ochłodzone do temperatury początkowej substratów; >cała wilgoć zawarta w spalinach pozostaje w postaci pary. Wg= Wd+r*f; r - ciepło parowania wody; f - liczba kg wody w spalinach. Przykładowe kolektorowe instalacje ogrzewania wody: a)z pompą i dwoma obiegami; b)grawitacyjny z dwoma obiegami; c)grawitacyjny z obiegiem otwartym. Pompy ciepła - pobierają darmową energię z wody, powietrza, odpadów, reakcji chemicznych. Kwant - przyrost energi następuje skokowo; jest proporcjonalny do częstotliwości Stała Plancka=h=6,6*10-34 [J*s]; Energia fotonu = 3*10-19 [J]. Równanie Bernoulliego opisuje parametry cieczy doskonałej płynącej w rurze o zmiennym przekroju. Wynika ono wprost z faktu zachowania objętości cieczy doskonałej i zasady zachowania energii mechanicznej. p+ρgh+pv2/2=const; ρ - gęstość cieczy; v - prędkość cieczy w rozpatrywanym miejscu; h - wysokość w układzie odniesienia w którym liczymy energię potencjalną; g - przyspieszenie grawitacyjne; p - ciśnienie cieczy w rozpatrywanym miejscu. Atmosfera fizyczna to poza układowa jednostka miary ciśnienia, równa ciśnieniu 760mm słupa rtęci w temp 273,16 K, przy normalnym przyspieszeniu ziemskim. obieg Diesla, obieg termodynamiczny złożony z 4 kolejnych procesów: adiabatycznego sprężania, izobarycznego ogrzewania, adiabatycznego rozprężania i izochorycznego chłodzenia czynnika termodynamicznego; realizowany w silniku Diesla. wilgotność bezwzględna: stosunek masy pary wodnej w danej objętości do tejże objętości zawierającej mieszaninę pary wodnej i powietrza suchego Punkt potrójny - to stan w jakim dana substancja może istnieć w trzech stanach skupienia równocześnie w równowadze termodynamicznej. Na wykresie stanów równowagi jest to punkt przecięcia krzywych równowagi fazowej substancji odpowiadający stanowi równowagi trwałej trzech stanów skupienia (ciało stałe, ciecz, gaz). Ciało doskonale szare. Stała absorpcyjność przy różnych długościach fali. Zdolność absorpcyjna danego ciała nie zależy od długości fali padającej na to ciało. Promieniowanie cieplne - promieniowanie termiczne; promieniowanie elektromagnetyczne emitowane pod wpływem temperatury przez ciała znajdujące się w stanie równowagi termodynamicznej. Uzyskanie stanu równowagi jest możliwe tylko wówczas, gdy ciało jest zamknięte nieprzezroczystymi ściankami, przy czym temp. Ścianek jest równa temp. Ciała. Zgodnie z prawem Prevosta wszystkie ciała stałe i ciekłe emitują promieniowanie cieplne bez względu na sąsiedztwo innych ciał. Promieniowanie cieplne zależy od własności fizycznych i chemicznych ciała, a w przypadku ciał stałych przede wszystkim od ich powierzchni zewnętrznej. Równanie van der Waalsa jest równaniem stanu gazu wiążące parametry stanu gazu ( ciśnienie p, objętość V i temperaturę T). Równanie van der Waalsa stanowi na ogół bardzo dobre przybliżenie równania stanu gazów rzeczywistych, szczególnie dla dużych ciśnień i w temperaturach i ciśnieniu zbliżonych do parametrów skraplania gazu i powyżej. Równanie kryterium przy konwekcji burzliwej. KONWEKCJA: Może być wymuszona lub swobodna. Zwykle konwekcja swobodna nakłada się na wymuszoną. K. wymuszona występuje w ruchu burzliwym. W urządzeniach chodzi głownie o k.α =λ/e*(T-V)*(T-V'). Przy konwekcji wymuszonej występuje 6 par niezależnych chemicznie współczynników przenikania. A przy konwekcji swobodnej α zależy od: α(T-V,β,J,Cp, λ,,V,l,g) β- współczynnik rozszerzalności objętościowej. przenikanie przez ściankę płaską. Rodzaje wymiany ciepła:1) przez przewodzenie i odbywa się tylko i wyłącznie w ciałach stałych, nie towarzyszy transport masy konwekcje 2) transport ciepła, któremu towarzyszy transport masy 3) promieniowanie - transport ciepła za pomocą fal elektromagne. Rozkład temperatur w ściance płaskiej, rozkład ten jest liniowy T(x)= ((T2 - T1)/δ)x +T1. Punkt krytyczny to warunki krytyczne definiujące stan układu fizycznego oddzielające stany o odmiennych właściwościach (ciecz - gaz), w którym nie można rozróżnić obu stanów (cieczy i gazu).
Wyszukiwarka
Podobne podstrony:
PWTC C2, UCZELNIA ARCHIWUM, UCZELNIA ARCHIWUM WIMiIP, Pomiary w Technice Cieplnej, lab moje
PWTC A1, UCZELNIA ARCHIWUM, UCZELNIA ARCHIWUM WIMiIP, Pomiary w Technice Cieplnej, lab moje
PWTC A2, UCZELNIA ARCHIWUM, UCZELNIA ARCHIWUM WIMiIP, Pomiary w Technice Cieplnej, lab moje
PWTC C1, UCZELNIA ARCHIWUM, UCZELNIA ARCHIWUM WIMiIP, Pomiary w Technice Cieplnej, lab moje
PWTC B2, UCZELNIA ARCHIWUM, UCZELNIA ARCHIWUM WIMiIP, Pomiary w Technice Cieplnej, lab moje
PWTC B1, UCZELNIA ARCHIWUM, UCZELNIA ARCHIWUM WIMiIP, Pomiary w Technice Cieplnej, lab moje
technika cieplna3 - ściąga, NAUKA, chemia, lab
technika cieplna2 - ściąga, NAUKA, chemia, lab
moje, SGGW Technika Rolnicza i Leśna, Technika cieplna
PWTC A2 02, UCZELNIA ARCHIWUM, UCZELNIA ARCHIWUM WIMiIP, Pomiary w Technice Cieplnej, lab moje
PWTC C2, UCZELNIA ARCHIWUM, UCZELNIA ARCHIWUM WIMiIP, Pomiary w Technice Cieplnej, lab moje
technika cieplna - ściąga
ściąga TC, SGGW Technika Rolnicza i Leśna, Technika cieplna
Pytania egzaminacyjne z techniki cieplnej, Technika cieplna, sciaga
sciaga cieplo!, SGGW Technika Rolnicza i Leśna, Technika cieplna
sciaga z ciepla, SGGW TRiL, Technika Cieplna Tril sggw
więcej podobnych podstron