Rola wody w środowisku (otoczeniu):
-składnik organizmu człowieka
-składnik roślin, zwierząt i mikroorganizmów
-przedmiot konsumpcji w tym warunek higieny
-drogi wodne, komunikacja, transport
-źródło energii mechanicznej i elektrycznej
-czynnik stabilizacji klimatu
-czynnik życia
-środowisko bytowania różnych istot żywych
woda ma wysokie ciepło właściwe, zmiany temperatury są powolniejsze niż powietrza
Woda w gospodarce przemysłowej:
-cenny surowiec chemiczny do otrzymywania wodoru i tlenu
-środowisko wielu reakcji chemicznych
-rozpuszczalnik substancji organicznej i nieorganicznej o różnych stanach skupienia
-nośnik ciepła w procesach ogrzewania i chłodzenia (odchodzimy od nośników Na)
-środek pomocniczy w procesach technologicznych, tj. rozdzielanie, flotacja, krystalizacja
-czynnik myjący, czyszczący, odprowadzający odpady w postaci ścieków przemysłowych i komunalnych
zajmuje ok. 70 % pow. Ziemi - 1 400 000km
najwięcej wody jest w morzach i oceanach 97 % lodowce 2 % wody głębinowe jeziora 0,02 % atmosfera 0,001 % rzeki 0,0001 %
WODY NATURALNE:
1.wody opadowe (podziemne, powierzchniowe, gruntowe) skropliny atmosferycznej pary wodnej, uważane za najczystsze, powstają w wyniku kondensacji pary wodnej,
2.powierzchniowe(strumienie, jeziora, zbiorniki retencyjne, morza i oceany) zasilane przez wody opadowe i wody podziemne, skład zależy od: ilości wody zasilającej zbiornik, od zagospodarowania zlewni, poza wodami górskimi nie nadają się do spożycia( zasolenie), stanowią one główne źródło zaopatrzenia w wodę użytkową,
3.podziemne
-przesiąkają wgłąb ziemi,
-rozpuszczają gazy, substancje organiczne i nieorganiczne (jeśli te wody znajduja się na powierzchni),
-przechodząc przez glebę pozbywają się (filtrują) zanieczyszczeń metalami ciężkimi (zatrzymują się one na przegrodzie filtracyjnej),
Wody, które znalazły się pod ziemią dzielimy na:
-zaskórne (podskórne) znajdują się na niewielkich głębokościach- kilku metrów, nie nadają się do spożycia
-wgłębne, są izolowane od odpływu zewnętrznego, znajdują się pod warstwą nieprzepuszczalną (np. glina), o takich wodach mówimy gdy znajdują się na głębokościach ok. 30 m, często SA bardzo zimne, w ciagu roku temperatura tych wód jest stała,
Zasolenie Bałtyku: 11g/l (morze średnio zasolone)
Woda - wodny roztwór substancji nieorganicznych i organicznych występujących na ziemi (mogą być zawarte koloidy i zawiesiny), substancje te mogą znaleźć się tam w sposób naturalny lub być wprowadzone w wyniku działalności człowieka.
Właściwości wody czystej:
-cząsteczka wody składa się z atomu tlenu i dwóch atomów wodoru,
-cząsteczka wody jest polarna, miara polarności jest moment dipolowy,
-dzięki temu, że woda ma charakter polarny istnieją w wodzie oddziaływania między cząsteczkami,
-woda tworzy asocjaty - układy od 100 cząsteczek wody połączonych ze sobą,
-wodór ma 3 izotopy,
-tlen ma 3 izotopy, ![]()
-wykazuje pewne podobieństwo z amoniakiem,
-gdyby skraplała się w temp. 100 st. C, a wrzała w temp. 80 st. C to woda na Ziemi występowałaby w postaci pary wodnej,
Względna częstość występowania cząstek wody:
H2 16O - 100000
H2 18O - 204
H2 17O - 37
D2 15O - 3
Podstawowe właściwości fizyczne wody:
-masa cząsteczkowa - 18,01
-gęstość- 998,2 kg/ m3 (20 st. C)
-temp. topnienia- 0 st. C
-temp. wrzenia- 100 st. C
-ciepło topnienia- 333,75 J/ g*K
-ciepło parowania- 2260 J/ g*K (0 st. C)
-ciepło właściwe- 4,19 J/ g*K (15 st. C)
-napięcie powierzchniowe- 72,75 mN/m (20 st. C)
-lepkość dynamiczna- 1,00 mNs/ m2 ( 20 st. C)
-przewodność elektrolityczna- 5*10-6 S/m (25 st. C)
-ma taką gęstość jak lód ma w temp. 30 st. C dzięki temu lód jest na powierzchni wody, największą gęstość ma w temp. 4 st. C
(3,98 st. C)
-lepkość wody zależy od temp., zmiana lepkości wpływa na sedymentacje - im większa lepkość tym mniejsza sedymentacja,
-ciepło właściwe wody jest największe ze wszystkich cieczy naturalnych, jeśli ciepło właściwe jest duże to woda się wolno nagrzewa,
-woda stanowi akumulator ciepła,
-obniżenie napięcia powierzchniowego przez substancje czynne jest niekorzystne dla mikroorganizmów,
szczególne właściwości wody:
-największa gęstość w temperaturze 3,98 st. C, a nie w punkcie zamarzania 0 st. C,
-b. dobry rozpuszczalnik wielu substancji,
-największe napięcie4 powierzchniowe ze wszystkich cieczy,
Stężenie substancji rozpuszczalnych w wodzie zależy od:
-powszechności jej występowania,
-rozpuszczalności,
-od procesów fizyko-chemicznych,
Substancje występujące w wodzie:
I:pochodzenia naturalnego, wprowadzone na skutek działalności gosp. człowieka,
II:organiczne, nieorganiczne,
III: składniki podstawowe od kilkunastu do kilkuset mg/ dm3, mikroskładniki od kilkuset μg/dm3 do kilkunastu mg/dm3, mikroskładniki (śladowa) poniżej μg/ dm3
Substancje występujące w przeciętnej wodzie rzecznej % / s.s:
Na+ - 6,Ca2+ - 20, Cl- - 6, SO2-4 - 12, CO2-3 (HCO3-) - 35, SiO2 - 12, Pozostałe - 9
Substancje zanieczyszczające wodę mogą występować w formie:
Rozpuszczonej, Koloidalnej ( 1-500nm), Zawiesiny (powyżej 500nm)
W wodach naturalnych znajdują się rozpuszczone gazy - woda pozostaje w kontakcie z atmosfera więc te gazy się rozpuszczają w wodzie, rozpuszczalność zależy od temperatury - im wyższa temp. tym rozp. niższa.
Przeciętny skład opadów atmosferycznych (mg/dm3):
SiO2 - 0,3-1,2; Al. - 0,01; Ca - 0,65-3,3; Mg - 0,2-1,2; Na - 0,6-9,4; K - 0,11-0,6; NH4 - 0,42; HCO3 - 3,7; SO4 - 0,7-2,2; Cl - 0,2-0,17; NO2 - 0,02; NO3 - 0,1-2,2
Toksyczność pierwiastków występujących wodzie:
-Nieszkodliwe: Na, K, Mg, Ca, N ,C, P, Fe, S, Cl, Br, F, Li, Sr, Al., S
-Toksyczne mało rozpuszczalne, rzadko występujące: Ti, Hf, Zr, W, Nb, Ta, Re, La, Os, Rh, Ir, Ru, Ba
-Toksyczne, często występujące: Be, Co, Ni, Cu, Zn, Sn, As, Se, Ag, Cd, Hg, Tl, Pb, Sb
Istotne jest to w jakiej formie te pierwiastki występują. Jeśli jest związany w kompleks to jest mniej toksyczny.
Skład wód powierzchniowych uwarunkowany jest:
1.procesami chemicznymi - duży wpływ mają:
-Kwas-zasada
-Procesy wymiany powietrza atm- woda
-Wytrącania i rozpuszczania ciał stałych (musi być iloczyn rozpuszczalności)
-Reakcje tworzenia kompleksów
-Reakcje redox
-Procesy adsorpcji i desporcji
![]()
Wody mogą zawierać różne substancje kompleksujące: EDTA, ENTA
Wpływ temp na rozpuszczalność: Rozpuszczalność - określa ilość substancji, którą możemy rozpuścić w określonej ilości rozpuszczalnika [w g,ml,itd.]
Temp. wpływa na rozpuszczalność:
- im wyższa temp tym lepiej się rozpuszcza ale nie zawsze
- im niższa temperatura tym lepiej się gaz rozpuszcza (np. tlen w wodzie)
- są substancje w których wraz ze wzrostem temperatury ich rozpuszczalność maleje
- kiedy ciepło rozpuszczania jest ujemne to w wyższej temperaturze rozpuści się więcej
Jeśli ciepło rozp jest dodatnie to przy wzroście temp rozpuszczalność będzie malała
- na rozpuszczalność wywierają wpływ inne substancje zawarte w rozpuszczalniku (np. woda bierze udzial w wietrzeniu skał i erozji; cząsteczki wody wypełniają przestrzeń pomiędzy jonami i w efekcie z dalszej substancji jony substancji zostają wymyte)
- niewolno mylić rozpuszczalności z iloczynem rozpuszczalności
Odczyn wód zalezy od: zaw węglanów i CO2, Rodzaju podłoża na którym wody się znajdują, Rodzaju gleby za zlewni z której pochodzi woda, Zanieczyszczeń odprowadzanych od wód (ścieki, odpady).
Wody powierzchniowe maja pH= 6,5-8,5, rzadko jest przekroczony zakres pH=4-9. -Wody nizinne są na ogół alkaliczne, a wody górskie są z reguły kwaśne. Mocne kwasy -> wysoka stała dysocjacji
Kwasy zawarte w wodach mogą być pochodzenia:
- naturalnego: kw. Węglowy, kw. wodorowęglowy
- z zewnątrz: z zanieczyszczeń, głownie kwasy mocne
Kwaśne deszcze:
SO2 + 1/2O2 -> SO3
SO2 + H2O -> H2SO3 + O2 ->H2SO4
tlenki azotu - przy spalaniu, wyładowaniu atm.
NO2 +O2 -> 2NO2
2NO2 = H2O -> HNO2 + HNO3
Te związki + opady atm. > kwaśne deszcze
Jeśli woda jest niezbuforowana to niewielkie ilości tych związków powoduje zmianę ich składu i pH.
60-70% tych kwasów to kwasy siarkowe, ok. 30% kwasy azotowe
pH ma wpływ na: Zycie biologiczne w wodzie, różne cele gospodarcze
Układ węglanowy:
CO2 gazowy, CO2aq - rozpuszczalne w wodzie,
H2CO3(CO32-) - kwas węglowy,
HCO3- - wodorowęglan. Węglany nierozpuszczalne w wodzie.
Węgiel nieorganiczny - obejmuje wszystkie formy układu węglanowego występującego w przyrodzie. Oznaczanie węgla nieorganicznego - zakwaszenie próbki w wysokiej temp. np. 150 st. C i oznaczenie wydzielonego CO2 (miareczkowo, podczerwień).
Wzrost pH=4-8 powoduje wzrost stężenia jonów HCO3-, od pH= 8-13 wzrasta udział CO32-
Stężenie CO2 w wodzie zależy od tego czy woda ma odczyn alkaliczny czy kwaśny.
Wysoka temp. to większa szybkość reakcji. W wysokich temp. wzrasta szybkość zużycia O2 i CO2 ale spada ich rozpuszczalność w wodzie.
Wyróżniamy wody:
1.alkaliczne. Zasadowość- dotyczy właściwości wody polegającej na tym, że ma ona zdolność do zobojętnienia silnego kwasu. Zasadowość nadają wodzie:HCO3-, CO2, CO32-, krzemiany.
Oznaczanie zasadowości: miareczkowanie silnym kwasem
A.zasadowość wodorotlenowa( trudna do oznaczenia): miareczkujemy do pH=10-11,
H++OH-=H2O pH=10-11
B.zasadowość węglanowa (fenoloftaleinowa) pH=8,3 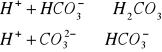
C.zasadowość ogólna (oranży metylowego) pH=4,3 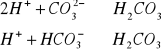
2. Kwasne. Kwasowość - zdolność wody do zobojętnienia silnej zasady: 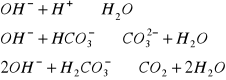
A.kwasowość mineralna, miareczkowanie do pH=4,3 ![]()
B.kwasowość węglanowa, miareczkowanie do pH=8,3 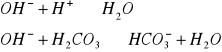
C.Kwasowość ogólna, miareczkowanie do pH= 10-11
Temperatura wód powierzchniowych zależy od: Strefy klimatycznej, Pory roku, Wysokości zbiornika nad poziomem morza, Ruchu wody w zbiorniku -większa amplituda w wodach stojących.
Temperatura wód powierzchniowych waha się od 0 do 30 st. C. Lepiej jest gdy woda jest chłodniejsza, wówczas związki chemiczne wolniej się rozpuszczają.
Mętność wody- spowodowana przez obecność w niej cząsteczek zawieszonych absorbujących promienie słoneczne.
Substancje powodujące mętność:
-Cząstki stałe i gleby, które się znalazły się w wodze w wyniku erozji,
-Osady denne,
-Zawiesiny w ściekach bytowo- gospodarczych,
-Zawiesiny przenoszone z wodami burzowymi,
-Koloidy,
Oznaczanie mętności wody:
a. określenie zawartości zawiesiny, zważenie,
b. obserwowanie warstwy roztworu,
Barwa wody- spowodowania przez: Kontakt wody z odpadami organicznymi (liście, drewno), W wyniku rozkładu ligniny, Ścieki przemysłowe, Obecność żelaza, Obecność planktonu
Oznaczenie barwy wody:
porównuje się ją do wzorca platynowego (chloroplatynian potasu w stężeniu 1mg/dm3).
Przewodność elektrolityczna. Przewodność właściwa [mS/cm] = konduktywność
Twardość wody- pojęcie umowne, określające zawartość w wodzie kationów dwuwartościowych, głownie wapnia i magnezu. Wyróżniamy twardość:
1.Ogólna-całkowita zawartość jonów wapnia i magnezu, a także żelaza, manganu, baru, strontu. W większości wód dominują kationy wapnia i magnezu.
2.Węglanowa (przemijająca)- odpowiada zawartości węglanów i wodorowęglanów wapnia i magnezu w wodzie. „Przemijająca” dlatego gdyż tego typu twardość jest łatwo niwelowana w wyniku ogrzewania, podgrzewania wody,
3.Niewęglanowa- różnica między twardością ogólna i węglanową, określa ona zawartość jonów dwuwartościowych odpowiadających anionom tj, siarczany, azotany.
Sole wapnia i magnezy nie ulegają wypadaniu w czasie gotowania.
Stopnie twardości wody: I.niemiecki, odpowiada 10 mg CaO/ dm3, II.francuski, 1 g węglanu wapnia CaCO3/ 100 dm3, III>brytyjski, 1 g CaCO3/ 70 dm3, IV.amerykański CaCO3/ 1000 dm3
Twardość wód naturalnych: 0,5- 10 mmol/ dm3, zależy od warunków geologicznych zlewni. Twardość niewęglanowa w wielu wodach naturalnych nie występuje, dominująca w wodach nat. jest twardość węglanowa. Wisła 12-17 mmol/ dm3
Znaczenie twardości wody:
Wady: negatywne przy praniu i gotowaniu, względy ekonomiczne- większe zużycie mydła przy twardej wodzie, walory smakowe potraw ulegają pogorszeniu, łatwo powstaje kamień kotłowy na skutek rozkładu wodorowęglanów wapnia i magnezu czy też krzemianów wapnia i magnezu
Zalety: gdybyśmy stosowali wodę destylowana zamiast zwykłej, to byśmy wypłukiwali z organizmu ważne substancje, 3-5 mval/dm3 wody do picia powinny mieć taką twardość.
Woda do picia i celów gospodarczych powinna:
-Nie zawierać substancji toksycznych lub szkodliwych dla zdrowia, ani takich które wywierają wpływ na jej smak,
-Być przezroczysta, bezbarwna, bez zapachu
-Mieć orzeźwiający smak,
-Nie zawierać dużych ilości Fe, Ca, Mg, Cl, azotanów i siarczanów,
-Pozostałość po odparowaniu nie powinna przekraczać 500 mg/l,
-Zawierać w odpowiednich ilościach te substancje, które są potrzebne do normalnego funkcjonowania.
Najlepszymi wodami są wody głębinowe, ale jest ich mało więc korzysta się z wód powierzchniowych, które muszą być uprzednio uzdatniane.Uzdatnianie obejmuje: Klarowanie i filtracja, Usuwanie związków żelaza i manganu- napowietrza się wodę aby wytrącić te pierwiastki, Zmiękczanie, Poprawianie smaku i odkażanie,
Wymagania stawiane wodzie do celów przemysłowych:
Przemysł spożywczy wymaga wody takiej, która się nadaje do picia.
Do robienia sztucznego lodu woda: musi być pozbawiona bakterii termofilnych, nie może być zbyt twarda, nie może być zbyt dużych ilości soli wapnia i magnezu- powodują one zmianę barwy na brązową, żelazo na żółtą, nie może być bakterii chorobotwórczych, zw. trujących- soli bary, rtęci, sodu, cyny,
Cukrownictwo: wody miękkie, mało zw. mineralnych
Przemysł ziemniaczany: wody o niskiej zawartości węglanowej ( do 3 -4 stopni niemieckich) - duża wartość kleikową, sole magnezu pow. wzrost higroskopowości, żelazo powoduje ciemnienie krochmalu
Przemysł browarski: woda do produkcji słodu powinna mieć większą twardość, szkodliwa jest zbyt duża ilość żelaza, powyżej 5 powodują kamienie słodu, żelazo+ garbniki= cierpki smak, zaburzenia w procesie fermentacji
Przemysł gorzelniczy: woda powinna zawierać pierwiastki Ca, K, Mg, Mn, które sprzyjają rozwojowi drożdży, miękka woda negatywnie wpływa na fermentacje, 16 stopni niemieckich- twardość, Siarczan miedzi utrudnia scukrzanie skrobi
Przemysł mleczarski: Woda nie powinna zawierać znacznych ilości soli, Zbyt dużo magnezu nadaje masłu gorzki smak, Żelazo działa katalitycznie- przyspiesza utlenianie tłuszczu
Woda w przemyśle spożywczym używana jest do chłodzenia, ważna jest tu korozyjność, wywołuje ją: Woda, Rozp. w wodzie wolne kwasy nieorganiczne, Tlen, Azotany, Chlorki magnezu i potasu, Substancje organiczne
Jakie warunki powinna spełniać woda do zasilania kotłów parowych wysokoprężnych: Musi być klarowna, pozbawiona zawiesin, Musi być bardzo miękka, Musi być odgazowana- nie zawierać węglanów, Nie powinna mieć odczynu kwaśnego
Sposoby zmiękczania wody:
1.Destylowanie wody (destylarka posiada grzejnik elektryczny, 2 elekrtrody, woda jest grzana,paruje, para się kondensuje), metoda ta jest energochłonna, nie stosowana w przemyśle ze względu na wysokie koszty energi cieplenej
2.Termiczna (już poniżej 40 stopni C), następuje termiczny rozpad wodorowęglanów wapnia i magnezu,
3.Dekarbonizacja Ca(OH)2, HCl:
- wytrącanie skł. Twardości węglanowej:
4.Zmękczanie sodą, stosowane do wód o przeważającej twardość niewęglanowej
5.Metoda „ wapno -soda”, Ca(OH)2 usuwa twardość węglanową, wszystkie sole magnezowe,
NA2CO3 usuwa twardość niewęglanową
6.Zmiękczanie ługiem sodowym, usuwa twardość wapniową niewęglanową magnezową i CO2 rozpuszcza się w wodzie, wtórnie powstająca soda likwiduje twardość wapniową niewęglanową,
7.Zmiękczanie fosforem, nie wymaga ścisłego dozowanie fosforu, 2 krotnie silniejsze reakcje, polega na strącaniu praktycznie nierozp. fosforanów wapnia i magnezu, twardość szczątkowa po procesie jest niewielka, fosforan może reagować z kamieniem kotłowym- zmiękcza wodę i usuwa kamień, w trakcie zmiękczania tworzą się kompleksy, wapń się nie wytrąca, nie powstaje osad, tylko jest on związany w kompleks.
Jonity- substancje praktycznie nie rozpuszczalne w wodzie które wymieniają z roztworem dodatnią lub ujemnie naładowane jony na równoważnej ilości jednoimiennych jonów wchodzących w skład jonitu. Rodzaje: kationy (Kt- wymieniają kationy, np. Na, P- mają charakter kwasów lub ich soli), aniony( A- wymieniają aniony- mają charakter zasad lub ich soli)
Jjonity ze względu na pochodzenie dzielimy na: naturalne (torf, węgiel brunatny, węgle sulfonowane), syntetyczne (wielkocząsteczkowe związki organiczne, otrzymywane syntetycznie, zawierają grupy jonowymienne - żywice)
Ze względu na rodzaj cząsteczki:
I.organiczne: 1.ze względu na kwasowość (stopnie dysocjacji): obojętne lub słabo kwaśne, silnie kwaśne. 2.ze względu na zasadowość: słabo zasadowe, średnio zasadowe, silnie zasadowe
II.nieorganiczne: uwodnione glinokrzemiany, krzemiany metali ciężkich, glaukonity, syliko-żel, fluorofosforany wapniowe, nie są powszechnie stosowane
Właściwości jonitów:
- pęcznienie - zależne od stopnia uwodnienia, rodzaju i gęstości grup funkcyjnych oraz postaci jonowej
- selektywność - potrafią wychwytywać jeden jon
- zdolność jonowymienna - ile masa/ objętość jonitu zdoła zatrzymać jonów [mmol/cm3]
Skala przebicia kolumny - proces wymiany zostaje przerwany po przekroczeniu dopuszczalnego stężenia wycieku
Jonit obsadzony sodem:
2KtNa + Ca(HCO3)2 Kt2Ca + 2NaHCO3
2KtNa + Mg(HCO3)2 Kt2Mg + 2NaHCO3
2KtNa + CaSO4 Kt2 Ca + Na2SO4
2KtNa + MgSO4 Kt2 Mg + Na2SO4
2KtNa + CaCl2 Kt2Ca + 2NaCl
2KtNa + MgCl2 Kt2Mg + 2NaCl
Kt2Ca + 2NaCl 2KtNa + CaCl2
Kt2Mg + 2NaCl 2KtNa + Mg
Uzdatnianie wód:
-mechaniczne- usuwanie zawiesin przez kraty (gałęzie), sita, osadniki, ultrafiltracja
-chemiczne- odżelazianie, octowanie, stabilizacja wody, koagulacja
Koagulacja:
Koloidy:
-liofilowe- ulegają solwatacji (adsorpcji i rozpuszczeniu)
-liofobowe- nie ma solwatacji
Koloidy:
-hydrofilowe- adsorbują na powierzchni cząsteczki wody
-hydrofobowe- nie adsorbują wody
Koloidy posiadają ładunek elektryczny, który jest wynikiem selektywnej adsorpcji. Najlepiej adsorbują się jony wchodzące w skald rozpuszczalnika
Koloidy nadają wodzie mętność i zabarwienie
Do koagulacji wód używa się: wodorotlenki żelaza, wodorotlenki glinu, siarczan glinu, -siarczan glinu 18- wodny, 7-wodny siarczan żelaza (II), 6-wodny siarczan żelaza (III), -glinian
W wodzie naturalnej spotykane koloidy to: cząstki gliny, cząstki iłów, związki humusowe, krzemionka
Koagulacja Al2(SO4)3 * 18H2O
I hydroliza
Al2(SO4)3 + 6H2O ↔ 2Al (OH)3 + 3 H2SO4
II r. wtórna
3H2SO4 + 3Ca(HCO3)2 3CaSO4 + 6CO2 + 6H2O
Sum. Al2(SO4)3 + Ca (HCO3)2 2Al(OH)3 + 3CaSO4+6CO2
Substancje neutralizujące:
Al2(SO4)3 + 6NaOH 2Al(OH)3+ Na2CO3
Al2(SO4)3 +3Na2CO3 2Al(OH)3+3Na2SO4+3CO2
Al2(SO4)3 +3Ca(OH)2 2Al(OH)3 + 3CaSO4
*Koagulacja Na2Al2O4
Na2Al2O4+4H2O↔2Al(OH)3+2NaOH
Na2Al2O4 +Ca(HCO3)2+2H2O CaCO3+Na2CO3+2Al(OH)3
Na2Al2O4 +MgSO4+4H2O Mg(OH)2+ 2Al(OH)3+Na2SO4
Na2Al2O4+CO2+3H2O 2Al(OH)3+Na2CO3
Na2Al2O4+4SiO22NaAl(SiO3)2
2Na2Al2O4+MgSO4MgAl2(SiO3)2+Na2SO4
Wyszukiwarka
Podobne podstrony:
Oczyszczanie gazów Antczak Ściąga nr 2, Studia, Ochrona środowiska
Korozja mikrobioloiczna ściąga moja, Studia, Ochrona środowiska
Oczyszczanie gazów Antczak Ściąga nr 3, Studia, Ochrona środowiska
Gazy Sroczyński ściąga część 2, Studia, Ochrona środowiska
Oczyszczanie gazów Antczak Ściąga nr 1, Studia, Ochrona środowiska
Woda ściąga, Studia, Ochrona środowiska
Technologia remediacji druga ściąga na 2 koło całość, Studia, Ochrona środowiska
Chemia ogólna - egzamin - ściąga3, studia ochrony środowiska, Chemia ogólna
GIS-ściąga, studia ochrony środowiska, GIS Systemy Informacji Środowiskowych, GIS
BIOLOGIA SANITARNA- ściąga, STUDIA (Ochrona Środowiska), IV semestr, Biologia sanitarna
Biopreparaty w oś ściąga z 2 pierwszych wykładów, Studia, Ochrona środowiska
Procesy fermentacyjne piwo i wino ściąga, Studia, Ochrona środowiska
Procesy fermentacyjne gorzelnictwo ściąga, Studia, Ochrona środowiska
Technologia remediacji druga ściąga na 2 koło, Studia, Ochrona środowiska
Procesy fermentacyjne mała ściąga, Studia, Ochrona środowiska
Ścieki ściąga, Studia, Ochrona środowiska
Procesy fermentacyjne duża ściąga, Studia, Ochrona środowiska
Woda wykady, Studia, Ochrona środowiska
Chemia ogólna - egzamin - ściąga1, studia ochrony środowiska, Chemia ogólna
więcej podobnych podstron