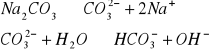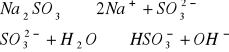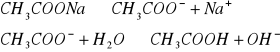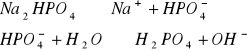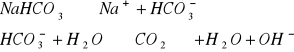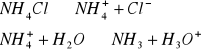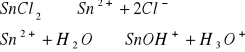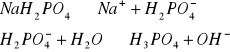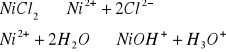Odczyn roztworów wodnych soli
Wykonanie ćwiczenia
Odczyn środowiska w roztworach różnych soli.
W zlewce o pojemności 25 cm3 kolejno rozpuścić łyżeczkę wskazanych przez prowadzącego 5 soli, następnie zmierzyć pH roztworu ( napisać równania kationu jako kwasu lub anionu jako zasady). Wyniki zastawić w tabeli. Wskazać jon niewywierający wpływu na pH.
Wyznaczanie stałej kwasowej.
Przenieść do zlewki na 20 cm3 0,2 M r-ru ZnCl2 i zmierzyć jego pH.
Wpływ stężenia soli na pH roztworu.
Zmierzyć pH 0,1 M i 0,01 M r-ru NH4Cl oraz 0,2 M i 0,02 M r-ru Na2CO3
Opracowanie wyników
L.p |
sól |
pH\ pH zmierzone paskiem |
Równanie kationu jako kwasu lub anionu jako zasady |
|
1 |
|
10,65 / 10 |
|
pKa2 = 7,2 pH = 7 + 0,5*7,2 + 0,5 log0,1 pH = 10,1 |
2 |
|
9,66 / 9 |
|
pKa2 = 7,2 pH = 7 + 0,5*7,2 + 0,5 log0,1 pH = 10,1 |
3 |
|
7,3 / 7 |
|
pKa = 4,75 pH = 7 + 0,5*4,75 + 0,5log0,1 pH = 8,87 |
4 |
|
9,2 / 9 |
|
pKa2 = 7,2 , pKa3 = 12,3 pH = (7,2 + 12,3) / 2 pH = 9,75 |
5 |
|
8,54 / 9 |
|
pKa1 = 6,4 , pKa2 = 10,3 pH = 8,35 |
6 |
|
7,1 / 7 |
KCl → K+ + Cl- |
pH = 7
|
7 |
|
7,2 / 7 |
NaCl → Na+ + Cl- |
pH = 7
|
8 |
|
6,2 / 6 |
|
pKa = 9,2 pH = 0,5 * 9,2 - 0,5log0,1 pH = 5,1 |
9 |
|
2 / 2 |
|
pKa = 3,9 pH = 0,5 * 3,9 - 0,5log0,1 pH = 1,45 |
10 |
|
4,5 / 4 |
|
pKa2 = 7,2 , pKa1 = 2,2 pH = (7,2 + 2,2) / 2 pH = 4,7 |
11 |
|
5,5 / 4 |
|
pKa = 9,3 pH = 0,5 * 9,3 - 0,5log0,1 pH = 5,15 |
Wyznaczanie stałej kwasowej 0,2 M r-ru ZnCl2:
C ZnCl2- 0,2mol/dm3 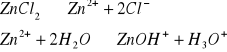
pH=6,54
Korzystamy ze wzoru na pH słabego kwasu: ![]()
Następnie przekształcamy wzór tak aby wyznaczyć pka
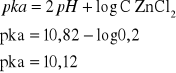
Sprawdzenie wpływu stężenia soli na pH:
0,1 M i 0,01 M r-ru NH4Cl
a) C= 0,1mol/dm3 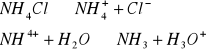
pH=6,54 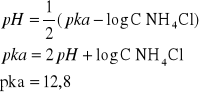
b) C= 0,01mol/dm3 do obliczeń używam powyższego równania
pH=6,46 pka=10,92
2 a) 0,2 M i 0,02 M r-ru Na2CO3
C Na2CO3=0,2 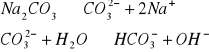
pH=11,8
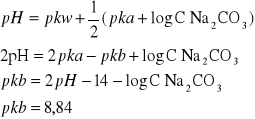
b) C Na2CO3=0,02mol/dm3 do obliczania pkb korzystam ze wzoru podanego powyżej:
pH=11,3
pkb=9,38
Wnioski: Jak widać w punkcie 1 na pH roztworów soli wpływają jony pochodzące ze słabego kwasu lub słabej zasady.
W punkcie 2 wyznaczaliśmy stałą kwasową. Obliczony wynik różni się od wartości podanej w tabelach, która wynosi: pka=9. Nie dokładność wyników może być spowodowana błędnym działaniem phmetru, z którym mieliśmy częste problemy podczas pomiarów.
W toku obliczeń dokonanych w punkcie 3 widać, że stężenie roztworów ma znaczący wpływ na pH roztworu, oraz na wartość pka i pkb
Wyszukiwarka
Podobne podstrony:
291
291
MTB 291
291 296 groborz
Mahabharata Księga V (Udyoga Parva) str 291 345
291 , Praca z osobami niepełnosprawnymi
Hall, Lindzey Teorie osobowości str 291 320(1)
mechanizmy lewopolkulowe id 291 Nieznany
kk, ART 291 KK, I KZP 8/08 - z dnia 30 czerwca 2008 r
kk, ART 291 KK, I KZP 8/08 - z dnia 30 czerwca 2008 r
Mahabharata Księga III (Vana Parva) str 291 366
281 291
290 291 id 32243 Nieznany (2)
Mechanika plynow PYTANIA id 291 Nieznany
Mechanika Techniczna I Skrypt przyklady do rozwiazania id 291
291
kp, ART 291 KP, 2001
Zobowiązania, ART 827 KC, V CSK 291/08 - wyrok z dnia 29 stycznia 2009 r
291
więcej podobnych podstron