V NaCl [ml] |
SEM |
V NaCl [ml] |
SEM |
0 |
0,100 |
17 |
0,070 |
0,5 |
0,096 |
17,5 |
0,068 |
1 |
0,098 |
18 |
0,066 |
1,5 |
0,099 |
18,5 |
0,064 |
2 |
0,099 |
19 |
0,062 |
2,5 |
0,098 |
19,5 |
0,060 |
3 |
0,098 |
20 |
0,057 |
3,5 |
0,097 |
20,5 |
0,053 |
4 |
0,096 |
21 |
0,050 |
4,5 |
0,096 |
21,5 |
0,044 |
5 |
0,095 |
22 |
0,039 |
5,5 |
0,095 |
22,5 |
0,032 |
6 |
0,094 |
23 |
0,020 |
6,5 |
0,093 |
23,2 |
0,011 |
7 |
0,092 |
23,3 |
0,005 |
7,5 |
0,091 |
23,4 |
-0,003 |
8 |
0,091 |
23,6 |
-0,032 |
8,5 |
0,090 |
23,8 |
-0,112 |
9 |
0,089 |
24,0 |
-0,152 |
9,5 |
0,089 |
24,2 |
-0,168 |
10 |
0,088 |
24,4 |
-0,175 |
10,5 |
0,087 |
24,6 |
-0,182 |
11 |
0,086 |
24,8 |
-0,187 |
11,5 |
0,085 |
25 |
-0,191 |
12 |
0,084 |
25,2 |
-0,195 |
12,5 |
0,083 |
25,4 |
-0,198 |
13 |
0,082 |
25,6 |
-0,201 |
13,5 |
0,081 |
25,8 |
-0,203 |
14 |
0,080 |
26 |
-0,205 |
14,5 |
0,078 |
26,5 |
-0,210 |
15 |
0,077 |
27 |
-0,213 |
15,5 |
0,075 |
27,5 |
-0,217 |
16 |
0,073 |
28 |
-0,220 |
16,5 |
0,072 |
|
|
2. Wykonanie ćwiczenia
W roztworach AgNO3 i AgCl zanurzyłam elektrody chlorosrebrowe i pobrany klucz elektrolityczny. Następnie podłączyłam elektrody do miernika napięcia i rozpoczęłam pomiar SEM. Do roztworu AgNO3 dodawałam porcjami roztwór NaCl z biurety najpierw po 0.5 ml a następnie, gdy SEM zaczęła maleć - po 0,2 ml. Mieszałam roztwór po każdym dodaniu i notowałam wartości SEM. Po zmianie wartości SEM na ujemną dodałam jeszcze kilka porcji NaCl po 0,2 ml i 0,5 ml. Po zakończeniu miareczkowania opłukałam elektrody wodą destylowaną i oddałam sprzęt.
3. Tabela pomiarowa
4. Wykres funkcji E=f(VNaCl)
5. Wykres zależności ![]()
6. Obliczenia
Punkt równoważnikowy: 23,8 ml NaCl.
Reakcja zachodzi zgodnie z równaniem:
![]()
Reakcja zachodzi równomolowo:
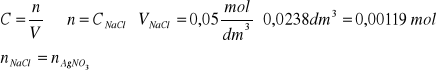
Masa azotanu:
![]()
![]()
Masa ![]()
= 0,202 g
Liczba moli ![]()
7. Wnioski
Liczba moli AgNO3 wynosi 0,00119 mol , punkt równoważnikowy odczytany z wykresu odpowiada 23,8 ml dodanego NaCl.
Stężenie jonów Ag+ w badanej próbce maleje wraz ze wzrostem ilości dodawanego NaCl, gdyż wytrąca się trudno rozpuszczalna sól AgCl, a wraz z tym maleje siła elektromotoryczna ogniwa. Po zakończeniu miareczkowania stężenie jonów Ag+ w badanym roztworze jest mniejsze niż w roztworze nasyconym, a SEM jest ujemna. Reakcja nie może już zachodzić samoistnie w dotychczasowym kierunku.
Wyszukiwarka