XIV. Z ZAKRESU ANALIZY I OCENY JAKOŚCI ŻYWNOŚCI
1. W jaki sposób oznacza się sacharozę w produktach żywnościowych?
(Edyta Szuba)
● Cukry oznaczane bez inwersji → cukry redukujące (bezpośrednio redukujące)
● Cukry oznaczane po inwersji → cukry ogółem = cukry redukujące bezpośrednio + cukry początkowo nieredukujące
● Cukry nieredukujące (sacharoza) = cukry ogółem - cukry redukujące bezpośrednio
Metody chemiczne wykorzystują redukujące właściwości cukrów redukujących oraz nieredukujących po hydrolizie. Własciwościami redukującymi odznaczają się wszystkie cukry proste oraz te kilkocukry, w których występuje wolny hydroksyl półacetylowy, a więc maltoza i laktoza. Chcąc oznaczyć metodami redukującymi cukry złożone, pozbawione właściwości redukujących (jak sacharoza), należy je uprzednio poddać hydrolizie do cukrów prostych.
Właściwości redukujące wykazują również inne związki, np. białka, barwniki, niektóre kwasy organiczne, które zawyżają wyniki oznaczenia zawartości cukrów.
Klarowanie roztworów przeznaczonych do oznaczenia zawartości cukrów przeprowadza się metodą Carreza, stosując dwa płyny: Carreza I - 15% K4Fe(CN)6 i Carreza II - 30% ZnSO4. Po dodaniu do roztworu cukru jednakowych objętości płynów Carreza I i Carreza II zachodzi następująca reakcja:
2 ZnSO4 + K4Fe(CN)6 = Zn2Fe(CN)6↓ + 2 K2SO4
W reakcji powstaje koloidalny heksocyjanożelazian(II) cynku, który opadając na dno, absorbuje związki wielkocząsteczkowe, oczyszczając w ten sposób roztwór.
Do usunięcia substancji przeszkadzających stosuje się najczęściej sole metali ciężkich, np. octan ołowiu(II), azotan(V) rtęci(II), kwas fosforo-molibdenowy, bądź etanol 70% lub aceton.
Do usuwania substancji barwnych używa się węgla aktywnego lub soli ołowiu.
Różnicę między zawartością cukrów ogółem a bezpośrednio redukujących przelicza się na sacharozę, mnożąc przez współczynnik przeliczeniowy (0,95), który jest ilorazem masy molowej sacharozy (342) i mas cząsteczek glukozy i fruktozy (360).
Rozróżnia się inwersję „krótką”, w której ulega hydrolizie wyłącznie sacharoza, oraz inwersję „długą”, w czasie której hydrolizuje maltoza.
Inwersją (hydrolizę) sacharozy najczęściej przeprowadza się metodą Clerget-Herzfelda, która polega na ogrzaniu roztworu sacharozy w środowisku kwasu solnego o stężeniu 0,71 M (do 70 cm3 wyciągu dodaje się 5 cm3 stężonego kwasu solnego), w czasie 5 minut w temperaturze 68-70⁰C. Po hydrolizie należy roztwór ochłodzić, a następnie zobojętnić wodorotlenkiem sodu wobec oranżu metylowego, ponieważ oznaczanie cukrów metodami chemicznymi prowadzi się w środowisku alkalicznym.
Istnieje wiele metod oznaczania cukrów redukujących:
Metoda Bertranda,
Metoda Luffa-Schoorla,
Metoda Lane-Eynona,
Metoda Munsona-Walkera,
Metoda Willstättera,
Metoda Hagedorna-Jensena,
Metody kolorymetryczne.
Metoda Bertranda- polega na przeprowadzeniu w roztworze alkalicznym redukcji soli miedziowych cukrem i oznaczeniu miedzi z wydzielonego tlenku miedzi(I). Oznaczenie miedzi polega na utlenieniu tlenku miedzi(I) w wyniku redukcji soli żelaza(III) do żelaza(II) i na oznaczeniu soli żelaza(II) manganometrycznie. W analizie cukrów redukujących metodą Bertranda badany roztwór gotuje się z mieszaniną roztworów Bertranda I i Bertranda II. Po zmieszaniu roztworu Bertranda I i II zachodzą następujące reakcje:
CuSO4 + 2 NaOH = Na2SO4 + Cu(OH)2
Powstały wodorotlenek miedzi(II) reaguje z winianem potasu i sodu, tworząc rozpuszczalny w wodzie miedziowinian potasu i sodu:
HO-CH-COONa O-CH-COONa
Cu(OH)2 + = Cu + 2 H2O
HO-CH-COOK O-CH-COOK
Roztwór cukru redukującego na gorąco redukuje powstały miedziowinian potasu i sodu do tlenku miedzi(I):
O-CH-COONa OH-CH-COONa
R-CHO + 2 Cu + 2 H2O = R-COOH + Cu2O↓ + 2
O-CH-COOK OH-CH-COOK
Zachodzące reakcje nie mają przebiegu ściśle stechiometrycznego, lecz są uzależnione od warunków, w jakich przebiegają. Dlatego do obliczenia wyniku stosuje się tablice. Po dodaniu roztworu Bertranda III następuje utlenienie miedzi jednowartościowej (Cu+) w Cu2O do miedzi dwuwartościowej (Cu2+) i przejście powstałej soli do roztworu. Jon żelaza(III) jest jednocześnie redukowany do jonu żelaza(II):
Cu2O + Fe2(SO4)3 + H2SO4 = 2 CuSO4 + H2O + 2 FeSO4
Ilość jonów żelaza(II) oznacza się przez miareczkowanie mianowanym roztworem manganianu(VII) potasu:
2 KMnO4 + 10 FeSO4 + 8 H2SO4 = K2SO4 + 5 Fe2(SO4)3 + 8 H2O + 2 MnSO4
Z ilości zużytego do miareczkowania roztworu manganianu(VII) potasu oblicza się ilość miedzi zredukowanej podczas oznaczenia, przyjmuje się, że 1 cm3 0,02 M KMnO4 odpowiada 6,357 mg Cu. Następnie z odpowiedniej tabeli odczytuje się ilość miligramów cukru odpowiadająca ilości miedzi zredukowanej.
Metoda Luffa-Schoorla, podobnie jak Bertranda, wykorzystuje właściwości redukujące cukrów. W metodzie tej zastąpiono wodorotlenek sodu - węglanem sodu, a winian potasu i sodu - kwasem cytrynowym. Ilość zredukowanej miedzi oznacza się pośrednio za pomocą metod jodometrycznych, a zawartość cukrów redukujących odczytuje się z tablic na podstawie ilości tiosiarczanu(VI) sodu zużytego do miareczkowania:
2 CuSO4 + 4 KI = 2 K2SO4 + Cu2I2 + I2
I2 + 2 Na2S2O3 = 2 NaI + Na2S4O6
Metoda Lane-Eynona polega na redukcji na gorąco alkalicznego roztworu soli miedzi(II) przez bezpośrednie miareczkowanie roztworem cukrów redukujących w obecności błękitu metylenowego jako wskaźnika. Błękit metylenowy ulega odbarwieniu w środowisku zasadowym dopiero po całkowitym zredukowaniu miedzi do tlenku, którego osad nadaje roztworowi zabarwienie czerwone. Bardzo ważne w przypadku tej metody jest utrzymywanie mieszaniny w stanie wrzenia podczas miareczkowania. Zawartość cukrów redukujących odczytuje się z tablic.
CuSO4 + 2 NaOH = Na2SO4 + Cu(OH)2
OH-CH-COONa O-CH-COONa
Cu(OH)2 + = Cu + 2 H2O
OH-CH-COOK O-CH-COOK
O-CH-COONa (błękit metylenowy) OH-CH-COONa
R-CHO + 2 Cu + 2 H2O = R-COOH + Cu2O + 2
O-CH-COOK OH-CH-COOK
Metoda Munsona-Walkera jest rozwinięciem metody Lane-Eynona, a modyfikacja polega na oznaczeniu wytrąconego i przesączonego osadu Cu2O przez miareczkowanie manganometryczne lub jodometryczne.
Metoda Willstättera polega na utlenieniu aldoz jodem w środowisku zasadowym. Jod w obecności wodorotlenku sodu utlenia grupę aldehydową cukru:
R-CHO + J2 + 3 NaOH = R-COONa + 2 NaI + 2 H2O
Jod i wodorotlenek dodaje się w nadmiarze. Po utlenieniu cukru i zakwaszeniu środowiska wydziela się wolny jod , który odmiareczkowuje się tiosiarczanem(VI) sodu:
I2 + 2 Na2S2O3 = 2 NaI + Na2S4O6
Na podstawie ilości jodu zużytego do utlenienia cukru oblicza się zawartość aldoz. Ketozy nie reagują z jodem, dlatego metodą Willstättera można oznaczyć glukozę w obecności fruktozy.
Metoda Hagedorna-Jensena polega na reakcji heksacyjanożelazianu(III) z cukrem:
2 K3Fe(CN)6 + R-CHO + 2 KOH = 2 K4Fe(CN)6 + R-COOH + H2O
Nadmiar niezredukowanego heksacyjanożelazianu(III) redukuje się jodkiem potasu:
2 K3Fe(CN)6 + 2 KI = 2 K4Fe(CN)6 + I2
A wolny jod odmiareczkowuje się tiosiarczanem:
(skrobia)
I2 + 2 Na2S2O3 = 2 NaI + Na2S4O6
Metoda kolorymetryczna np. w której wykorzystuje się kwas pikrynowy. Opiera się na redukcji tego kwasu pikrynowego w środowisku zasadowym przez cukry redukujące do kwasu pikraminowego o barwie czerwonej.
Wśród metod fizycznych oznaczania cukrów stosowane są:
a). metody densytometryczne - opierają się na zależności między gęstością cieczy a zawartością w niej cukru. (Przy oznaczaniu sacharoz raczej muszą być czyste roztwory sacharozy).
b). metody refraktometryczne - polegające na pomiarze współczynnika załamania światła
c). metody polarymetryczne - polegają na mierzeniu kąta skręcenia płaszczyzny światła spolaryzowanego przez roztwory cukrów.
d). metody chromatograficzne - badania za pomocą chromatografii gazowej (GC) lub wysokosprawnej chromatografii cieczowej (HPLC). Sacharydy jako związki nielotne, przed oznaczenie za pomocą GC muszą być przeprowadzone w lotne pochodne trimetylosililowe (TMS). W tym celu prowadzi się sililację, używając mieszaniny złożonej z heksametylodisilazanu, trimetylochlorosilanu i pirydyny. Do oznaczenia stosuje się detektor jonizacji płomieniowej (FID). W HPLC do detekcji sacharydów używa się detektora refraktometrycznego (RI). Identyfikację prowadzi się po rozdziale składników próbki na odpowiedniej kolumnie chromatograficznej, biorąc pod uwagę czasy retencji, a ilość poszczególnych cukrów w próbce oblicza się, biorąc pod uwage powierzchnie rozdzielonych pików. Metody te można stosować jeżeli w roztworze nie znajdują się substancje interferujące.
Metody biologiczne polegają na przeprowadzeniu fermentacji alkoholowej poszczególnych cukrów pod wpływem drożdży, a następnie oznaczeniu ilościowym produktów fermentacji, tj. alkoholu lub dwutlenku węgla. Metody fermentacyjne są stosowane na przykład przy określeniu zawartości cukru w surowcach przemysłu fermentacyjnego, przy czym wynik oblicza się często w litrach alkoholu absolutnego, jaką można uzyskać ze 100 kg surowca (wydajność w skali technicznej w stosunku do teoretycznej wynosi w gorzelnictwie średnio 88 - 92% alkoholu).
Metodami fermentacyjnymi można również w przybliżeniu oznaczyć różne rodzaje cukrów występujące w mieszaninie. W tym celu stosuje się różne gatunki drożdży oraz bakterii i pleśni posiadające specyficzne działanie fermentacyjne, co umożliwia odfermentowanie odpowiednich cukrów.
2. Na czym polega oznaczanie białka metodą Kjeldahla?
(Karolina Laskowska i Iwona Kuś)
Metoda KJELDAHLA (1883r) to metoda klasyczna, najczęściej stosowana podczas oznaczania zawartości azotu ogólnego i składa się z trzech etapów:
1. Mineralizacja próbki odbywa się w stężonym H2SO4 (wolnym od azotu) w temp wrzenia tego kwasu. Podczas mineralizacji związki organiczne utlenieniają do ditlenku węgla i wody a zawarty w nich azot wydziela się w postaci amoniaku, tworząc w środowisku kwasu siarczan VI amonu:
2 H2SO4→ 2 SO2 + 2 H2O + O2
COOH
R-CH-NH2 + O2 → x CO2 + y NH3 + z H2O
2 NH3 + H2SO4→ (NH4)2SO4
Mineralizacje przeprowadza się w obecności katalizatorów które mają na celu przyśpieszenie utleniania poprze przenoszenie tlenu z kwasu siarkowego VI do związku organicznego (Hg, Cu, Se, CuO, HgO, CuSO4 ) lub podniesienie temp spalania (K2SO4, Na2SO4). Bardzo dobre efekty daje tzw. mieszanina selenowa (Na2SO4, Hg2SO4, CuSO4,Se).Stosowanie katalizatorów musi być kontrolowane ponieważ może doprowadzić do strat azotu. Spalanie przeprowadza się w kolbach Kjeldahla nad palnikiem gazowym lub w piecu elektr. Mineralizacje uważa się za zakończoną gdy ciecz w kolbie stanie się bezbarwna lub w wypadku stosowania mieszaniny selenowej - zielonkawa.
2. Oddestylowanie amoniaku odbywa się aparacie Parnasa - Wagnera. Po zakończonej mineralizacji odpowiednio rozcieńczoną próbkę przenosi się przez lejek do kolby destylacyjnej aparatu i dodaje się nadmiar 33% wodorotlenku sodu w celu wydzielenia amoniaku
(NH4)2SO4 + 2 NaOH → 2 NH3 + Na2SO4 + 2 H2O
Oddestylowany z parą wodną amoniak przechodzi przez deflegmator i zostaje skroplony w chłodnicy. Wylot chłodnicy powinien być zanurzony w kwasie znajdującym się w odbieralniku w celu ograniczenia strat azotu. W odbieralniku skroplony amoniak jest wiązany w nadmiarze kwasu borowego, siarkowego VI lub solnego w obecności wskaźnika Tashiro (alkoholowy r-r 0,026 % czerwieni metylowej i 0,013% błękitu metylenowego):
NH4OH+ H3BO3 → NH4H2BO3+ H2O lub
NH4OH + HCl → NH4Cl + H2O lub
2 NH4OH + H2SO4 → (NH4)2SO4 + 2 H2O
Destylację z parą wodną kończy się zwykle po 15min, zazwyczaj po oddestylowaniu ok. 150 cm3 roztworu. Po zakończonej destylacji nadzy wyłączyć gaz podgrzewający generator pary wodnej i zamknąć wszystkie zawory. Opróżnienie kolby destylacyjnej do łapacza następuję samoczynnie wskutek różnicy ciśnień
3. Zawartość odbieralnika do którego oddestylowano amoniak miareczkuje się mianowanym r-rem kwasu solnego w wypadku stosowania kwasu borowego lub wodorotlenkiem sodu w przypadku stosowania kwasu solnego lub siarkowego VI. Miareczkowanie odbywa się w obecności wskaźnika Tashiro który w środowisku kwaśnym jest amarantowofioletow a w zasadowym zielony.
NH4H2BO3 + HCl → NH4Cl + H3BO3 lub
HCl + NaOH → NaCl + H2O lub
H2SO4 + 2 NaOH → Na2SO4 + 2 H2O
Miareczkowanie można również przeprowadzić konduktometrycznie lub potencjometrycznie. Oznaczenie ilość azotu stanowi podstawę obliczenia zawartości białka w badanym produkcie. Metodą tą obok połączeń azotowych zawartych w białku mogą również być oznaczone jony amonowe oraz inne związki zawierające grupy amidowe, amidowe, aminowe. Nie są natomiast za jej pomocą oznaczane azotany III i V ani azot zawarty w pierścieniach heterocyklicznych.
Zasada Kjeldahla jest tez wykorzystywana w nowoczesnych urządzeniach analitycznych o wysokim stopniu automatyzacji, które zapewniają bezpieczeństwo i wygodę analizy oraz skracają jej czas. Przykład - aparaty firmy Buchi Labortechnik, Tecator lub Gerhard
3. W jakich oznaczeniach w analizie żywności możemy wykorzystać refraktometr i
polarymetr?
(Marcelina Śmigielska)
Refraktometr
Metoda refraktometryczna znajduje szerokie zastosowanie w przemyśle spożywczym przy oznaczaniu zawartości m.in.: ekstraktu, tłuszczów, cukru i alkoholu.
Metody refraktometryczne opierają się na pomiarze współczynnika załamania światła, który stanowi stosunek prędkości światła w dwóch środowiskach o różnych właściwościach optycznych i jest równy liczbowo stosunkowi sinusów kątów, które tworzą promienie: padający i załamany z prostopadłą do powierzchni granicznej tych środowisk. Najbardziej popularnymi refraktometrami są refraktometr typu Abbego, refraktometr zanurzeniowy (immersyjny) i refraktometr ręczny.
Współczynnik załamania światła zależy od:
długości fali padającego światła,
rodzaju substancji,
stężenia substancji,
temperatury środowiska.
OZNACZENIE ZAWARTOŚCI EKSTRAKTU - na dolnym pryzmacie refraktometru należy umieścić kilka kropli badanego produktu np. soku owocowego i docisnąć pryzmaty. Następnie oświetlić pole widzenia, naprowadzić linie rozgraniczającą jasna i ciemną powierzchnię pola widzenia w sposób odpowiedni dla danego typu refraktometru i odczytać procentowa zawartość sacharozy. Wprowadzić ewentualną poprawkę temperaturową.
OZNACZENIE ZAWARTOŚCI TŁUSZCZU- polega na pomiarze współczynnika załamania światła ekstraktu tłuszczu w odpowiednio dobranym rozpuszczalniku (o współczynniku refrakcji różniącym się znacznie od współczynnika refrakcji tłuszczu). Podstawą do wyznaczenia zawartości tłuszczu jest różnica pomiędzy współczynnikiem refrakcji rozpuszczalnika i badanego ekstraktu. Zawartość tłuszczu oblicza się z odpowiednich wzorów lub odczytuje z tablic.
OZNACZENIE ZAWARTOŚCI ALKOHOLU- następuje przy użyciu refraktometru zanurzeniowego. Zawartość alkoholu (np. w piwie) obliczamy ze wzoru.
Polarymetr
Metody polarymetryczne najczęściej stosowane są do ilościowego oznaczania zawartości skrobi. Wykorzystują one zdolność skręcania płaszczyzny światła spolaryzowanego przez roztwory. Roztwór skrobi skręca płaszczyznę polaryzacji zgodnie ze wzorem Biota:
![]()
gdzie:
c - stężenie badanego roztworu [g/100 cm3]
α - kąt skręcania płaszczyzny polaryzacji światła [stopnie kątowe]
[α]20D - skręcalność właściwa skrobi, tj. kąt o jaki następuje skręcenie płaszczyzny polaryzacji światła przez roztwór skrobi o stężeniu 100g w 100 cm3 roztworu, w rurce o długości 1 dm, przy użyciu światła żółtego
l - długość warstwy roztworu, czyli długość rurki polarymetrycznej [dm]
Skrobia odznacza się wysoką dodatnią skręcalnością właściwą. Jest to związane obecnością w skrobi dużej ilości wiązań α-glikozydowych. Skręcalność właściwa skrobi zależy od rodzaju rozpuszczalnika oraz warunków rozpuszczania skrobi, powodujących jej częściową hydrolizę. Najwyższą skręcalność uzyskuje się przy rozpuszczaniu skrobi na gorąco w stężonym roztworze chlorku wapnia zakwaszonym kwasem octowym. Dla tej grupy metod przyjmuje się wartość skręcalności właściwej +203o.
Nieodzownym warunkiem bezbłędnego wykonania analizy polarymetrycznej jest całkowite rozpuszczenie i wyekstrahowanie skrobi z badanego materiału oraz uzyskanie zupełnie przejrzystego roztworu pozwalającego na prawidłowe dokonanie odczytu na polarymetrze. Ponadto w badanym roztworze oprócz skrobi nie powinny znajdować się inne substancje optycznie czynne.
Pomiarów polarymentrycznych dokonuje się w urządzeniach zwanych polarymetrami. Wykorzystuje się w nich jednobarwne światło monochromatyczne, najczęściej sodowe. Układy optyczne, tzw. nikole (polaryzator i analizator), polaryzuja światło.
Do badania produktów spożywczych stosuje się polarymetry kołowe. Mierzy się w nich kąt, o jaki należy obrócić analizator po wprowadzeniu optycznie czynnej substancji między skrzyżowane nikole, aby ponownie uzyskać obraz pierwotny.
4. Co to jest tłuszcz surowy i jak go oznaczamy?
(Natalia Nykiel)
Tłuszcz surowy - pod tym pojęciem, rozumie się wszystkie składniki produktów żywnościowych, które można wyekstrhowac za pomocą rozpuszczalnika organicznego i które nie są lotne przy suszeniu trwającym 1 godz. w temperaturze 1050C.
W skład tłuszczu surowego wchodzą tłuszcze właściwe, woski, sterydy i ich estry, olejki eteryczne, barwniki i inne związki. Skład tłuszczu surowego zarówno jakościowy jak ilościowy, jest różny i zależy od badanego materiału i użytego rozpuszczalnika. Najczęściej stosowanymi rozpuszczalnikami są eter etylowy, eter naftowy(lub ich mieszaniny), tri chloroetylen, chloroform, tetra chlorek węgla, heksan, benzen, aceton. Ekstrakcja tłuszczu przy użyciu tych rozpuszczalników zachodzi najlepiej w materiale rozdrobnionym. Obecność wody utrudnia ekstrakcję tłuszczu i powoduje przechodzenie do ekstraktu różnych substancji nietłuszczowych. Produkty zawierające dużo białek i węglowodanów należy przed ekstrakcją zhydrolizować.
Metody oznaczania tłuszczów w produktach żywnościowych można podzielić na:
Metody ekstrakcyjno wagowe : dzielimy na periodyczne i ciągłe. Metody periodyczne polegają na wymywaniu tłuszczu porcjami rozpuszczalnika. Metody ekstrakcji ciągłej zasadzają się na wielokrotnej ekstrakcji tłuszczu z produktu w specjalnych aparatach.
Metody ekstrakcyjno-wagowe polegają na wydzieleniu z badanej próbki substancji tłuszczowej za pomocą rozpuszczalnika i oznaczaniu jej wagowo. Do tej grupy metod zalicza się metodę Weibull-Stolda. Polega ona przeprowadzeniu hydrolizy badanej próbki za pomocą kwasu solnego w celu uwolnienia wszystkich substancji tłuszczowych znajdujących się w próbce, oddzieleniu ich od hydrolizatu, wysuszeniu na sączku, wyekstrahowaniu rozpuszczalnikiem i oznaczeniu wagowym.
Metody Rosego- Gottlieba, wg tej metody rozpuszczanie substancji białkowej mleka przeprowadza się za pomocą amoniaku, następnie dokonuje się wyekstrahowaniu tłuszczu uwolnionego z otoczek białkowych, odparowania rozpuszczalnika i w końcu substancje tłuszczowe oznacza się wagowym.
Metoda Schmida-Bądzyńskiego-Ratzlaffa polega na rozpuszczeniu substancji białkowej za pomocą kwasu solnego, wyekstrahowaniu rozpuszczalnikiem uwolnionego tłuszczu, odpędzeniu rozpuszczalnika i oznaczaniu substancji tłuszczowej wagowo.
Metoda Grossfelda - próbkę poddaje się wyekstrahowaniu za pomocą tri chloroetylenu, po uprzedniej hydrolizie kwasem solnym, a następnie po odpędzeniu rozpuszczalnika oznacza się substancję tłuszczową wagowo.
Najbardziej znanym sposobem oznaczania zawartości tłuszczu jest metoda wielokrotnej ciągłej ekstrakcji - metoda Soxhleta - Polega ona na wyekstrahowaniu substancji tłuszczowych z rozdrobnionego i uprzednio wysuszonego produktu za pomocą eteru etylowego, uwolnionego od nadtlenków i pozbawionego wody, lub innego rozpuszczalnika organicznego. Ekstrakcję przeprowadza się w aparacie Soxleta, który dzięki zastosowaniu chłodnicy i lewarka umożliwia przeprowadzenie ekstrakcji ciągłej. Rozpuszczalnik w czasie podgrzewania przechodzi z kolbki boczną rurką do chłodnicy, a po skropleniu ścieka z niej do ekstraktora, w którym znajduje się gilza z odpowiednią rozdrobnioną badaną próbką. Ekstraktor połączony jest lewarkiem z kolbą, wskutek czego jego opróżnienie następuje samoczynnie. Proces ekstrakcji powtarza się w sposób ciągły. Szybkość ekstrakcji powinna być regulowana intensywnością ogrzewania, tak aby opróżnienie naczyńka ekstrakcyjnego następowało co 5- 10 min. Ekstrakcja w aparacie Soxhleta trwa kilka godzin, należy ją uważać za zakończoną, gdy ściekająca z naczynka ekstrakcyjnego kropla cieczy nie pozostawia na płytce szklanej - po odparowaniu- śladów tłuszczu.
Po usunięciu rozpuszczalnika z roztworu tłuszczu zabranego w kolbce tłuszcz suszy się w temperaturze 1050C przez 1 godz. Kolbkę ekstrakcyjną należy przed ekstrakcją wysuszyć i dokładnie zważyć. Substancje tłuszczową w kolbce waży się po wystudzeniu w eksykatorze i na podstawie masy otrzymanego tłuszczu oblicza się jego zawartość w badanej próbce.
Metody ekstrakcyjno-wagowe należą do metod najbardziej czasochłonnych, jednak są uznawane za najdokładniejsze.
Metody objętościowe
Polegają na rozpuszczeniu białek i substancji towarzyszących stężonym kwasem siarkowym(VI) w specjalnych wyskalowanych przyrządach zwanych tłuszczomierzami czyli butyrometrami. W tej grupie najpopularniejsza jest metoda Gerbera. Znalazła ona powszechne zastosowanie w przemyśle mleczarskim i mięsnym. Metoda ta polega na rozpuszczeniu otoczek białkowych emulsji tłuszczu(np. w mleku) za pomocą kwasu siarkowego(VI) i wydzieleniu tłuszczu w przyrządzie zwanym tłuszczomierzem. Otrzymanie tłuszczu w postaci klarownej ułatwia dodatek alkoholu izoamylowego. Wskutek wirowania następuje oddzielenie fazy tłuszczowej od rozpuszczonych w kwasie siarkowym(VI) cząstek mleka. Po odwirowaniu zawartość tłuszczu(w procentach) odczytuje się na skali tłuszczomierza. Do najczęściej stosowanych tłuszczomierzy zalicza się:
Tłuszczomierz Gerbera do mleka, pozwalający zmierzyć zawartość tłuszczu od 0 do 6%, z dokładnością do 0,1 %.
Tłuszczomierz Gerbera - Roedera do śmietany i masła
Tłuszczomierz Kohlera do śmietany (posiadający „0” w górnej skali odwrotnie niż w butyrometrach),
Tłuszczomierz van Gulika do sera
Tłuszczomierz Teicherta do mleka w proszku
Ze skali tłuszczomierza odczytuje się bezpośrednio zawartość tłuszczu. Procent zawartości tluszczu odczytuje się wg menisku dolnego dla mleka pełnego i innych produktów, z wyjątkiem mleka odłuszczonego, dla którego miarodajny jest menisk górny.
Metody ekstrakcyjno - refraktometryczne oznaczania tłuszczu w produktach polegają na pomiarze współczynnika załamania światła(n
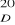
) ekstraktu tłuszczu w odpowiednio dobranym rozpuszczalniku( o współczynniku refrakcji różniącym się znacznie od współczynnika refrakcji tłuszczu). Podstawą do wyznaczania zawartości tłuszczu jest różnica pomiędzy współczynnikiem refrakcji i badanego ekstraktu. Zawartość tłuszczu oblicza się za pomocą odpowiednich wzorów lub odczytuje z tablic.Obecnie coraz częściej stosuje się urządzenia automatyczne do analizy tłuszczu.
5. Na czym polegają i w jakich oznaczeniach są wykorzystywane metody densymetryczne w analizie żywności?
(Agnieszka Kosik)
Metody densymetryczne - są to metody służące do określenia gęstości cieczy.
Do metod densymetrycznych zaliczamy:
- metoda piknometryczna,
- metoda hydrostatyczna,
- metoda areometryczna,
Pomiary areometryczne.
Aerometr jest to szklana rurka, której górna część (trzpień) jest zaopatrzona w skalę, zaś dolna - w postaci bańki szklanej - zawiera balast (np. śrut). Pomiaru dokonuje się, zanurzając aerometr w badanej cieczy i odczytując wskazania na wyskalowanym trzpieniu przyrządu. Ponieważ napięcie powierzchniowe jest zależne od rodzaju roztworu, aerometry cechuje się dla określonej cieczy.
Areometry w analizie żywności najczęściej stosuje się do pomiaru gęstości bezpośrednio w g/cm3 (areometr Gay - Lussaca), gęstości syropu ziemniaczanego, melasy, roztworów ługu sodowego, kwasu siarkowego (VI), chlorku sodu (areometr Baumé), wskazują zawartość sacharozy w roztworach wodnych w procentach wagowych (cukromierze - areometry Ballinga i Brixa), pomiar gęstości moszczu gronowego (areometr Oeschle), określenie gęstości mleka (laktodensymetr), oznaczenie zawartości alkoholu etylowego (alkoholomierze - Trallesa i Richtera)
Pomiary piknometryczne.
Do pomiarów piknometrycznych używa się specjalnych naczyń szklanych - piknometrów. Zasada pomiaru gęstości tą metodą polega na porównaniu masy pewnej objętości roztworu badanego z masą takiej samej objętości wody (cieczy wzorcowej), w tej samej temperaturze. Pomiar gęstości piknometrem sprowadza się do zważenia suchego, pustego piknometru, następnie piknometru napełnionego badanym roztworem o określonej temperaturze (najczęściej 20°C) oraz piknometru napełnionego cieczą wzorcową o takiej samej temperaturze. Piknometrycznie oznacza się gęstość względną badanego roztworu. Gęstość względną należy wyrazić jako gęstość bezwzględną, uwzględniając gęstość cieczy wzorcowej w temperaturze t.
Pomiary piknometryczne są stosowane również d oznaczenia gęstości sproszkowanych ciał stałych.
Pomiar przy użyciu wagi hydrostatycznej.
Zasada pomiaru hydrostatycznego podobnie jak pomiaru areometrycznego opiera się na prawie Archimedesa, zgodnie z którym na ciało zanurzone w cieczy działa siła wyporu skierowana pionowo w górę, równa ciężarowi wypartej cieczy. Znając objętość ciała (v), jego ciężar w powietrzu (G0) i jego ciężar w cieczy (Gc), można wyliczyć gęstość cieczy. Najczęściej stosuje się wagi Mohra-Westphala i Parowa. Waga Parowa służy do oznaczenia skrobiowości ziemniaków.
Zatem metody densymetryczne m.in. :
Są metodą pośrednią oznaczenia wody i słuchaj masy.
Metody densymetryczne polegają na przygotowaniu roztworu podstawowego i zmierzeniu jego gęstości, którą na podstawie specjalnych tablic przelicza się na zawartość ekstraktu. Po oznaczeniu części nierozpuszczalnych oblicza się zawartość wody i suchej masy. Metody te stosowane są do badania produktów, w których jeden składnik (np. cukry) może występować w różnych ilościach (np. marmolady, dżemy, miody).
Metoda fizyczną oznaczenia węglowodanów rozpuszczalnych w wodzie (sacharydów przyswajalnych)
Metody densymetryczne - polegają na pomiarze gęstości wodnych roztworów sacharydów za pomocą areometru lub piknometru i odczytaniu z odpowiednich tablic odpowiadających im zawartości sacharydów w próbce. W przypadku pomiarów w roztworach zawierających oprócz sacharydów inne składniki rozpuszczalne w wodzie, uzyskany wynik odpowiada
ekstraktowi ogólnemu i ma charakter przybliżony.
Oznaczenie zawartości tłuszczu.
Metody ekstrakcyjno-densymetryczne - polegają na wyekstrahowaniu tłuszczu z badanej próbki i oznaczeniu gęstości wyciągu tłuszczowego. Zasada metod polega na zmianie gęstości rozpuszczalnika w zależności od ilości rozpuszczonego w nim tłuszczu. Zawartość tłuszczu odczytuje się z krzywych. Jako rozpuszczalnik najczęściej stosuje się tetrachlorek węgla (bo duża gęstość, mała lotność, dobry rozpuszczalnik tłuszczowy).
6. Zdefiniuj błonnik surowy i podaj sposób jego oznaczania?
(Dorota Ptak)
Błonnik ( włókno surowe występuje we wszystkich produktach roślinnych. Jest to frakcja niestrawnych części pożywienia obejmująca celulozę (polisacharyd zbudowany z reszt glukozowych powiązanych ze sobą wiązaniami β-1,4-glikozydowymi, nie przedstawia żadnej wartości odżywczej ułatwia jedynie trawienie, przez niektórych autorów uważana jest za tzw. czysty błonnik), ligninę, hemicelulozy i pektyny, które nie rozpuszczają się w czasie gotowania z kwasami i ługami w określonych warunkach. Pod pojęciem błonnika pokarmowego rozumie się szkieletową pozostałość ścian komórek roślinnych opornych na hydrolizę enzymatyczną w przewodzie pokarmowym człowieka. Oznaczenie zawartości błonnika ma ma duże znaczenie przy ustalaniu wartości odżywczych poszczególnych produktów żywnościowych, lub gotowych posiłków, ponieważ umożliwia ocenę przydatności poszczególnych diet dla niektórych grup ludności ( dzieci, chorzy, itp.)
Metoda Henneberga-Stohmanna- polega na gotowaniu substancji, w której ma być oznaczony błonnik, z 1,25 - procentowym kwasem siarkowym (VI) i 1,25- procentowym wodorotlenkiem potasu, a nastepnie wagowym oznaczeniu ilości uzyskanego osadu po przemyciu go i wysuszeniu.
Metoda Scharrera -Kűrschchnera- zaleca gotowanie próbki w której ma być oznaczony błonnik z mieszaniną kwasów: octowego, azotowego (V), i trichlorooctowego. Uzyskany osad przemywa się na sączku, suszy w temperaturze 105°C do stałej masy i waży. Następnie sączek z osadem spopiela się w temperaturze 550°C i waży. Oblicza się zawartość błonnika bezpopiołowego. Procentową zawartość błonnika bezpopiołowego (x) oblicza się ze wzoru:
![]()
gdzie:
a- masa błonnika po wysuszeniu (g)
b- masa popiołu w uzyskanym błonniku (g)
c- masa odważonego produktu (g)
7. Scharakteryzuj metody mineralizacji próbek w analizie żywności.
Sposób mineralizacji:
Mineralizacja „na sucho”
Mineralizacja „ na mokro'
Stapianie próbki
Mineralizację „na sucho” (spalanie) prowadzi się w atmosferze tlenu lub powietrza w piecach muflowych (silitowych) lub mikrofalowych. Próbkę umieszcza się w tyglach kwarcowych, porcelanowych lub platynowych. Wstępnie próbkę należy zwęglić nad palnikiem gazowym. Podczas zwęglania następuje utlenienie niektórych pierwiastków do odpowiednich tlenków, część lotna składników ulatnia się w postaci dymów, a sole kwasów organicznych zostają przeprowadzone w węglany. Po zwęgleniu próbkę praży się w wysokiej temperaturze ( 550-600°C), a czasami 900°C- jak w wypadku produktów zbożowych. Spalanie produktów żywnościowych przebiega bardzo różnorodnie i zależy od: składu produktu, stosunku ilościowego składników zasado- i kwasotwórczych, topliwości, lotności soli. Produkty płynne i półpłynne przed spopieleniem należy zagęścić w łaźni wodnej. W celu niedopuszczenia do strat fosforu i chloru można dodać przed mineralizacją substancje alkalizujące np. octan magnezu, a w celu przyspieszenia mineralizacji można w jej trakcje dodać kilka kropli nadtlenku wodoru.
Mineralizacja „ na mokro” polega na utlenieniu substancji organicznych za pomocą mocnych kwasów mineralnych lub mieszanin (HNO3, H2SO4 , HClO4, któreyze względów bezpieczeństwa może być stosowany tylko w mieszaninach), a także z dodatkiem innych substancji utleniających (H2O2, KMnO4, KClO4). Mineralizacja ta zachodzi w stosunkowo niskich temperaturach ( 150-350°C), co stwarza mniejsze ryzyko strat lotnych składników minerlanych. Przeprowadza się ją w kolbach Kjeldahla nad palnikiem gazowym lub w specjalny piecach do mineralizacji „na mokro”.
Zarówno spopielanie jak i mineralizację „na mokro” można przeprowadzać w układach otwartych lub zamkniętych ( bomby teflonowe, piece mikrofalowe). Lepsze efekty dają układy zamknięte ze względu na wyższe ciśnienie, wyższą temperaturę, mniejsze zużycie odczynników, małe ryzyko strat. Ich wadą jest natomiast wysoki koszt urządzeń
Mineralizacja polegająca na stapianiu próbki z substancjami utleniającymi jest rzadko stosowana w analizie żywności.
8. Podaj przykłady oznaczania cech fizycznych żywności.
(Urszula Galemba)
Oznaczanie gęstości
Pomiary areometryczne.
Areometr to szklana rurka, której górna cześć - trzpień jest zaopatrzona w skalę, zaś dolna - w postaci bańki szklanej - zawiera balast np. śrut. Pomiaru dokonuje się, zanurzając areometr w badanej cieczy i odczytując wskazanie na wyskalowanym trzpieniu przyrządu.
Pomiary piknometryczne.
Do tych pomiarów używa się specjalnych naczyń szklanych - piknometrów. Zasada pomairu gęstości tą metodą polega na porównaniu masy pewnej objętości roztworu badanego z masą takiej samej objętości wody (cieczy wzorcowej), w tej samej temperaturze. Pomiar gęstości piknometrem sprowadza się do zważenia suchego, pustego piknometru, piknometru napełnionego badanym roztworem o określonej temperaturze (najczęściej 20°C) oraz piknometru napełnionego cieczą wzorcową o tej samej temperaturze.
Pomiary przy użyciu wagi hydrostatycznej.
Zasada tego pomiaru opiera się na prawie Archimedesa, wg którego na ciało zanurzone w cieczy działa siła wyporu skierowana pionowo ku górze, równa ciężarowi cieczy wypartej. Znając objętość ciała (V), jego ciężar w powietrzu G0 i jego ciężar w cieczy Gc można wyliczyć gęstość cieczy:
![]()
Oznaczanie lepkości
Metody oparte na pomiarze przepływu określonej objętości cieczy przy zastosowaniu wiskozymetrów kapilarnych: Ostwalda, Ubbelohde czy Cannon - Fenske. Pomiar lepkości sprowadza się do zmierzenia czasu przepływu określonej objętości badanej cieczy między punktami a i b.
Metoda oparta na pomiarze czasu opadania kulki o znanej gęstości pomiędzy pierścieniami a i b zaznaczonymi na rurce przy użyciu wiskozymetru Hӧpplera.
Wiskozymetria (reometria) rotacyjna - w metodzie tej stosuje się wiskozymetr Rheotest 2, który służy do wyznaczania krzywych płynięcia lub krzywych lepkości charakteryzujących ciecze nienewtonowskie.
Oznaczanie tekstury
Najprostszymi urządzeniami do badania tekstury są penetrometry. Zasada analizy z ich wykorzystaniem polega na polega na pomiarze stopnia penetracji (deformacji polegającej na wniknięciu elementu pomiarowego w badany materiał) w określonym czasie i temperaturze.
Bardziej uniwersalne są teksturometry np. Instron. Pomiar polega na poddaniu próbki deformacji (zgniataniu, cięciu, penetracji, rozciąganiu) w odpowiednich warunkach i pomiarze powstałego odkształcenia.
9. Omów metody oznaczania zawartości alkoholu w żywności.
(Klos i Kidoń)
Alkohol etylowy w produktach można oznaczyć metodami fizycznymi lub chemicznymi.
METODA FIZYCZNA polega na oddestylowaniu z badanej próbki alkoholu i zmierzeniu zawartości etanolu alkoholomierzem Trallesa lub Richtera albo oznaczeniu gęstości destylatu metodą piknometryczną. Metody te stosowane są jeśli w próbce znajduje się powyżej 1% alkoholu. Oddestylowanie etanolu jest możliwe ze względu na niską temperaturę wrzenia tego związku, która wynosi 78,3 st.C.
METODA CHEMICZNA polega na utlenianiu alkoholu dwuchromianem VI potasu lub manganianem VII potasu. jeśli substancją utleniającą jest K2Cr2O7, alkohol etylowy utlenia się do kwasu octowego w środowisku kwaśnym.
Spośród instrumentalnych metod chemicznych oznaczania alkoholu etylowego można wymienić METODĘ SPEKTROFOTOMETRYCZNĄ, niezbyt czułą jednak pozwalającą na oznaczenie etanolu w obecności ketonów i aldehydów, estrów i kwasów organicznych. Zawartość alkoholu nie może być większa od 0.05%. Metoda polega na wywołaniu reakcji barwnej roztworem azotanu V ceru-amonu i spektrofotometrycznym oznaczaniu zawartości etanolu przy długości fali 475-487 nm.
Ze względu na lotność alkoholu etylowego do oznaczania jego zawartości stosuje się również CHROMATOGRAFIĘ GAZOWĄ, która służy do rozdzielania mieszanin substancji, które w warunkach analizy mają postać par lub gazów.
10. Omów metody sprawdzające wrażliwość sensoryczną kandydatów do panelu
sensorycznego.
(Zgraj Magdalena)
Testy szkoleniowe można podzielić na 3 rodzaje:
-określające pewne słabości kandydatów
-określające wrażliwość sensoryczną
- oceniające potencjalne zdolności kandydatów do opisywania i przekazywania wrażeń sensorycznych.
Przy ocenie predyspozycji i kwalifikacji osób przewidzianych do wykonania analiz sensorycznych należy poddać je testom sprawdzającym ich zdolności z zakresie rozróżniania, definiowania i różnicowania odbieranych wrażeń smakowo-zapachowo-czuciowych.
Wyróżnia się następujące rodzaje testów sprawdzających:
Próba na daltonizm smakowy polega na ocenie zdolności rozpoznawania i definiowania czterech podstawowych smaków: słodkiego, słonego, kwaśnego i gorzkiego, przygotowanych odpowiednio z sacharozy, chlorku sodu, kwasu winowego lub cytrynowego oraz kofeiny lub chlorowodorku chininy.
Próba na określenie progów wrażliwości smakowej polega na dawaniu osobie testowanej próbek roztworów czterech podstawowych smaków w kolejności wzrastających stężeń, bez udzielenia jakichkolwiek informacji odnośnie rodzaju smaku. Zadaniem osoby testowanej jest stwierdzenie wyczuwalności podniety smakowej i jej jakościowa identyfikacja. Za próg wrażliwości smakowej przyjmuje się najniższe stężenie, przy którym osoba poddawana testowi prawidłowo zidentyfikowała rodzaj smaku.
Próba na określenie wartości smakowych progów różnicy może być przeprowadzona metodą testu parzystego, próby trójkątowej, testu dwie z trzech (duo-trio) Wszystkie wyżej wymienione testy mają za zadanie sprawdzenie zdolności osoby testowanej do stwierdzenia różnic w natężeniu bodźca smakowego. Do ustalenia progów różnicy stosuje się wodne roztwory czystych substancji o następujących stężeniach (g w 100cm^3):
-sacharoza 0,8 i 1,1
-chlorek sodu 0,2 i 0,25 lub 0,25 i 0,3
-kwas winowy 0,018 i 0,021
-kwas cytrynowy 0,02 i 0,025
-chlorowodorek chininy 0,00012 i 0,00025
Przypomnienie:
Metoda testu parzystego- polega na podaniu do oceny roztworów bodźcowych o 2 stężeniach w siedmiu powtórzeniach, przy czym w każdej parze występuje próbka słabsza i mocniejsza. Wszystkie próbki podlegają ocenie, na podstawie której oceniający zaznacza na specjalnym blankiecie w każdej parze znakiem(+) numery próbek charakteryzujących się większym natężeniem smaku. W przypadku tej metody za wynik pozytywny przyjmuje się sześć par prawidłowo rozpoznanych na ogólną liczbę siedmiu.
Metoda trójkątowa- podczas oceniania jakości produktu osobie badającej podaje się trzy próbki, z których dwie są identyczne, trzecia zaś odmienna. Oceniający ma wskazać, która próbka jest odmienna, a które identyczne. Aby prawdopodobieństwo przypadkowego odgadnięcia było mniejsze stosuje się serie próbek ( nie mniej niż 7 zestawów) w losowej kolejności. Pomiędzy podawanymi zestawami powinno się stosować przerwy(10-40s), a jeśli oceniane są bodźce bardzo intensywne i ostre, przerwy powinny być dłuższe. W metodzie tej wymagane jest rozpoznanie róznicy bodźca w co najmniej 5 trójkątach na ogólna liczbę 7.
Metoda duo-trio-jest w pewnym sensie poszerzeniem metody parzystej. Innowacja polega na tym, że przed podaniem 2 nieznanych próbek do oceny, podaje się osobie badającą próbkę standardową z poleceniem stwierdzenia, która z dwóch nieznanych próbek jest identyczna ze standardem, a która rózni się od niego.
-------------------------------------------------------------------------------------------------------------
Próba na pamięć smakową ma na celu określenie zdolności do zapamiętywania natężenia smaku roztworów. Polega ona na podaniu osobie testowanej roztworu substancji smakowej o określonym stężeniu i następnie po upływie 3 min ponownym podaniu roztworu o tym samym smaku, ale o stężeniu mniejszym, większym lub takim samym.
Próba na rozpoznawanie i definiowanie zapachów polega na rozpoznawaniu i definiowaniu około dwudziestu podstawowych rodzajów zapachów. Substancje zapachowe dobiera się zgodnie z rodzajem zapachów występujących produktach, które osoba testowana będzie w przyszłości oceniać.
Próba na węchowe progi różnicy podobnie jak w przypadku oceny wrażeń smakowych-polega na ocenie zdolności do stwierdzenia różnic w natężeniu bodźca zapachowego. Test ten najczęściej wykonuje się metodą próby kolejności (ranking test) polegająca na tym, że osoba poddawana badaniu ma na podstawie próby węchowej ustawić prezentowane próby w kolejności wzrastającej intensywności odbieranego wrażenia.
Roztwór Bertranda I : CuSO4 · 5H2O
Roztwór Bertranda II: NaOH + KNaH4C4O6 · 4H2O
Roztwór Bertranda III: Fe2(SO4)3 + H2SO4
Wyszukiwarka