Zadanie I 11
Określić promień cząsteczki tlenu O2 przy założeniu, że ma ona ksztalt kulisty i wiedząc że wartość molowej współobjętości (objętości wyłączonej molowej) w równaniu stanu gazu rzeczywistego van der Waalsa jest równa b=32[![]()
], zaś liczba Avogadra NA=6,022*1023 [![]()
].
Dane: b=32[![]()
], NA=6,022*1023 [mol-1]; Obliczyć: r=![]()
=?
Wyznaczanie objętości cząsteczki w kształcie kuli o średnicy d:
Vcz= 4/3π(![]()
)3
Wyznaczanie objętości wyłączonej dla cząsteczki.
Objętość wyłączona jest objętością w której środki cząsteczek nie mogą się poruszać ze względu na swoją wzajemną obecność i równa jest połowie objętości kuli
o promieniu równym średnicy cząsteczki.
d Vw= 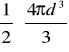
= 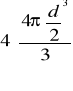
Vw= ![]()
= 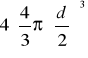
Objętość włączona zasobu ilości materii n=1[mol] cząsteczek (współobjętość molowa) równa jest iloczynowi liczby Avogadra NA i objętości wyłączonej
cząsteczek Vw
b=NAVw[![]()
]
Równanie stanu gazu rzeczywistego van der Waalsa odniesione do masowych gęstości zasobu określone jest związkiem:
(p+![]()
)(ϑ-α)=RT
gdzie:
a - współczynnik kohezyjności masowej
α -współobjętość masowa (kowolumen),
Współczynnik kohezyjności masowej określony jest związkiem
a = ![]()
gdzie:
![]()
- współczynnik kohezyjności molowej
M - masa cząsteczkowa
Ciśnienie kohezyjne określone jest związkiem ![]()
, natomiast współobjętość masowa
jest równa:
α = ![]()
gdzie:
b - współobjętość molowa (objętość wyłączono molowa).
Zatem równanie van der Waalsa zapiszemy w postaci:
[p+ ![]()
](ϑ-![]()
)=RT
Relacja między masową a molową gęstością zasoby objętości określona jest związkiem
ϑ=![]()
stąd:
(p+ ![]()
)( ![]()
-![]()
)=RT
Uwzględniając, iż:
[R] = ![]()
oraz:
MR = B
gdzie:
[B]=![]()
po pomnożeniu przez M
Otrzymamy równanie stanu gazu rzeczywistego van der Waalsa odniesione do molowych gęstości zasobu
(p+ ![]()
)( ϑn -b)=BT
Wyznaczanie promienia cząsteczki tlenu.
Dzieląc objętość wyłączoną molową cząsteczek b przez liczbę Avogarda NA cząsteczek O2 tlenu zawartych w 1 molu tego gazu
Vw= b/NA
Otrzymamy objętość wyłączoną cząsteczki telu O2 określoną związkiem:
Vw= 4[![]()
π(![]()
)3]
Porónując prawe strony powyższych dwóch zależności
b/NA= ![]()
π(![]()
)3
otrzymay promień cząsteczki telnu O2, przy zależności, że ma ona kształt kulisty
r=![]()
=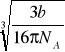
Rachunek mian:
[r] = 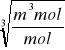
= m
Obliczenie wartości promienia cząsteczki tlenu.
r = ![]()
= 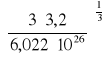
= 2,51445*10-9 [m]
d= 5,0289*10-9 [m] ≈ 5,03 [nm]
d
Wyszukiwarka
Podobne podstrony:
zad. I.27, MiBM WIP PW, inżynierskie, 4 semestr, TERTE, I kolokwium
zad. I.29, MiBM WIP PW, inżynierskie, 4 semestr, TERTE, I kolokwium
zad. I.18, MiBM WIP PW, inżynierskie, 4 semestr, TERTE, I kolokwium
Zad. I.25, MiBM WIP PW, inżynierskie, 4 semestr, TERTE, I kolokwium
Zad. I.09, MiBM WIP PW, inżynierskie, 4 semestr, TERTE, I kolokwium
zad. I.06, MiBM WIP PW, inżynierskie, 4 semestr, TERTE, I kolokwium
zad. I.10, MiBM WIP PW, inżynierskie, 4 semestr, TERTE, I kolokwium
Zad. I.20, MiBM WIP PW, inżynierskie, 4 semestr, TERTE, I kolokwium
zad. I.21, MiBM WIP PW, inżynierskie, 4 semestr, TERTE, I kolokwium
zad. I.30, MiBM WIP PW, inżynierskie, 4 semestr, TERTE, I kolokwium
Zad. I.35, MiBM WIP PW, inżynierskie, 4 semestr, TERTE, I kolokwium
zad. I.16, MiBM WIP PW, inżynierskie, 4 semestr, TERTE, I kolokwium
zad. I.19, MiBM WIP PW, inżynierskie, 4 semestr, TERTE, I kolokwium
zad. I.17, MiBM WIP PW, inżynierskie, 4 semestr, TERTE, I kolokwium
zad. I.14, MiBM WIP PW, inżynierskie, 4 semestr, TERTE, I kolokwium
zad. I.36, MiBM WIP PW, inżynierskie, 4 semestr, TERTE, I kolokwium
zad. I.28, MiBM WIP PW, inżynierskie, 4 semestr, TERTE, I kolokwium
Zad. I.04, MiBM WIP PW, inżynierskie, 4 semestr, TERTE, I kolokwium
zad. I.07, MiBM WIP PW, inżynierskie, 4 semestr, TERTE, I kolokwium
więcej podobnych podstron