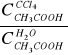sprawozdanie z laboratorium
Ćwiczenie nr 13
TEMAT : Prawo podziału
Pomiar współczynnika podziału kwasu octowego między czterochlorek węgla i wodę
Celem ćwiczenia jest wyznaczenie współczynnika podziału monomeru kwasu octowego pomiędzy fazę czterochlorku węgla i wody kmc oraz wyznaczenie stałej dimeryzacji kwasu octowego w czterochlorku węgla Kdim.
Współczynnik podziału wiąże się z procesem rozpuszczania substancji w układzie dwóch niemieszających się cieczy, rozdzielonych powierzchnia międzyfazową. Rozpuszczalność tej substancji zależy od właściwości fizykochemicznych poszczególnych faz. Stąd też należy oczekiwać, że ilość rozpuszczonego składnika będzie różna w poszczególnych fazach.
Do wykonania ćwiczenia używamy aparatu Bath Shaker. Jest to urządzenie, które jednocześnie termostatuje i wytrząsa badane próbki.
Przed przystąpieniem do ćwiczenia włączamy i ustalamy odpowiednią temperaturę w termostacie. Następnie przystępujemy do przygotowania próbek pomiarowych. W tym celu do pięciu kolbek stożkowych wlewamy po 20 cm3 czterochlorku węgla, poczym do kolbek odmierzamy po 20 cm3 kwasu octowego ( kolejno 1m, 2m ,3m, 4m, 5m)
Po ustaleniu się temperatury w termostacie, umieszczamy w nim kolbki z przygotowanym roztworem i przystępujemy do termostatowania i wytrząsania próbek. Próbki wytrząsamy przez 15 minut, a następnie pozostawiamy je w termostacie na 20 minut w celu dokładnego rozdzielenia faz.
Podczas oczekiwania na rozdzielenie faz przygotowujemy zestaw do analiz. Przemywamy strzykawkę, ustalamy poziom zerowy w biurecie z 0,05 m NaOH. Do pięciu kolbek o pojemności 250 cm3 wlewamy ok. 100 ml wody destylowanej i parę kropel fenoloftaleiny.
Po rozdzieleniu się faz w termostatowanych próbkach przechodzimy do pobierania próbek. Jest to czynność od której w największym stopniu zależy prawidłowość uzyskanych wyników. Próbkę pobieramy za pomocą strzykawki z dolnej warstwy (CCl4), w której stężenie kwasu octowego jest ok. 50 razy mniejsze niż w warstwie górnej (H2O). Pobieramy ok. 2 cm3 roztworu z dolnej warstwy, uważając aby nie zmącić roztworu. Pobraną próbkę wlewamy do uprzednio przygotowanej kolbki o poj. 250 cm3. zawartość kolbki miareczkujemy za pomocą 0,05m roztworu NaOH w obecności fenoloftaleiny jako wskaźnika, aż do chwili uzyskania trwałego różowego zabarwienia, pochodzącego od fenoloftaleiny. Następnie wstrząsamy kolbką i gdy zabarwienie zniknie miareczkujemy tak długo, aż zabarwienie nie będzie znikać pomimo wstrząsania. W analogiczny sposób postępujemy z pozostałymi próbkami.
Wyniki pomiarów zestawiono w tabeli
Nr próbki |
Początkowe stężenie CH3COOH w warstwie wodnej [mol/dm3]
wodnej |
Objętość 0,05m NaOH VNaOH [cm3] (równoważna CH3COOH zawartemu w pobranej próbce warstwy CCl4 o objętości VprCCl4) |
Stężenie CH3COOH w warstwie CCl4
|
Stężenie CH3COOH w warstwie wodnej |
Stosunek stężeń CH3COOH w obu warstwach
|
1 2 3 4 5
|
1 2 3 4 5
|
0,8 2,4 4,8 7,5 11,0
|
0,02 0,06 0,12 0,1875 0,275
|
0,98 1,94 2,88 3,8125 4,725
|
0,02 0,03 0,04 0,05 0,06
|
Wyszukiwarka
Podobne podstrony:
065S~1, 1 STUDIA - Informatyka Politechnika Koszalińska, Labki, fizyka1, fiza, fizyka
051C~1, 1 STUDIA - Informatyka Politechnika Koszalińska, Labki, fizyka1, fiza, fizyka
062C~1, 1 STUDIA - Informatyka Politechnika Koszalińska, Labki, fizyka1, fiza, fizyka
065A~1, 1 STUDIA - Informatyka Politechnika Koszalińska, Labki, fizyka1, fiza, fizyka
063A~1, 1 STUDIA - Informatyka Politechnika Koszalińska, Labki, fizyka1, fiza, fizyka
071B~1, 1 STUDIA - Informatyka Politechnika Koszalińska, Labki, fizyka1, fiza, fizyka
051A~1, 1 STUDIA - Informatyka Politechnika Koszalińska, Labki, fizyka1, fiza, fizyka
el.cw13 - Oświetlenie elektryczne, Politechnika Lubelska, Studia, Studia, Sprawozdanka, ELEKTROTECH
FIZ11 ~1, studia mechatronika politechnika lubelska, fizyka, Fizyka - Sprawozdania poukładane, Fizyk
072I~1, 1 STUDIA - Informatyka Politechnika Koszalińska, Labki, fizyka1, fiza, fizyka
063O~1, 1 STUDIA - Informatyka Politechnika Koszalińska, Labki, fizyka1, fiza, fizyka
ĆW-68-~1, 1 STUDIA - Informatyka Politechnika Koszalińska, Labki, fizyka1, fiza, fizyka
051B~1, 1 STUDIA - Informatyka Politechnika Koszalińska, Labki, fizyka1, fiza, fizyka
021F~1, 1 STUDIA - Informatyka Politechnika Koszalińska, Labki, fizyka1, fiza, fizyka
więcej podobnych podstron