Robert Maniura
Sprawozdanie z ćwiczenia nr B-8: Parachora.
1. Wstęp teoretyczny:
Rezultatem oddziaływań międzycząsteczkowych na granicy rozdziału fazy gazowej i ciekłej jest napięcie powierzchniowe cieczy. Wielkością fizyczną charakteryzującą powierzchnię rozdziału faz jest współczynnik napięcia powierzchniowego. Wartość liczbowa napięcia powierzchniowego jest określona wzorem:
![]()
gdzie: W - praca niezbędna do zwiększenia w procesie izotermicznym pola powierzchni rozdziału faz o S. Jednostką napięcia powierzchniowego w układzie SI jest niuton na metr (N/m).
Wartość napięcia powierzchniowego zależy w istotny sposób od rodzaju substancji i temperatury. Ze wzrostem temperatury napięcie powierzchniowe maleje (zależność ta jest zwykle liniowa), stając się równe zeru w temperaturze krytycznej.
Zdolność do zmniejszania napięcia powierzchniowego nazywa się aktywnością powierzchniową. Substancje wykazujące taką właściwość nazywa się powierzchniowo czynnymi lub powierzchniowo aktywnymi.
Molowa energia powierzchniowa jest to energia napięcia powierzchniowego 1 mola cieczy pod postacią kuli. Pochodna molowej energii powierzchniowej powinna być stała dla wszystkich cieczy i niezależna od temperatury (Eötvös). Wówczas jest zajmowana najmniejsza swobodna powierzchnia:
![]()
gdzie: M- masa molowa [kg/mol]; d- gęstość [kg/m3]
Pochodna energii napięcia powierzchniowego wynosi:
![]()
gdzie: k- stała Eötvösa, równa 2,12.
W cieczach, w których występują wiązania wodorowe (asocjacja) wartość k jest mniejsza od 2,12.
Parachora łączy zależność między gęstością i napięciem powierzchniowym cieczy.
![]()
gdzie; c- stała dla danej substancji; dc- gęstość cieczy [kg/m3]; dp- gęstość pary [kg/m3]
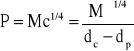
dp jest mała w porównaniu z dc - można ją ominąć. Wtedy:
![]()
gdzie: V- objętość molowa cieczy [m3/mol]
Parachora wykazuje właściwości addytywne. Do całkowitej wartości parachory swój wkład wnoszą poszczególne atomy, wiązania i ugrupowania atomów.
Opracowanie wyników:
Celem ćwiczenia jest wyznaczenie napięcia powierzchniowego czystej cieczy i sprawdzenie reguły addytywności parachory.
Pomiaru napięcia powierzchniowego dokonuję za pomocą stalagmometru. Pomiar polega na zmierzeniu liczby kropli, które wypływają z objętości zawartej między kreskami pomiarowymi stalagmometru dla badanej cieczy i wody. Napięcie powierzchniowe wyznacza się z odpowiedniego równania. Gęstość badanej cieczy wyznacza się za pomocą piknometru. Na podstawie znalezionego napięcia powierzchniowego oblicza się wartość parachory.
Gęstość metanolu wyznaczona metodą piknometryczną:
![]()
gdzie: d - gęstość metanolu [g/cm3]; ms - masa piknometru wypełnionego metanolem [g]; mw - masa piknometru wypełnionego wodą [g]; m0 - masa pustego piknometru [g]; dH2O - gęstość wody w temperaturze pomiaru [g/cm3] - w 18 °C wynosi 0,99843 g/cm3.
![]()
Gęstość metanolu wynosi 0,79469 g/cm3 = 794,69 kg/m3.
Błąd wyznaczenia gęstości metanolu obliczony metodą różniczki zupełnej:
![]()
gdzie: mm - masa metanolu w piknometrze [kg]; mw - masa wody w piknometrze [kg]; dw - gęstość wody w temperaturze pomiaru [kg/m3];
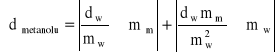
gdzie: mw = 0,1*10-3 kg; mm = 0,1*10-3 kg; dw = 998,43 kg/m3; mw = 3,3314*10-3 kg; mm = 2,6516*10-3 kg;
db = 53,82 kg/m3
Gęstość metanolu wynosi 794,69 ± 53,82 kg/m3.
Napięcie powierzchniowe metanolu przedstawia następujący wzór:
![]()
gdzie: Z - ilość kropel; d - gęstość (kg/m3); σ - napięcie powierzchniowe (N/m); w - woda; m - metanol.
Do powyższego wzoru wstawiam następujące dane: Zm = 69,14; Zw = 28,14; σw = 72,75*10-3 N/m; dw = 998,43 kg/m3; dm = 794,69 kg/m3
![]()
Błąd wyznaczonego napięcia powierzchniowego:
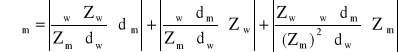
gdzie: Zm = 69,14; Zw = 28,14; σw = 72,75*10-3 N/m; dw = 998,43 kg/m3; dm = 794,69 kg/m3; Zw = 1; Zm = 1; dm = 53,82 kg/m3.
σm 2,80*10-3 N/m
Napięcie powierzchniowe wynosi σm = 23,57*10-3±2,80*10-3 N/m.
Molowa energia powierzchniowa dla metanolu w oparciu o znalezione napięcie powierzchniowe i gęstość:
![]()
gdzie: σm = 23,57*10-3 N/m; Mm = 32,04*10-3 kg/mol; dm = 794,69 kg/m3
Po podstawieniu do równania:
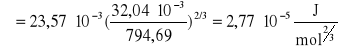
Błąd wyznaczenia molowej energii powierzchniowej:
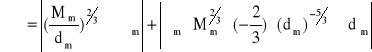
gdzie: Mm = 32,04*10-3 kg/mol; σm = 23,57*10-3 N/m; σm = 2,80*10-3 N/m; dm = 794,69 kg/m3; dm = 53,82 kg/m3
= 0,20*10-5 J/mol2/3
Molowa energia powierzchniowa wynosi: = 2,77*10-5 ± 0,20*10-5 J/mol2/3.
Pochodna molowej energii powierzchniowej względem temperatury powinna być stała dla wszystkich cieczy i niezależna od temperatury.
![]()
W temperaturze krytycznej TK napięcie powierzchniowe zanika całkowicie. Całkując powyższe równanie dostaje się zależność:
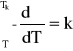
; = k (Tk - T) gdzie: Tk - temperatura krytyczna metanolu = 513,15 K; T- temperatura pomiaru = 291,15 K; - molowa energia powierzchniowa.
Ponieważ zanik napięcia powierzchniowego następuje w temperaturze o kilka stopni niższej od temperatury krytycznej lepiej jest spełniona zależność:
= k(Tk - T - 6)
skąd stała k wynosi:
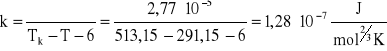
Błąd stałej równania Eötvösa:
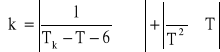
gdzie: T = 1 K; = 0,20*10-5; TK = 513,15 K; = 2,77*10-5 J/mol2/3; T = 291,15 K
Dk = 0,10*10-7
Stała Eötvösa k = 1,28*10-7±0,10*10-7[J/(mol2/3*K].
Obliczona wartość parachory na podstawie wyznaczonego napięcia powierzchniowego oraz gęstości metanolu:
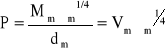
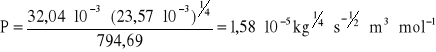
Błąd wyznaczenia parachory:
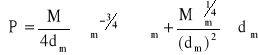
; M = 32,04*10-3 kg/mol; σm = 23,57*10-3 N/m; σm = 2,80*10-3 N/m; dm = 794,69 kg/m3; dm = 53,82 kg/m3
P = 0,20*10-5[kg1/4 * s-1/2 * m3 * mol-1]
Wartość parachory P = 1,58*10-5 ± 0,20*10-5 [kg1/4 * s-1/2 * m3 * mol-1].
Wartość parachory obliczona teoretycznie na podstawie addytywności. Cząsteczka metanolu zawiera:
1 atom węgla
3 atomy wodoru
1 grupa wodorotlenowa
P = 1*PC + 3*PH + 1*POH; gdzie: PC =0,85 * 10-6[kg1/4 * s-1/2 * m3 * mol-1]; PH = 3,04*10-6[kg1/4 * s-1/2 * m3 * mol-1]; POH = 5,74*10-6[kg1/4 * s-1/2 * m3 * mol-1];
P = 0,85*10-6 + 3*3,04*10-6 +5,74*10-6 = 1,571*10-5[kg1/4 * s-1/2 * m3 * mol-1]
Zestawienie wyników pomiarów i obliczeń dla metanolu:
L.p. |
Wielkość i jednostka |
Wartość |
Błąd |
1 |
Masa molowa [kg/mol] |
32,04*10-3 |
--- |
2 |
Gęstość [kg/m3] |
794,69 |
53,82 |
3 |
Napięcie powierzchniowe [N/m] |
23,57*10-3 |
2,80*10-3 |
4 |
Temp krytyczna [K] |
513,15 |
--- |
5 |
Molowa energia powierzchniowa [J/mol2/3] |
2,77*10-5 |
0,20*10-5 |
6 |
Stała Eötvösa [J/(mol2/3*K)] |
1,28*10-7 |
0,10*10-7 |
7 |
Parachora wyznaczona [kg1/4 s-1/2 m3 mol-1] |
1,58*10-5 |
0,20*10-5 |
8 |
Parachora obliczona [kg1/4 s-1/2 m3 mol-1] |
1,571*10-5 |
--- |
4. Wnioski:
Wyznaczona doświadczalnie wartość parachory jest w dobrej zgodności z wartością parachory wyznaczonej teoretycznie na podstawie parachor atomowych. Powstałe rozbieżności pomiędzy wynikami uzyskanymi doświadczalnie a wynikami uzyskanymi w obliczeniach teoretycznych mogły być spowodowane niedokładnościami związanymi z ważeniem podczas wyznaczania gęstości przy pomocy piknometru. Innym źródłem niedokładności mogły być błędy związane z liczeniem wypływających kropli, a także z niedokładnościami odmierzania objętości cieczy. Na podstawie uzyskanych wyników doświadczenia, i ich zgodności z wartością parachory wyznaczonej teoretycznie można potwierdzić, iż parachora jest wielkością addytywną, i można ją rozłożyć na składowe pochodzące od poszczególnych atomów, wiązań czy szczególnych ugrupowań atomowych.
5. Literatura:
Kazimierz Gumiński „Wykłady z chemii fizycznej”.
Witold Mizerski „Tablice chemiczne”.
Kalendarz chemiczny.
1
Wyszukiwarka
Podobne podstrony:
Prawo inżynierskie i ochrona własności intelektualnych. Wykład 3, Studia, Politechnika Łódzka - Pend
Testy biodegradacji, Studia, Politechnika
Chf9, Studia, Politechnika
Wyznaczanie stałej reakcji szybkości zmydlania estru, Studia, Politechnika
CH.F.L9, Studia, Politechnika
ZAKAAD CHEMI FIZYCZNEJ, Studia, Politechnika
C15, Studia, Politechnika
podstawowe informacje o ochronie prawnej wzorów przemysłowych, Studia - Politechnika Śląska, Zarządz
Sprawko spawalnictwo 1, studia, studia Politechnika Poznańska - BMiZ - Mechatronika, 2 semestr, obro
dziadek25, Studia, Politechnika
4 2 vademecum echosondy (w tym przykładzie wodnej), studia, studia Politechnika Poznańska - BMiZ - M
LABORKA7, Studia, Politechnika
Wyznaczanie stopnia asocjacji kwasu octowego w rozpuszczalni, Studia, Politechnika
deacon1, Studia, Politechnika
Destylacja wojtek, Studia Politechnika Poznańska, Semestr I, Chemia, Chemia laboratoria, Destylacja
Liczby przenoszenia jonów, Studia, Politechnika
103, Studia Politechnika Poznańska, Semestr II, I pracownia fizyczna, LABORKI WSZYSTKIE, FIZYKA 2, F
poprawione7, Studia, Politechnika
CHEMIA~7, Studia, Politechnika
więcej podobnych podstron