ZAKŁAD CHEMII FIZYCZNEJ
![]()
Ćwiczenie nr 7
Temat: Adsorbcja na granicy faz roztwór-gaz. Izoterma adsorbcji GIBBSA
Wykonali:
Matusiak Jacek
Kosowski Patryk
Właściwością odróżniającą ciecz od gazu jest napięcie powierzchniowe. Napięcie międzyfazowe warunkuje spójność cieczy i powstanie powierzchni międzyfazowej ciecz-gaz.
Cząsteczka znajdująca się wewnątrz fazy ciekłej jest mniej więcej równomiernie otoczona przez inne cząsteczki, a siły z jakimi one na nią oddziaływują praktycznie kompensują się, więc ich wypadkowa równa jest zeru. Cząsteczki, które leżą na graniczącej z fazą gazową powierzchni cieczy ulegają oddziaływaniu cząsteczek z wnętrza cieczy. Dzieje się tak, ponieważ oddziaływanie cząsteczek powierzchniowych z cząsteczkami gazu nad powierzchnią są znikomo małe w porównaniu z siłami oddziaływania z cząsteczkami cieczy. Powoduje to, ze każda cząsteczka cieczy znajdująca się w warstwie powierzchniowej doznaje jednostronnego przyciągania od strony cząsteczek cieczy, a wypadkowa sił działa prostopadle do powierzchni i jest skierowana do wnętrza cieczy, a więc cząsteczka cieczy w warstwie powierzchniowej znajduje się pod działaniem sił wciągających ja do wnętrza cieczy. W skutek tego działania obok ciśnienia wewnętrznego występuje zjawisko napięcia powierzchniowego.
Napięcie powierzchniowe σ jest to zmniejszenie potencjału termodynamicznego układu G towarzyszące zmniejszeniu się jego powierzchni A o jednostkę 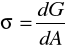
lub siła styczna do powierzchni potrzebna do rozerwania błonki powierzchniowej na długości jednostkowej. Wymiar tej wielkości jest J/m2 lub N/m.
Istnieje szereg metod pomiaru napięcia powierzchniowego, które można podzielić na statyczne i dynamiczne. Najbardziej dogodne do oznaczania napięcia powierzchniowego cieczy i roztworów są następujące metody:
kapilarnego wzniesienia,
kroplowa,
-pęcherzykowa,
Wilhelmy'ego,
profilu leżącej kropli.
Szczegółowe rozważania dotyczące adsorpcji na granicy faz roztwór-gaz przeprowadził Gibbs. Równanie Gibbsa zwane izotermą adsorpcji ustala zależność między nadmiarem powierzchniowym zaadsorbowanych cząsteczek (jonów) i- tej substancji (Гi), jej potencjałem chemicznym (μi) oraz napięciem powierzchniowym (σ). Równanie izotermy Gibbsa w stałej temperaturze i przy stałym ciśnieniu ma postać:
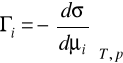
Metoda pęcherzykowa polega na powolnym wdmuchiwaniu pęcherzyków powietrza do badanej cieczy za pomocą kapilary, której wylot znajduje się pod powierzchnią cieczy. Względne pomiary napięcia prowadzi się używając jako cieczy wzorcowej wody. W metodzie tej posługuje się zależnością:
![]()
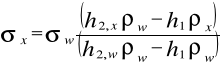
Stęż.C2H5OH (% wag.) |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
Ciśn. manom. pm (mmH2O) |
87,3 |
65 |
58,67 |
55,67 |
48,67 |
49,33 |
47,33 |
45 |
44 |
Napięcie pow. (N/m) |
0,07244 |
0,04729 |
0,04092 |
0,03793 |
0,03128 |
0,03109 |
0,03017 |
0,02815 |
0,02767 |
Obliczanie napięcia powierzchniowego:
ρw-gęstość wody (kg/m3)
ρx -gęstość badanej cieczy (kg/m3)
h2x -różnica poziomów wody w ramionach manometru, gdy badamy roztwór alkoholu (m)
h2w - różnica poziomów wody w ramionach manometru, gdy badana cieczą jest woda (m)
h1 - głębokość zanurzenia kapilary (m)
σw - napięcie powierzchniowe wody (N/m)
σx - napięcie powierzchniowe badanej cieczy (N/m)
Pomiar został wykonany w temp. 22˚C i dla tych warunków przyjmujemy:
σw = 0,07244 N/m
ρw = 998 kg/m3
h1 = 23*10-3 m
h2,w = 87,33 * 10-3 m
np.
![]()
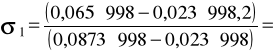
0,04729
Obliczanie aktywności alkoholu etylowego:
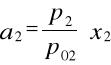
gdzie:
p2 - prężność alkoholu nad jego roztworem wodnym
p02 - prężność alkoholu nad czystym etanolem
Lp. |
Stęż. C2H5OH (% wag.) |
X1 |
X2 |
ρ (g/cm3) |
p2 (mmHg) |
a2 |
σ (N/m) |
|
z (10-3) |
Γ2(10-6) (mol/m2) |
1 |
0 |
1,00 |
0 |
0,998 |
0 |
0 |
0,07244 |
|
0 |
0 |
2 |
10 |
0,958 |
0,042 |
0,982 |
6,7 |
0,00645 |
0.05167 |
-9,33 |
28 |
2,04 |
3 |
20 |
0,911 |
0,089 |
0,969 |
12,6 |
0,02572 |
0,04092 |
-2,4 |
24 |
1,76 |
4 |
30 |
0,857 |
0,143 |
0,954 |
17,1 |
0,05608 |
0,03793 |
-1,05 |
23 |
1,63 |
5 |
40 |
0,794 |
0,206 |
0,935 |
20,7 |
0,0978 |
0,03128 |
-0,56 |
22 |
1,53 |
6 |
50 |
0,719 |
0,281 |
0,914 |
23,5 |
0,15146 |
0,03109 |
-0,34 |
21 |
1,48 |
7 |
60 |
0,631 |
0,369 |
0,891 |
25,6 |
0,21666 |
0,03017 |
-0,23 |
20 |
1,42 |
8 |
70 |
0,524 |
0,476 |
0,868 |
28,0 |
0,30569 |
0,02815 |
-0,16 |
19 |
1,38 |
9 |
80 |
0,391 |
0,609 |
0,843 |
31,2 |
0,4358 |
0,02767 |
-0,08 |
13 |
1,33 |
Przykład obliczania nadmiarów powierzchniowych metodą analityczną:
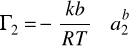
k=0,03
b=-0,1
R=8,31438 J/mol*K
T=295,15 K
a2=0,02572
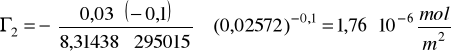
Przykład obliczania nadmiarów powierzchniowych metodą graficzną:
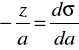
![]()
a2=0,00645
z=0,028 (w jednostkach napięcia powierzchniowego J/m2)
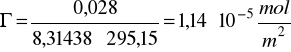
Porównanie wyników uzyskanych metodą graficzną i analityczną:
Lp. |
Stęż.C2H5OH (%wag.) |
Γ2(10-6mol/m2) (m. analityczna) |
Γ (10-5 mol/m2) (m. graficzna) |
1 |
0 |
0 |
0 |
2 |
10 |
2,04 |
1,14 |
3 |
20 |
1,76 |
0,98 |
4 |
30 |
1,63 |
0,94 |
5 |
40 |
1,53 |
0,90 |
6 |
50 |
1,48 |
0,86 |
7 |
60 |
1,42 |
0,82 |
8 |
70 |
1,38 |
0,78 |
9 |
80 |
1,33 |
0,53 |
1
Wyszukiwarka
Podobne podstrony:
Prawo inżynierskie i ochrona własności intelektualnych. Wykład 3, Studia, Politechnika Łódzka - Pend
Testy biodegradacji, Studia, Politechnika
Chf9, Studia, Politechnika
Wyznaczanie stałej reakcji szybkości zmydlania estru, Studia, Politechnika
CH.F.L9, Studia, Politechnika
ZAKAAD CHEMI FIZYCZNEJ, Studia, Politechnika
C15, Studia, Politechnika
podstawowe informacje o ochronie prawnej wzorów przemysłowych, Studia - Politechnika Śląska, Zarządz
Sprawko spawalnictwo 1, studia, studia Politechnika Poznańska - BMiZ - Mechatronika, 2 semestr, obro
dziadek25, Studia, Politechnika
4 2 vademecum echosondy (w tym przykładzie wodnej), studia, studia Politechnika Poznańska - BMiZ - M
LABORKA7, Studia, Politechnika
Wyznaczanie stopnia asocjacji kwasu octowego w rozpuszczalni, Studia, Politechnika
deacon1, Studia, Politechnika
Destylacja wojtek, Studia Politechnika Poznańska, Semestr I, Chemia, Chemia laboratoria, Destylacja
Liczby przenoszenia jonów, Studia, Politechnika
103, Studia Politechnika Poznańska, Semestr II, I pracownia fizyczna, LABORKI WSZYSTKIE, FIZYKA 2, F
poprawione7, Studia, Politechnika
CHEMIA~7, Studia, Politechnika
więcej podobnych podstron