WPŁYW TEMPERATURY NA SZYBKOŚĆ REAKCJI CHEMICZNEJ |
ĆW.13. |
Cel ćwiczenia
Zależność stałej szybkości reakcji, k od temperatury wyraża równanie Arrheniusa: ![]()
, gdzie Ea to energia aktywacji reakcji chemicznej, R to stała gazowa, T - temperatura bezwzględna. Współczynnik przedwykładniczy A wyraża częstość zderzeń elementarnych. Równanie wskazuje, że stała szybkości reakcji k jest wprost proporcjonalna do częstości zderzeń. Ze względu na ujemny znak wykładnika potęgi (-Ea/RT) stała szybkości k zmniejsza się ze wzrostem energii aktywacji reakcji chemicznej oraz wzrasta ze wzrostem temperatury układu. Celem ćwiczenia jest wykazanie, że szybkość reakcji wzrasta ze wzrostem temperatury na przykładzie reakcji rozkładu tiosiarczanu(VI) sodu, przebiegającej zgodnie z równaniem: S2O32- + 2H+ ↔ H2O + SO2 + S
Odczynniki:
► 0,25 M tiosiarczan(VI) sodu, Na2S2O3
► 1,0 M kwas siarkowy(VI), H2SO4
Sprzęt laboratoryjny:
► probówki z podziałką
► termometr
► stoper
► zlewka o pojemności 250 cm3
Wykonanie ćwiczenia:
Ćwiczenie obejmuje pomiary szybkości reakcji chemicznych zachodzących w trzech różnych temperaturach.
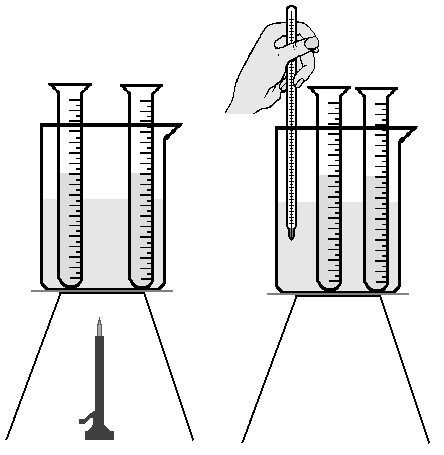
Pierwszy pomiar należy wykonać w temperaturze pokojowej. Do pierwszej probówki wlej 10 cm3 0,25 M roztworu tiosiarczanu(VI) sodu, Na2S2O3, a do drugiej - 1 cm3 1 M roztworu kwasu siarkowego(VI), H2SO4. Roztwory zmieszaj ze sobą wlewając szybkim ruchem roztwór kwasu do probówki z roztworem tiosiarczanu(VI) sodu.
Stoperem zmierz czas od chwili zmieszania roztworów do chwili wystąpienia opalescencji związanej z powstawaniem siarki koloidalnej.
Drugi pomiar należy prowadzić w temperaturze o 10˚C wyższej. W tym celu zlewkę o pojemności 250 cm3 napełnij do 2/3 wodą i ustaw nad włączonym palnikiem, jak pokazuje rysunek i ogrzewaj, aż temperatura wody wzrośnie o 10˚C w porównaniu z temperaturą otoczenia.
Wlej 10 cm3 0,25 M tiosiarczanu(VI) sodu do pierwszej probówki, a do drugiej 1 cm3 1 M kwasu siarkowego(VI). Probówki z roztworami umieść w zlewce z ogrzaną wodą, odczekaj 10 - 15 minut, aby roztwory uzyskały temperaturę kąpieli wodnej. Następnie zmieszaj roztwory i zmierz czas do chwili pojawienia się opalescencji.
Trzeci pomiar wykonaj analogicznie jak drugi, zwiększając temperaturę o kolejne 10˚C.
Zanotuj czasy i temperaturę reakcji.
Obliczenia:
Za miarę szybkości reakcji przyjmujemy odwrotność czasu jej całkowitego przebiegu V~1/t. Wzór van΄t Hoffa określa wpływ temperatury na szybkość reakcji: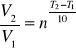
gdzie: V1- szybkość reakcji w temp. T1
V2- szybkość reakcji w temp. T2
n - współczynnik temperaturowy reakcji.
Najczęściej wzrost temperatury o 10˚C podwaja szybkość reakcji, o ile nie ma odstępstwa od reguły van't Hoffa. Z danych doświadczalnych wylicz współczynnik temperaturowy badanej reakcji, biorąc pod uwagę pomiar 1 i 2 oraz 2 i 3. Wylicz wartość średnią współczynnika temperaturowego.
Wyniki:
Pomiar |
Temperatura [˚C] |
Czas reakcji [s] |
Szybkość reakcji [1/s] |
Współczynnik temp. reakcji, n |
Wartość średnia, nśr |
1 |
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
Dyskusja:
Wyjaśnij, dlaczego wzrost temperatury powoduje wzrost szybkości reakcji.
Wyszukiwarka
Podobne podstrony:
10 ZALEŻNOŚĆ STAŁEJ SZYBKOŚCI REAKCJI OD TEMPERATURY
6 Zależność stałej szybkości reakcji od temperatury
Ad 8 Zależność stałej równowagi reakcji od temperatury
zaleznosc stalej szybkosci reakcji od temp
Zależność stałej równowagi reakcji od temperatury sprawozdanie, Politechnika Poznańska, Laboratorium
zaleznosc stalej szybkosci reakcji od temp (2)
Zależność stałej równowagi reakcji od temperatury sprawozdanie 2, Politechnika Poznańska, Laboratori
Zależność stałej równowagi reakcji od temperatury sprawozdanie 3
Ad 8 Zależność stałej równowagi reakcji od temperatury
Ad 8 Zależność stałej równowagi reakcji od temperatury
Ćw 7 Zależność stałej równowagi reakcji od temperatury
zaleznosc stalej szybkości reakcji od temp
zadania3-wplyw temperatury na szybkosc reakcji
WPŁYW TEMPERATURY NA SZYBKOŚĆ REAKCJI, NAUKA, chemia, lab
Od czego zależy szybkość reakcji chemicznych
zadania3 wplyw temperatury na szybkosc reakcji
ZALEŻNOŚCI FUNKCYJNE SZYBKOŚĆI REAKCJI CHEMICZNYCH OD PARAMETRÓW STANU UKŁADU REAKCYJNEGO
więcej podobnych podstron