PAWEŁ WETKLO
RAFAŁ KMIECIK
ĆWICZENIE 14
WYZNACZANIE STAŁEJ RÓWNOWAGI REAKCJI
I2 + I- = I-3
CEL ĆWICZENIA
Celem ćwiczenia jest ustalenie stałej równowagi reakcji:
I2 + I- ![]()
I-3
i wykazanie, że wielkość ta nie zależy od stężenia reagentów w roztworze.
WSTĘP
RÓWNOWAGA CHEMICZNA - mówimy, że układ znajduje się w stanie równowagi wtedy, gdy nie występują w nim przepływy masy i energii, parametry stanu zachowują w czasie wartości stałe, a stan ten nie ulega zmianie przy zmianie warunków zewnętrznych.
W chwili osiągnięcia równowagi chemicznej szybkość reakcji pierwotnej staje się równa szybkości reakcji odwrotnej. Z tego warunku wyprowadza się stałą równowagi chemicznej metodami kinetyki chemicznej. Większość reakcji prowadzi się w warunkach
T,p = const.
Przebiegowi izotermicznej i izobarycznej reakcji chemicznej typu ![]()
towarzyszy zmiana potencjału chemicznego układu, którą ogólnie można przedstawić równaniem
![]()
(1)
prod. substr.
gdyż w układzie znikają substraty (vi<0), a na ich miejsce powstają stechiometryczne ilości produktów (vi>0). Równanie to jest słuszne dla ![]()
= 1. Warunek równowagi, dla przemian izotermiczno - izobarycznych, przy braku pracy nieobjętościowej, brzmi ![]()
= 0. Wobec tego równanie (1) zapisujemy następująco
![]()
(2)
Potencjał chemiczny reagenta jest związany z jego aktywnością.
![]()
(3)
Podstawiając tę zależność do równania (2) oraz wprowadzając pojęcie aktywności w stanie równowagi ai* , otrzymujemy:
![]()
(4)
stąd:
![]()
(5)
gdzie ![]()
![]()
- potencjał standardowy reakcji chemicznych.
W warunkach T,p = const. wartość tej funkcji jest stała. Dlatego możemy napisać:
Ka(T,p)= π(ai*)v![]()
(6)
Pamiętając, że vi >0 dla produktów reakcji i vi <0 dla substratów reakcji, z równania (6) wynika, że w warunkach T,p=const, w stanie równowagi, stosunek iloczynu substratów, jest wielkością stałą.
Równanie (5) definiuje termodynamiczną stałą równowagi chemicznej. Jeżeli aktywność zamienimy stężeniem, co jest słuszne tylko przy spełnieniu określonych warunków, wtedy otrzymamy klasyczne prawo równowagi chemicznej nazywane prawem działania mas. Jeżeli wprowadzimy stężenie objętościowe c [mol/dm3], wtedy:
Kc(T,p)=π![]()
(7)
WYKONANIE ĆWICZENIA
Reakcję jodu z jonem jodkowym prowadzi się w dwóch roztworach, które różnią się stężeniem jodu. Stan równowagi tej reakcji ustala się szybko. Stężenie jodu w mieszaninie reakcyjnej oznacza się za pomocą miareczkowania roztworem tiosiarczanu sodowego. W ten sposób oznacza się całkowite stężenie jodu (I2 + I-3) w roztworze wodnym, zgodnie z równaniami reakcji:
2S2O32- + I2 = S4O62-
oraz
2S2O32-+ I-3 = S4O62- + 3I-
Jony I-3 są nietrwałe i rozpadają się w czasie miareczkowania. W celu obliczenia stałej równowagi należy znać stężenie wolnego I2 i stężenie jonu trójjodowego I-3 w stanie równowagi. Należy więc w odpowiedni sposób oznaczyć stężenie jednego z tych reagentów.
Stężenie wolnego jodu w mieszaninie reakcyjnej można wyznaczyć wykorzystując prawo podziału Nernsta. W tym celu wodny roztwór, w którym zachodzi reakcja chemiczna wytrząsa się z czterochlorkiem węgla. Praktycznie tylko I2 rozpuszcza się w CCl4 i przechodzi do warstwy organicznej w takich ilościach, że stosunek jego stężeń w obu warstwach równa się współczynnikowi podziału. W układzie ustala się równowaga dwóch procesów: równowaga reakcji chemicznej w roztworze wodnym, oraz równowaga podziału I2 pomiędzy wodę i CCl4. Stężenie I2 w CCl4 w stanie równowagi obu procesów oznacza się również za pomocą miareczkowania roztworem Na2S2O3. Znając współczynnik podziału I2 pomiędzy CCl4 i wodę, oraz stężenie I2 w warstwie czterochlorku węgla oblicza się stężenie wolnego I2 w warstwie wodnej. Na tej podstawie można obliczyć stężenia reagentów oraz stałą równowagi.
WYKONANIE POMIARÓW
Do dwóch rozdzielaczy o pojemności 250 cm3 wprowadziliśmy następujące odczynniki:
rozdzielacz 1: 20cm3 nasyconego roztworu I2 w CCl4,
100cm3 0,1 m KI
rozdzielacz 2: 10cm3 nasyconego roztworu I2 w CCl4,
10cm3 CCl4,
100cm3 0,1 m KI.
Zawartość rozdzielaczy wytrząsaliśmy się w ciągu 15 minut i umieściliśmy w łapach statywów na 30 minut. Następnie kolejno w każdym rozdzielaczu oznaczaliśmy stężenie jodu w obu warstwach. W tym celu z każdej warstwy pobraliśmy 3 próbki po 5cm3 roztworu.
Próbkę pobraną z warstwy organicznej wprowadziliśmy do kolbki zawierającej 10cm3 0,1 m KI i roztwór miareczkowaliśmy za pomącą 0,01 n Na2S2O3. Pod koniec miareczkowania, gdy roztwór jest lekko żółty dodaliśmy kilka kropli roztworu skrobi i miareczkowaliśmy do całkowitego odbarwienia.
Próbkę pobraną z warstwy wodnej miareczkowaliśmy roztworem tiosiarczanu sodowego bezpośrednio. Wyniki miareczkowania zanotowaliśmy.
OBLICZENIA I WNIOSKI
stężenie molowe jodu w warstwie czterochlorkowej jodu
![]()
gdzie ![]()
- ilość ml Na2S2O3 zużyta do miareczkowania próbki pobranej z warstwy czterochlorkowej.
Rozdzielacz
c=0,5·18,3·(0,01·10-3·1000)/5=0,0183 [molI2/dm3]
Rozdzielacz
c=0,5·9,2·(0,01·10-3·1000)/5=0,0092 [molI2/dm3]
suma stężeń molowych jodu I2 i jonów I-3 w warstwie wodnej
![]()
I Rozdzielacz
c=0,5·14,4·(0,01·10-3·1000)/5=0,0144 [mol(I2+I-3)/dm3]
II Rozdzielacz
c=0,5·7,3·0,01·10-3·1000/5=0,0073 [mol(I2+I-3)/dm3]
stężenie wolnego jodu I2 w warstwie wodnej
![]()
I Rozdzielacz
c=0,01·0,0183=0,000183=0,183·10-3
II Rozdzielacz
c=0,01·0,0092=0,000092=0,092·10-3
stężenie molowe jonów I-3 w warstwie wodnej
![]()
I Rozdzielacz
c=0,0144-0,000183=0,014217=14,217·10-3
II Rozdzielacz
c= 0,0073-0,000092=0,007208=7,208·10-3
stężenie molowe jonów jodkowych I- w warstwie wodnej
CoI- =0.1 mol/dm3
![]()
I Rozdzielacz
c=0,1-0,014217=0,085783=85,783·10-3
II Rozdzielacz
c=0,1-0,007208=0,092792=92,792·10-3
stałą równowagi obliczamy ze wzoru:
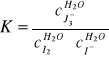
I Rozdzielacz
K=14,217·10-3/(0,183·10-3·85,783·10-3)=905,6
II Rozdzielacz
K=7,208·10-3/(0,092·10-3·92,792·10-3)=844,3
WNIOSKI
Stałe równowagi reakcji nie różnią się zbytnio od siebie, co świadczy, że stała równowagi jest wielkością charakterystyczną dla danej reakcji i jest niezależna od stężenia substancji reagujących (reagentów).
Niewielka różnica jest wynikiem użycia 10cm3 CCl4 do reakcji zachodzącej w drugim rozdzielaczu.
TABELA WYNIKÓW
|
ROZDZIELACZ I
|
ROZDZIELACZ II |
n [ml/5ml próbki]
|
18,3 |
9,2 |
n [ml/5ml próbki]
|
14,4 |
7,3 |
c [mol/dm3]
|
18,3·10-3 |
9,2·10-3 |
c [mol/dm3]
|
14,4·10-3 |
7,310-3 |
c [mol/dm3]
|
18,3·10-5 |
9,2·10-5 |
c [mol/dm3]
|
14,217·10-3 |
7,208·10-3 |
c [mol/dm3]
|
85,783·10-3 |
92,792·10-3 |
K
|
905,6 |
844,3 |
Wyszukiwarka
Podobne podstrony:
M-14.1P, Politechnika Lubelska, Studia, Studia, fizyka
Prawo inżynierskie i ochrona własności intelektualnych. Wykład 3, Studia, Politechnika Łódzka - Pend
Testy biodegradacji, Studia, Politechnika
Chf9, Studia, Politechnika
Wyznaczanie stałej reakcji szybkości zmydlania estru, Studia, Politechnika
CH.F.L9, Studia, Politechnika
ZAKAAD CHEMI FIZYCZNEJ, Studia, Politechnika
C15, Studia, Politechnika
podstawowe informacje o ochronie prawnej wzorów przemysłowych, Studia - Politechnika Śląska, Zarządz
Sprawko spawalnictwo 1, studia, studia Politechnika Poznańska - BMiZ - Mechatronika, 2 semestr, obro
dziadek25, Studia, Politechnika
4 2 vademecum echosondy (w tym przykładzie wodnej), studia, studia Politechnika Poznańska - BMiZ - M
LABORKA7, Studia, Politechnika
Wyznaczanie stopnia asocjacji kwasu octowego w rozpuszczalni, Studia, Politechnika
deacon1, Studia, Politechnika
Destylacja wojtek, Studia Politechnika Poznańska, Semestr I, Chemia, Chemia laboratoria, Destylacja
Liczby przenoszenia jonów, Studia, Politechnika
103, Studia Politechnika Poznańska, Semestr II, I pracownia fizyczna, LABORKI WSZYSTKIE, FIZYKA 2, F
poprawione7, Studia, Politechnika
więcej podobnych podstron