ZAKŁAD CHEMII FIZYCZNEJ
LABORATORIUM STUDENCKIE
Ćwiczenie nr 4
Temat ćwiczenia: Momenty dipolowe
Wyposażenie ćwiczenia:
Aparatura i urządzenia: Mostek C (typ E315 A)
Kondensator
Suszarka elektryczna
Refraktometr
Szkło: Zlewka na 100 cm3
Lejek
Odczynniki: Czterochlorek węgla
Roztwory nitrobenzenu w CCl4 o stężeniach wyrażonych w ułamkach molowych nitrobenzenu:-0,025;0,05;0,075;0,1
Aceton
Bibuła
Przy wyznaczaniu momentów dipolowych opieramy się na teorii Debye'a, w myśl, której między momentem dipolowym i polaryzacją P jednego mola nie oddziaływujących na siebie molekuł istnieje zależność:
![]()
(1)
gdzie:
PE,PA - polaryzacja elektronowa i atomowa
N - liczba Avogadro
k - stała Boltzmana
T - temperatura w skali Kelwina
Potrzebne do obliczenia polaryzacji wartości przenikalności dielektrycznej wyznacz się z pomiarów pojemności kondensatora.
Aby spełnić warunek, przy którym słuszny jest wzór Debye'a (brak oddziaływań elektrostatycznych między dipolami) przeprowadza się serię pomiarów z rozcieńczonymi roztworami badanej substancji w niepolarnym rozpuszczalniku, a uzyskane wyniki ekstrapoluje się do stężenia zerowego.
Opracowanie wyników:
Na podstawie mierzonych pojemności kondensatora w CCl4 i powietrzu obliczam stałą dielektryczną czterochlorku węgla:
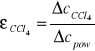
![]()
=2,3951
Natomiast względną stałą dielektryczną obliczam z zależności:
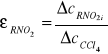
Wyniki obliczeń zestawione są w tabeli nr 1.
Tabela 1:Wyniki pomiarów pojemności kondensatora i wartości stałej dielektrycznej w zależności od stężeń.
Rodzaj wypełnienia kondensatora |
Pojemność kondensatora |
Względna stała dielektryczna roztworu |
||
|
Max. cA |
Min. cB |
Różnica
|
|
Powietrze |
5.654 |
24.38 |
18.726 |
-- |
CCl4 |
10.91 |
55.76 |
44.85 |
1.0000 |
Roztwór RNO2 w CCl4 x=0,025 |
13.63 |
68.68 |
55.05 |
1.2274 |
Roztwór RNO2 w CCl4 x=0,05 |
18.81 |
95.83 |
77.02 |
1.7173 |
Roztwór RNO2 w CCl4 x=0,075 |
22.15 |
110.8 |
88.65 |
1.9766 |
Roztwór RNO2 w CCl4 x=0,1 |
28.56 |
148.4 |
119.84 |
2.6720 |
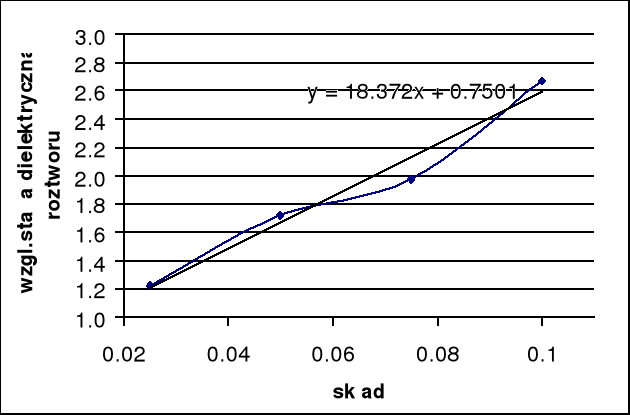
Rys. 1: Zależność względnej stałej dielektrycznej roztworu od stężenia.
Obliczamy współczynnik kierunkowy prostej metodą graficzną:
![]()
Obliczamy współczynnik kierunkowy prostej metodą najmniejszych kwadratów:
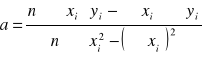
gdzie:
n=4
Σxi⋅yi=0.5738
Σxi=0.25
Σyi=8.0858
Σxi2=0,0187
(Σxi)2=0.0625
![]()
=21,644
Obliczamy wartość polaryzacji molowej nitrobenzenu z zależności:
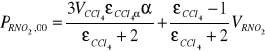
gdzie:
![]()
MRNO=123,12g/mol
MCCl4=153,6g/mol
ρRNO=1,203g/cm3
ρCCl4=1,594g/cm3
więc:
VRNO=102,34cm3/mol
VCCl4=96,36cm3/mol
PRNO2,00=3215,88cm3/mol
Moment dipolowy nitrobenzenu obliczamy z zależności:
![]()
refrakcję molową nitrobenzenu obliczamy z równania:
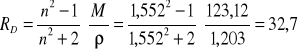
cm3/mol
T=293K
po podstawieniu otrzymujemy:
![]()
Wyszukiwarka
Podobne podstrony:
Prawo inżynierskie i ochrona własności intelektualnych. Wykład 3, Studia, Politechnika Łódzka - Pend
Testy biodegradacji, Studia, Politechnika
Chf9, Studia, Politechnika
Wyznaczanie stałej reakcji szybkości zmydlania estru, Studia, Politechnika
CH.F.L9, Studia, Politechnika
ZAKAAD CHEMI FIZYCZNEJ, Studia, Politechnika
C15, Studia, Politechnika
podstawowe informacje o ochronie prawnej wzorów przemysłowych, Studia - Politechnika Śląska, Zarządz
Sprawko spawalnictwo 1, studia, studia Politechnika Poznańska - BMiZ - Mechatronika, 2 semestr, obro
dziadek25, Studia, Politechnika
4 2 vademecum echosondy (w tym przykładzie wodnej), studia, studia Politechnika Poznańska - BMiZ - M
LABORKA7, Studia, Politechnika
Wyznaczanie stopnia asocjacji kwasu octowego w rozpuszczalni, Studia, Politechnika
deacon1, Studia, Politechnika
Destylacja wojtek, Studia Politechnika Poznańska, Semestr I, Chemia, Chemia laboratoria, Destylacja
Liczby przenoszenia jonów, Studia, Politechnika
103, Studia Politechnika Poznańska, Semestr II, I pracownia fizyczna, LABORKI WSZYSTKIE, FIZYKA 2, F
poprawione7, Studia, Politechnika
CHEMIA~7, Studia, Politechnika
więcej podobnych podstron