|
KF PŚk
|
|
Wydział, grupa: |
|||
|
Symbol ─çwiczenia: E6 |
Temat: Wyznaczanie równoważnika elektrochemicznego miedzi i stałej Faradaya.
|
||||
|
Data wykonania: |
Data oddania do poprawy: |
Ocena: |
|||
WST─śP TEORETYCZNY:
Dysocjacja elektrolityczna
W wyniku reakcji z rozpuszczalnikiem drobiny kwas├│w, zasad i soli rozpadaj─ů si─Ö na jony.
Proces ten nosi nazw─Ö dysocjacji elektrolitycznej. Elektrolity, czyli roztwory substancji
ulegaj─ůcych dysocjacji, dzielimy na zdysocjowane ca┼ékowicie (elektrolity mocne) i
cz─Ö┼Ťciowo zdysocjowane na jony (elektrolity s┼éabe). Miar─ů dysocjacji elektrolitycznej, czyli miar─ů mocy elektrolitu jest stopie┼ä dysocjacji substancji rozpuszczonej a:
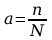
gdzie: n jest liczb─ů cz─ůsteczek zdysocjowanych na jony, a N - ca┼ékowit─ů liczb─ů cz─ůsteczek
wprowadzonych do roztworu.
Warto┼Ť─ç stopnia dysocjacji zale┼╝y od wielu czynnik├│w: temperatury, st─Ö┼╝enia roztworu,
rodzaju ciała rozpuszczonego, a przede wszystkim od natury rozpuszczalnika.
Elektroliza
Elektroliza jest to zmiana sk┼éadu chemicznego roztworu (lub stopu), podczas przep┼éywu sta┼éego pr─ůdu elektrycznego, spowodowana przy┼é─ůczeniem lub utrat─ů elektron├│w przez jony substancji rozpuszczonej (lub stopionej). W czasie elektrolizy w wyniku przy┼é─ůczenia elektron├│w do jon├│w powstaj─ů na katodzie produkty redukcji, a na anodzie, w wyniku straty elektron├│w ÔÇô produkty utleniania.
Jako┼Ťciowe zmiany sk┼éadu roztworu zale┼╝─ů od charakteru proces├│w elektrodowych,
zachodz─ůcych na katodzie i anodzie. Je┼Ťli jony wydzielane na elektrodach nie mog─ů istnie─ç w stanie wolnym, to wchodz─ů one w reakcje chemiczne albo z materia┼éem elektrody albo z cz─ůsteczkami elektrolitu.
I prawo Faradaya:
Masa substancji m, kt├│ra uleg┼éa przemianie na elektrodzie podczas przep┼éywu pr─ůdu
przez elektrolit jest wprost proporcjonalna do ┼éadunku elektrycznego Q jaki przep┼éyn─ů┼é w tym czasie:

gdzie: I ÔÇô nat─Ö┼╝enie pr─ůdu, k ÔÇô wsp├│┼éczynnik proporcjonalno┼Ťci, t ÔÇô czas przep┼éywu pr─ůdu.
Wsp├│┼éczynnik k jest zale┼╝ny od rodzaju wydzielaj─ůcej si─Ö substancji, natomiast niezale┼╝ny od st─Ö┼╝enia roztworu, od kszta┼étu i wzajemnej odleg┼éo┼Ťci elektrod oraz od temperatury roztworu.
Nosi on nazw─Ö r├│wnowa┼╝nika elektrochemicznego substancji. Liczbowo jest r├│wny masie
substancji wydzielonej przez pr─ůd o nat─Ö┼╝eniu 1 A w czasie 1 s.
Równoważnik elektrochemiczny można również interpretować na gruncie rozważań
molekularnych. Wzrost masy elektrody, zwi─ůzany z wydzieleniem si─Ö na niej n jon├│w
wynosi:

gdzie: NA ÔÇôliczba Avogadra, M ÔÇô masa jonu.
Przeniesiony wraz z jonami ładunek Q:
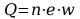
gdzie: e ÔÇô ┼éadunek elementarny, w ÔÇô warto┼Ťciowo┼Ť─ç jonu.
Z powyższych równań wynika:

Stosunek R masy gramocz─ůsteczki substancji M do jej warto┼Ťciowo┼Ťci w nazywamy
gramor├│wnowa┼╝nikiem chemicznym substancji:

II prawo Faradaya:
Stosunek mas r├│┼╝nych substancji ulegaj─ůcych przemianom chemicznym na
elektrodach podczas przepływu jednakowych ładunków elektrycznych jest równy stosunkowi ich równoważników chemicznych:

Z praw elektrolizy wynika, ┼╝e do wydzielenia 1 gramor├│wnowa┼╝nika dowolnej substancji
potrzeba takiego samego ładunku. Ładunek ten nosi nazwę stałej Faradaya i wynosi
F=96500C.
Na wydzielenie si─Ö 1 r├│wnowa┼╝nika gramowego dowolnego jonu potrzebny jest taki sam ┼éadunek. ┼üadunek ten nazywamy sta┼é─ů Faradaya F. Dla masy R jednego r├│wnowa┼╝nika gramowego wydzielonej substancji mamy

st─ůd sta┼éa Faradaya:

POMIARY:
masa katody przed elektroliz─ů - 71,08g
masa katody po elektrolizie - 71,57g
masa wydzielonej miedzi - 71,57g-71,08g=0,49g
powierzchnia zanurzenia katody - 0,5dm3
powierzchnia zanurzenia anody - 0,252dm3
zakres amperomierza - 1500mA
klasa amperomierza - 0,5
całkowity czas elektrolizy - 1800s (30min)
┼Ťrednia nat─Ö┼╝enia pr─ůdu ÔÇô 0,98A
|
czas t (s) |
Pomiary nat─Ö┼╝enia pr─ůdu I (A) |
|
180 360 540 720 900 1080 1260 1440 1620 1800 |
1,04 1,00 0,96 0,98 0,88 0,98 0,96 0,98 0,98 1,04 |
OBLICZENIA:
Wyznaczanie warto┼Ťci r├│wnowa┼╝nika elektrochemicznego k:

- masa wydzielonej miedzi:
m2 - m1 = 71,57g - 71,08g = 0,49g
- ┼Ťrednie nat─Ö┼╝enie pr─ůdu:
I┼Ťr = 0,98A
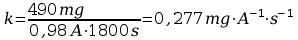
Wyznaczanie stałej Faradaya F:
R dla miedzi wynosi 31,8g.

Wyszukiwarka
Podobne podstrony:
Wyznaczanie równoważnika elektrochemicznego miedzi i stałej?radaya na podstawie elektrolizy CuSO4x
Wyznaczanie równoważnika elektrochemicznego miedzi i stałej?radaya na podstawie elektrolizy CuSO4
Elek- Wyznaczanie r├│wnowa┼╝nika elektrochemicz miedzi i sta(2, Sprawozdania - Fizyka
24.WYZNACZANIE RÓWNOWAŻNIKA ELEKTROCHEMICZNEGO MIEDZI ORAZ STAŁEJ FARADAYA., Fizyka
23 Wyznaczanie równoważnika elektrochemicznego miedzi oraz stałej Faradaya
24 WYZNACZANIE RÓWNOWAŻNIKA ELEKTROCHEMICZNEGO MIEDZI ORAZ STAŁEJ FARADAYA doc
wyznaczanie równoważnika elektorchemicznego miedzi i stałej?radaya
1Wyznaczanie równoważnika elektrochemicznego miedzi i stałej
Cw 25 - Wyznaczenie rownowaznika elektrochemicznego miedzi, AKADEMIA TECHNICZNO-ROLNICZA W BYDGOSZCZ
Wyznaczanie równoważnika elektrochemicznego miedzi, laboratorium fizyczne, Laboratorium semestr 2 RÓ
Wyznaczanie r├│wnowa┼╝nik├│w elektrochemicznych metali, sta┼éej?radayÔÇÖa i ┼éadunku elementarnego
3. Wyznaczanie wsp├│┼éczynnika elektrochemicznego miedzi i sta┼éej FaradayÔÇÖa, LAB10 02, Wyznaczanie r╦Öw
wyznaczanie rownowaznika elektrochemicznego miedzi
Wyznaczanie równoważników elektrochemicznych, metali stałej?raday`a i ładunku elementarnego