Sergiusz Bielawny |
GRUPA: A / I |
Technologia Chemiczna |
Nr ćwiczenia: 6 |
Prowadzący: Dr B. Wyrwas |
Data: 6.03.2007 |
Rozdział metodą chromatografii jonowymiennej |
|
I
przed dodaniem H2SO4 kolor lekko niebieski roztworu, jonit żółty
buraczkowy kolor roztworu, jonit żółty
lekko pomarańczowy kolor roztworu, jonit żółty
II etap:
po dekantacji i dodaniu H2SO4 bezbarwny roztwór, jonit lekko żółty
lekkie odbarwienie roztworu, odbarwienie jonitu
mniej żółty roztwór, pomarańczowy jonit
III etap:
bez zmian
bez zmian
odbarwienie roztworu lekkie, jonit intensywnie pomarańczowy
etapy stanowią tutaj pewien określony przedział czasu
obliczenia:
1 3Cr+ + 3NO-3 + 2K-H+ → 3KCr + 3HNO3
K-Cr+ + H2SO4 → KH + CrSO4
2 Ce(SO4)2 + 2ACl → CeCl2 + 2ASO4
KMnO4 + ACl → KCl + AMnO4
3 K2Cr2O7 + ACl → KCl + A2Cr2O7
Cr(NO 3)3 + 3ACl → CrCl3 + 3ANO3
Do 4 kropel 0,1M CoCl2 (różowy) dodano 2 krople 0,05M
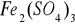
(jasnobrązowy/ bursztynowy). Do tej mieszaniny o kolorze żółtym (barwa wypadkowa kolorów obu soli) dodano 3 krople 0,5 M NH4SCN - roztwór zmienia barwę na krwisto czerwoną , za co są odpowiedzialne barwne kompleksy rodanku żelaza III.
Po dodaniu anionitu, roztwór zmienił barwę na pomarańczową , a złoże zabarwiło się na krwisto.
Po dodaniu do probówki kilku kropel NH4F roztwór odbarwił a złoże zmieniło kolor na niebieski.
W przypadku samej soli kobaltu, po dodaniu 3 kropel
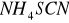
kolor nie zmienił się.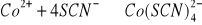
(różowy) (różowy w obecności wody)
Po dodaniu anionitu roztwór odbarwia się, a złoże przybiera barwę niebieską
![]()
(różowy) (niebieski w środowisku bezwodnym)
Po dodaniu ![]()
nie zaobserwowano zmian.
W przypadku soli żelaza III po dodaniu
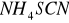
roztwór zabarwia się na krwisto czerwony kolor
![]()
(krwisto czerwony)
Anionit po dodaniu zabarwia się na ciemnoczerwony kolor a roztwór robi się pomarańczowy (anionit wiąże krwisto czerwone kompleksy rodanku żelaza III)
![]()
(krwisto czerwony) (krwisto czerwony)
Po dodaniu ![]()
zaobserwowano odbarwienie się roztworu i powrót barwy anionitu do barwy pierwotnej (żółty).
1.2.2 Do probówki wprowadzono 1 - 2 kropli 0,1 M NiCl2 w 8 M HCl i 1 - 2 kropli 0,1 M CoCl2 w 8 M HCl. Dodano trochę kationitu, próbę wstrząśnięto i odstawiono. Te same operacje powtórzono oddzielnie z roztworem NiCl2 i CoCl2. Następnie roztwory zdekantowano z nad złoża i zalano 1 - 2 cm3 wody po intensywnym wstrząśnięciu roztwory zdekantowano do probówek i dodano 1 - 2 cm3 stężonego HCl.
W efekcie nie zaobserwowano żadnych zmian barwy złoża oraz roztworu.
1.2.3 Po dodaniu kationity do roztworu zawierającego jony Cu2+ nastąpiło odbarwienie niebieskiego roztworu a żółty kationit przyjął zieloną barwę.
![]()
(zielony)
Po dodaniu NH4OH roztwór nad złożem przyjmuje granatowy kolor.
![]()
(granatowy)
Po wstrząśnięciu roztwór odbarwia się nad złożem odbarwia się a złoże przyjmuje granatowy kolor.
1.3
Obserwacje
1. W kolbie z wyciekiem z kolumny z RH roztwór zmienił kolor na niebieski bezpośrednio po dodaniu roztworu buforowego i czerni eriochromowej. W kolbie z woda wodociągowa roztwór po dodaniu buforu i czerni eriochromowej zmienił barwę na fioletowa, a po dodaniu 28 ml 0,005 M roztworu EDTA na niebieski.
2. W probówce z ROH Nie zaobserwowano zmętnień, natomiast w dwóch pozostałych naczyniach zauważono zmętnienie roztworów.
.3. W każdej z probówek wytrącił się osad.
Wnioski:
Twardość wody wodociągowej (ml/dm3) badanej wody obliczamy według wzoru: X =a * 0,05 *1000/V - ilość 0,01M roztworu EDTA, użyta do zrniareczkowania próbki wody, cm3 V- objętość próbki wody użytej do oznaczania, cm30,05 - współczynnik przeliczeniowy, określa ilość wapnia i magnezu odpowiadająca 1cm3 0,01M roztworu EDTA, dla a=28cm3 i V=55cm3otrzymany wynik twardości wody: X=25,45 woda jest twarda.
Zmętnienie roztworów w probówkach z wyciekiem z kolumny z RH i z woda wodociągowa swiadczy o obecnosci siarczanów, natomiast w próbówce z ROH brak zmętnienia świadczy o ich braku.
Obecność osadu w każdej probówce świadczy o obecności chlorków we wszystkich roztworach.
Wyszukiwarka
Podobne podstrony:
kationy, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
Chemia mat. bud, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki, Chemi
sciaga na egzmin, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki
sprawko z osadów, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organic
hydroliza, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki, Chemia - I
sprawko cw1, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
sprawozdanie z cw 4, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie orga
Odczyn roztworów wodnych soli, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogoln
redoksy part1, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
Badanie substancji błonotwórczych, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.che
Cw12 Rozdzial przez stracanie, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogoln
ćw.5 Ania, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki
Cw10 Reakcje utleniania i redukcji, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia
Hydroliza soli i pH roztworów, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.
sprawko z kompleksy I, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie or
Spoiwa mineralne, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki, Chem
Cw11 Utlenianie, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organicz
więcej podobnych podstron