Dwuskładnikowe układy ciekłe o ograniczonej rozpuszczalności
Jeżeli entalpia swobodna mieszania jest dodatnia układ wykazuje ograniczoną rozpuszczalność.
Układy z górną krytyczną temperaturą mieszania TKG
powyżej TKG jedna faza ciekła, poniżej TKG dwie fazy ciekłe - roztwory nasycone.
W warunkach izotermiczno-izobarycznych:
Ograniczona rozpuszczalność gdy
ponieważ
stąd
Zależność entalpii mieszania od temperatury dla układu z TKG.

Ze wzrostem temperatury zanika maksimum ΔGmix.
Układ dwufazowy wyznaczają lokalne minima na krzywej rozpuszczalności.
Nitrobenzen- n-heksan TKG = 293 K:

Skład obu faz ciekłych określa reguła dzwigni:
(nB)α - liczba moli składnika B w fazie α,
(nB)β - liczba moli składnika B w fazie β,
(xB)α - ułamek molowy składnika B w fazie α,
(xB)β - ułamek molowy składnika B w fazie β,
Układy z dolną krytyczną temperaturą mieszania TKD poniżej TKD jedna faza ciekła, powyżej TKD dwie fazy ciekłe

Trietyloamina -woda TDK=292K
W niskich temperaturach składniki tworzą słabe kompleksy.
Układ z dolną i górną krytyczną temperaturę mieszania
Składniki, które wykazują ograniczoną rozpuszczalność w pewnym zakresie temperatur, z dwiema krytycznymi temperaturami mieszania TKD oraz TKG, tworzą słabe kompleksy zarówno w temperaturach niższych od TKD oraz w temperaturach wyższych od TKG (zazwyczaj pod ciśnieniem wyższym od atmosferycznego).
Destylacja układu o ograniczonej rozpuszczalności
Temperatura krytyczna górna jest niższa od temperatury wrzenia
TKG<Twrz
Prężności składników wykazujących ograniczoną rozpuszczalności są większe niż przewiduje prawo Raoulta - azeotropy dodatnie.
Temperatura krytyczna górna jest wyższa od temperatury wrzenia
(składniki mieszają się bez ograniczeń pod ciśnieniem wyższym od atmosferycznego)

TKG> Twrz
Prężność takiego układu jest sumą prężności składników w obu fazach:
Ponieważ rozpuszczalność składników jest ograniczona można pominąć niewielkie stężenia drugiego składnika:
stąd prężności składników:
prężność roztworu:
Temperatura wrzenia mieszaniny jest niższa od temperatury wrzenia wody (niżej wrzącego składnika).
Zawartość składnika o wyższej temperaturze wrzenia w parze (w destylacie) można obliczyć:
Potencjał chemiczny składnika w układach o ograniczonej rozpuszczalności
W roztworze ułamek molowy xA substancji rozpuszczonej A (gazu lub cieczy) jest znacznie mniejszy od ułamka molowego xS rozpuszczalnika S
A + S → roztwór A w S
Zależność pomiędzy prężnością substancji rozpuszczonej i jej stężeniem w roztworze określa prawo Henry'ego:
Wodny roztwór Ar
Roztwory gazu w cieczy
A(g) + S(ciecz) → roztwór A w S
↓ ΔHskr
A(g) + S(ciecz) → roztwór A w S
Rozpuszczalność gazu w cieczy (xA)c zależy od temperatury i ciśnienia, co wynika z warunku równowagi termodynamicznej:
Wpływ ciśnienia na rozpuszczalność gazu dla T=const.
Rozpuszczalność gazu wzrasta z ciśnieniem gazu
Wpływ temperatury na rozpuszczalność gazu dla p=const.
Rozpuszczalność gazu maleje ze wzrostem temperatury, ponieważ skraplanie jest procesem egzotermicznym, ΔHskraplania<0,.
Roztwór gazu w cieczy jest doskonały, gdy:
prężność gazu spełnia prawo Henry'ego,
prężność rozpuszczalnika spełnia prawo Raoulta
entalpia rozpuszczania = entalpia skraplania
entropia rozpuszczania jak dla mieszaniny gazów spełniających równanie stanu gazu doskonałego
potencjał chemiczny gazu w roztworze:
z równości potencjałów w roztworze i fazie gazowej oraz po uwzględnieniu prężności określonej prawem Henry'ego:
Standardowy potencjał chemiczny gazu (substancji rozpuszczonej) w roztworze - stanem odniesienia
roztwór nieskończenie rozcieńczony:
Potencjał chemiczny rozpuszczalnika jest zdefiniowany na podstawie prawa Raoulta.
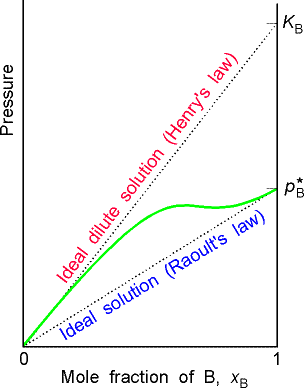
Sens fizyczny stałej Henry'ego:
Ki odpowiada ciśnieniu pary nasyconej czystej substancji rozpuszczonej, której właściwości byłyby takie, jak w roztworze nieskończenie rozcieńczonym.

W roztworze nieskończenie rozcieńczonym cząsteczkę substancji rozpuszczonej otaczają tylko cząsteczki rozpuszczalnika - inne oddziaływania, inne ciśnienie pary nasyconej.
Różnica potencjałów chemicznych zdefiniowanych w oparciu o prawa Raoulta i Henry'ego wynika z różnych stanów odniesienia.
Prawo Raoulta pokazuje zmianę prężności wskutek rozcieńczania czystego składnika poprzez dodawanie innego składnika jak zmieniają się oddziaływania jednoimienne w polu innych cząsteczek.
Prawo Henry'ego pokazuje zmianę prężności wskutek zwiększania stężenia substancji rozpuszczonej jak zmieniają się oddziaływania różnoimienne, wskutek oddziaływań jednoimiennych.
Roztwór niedoskonały prężność substancji rozpuszczonej nie spełnia prawa Henry'ego:
co można zapisać następująco:
Potencjał chemiczny substancji rozpuszczonej można wyrazić:
fA - współczynnik aktywności termodynamicznej:
aA - aktywność termodynamiczna, która wyraża efektywne stężenie składnika w roztworze
11
Wyszukiwarka