Wyniki pomiarów:
Tabela 1. Przewodnictwo roztworu wzorcowego KCl
Stężenie roztworu KCl [M] |
Temperatura [°C] |
Przewodnictwo roztworu KCl L, [mS] |
Stała naczyńka k [m-1] |
Stała naczyńka kśrednia [m-1] |
|||
|
|
L1KCl
|
L2KCl
|
L3KCl
|
LKCl średnia |
|
|
0,1 |
18 |
10,65 |
10,79 |
10,70 |
10,71 |
104,5 |
96,3 |
0,01 |
18 |
1,403 |
1,376 |
1,38 |
1,39 |
88,1 |
|
Obliczenia:
stała naczyńka pomiarowego:
Tabela 2. Przewodnictwo badanego roztworu
Dane w tabeli zawierają średnią wartość przewodnictwa roztworu SDS, wyliczoną z trzech pomiarów.
Objętość dodanego roztworu SDS - V [cm3] |
Przewodnictwo roztworu SDS - Ls [μS] |
Stężenie roztworu SDS - Cs [mol/m3] |
Przewodnictwo właściwe roztworu SDS - ks [S/m] |
Przewodnictwo molowe roztworu SDS - Λ[S*m2/mol] |
0 |
1,7 |
0 |
0,0001637 |
0 |
1 |
26,6 |
0,331 |
0,0025616 |
0,0077360 |
2 |
48,9 |
0,658 |
0,0047091 |
0,0071578 |
3 |
71,9 |
0,98 |
0,0069240 |
0,0070624 |
4 |
95 |
1,299 |
0,0091485 |
0,0070443 |
5 |
117,8 |
1,613 |
0,0113441 |
0,0070334 |
6 |
140,2 |
1,923 |
0,0135013 |
0,0070207 |
7 |
161,2 |
2,229 |
0,0155236 |
0,0069634 |
8 |
184,5 |
2,532 |
0,0177674 |
0,0070181 |
9 |
204,7 |
2,83 |
0,0197126 |
0,0069651 |
10 |
225,7 |
3,125 |
0,0217349 |
0,0069552 |
11 |
246,3 |
3,416 |
0,0237187 |
0,0069431 |
12 |
267 |
3,704 |
0,0257121 |
0,0069423 |
13 |
287,3 |
3,988 |
0,0276670 |
0,0069380 |
14 |
306,7 |
4,268 |
0,0295352 |
0,0069197 |
15 |
326,7 |
4,545 |
0,0314612 |
0,0069215 |
16 |
346 |
4,819 |
0,0333198 |
0,0069139 |
17 |
365,7 |
5,09 |
0,0352169 |
0,0069191 |
18 |
384 |
5,357 |
0,0369792 |
0,0069028 |
19 |
403 |
5,621 |
0,0388089 |
0,0069039 |
20 |
420,7 |
5,882 |
0,0405134 |
0,0068873 |
21 |
439,7 |
6,14 |
0,0423431 |
0,0068959 |
22 |
457,7 |
6,395 |
0,0440765 |
0,0068920 |
23 |
475 |
6,647 |
0,0457425 |
0,0068813 |
24 |
493 |
6,896 |
0,0474759 |
0,0068840 |
25 |
509,3 |
7,143 |
0,0490456 |
0,0068664 |
26 |
524,7 |
7,386 |
0,0505286 |
0,0068408 |
27 |
539 |
7,627 |
0,0519057 |
0,0068054 |
28 |
553,3 |
7,865 |
0,0532828 |
0,0067745 |
29 |
567,7 |
8,101 |
0,0546695 |
0,0067489 |
30 |
578 |
8,333 |
0,0556614 |
0,0066794 |
31 |
588 |
8,564 |
0,0566244 |
0,0066123 |
32 |
596,7 |
8,791 |
0,0574622 |
0,0065363 |
33 |
606 |
9,016 |
0,0583578 |
0,0064724 |
34 |
613,3 |
9,239 |
0,0590608 |
0,0063925 |
35 |
620,7 |
9,459 |
0,0597734 |
0,0063189 |
36 |
627,3 |
9,677 |
0,0604090 |
0,0062423 |
37 |
635,3 |
9,893 |
0,0611794 |
0,0061841 |
38 |
641,7 |
10,106 |
0,0617957 |
0,0061145 |
39 |
648,3 |
10,317 |
0,0624313 |
0,0060510 |
40 |
655 |
10,526 |
0,0630765 |
0,0059923 |
41 |
660,7 |
10,733 |
0,0636254 |
0,0059280 |
42 |
663,7 |
10,938 |
0,0639143 |
0,0058436 |
43 |
672,7 |
11,14 |
0,0647810 |
0,0058152 |
44 |
678,7 |
11,34 |
0,0653588 |
0,0057635 |
45 |
685,3 |
11,538 |
0,0659944 |
0,0057195 |
stężenie surfaktanta:
, gdzie C0=0,05 mo/dm3= 50 mol/m3
przewodnictwo właściwe:
przewodnictwo molowe:
Opracowanie wyników:
Wzrost stężenia surfaktanta w roztworze powoduje wzrost przewodnictwa właściwego
i jednocześnie spadek przewodnictwa molowego badanego roztworu. Wzrost przewodnictwa właściwego zależy od ilości jonów obecnych w roztworze, im większe stężenie surfaktanta, tym większa będzie liczba jonów zdolnych do przenoszenia prądu elektrycznego. Wzrost stężenia dodawanej substancji powoduje jednak zmniejszenie ruchliwości jonów, a co za tym idzie zmniejszenie przewodnictwa molowego roztworu.
Wyznaczenie CMC:
Zgodnie z równaniami dwóch prostych, punkt przecięcia prostych jest punktem Krytycznego Stężenia micelizacji.
CMC= 8,11 mol/m3
CMCliteraturowe= 8,30
Otrzymany wynik różni się od wartości literaturowej o 0,19. Na błąd pomiaru może wpływać niedokładne miareczkowanie ilości surfaktanta bądź zbyt szybkie odczytywanie wartości wskazywanych przez konduktometr.
Obliczenie stopnia jonizacji surfaktanta α:
constans1 = 0,0098
constans2 = 0,007
constans2=α∙constans1
α=
Obliczanie wartości standardowej entalpii swobodnej micelizacji
β=1 - α = 1 - 0,82 = 0,18
ΔGM = RT(1+β)ln[CMC] = 8,314* (18+273)*(1+0,18)ln[0,00794]= - 13805,66 [
Ujemna wartość standardowej entalpii swobodnej świadczy o samorzutności procesu micelizacji.
Jeżeli natomiast rozpatrujemy poszczególne funkcje termodynamiczne micelizacji, wiemy, że dla danego surfaktantu powyżej stężenia krytycznego proces micelizacji jest procesem samorzutnym. W takiej sytuacji wartość ΔGM musi być mniejsza od zera. W przypadku entalpii micelizacji ΔHM, trudno na podstawie apriorycznych rozważań określić jej znak. Z pomiarów doświadczalnych wiadomo jednak, że proces micelizacji jest zazwyczaj procesem endotermicznym (ΔHM>0). Wiedząc, że ΔGM<0 i ΔHM>0 łatwo możemy określić znak entropii micelizacji ΔSM. Ponieważ z równania Gibasa-Helmholtza mamy: ΔGM=ΔHM - TΔSM<0, stąd TΔSM>ΔHM, a więc ΔSM musi być większa od zera (ponieważ T>0).
Entropia micelizacji ma wartość dodatnią, gdyż wartość entropii układu micelarnego jest większa niż roztworu doskonałego (nie micelarnego). Opisywane tu zjawisko przyciągania się grup hydrofobowych związane ze zwiększaniem się entropii rozpuszczalnika polarnego nazywane jest oddziaływaniem hydrofobowym.
Oddziaływania hydrofobowe - polegają na łączeniu się grup hydrofobowych, w celu ochrony cząsteczki przed oddziaływaniem na nie cząsteczek wody. Oddziaływanie to odpycha cząsteczki wody. Jest to bardzo szczególne oddziaływanie, ponieważ najczęściej rozpuszczalnikiem jest woda.
Standardowa entalpia swobodna tworzenia miceli ΔGM jest parametrem termodynamicznym charakteryzującym dany surfaktant i jest ściśle powiązana z wartością CMC. Dla roztworu doskonałego surfaktantu jego potencjał chemiczny zmienia się logarytmicznie ze stężeniem, co wyrażone jest równaniem (na rysunku linia przerywana):
μ = μ0 + RT ln c
gdzie μ0 - standardowy potencjał chemiczny surfaktantu w danym rozpuszczalniku, R - stała gazowa, T - temperatura wyrażona w K, c - stężenie molowe surfaktantu tworzącego roztwór doskonały.
Zależność potencjału chemicznego surfaktantu od stężenia: linia przerywana - roztwór doskonały, linia ciągła - układ rzeczywisty.
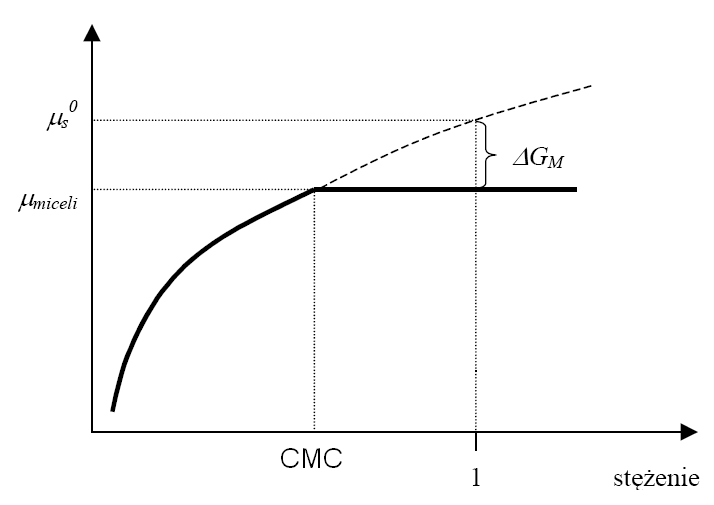
ΔGM = RT ln CMC równanie to spełnione jest dla miceli z surfaktantów niejonowych.
Dla surfaktantów jonowych równanie to przyjmuje postać: ΔGM = RT(1+β) ln CMC
gdzie β oznacza procent ładunku miceli zneutralizowanego przez przeciwjony z roztworu (w przypadku surfaktantu anionowego przeciwjonami są kationy, a w przypadku kationowego - aniony).
Wnioski:
Celem powyższego ćwiczenia było wyznaczenie krytycznego stężenia micelizacji. Jak wynika z otrzymanych wykresu zależność przewodnictwa właściwego od stężenia jest zależnością liniową. Zależność przewodnictwa molowego od stężenia jest zależnością bardziej złożoną. Przewodnictwo molowe w zakresie niskich stężeń maleje, następnie utrzymuje się na stałym poziomie, a w zakresie wysokich stężeń znowu zaczyna maleć. Zjawisko to jest spowodowane powstawaniem miceli. Źródłem błędów uzyskanych wyników może być niedokładne wyznaczenie stałej naczyńka konduktometrycznego oraz niedokładne sporządzenie r-rów.
4
Wyszukiwarka
Podobne podstrony:
W 11 Sprawozdania
Ćw nr 11, 11, Sprawozdanie nr 1
sprawozdanie nasze
Sprawozdanie NASZE
C 11, Sprawozdanie z ˙wiczenia C-11
B-11, Sprawozdanie z ˙wiczenia B-11
protokol(11), SPRAWOZDANIA czyjeś
Ćwiczenie nr 11, sprawozdania, Fizyka - Labolatoria, Ćwiczenie nr11
11, Sprawozdanie 11', SCHEMAT OPRACOWANIA ĆWICZENIA
C-11, Sprawozdanie z ˙wiczenia C11
ĆW 11 - Sprawozdanie, Fizyka
06 (11) - sprawozdanie, Studia, Geofizyka, Fizyka
z2 11, SPRAWOZDANIA czyjeś
11 - sprawozdanie z promieniowania WM (2), Laboratoria FIZYKA PW, 11 (Badanie osłabienia promieniowa
Sprawozdanie 3 - nasze, podstawy robotyki
C 11, Sprawozdanie z ˙wiczenia C-11
Sprawozdanie nasze
sprawka zrobione, biofizyki prady 11, Sprawozdanie z ćwiczenia z biofizyki
więcej podobnych podstron