
ILOCZYN JONOWY WODY
to
dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
H
2
O H
+
+ OH
−
H
2
O + H
2
O H
3
O
+
+ OH
−
ILOCZYN JONOWY WODY, pH
→
←
K = 3,25 · 10
–18
w warunkach standardowych (p = 1013,25 hPa, t = 25
o
C)
K · [H
2
O]
2
= 3,25 · 10
–18
· (55,5)
2
= 1 · 10
–14
= [H
3
O
+
] · [OH
−
] = K
w
2
O
H
OH
H
2
-
+
a
a
a
K
⋅
=
→
←
1
f
f
OH
H
≈
=
−
+
ponieważ a = f · c oraz
2
2
3
O]
[H
]
[OH
]
O
[H
K
−
+
⋅
=

dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
25 · 10
-14
80
o
C
9,3 · 10
-14
60
o
C
48 · 10
-14
100
o
C
1 · 10
-14
25
o
C
0,13 · 10
-14
0
o
C
K
w
temp.
Roztwory, dla których:
[H
3
O
+
] > 10
−7
mol/dm
3
są roztworami kwaśnymi
[H
3
O
+
] = 10
−7
mol/dm
3
są roztworami obojętnymi
[H
3
O
+
] < 10
−7
mol/dm
3
są roztworami zasadowymi
W czystej wodzie, w temperaturze 25
o
C, stężenia [H
3
O
+
] i [OH
−
]
są sobie równe:
[H
3
O
+
] = [OH
−
] = = 1 · 10
–7
mol/dm
3
(roztwór obojętny)
w
K
dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
skala pH
+
−
=
H
a
log
pH
Søren Peter Sørensen
(1868-1939)
pH roztworu:
pH = - log [H
3
O
+
]
⇒ [H
3
O
+
] = 10
−pH
pOH roztworu: pOH = - log [OH
−
]
⇒ [OH
−
] = 10
−pOH
W roztworze:
kwaśnym
pH < 7 a pOH > 7
obojętnym
pH = pOH = 7
zasadowym
pH > 7 a pOH < 7
pH < 0 i pH > 14 (???)
kwasowość roztworu mierzona funkcją kwasowości Hammetta H
o
,
np.
80% H
2
SO
4
H
o
= - 7,3
12 M KOH
H
o
= 18,2
pH + pOH = 14
dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
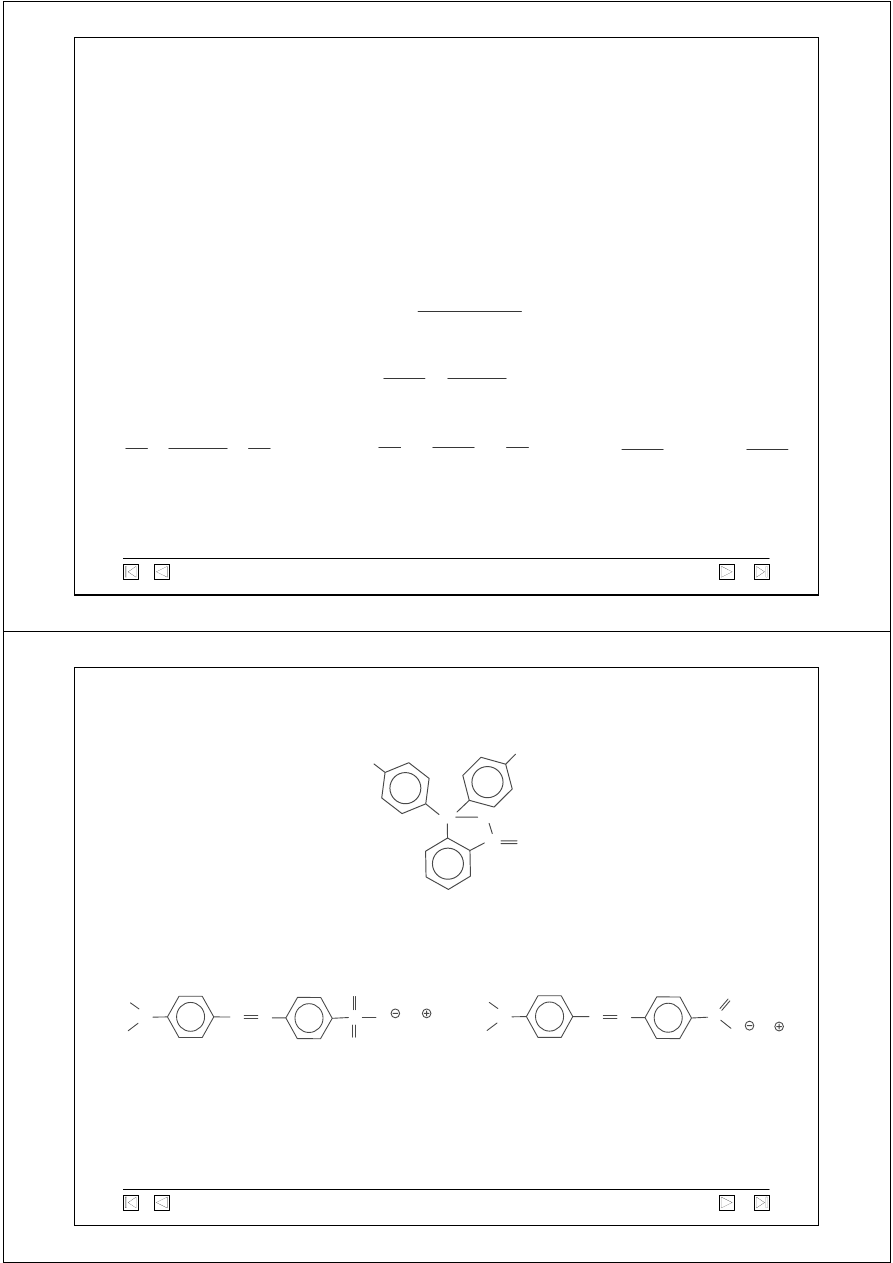
Wskaźniki pH
Służą do przybliżonego określania odczynu roztworu (pH), są nimi
słabe kwasy lub zasady organiczne, których forma niezdysocjowana
ma inną barwę niż w forma zdysocjowana.
HInd H
+
+ Ind
−
IndOH
Ind
+
+ OH
−
pH + 1
≥ pK
a
≥ pH - 1
(wskaźniki kwasowo-zasadowe, indykatory)
[HInd]
]
[Ind
]
[H
K
a
−
+
⋅
=
[HInd]
]
[Ind
]
[H
K
+
a
−
=
1
10
[HInd]
]
[Ind
10
1
≤
≤
−
→
←
→
←
1
10
]
[H
K
10
1
a
≤
≤
+
]
[H
10
K
10
]
[H
a
+
+
≤
≤
więc
więc
dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
K
a
= 3,5 · 10
−4
N
N
N
H
3
C
H
3
C
S
O
O
O
Na
oranż metylowy
(czerwona) 3,2 < pH < 4,5 (żółta)
N
N
N
H
3
C
H
3
C
O Na
(czerwona) 4,2 < pH < 6,2 (żółta)
czerwień metylowa
C
O
K
a
= 1,0 · 10
−5
C
C
O
O
OH
HO
fenoloftaleina

dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
Barwa postaci
zasadowej
Barwa postaci
kwasowej
Zakres pH
zmiany barwy
Wskaźnik
malinowa
bezbarwna
8,2
÷ 10,0
Fenoloftaleina
niebieska
żółta
6,0
÷ 7,6
Błękit bromotymolowy
niebieska
czerwona
5,0
÷ 8,0
Lakmus
żółta
czerwona
3,2
÷ 4,5
Oranż metylowy
•
papierki wskaźnikowe - paski bibuły nasączone
odpowiednimi wskaźnikami
•
pehametr - aparat do mierzenia pH
dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
7,3
÷ 7,4
Osocze krwi
2,2
÷ 2,4
Cytryny
12
10% NH
3
9
÷ 10
Środki piorące
~ 8
Roztwór proszku do pieczenia
6,3
÷ 6,6
Mleko krowie
5,8
÷ 6,4
Gruszki
~ 5
Kawa
4,4
Kwaśne mleko
4
÷ 5
Piwo
~ 3,9
Woda sodowa
2,9
÷ 3,3
Jabłka
2,8
÷ 3,8
Wino
pH
Roztwór
2,3
Ocet spożywczy
2,1
Coca-cola
~ 1
Sok żołądkowy
0
4% HCl
Kwasowość różnych środowisk
Wyszukiwarka
Podobne podstrony:
Iloczyn jonowy wody, CHEMIA, semestr 1, chemia ogólna, wykłady
Chemia labolatorium, chemia gr.B, Iloczyn jonowy wody i jego zal
Chemia XIII Iloczyn jonowy wody id 113005
Iloczyn jonowy wody
Chemia labolatorium, Wskaźniki pH, Iloczyn jonowy wody i jego zależność od temperatury
38 Równowagi jonowe w roztworach wodnych (dysocjacja, iloczyn jonowy wody, pH, indykatory pH, roztwo
ILOCZYN JONOWY id 210758 Nieznany
Iloczyn jonowy, AWF Wro, Studia 2 semestr
iloczyn jonowy, Szkoła, penek, Przedmioty, Chemia, Teoria
3 - Bilans jonowy wody, AGH, SEMESTR 3, TECHNOLOGIE OCZYSZCZANIA WODY I ŚCIEKÓW, Ćwiczenie 3
ILOCZYN JONOWY id 210758 Nieznany
Bilans jonowy, AGH, SEMESTR 3, TECHNOLOGIE OCZYSZCZANIA WODY I ŚCIEKÓW, Ćwiczenie 3
5.Zastosowanie mas jonowymiennych w technologii uzdatniania wody, pytania dyplomowe
30 iloczyn próba, 13
więcej podobnych podstron