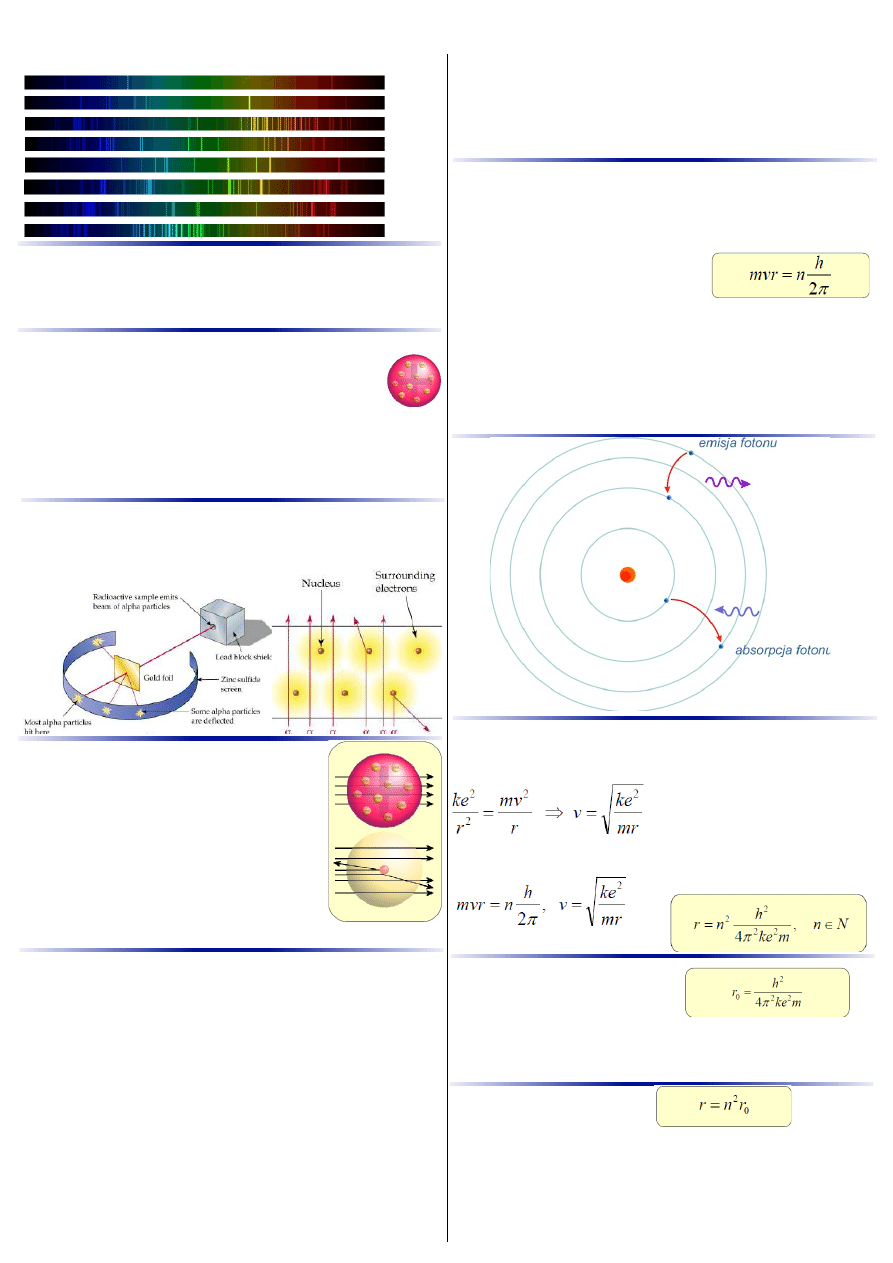
Model Bohra atomu wodoru.
Widma liniowe pierwiastków.
wodór
hel
neon
tlen
węgiel
azot
sód
żelazo
Aby odpowiedzieć na pytanie dlaczego wodór i inne
pierwiastki nie emitują wszystkich częstotliwości fal
elektromagnetycznych należy zastanowić się nad budową
atomu.
W 1897 roku Joseph Thomson odkrył elektron.
Stwierdzono wówczas, że cząstka ta ma ładunek
ujemny. żeby atom miał być cząstką elektrycznie
obojętną musi w swoim wnętrzu zawierać ładunek
dodatni.
Według pomysłu Thomsona atom to kula materii o
ładunku dodatnim, w której zawieszone są elektrony o
ładunku ujemnym.
Doświadczenie Rutherforda (1909).
Polegało na bombardowaniu złotej folii strumieniem
cząstek alfa (jąder helu) i obserwacji odchyleń ich toru
ruchu.
Gdyby atom był zbudowany tak, jak
twierdził Thomson, to cząstki alfa
swobodnie przechodziłyby przez złotą
folię bez odchylenia.
Doświadczenie Rutherforda wykazało, że
atom składa się z ciężkiego, ale bardzo
małego, dodatnio naładowanego jądra i
krążących wokół niego lekkich, ujemnie
naładowanych elektronów.
Większość przestrzeni wewnątrz atomu jest pusta.
Według fizyki klasycznej dowolna cząstka naładowana
poruszająca się po linii krzywej wysyła promieniowanie
elektromagnetyczne, tracąc energię kinetyczną i, co za
tym idzie, zwalniając.
Elektron krążący wokół jądra atomowego, jako cząstka
naładowana, powinien emitować energię w postaci fali
elektromagnetycznej o dowolnej długości tracąc w tym
czasie energię.
W takim przypadku w bardzo krótkim czasie
(rzędu 10-18s) straciłby całą energię kinetyczną
i spadłby na jądro atomowe.
W 1918 roku duński fizyk Niels Bohr, w oparciu o wyniki
doświadczenia Rutherforda, stworzył model atomu, który
wyjaśniał pochodzenie liniowego widma wodoru.
Założenia modelu były sprzeczne z założeniami fizyki
klasycznej.
Postulaty Bohra:
• elektron może poruszać się tylko po dozwolonych
(skwantowanych) kołowych orbitach, dla których moment
pędu jest równy całkowitej wielokrotności stałej Plancka
podzielonej przez 2π. (n jest liczbą
naturalną, nazywaną główną liczbą
kwantową).
• elektron poruszając się po dozwolonej orbicie nie
wypromieniowuje energii,
• promieniowanie zostaje wyemitowane, gdy elektron
skokowo przechodzi z orbity wyższej na niższą,
• elektron przechodzi na orbitę wyższą po pochłonięciu
kwantu energii o wartości równej różnicy energii orbit.
Jaki jest promień dozwolonej orbity?
Na poruszający się elektron działa siła oddziaływania
elektrostatycznego, będąca jednocześnie siłą dośrodkową.
Podstawiając otrzymane wyrażenie do pierwszego
postulatu Bohra:
Otrzymujemy:
Jaki jest najmniejszy promień?
Dla n=1, otrzymujemy:
Stałą taką nazywany jest
promieniem Bohra atomu wodoru
.
Jeśli elektron krąży po orbicie o promieniu r0, to
atom
jest w stanie podstawowym.
Promień dowolnej orbity:
Jeśli elektron krąży po orbicie o promieniu większym niż
r0, to
elektron znajduje się na wyższym poziomie
energetycznym
, a
atom jest w stanie wzbudzonym
.
Model Bohra atomu wodoru.
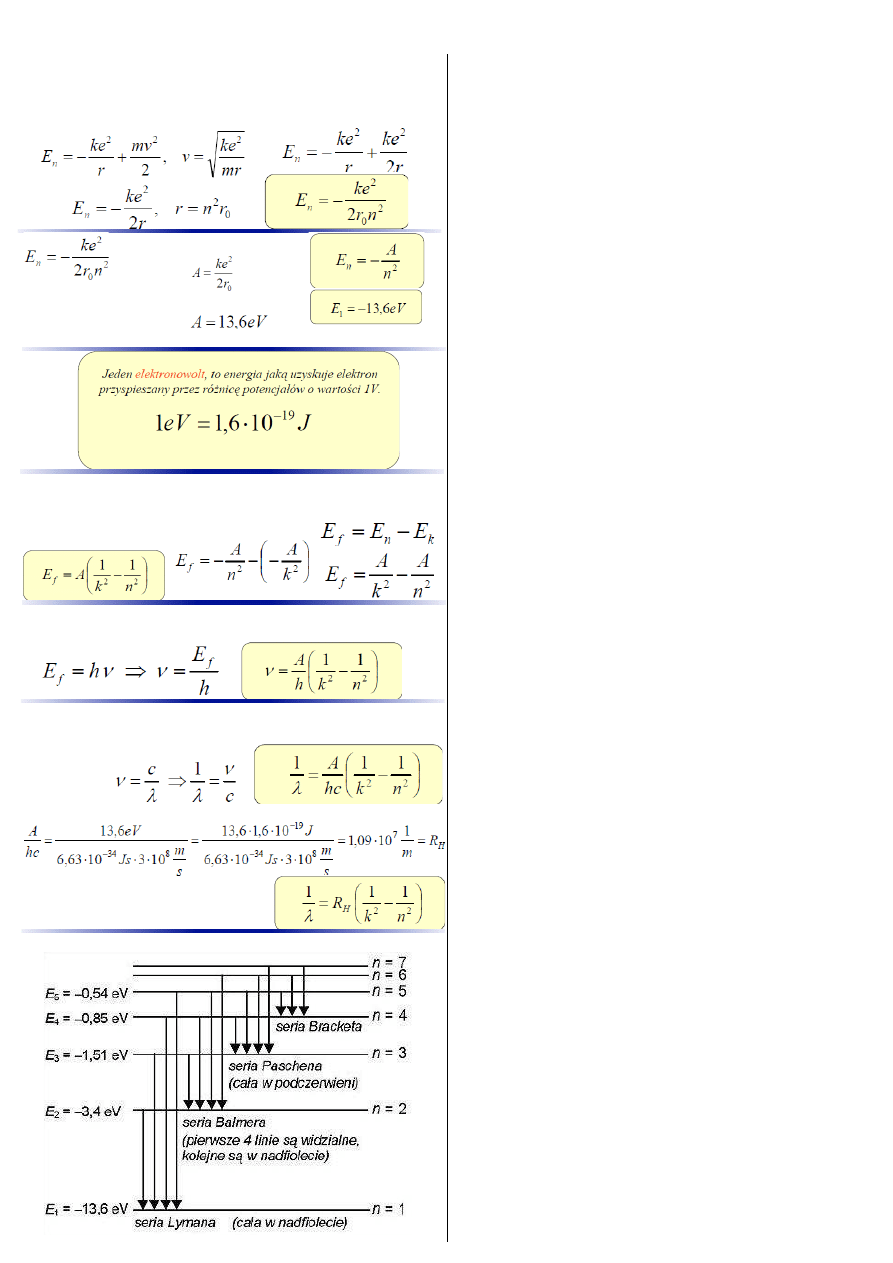
Jaką energię posiada elektron na dozwolonej orbicie?
Całkowita energia elektronu jest sumą jego energii kinetycznej
i potencjalnej oddziaływania elektrostatycznego z jądrem
atomowym.
Jeśli wprowadzimy stałą
to
energia elektronu na n-tej orbicie
Wartość stałej A wynosi
:
A więc
energia elektronu na pierwszej orbicie
wynosi
Jaką energię ma foton przeskakujący z orbity n na orbitę k?
Jeśli elektron przeskakuje z n-tej orbity na k-tą (n>k),
to wysyła foton o energii równej różnicy
energii na orbitach.
Jaką jest częstotliwość takiego fotonu?
Ponieważ energię fotonu określa równanie:
Jaką długość ma taka fala elektromagnetyczna?
Częstotliwość i długość fali elektromagnetycznej powiązane są
równaniem:
wyrażenie
to stała Rydberga, czyli
otrzymaliśmy
równanie Balmera
Możliwość zmiany orbity przez elektron w atomie wodoru.
Model Bohra został zastąpiony przez nową teorię
–
mechanikę kwantową
.
Wyszukiwarka
Podobne podstrony:
Model budowy atomu wodoru postulaty Bohra
Model budowy atomu wodoru postulaty Bohra
04 TEORIA (MODEL) BOHRA ATOMU Nieznany
F-2 Model atomu wodoru według Bohra
Model Bohra budowy atomu wodoru
1 Budowa atomu model Bohra cw 11
Model Bohra budowy atomu, Radosna Tfurczość Własna, referaty pół-moje
Model budowy atomu Bohra
9Efekt Comptona i model budowy atomu wg bohra
Własności atomu wodoru według modelu Bohra
rys, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, 11 Poziomy energetyc
Promieniowanie atomu wodoru
Nr ćwiczenia 11, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, 11 Pozio
poziomy energetyczne atomu wodoru, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Labo
Poziomy energetyczne atomu wodoru. Stała Rydberga, Elektrotechnika AGH, Semestr II letni 2012-2013,
model bohra somm
model budowy atomu 2
Model Bohra
więcej podobnych podstron