
ANNA LEŚNIKOWSKA
JOLANTA BIAŁASIEWICZ
SYLWIA KOKOCKA
METODY ROZDZIELCZE:
CHROMATOGRAFIA GAZOWA,
CHROMATOGRAFIA CIENKOWARSTWOWA,
CHROAMTOGRAFIA CIECZOWA,
ELEKTROFOREZA,

Wprowadzenie do chromatografii
gazowej
Chromatografia jest fizykochemiczną metodą
rozdzielania, w której składniki rozdzielane
ulegają podziałowi między dwie fazy: jedna jest
nieruchoma (faza stacjonarna), a druga (faza
ruchoma) porusza się w określonym kierunku.
Różny podział składników mieszaniny pomiędzy
obie fazy powoduje zróżnicowanie prędkości
migracji i rozdzielenie składników. Jeżeli fazą
ruchomą jest gaz to jest to chromatografia
gazowa.
Fazą stacjonarną w chromatografii gazowej może
być:

Fazą stacjonarną w chromatografii gazowej może
być:
· ciało stałe: adsorbent, wtedy mamy do czynienia
z chromatografią adsorpcyjną
· ciecz osadzona na stałym nośniku w postaci
jednorodnego filmu (warstwy), wtedy mamy
do czynienia z chromatografią podziałową
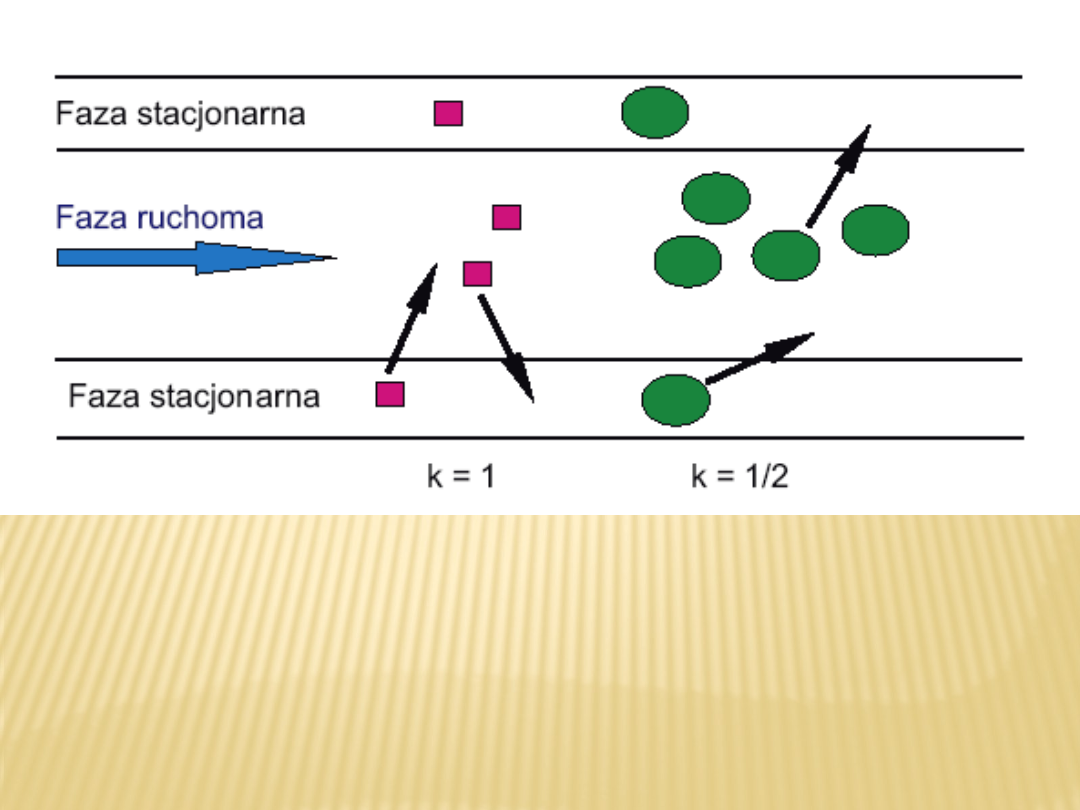
Mechanizm procesu chromatograficznego.
Substancje różowa i zielona charakteryzują się
zróżnicowanymi współczynnikami retencji k.

Faza ruchoma porusza się wewnątrz kolumny
natomiast faza stacjonarna jest osadzona na
wewnętrznych ściankach kolumny. Związki
chemiczne z większym powinowactwem do fazy
stacjonarnej są selektywnie zatrzymywane przez
nią i poruszają się wzdłuż kolumny znacznie
wolniej.
Związki z mniejszym powinowactwem do fazy
stacjonarnej poruszają się wzdłuż kolumny
szybciej i tym samym opuszczają kolumnę, czyli
eluują z kolumny, jako pierwsze. Równowaga
podziału pomiędzy fazy ma charakter
dynamiczny, czyli cząsteczki substancji
nieustannie
przechodzą od fazy ruchomej do stacjonarnej i z
powrotem.

Parametry chromatograficzne w
chromatografii gazowej
Podstawowym parametrem określającym podział
substancji X pomiędzy dwie fazy jest
stała podziału Kc, którą można wyrazić
równaniem Nernsta.
Cs
Kc = -----
Cm
gdzie: cs - oznacza stężenie substancji X w fazie stacjonarnej,
cm – oznacza stężenie substancji X w fazie ruchomej.

Innym ważnym parametrem jest współczynnik
retencji k, który jest miarą czasu, w jakim
substancja X przebywa w fazie stacjonarnej, w
stosunku do czasu, w którym przebywa ona w
fazie
ruchomej. Określa on, ile razy dłużej dana
substancja jest zatrzymywana przez fazę
stacjonarną niż
potrzebowałaby na przejście przez kolumnę z
prędkością poruszania się fazy ruchomej. Związki
chemiczne charakteryzujące się różnymi
współczynnikami retencji mogą zostać
rozdzielone na
kolumnie chromatograficznej.
liczba moli substancji X w fazie stacjonarnej
k=-----------------------------------------------------------------------------
liczba moli substancji X w fazie ruchomej

Efekt rozdziału chromatograficznego jest
wykreślany w postaci chromatogramu, który
przedstawia wykres wskazań sygnału uzyskanego
w detektorze w funkcji czasu lub w funkcji
objętości fazy ruchomej. Zapis stężenia
pojedynczej substancji w funkcji czasu ma postać
krzywej
Gaussa i nosi nazwę piku (ang. peak czyli szczyt).
Typowy chromatogram przedstawiony jest na rys.
2. Możemy określić na nim:
· czas retencji tR - czas mierzony od momentu
wprowadzenia próbki na kolumnę do
momentu pojawienia się na wyjściu z kolumny
maksimum stężenia danego związku
chemicznego czyli maksimum piku

L
tR = --------- X (1+k)
u
gdzie: L - długość kolumny chromatograficznej, u - średnia, liniowa prędkość
przepływu
gazu nośnego, k - współczynnik retencji,
· zerowy czas retencji tM (czas „martwy”) - czas
przebywania w kolumnie substancji,
która nie ma powinowactwa do fazy stacjonarnej
np. metanu; czas zerowy jest równy
czasowi przepływu fazy ruchomej przez kolumnę,
· zredukowany czas retencji t’R - jest różnicą
pomiędzy czasem retencji a zerowym
czasem retencji
t’R = tR - tM
tM
L
u = (6)
Rys.

-współczynnik retencji k
tR- tM
k=---------------------
tM
· szerokość piku mierzoną u podstawy piku w lub
szerokość piku mierzoną na określonej
wysokości piku np. w połowie wysokości w1/2h,
· liniową prędkość przepływu fazy ruchomej (u)
przez kolumnę można łatwo wyznaczyć
eksperymentalnie poprzez analizę
chromatograficzną substancji niezatrzymywanej
na
kolumnie np. metanu i zmierzenie czasu przejścia
jej przez kolumnę czyli czasu
zerowego (tM).
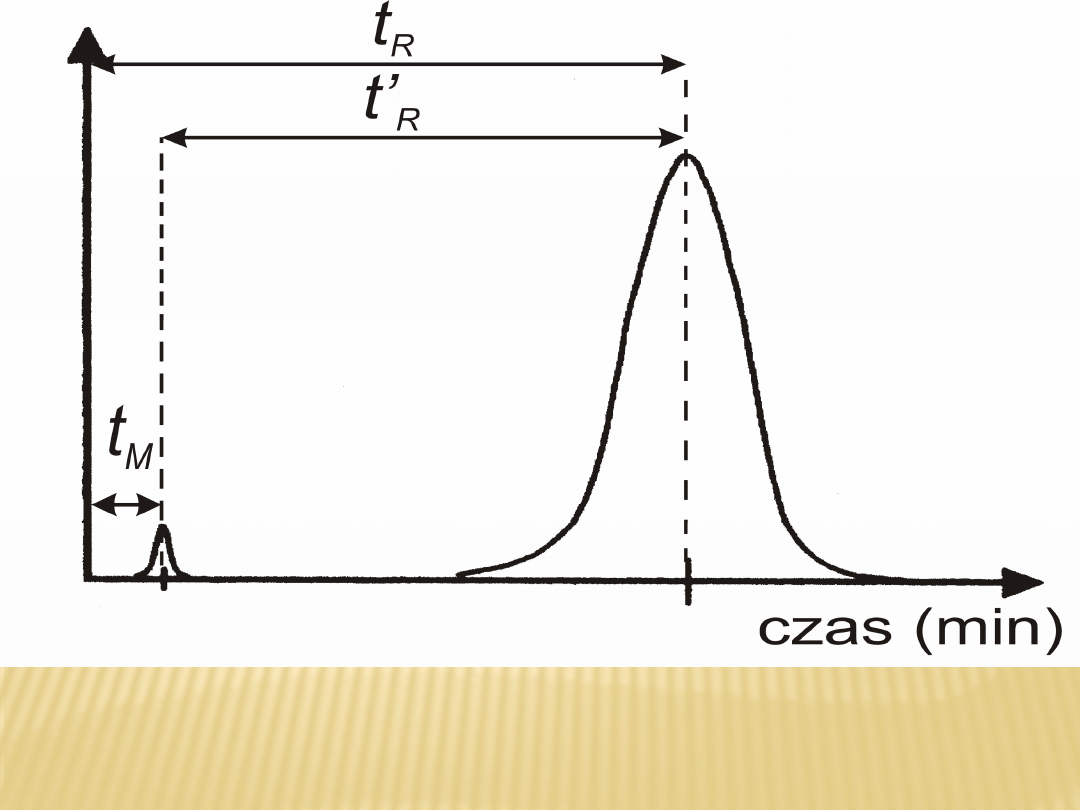
Chromatogram i sposób pomiaru podstawowych wielkości
chromatograficznych.

Chromatografia cienkowarstwowa
Chromatografia cienkowarstwowa (w skrocie z
ang. TLC = Thin Layer Chromatography) ma
szereg cech wspólnych z bibułową - posiada
wszystkie jej zalety, natomiast pozwala uniknąć
wielu jej wad. Fazę nieruchomą (adsorbent, ciecz
na nośniku, jonit, porowaty polimer) nanosi się
cienką warstwą (ok.0,25 mm) na płytkę szklaną
lub metalową w postaci drobnoziarnistego
proszku. Aby uzyskać powtarzalne wyniki analiz,
zarówno grubość warstwy, jak
i równomierność jej rozłożenia na wszystkich
używanych płytkach musi być taka sama.

Dlatego
stosuje się zwykle specjalne urządzenia do
nanoszenia sorbenta na płytki. Po naniesieniu
warstwy
sorbenta poddaje się ją suszeniu w temperaturze
100 - 1100C.
W odmianie adsorpcyjnej chromatografii
cienkowarstwowej najczęściej stosuje się jako
fazę
stacjonarną żele krzemionkowe (ok. 80%
zastosowań), niekiedy tlenek glinu, ziemię
okrzemkową i in. Możliwości doboru
rozpuszczalnika w chromatografii
cienkowarstwowej są
bardzo szerokie. Doboru rozpuszczalnika
dokonuje się zwykle na podstawie tzw. szeregu
eluotropowego rozpuszczalników ułożonego w
kolejności rosnącej polarności jego składników.

Analizowane mieszaniny wprowadza się na płytkę
identycznie jak w przypadku chromatografii
bibułowej. Do rozwijania chromatogramów stosuje
się najczęściej technikę wstępującą.
Wywoływanie chromatogramów przeprowadza się
po wysuszeniu płytki. tj. po odparowaniu
zawartego w niej rozpuszczalnika rozwijającego
podobnie jak w chromatografii bibułowej.
Rownież metody jakościowej i ilościowej
interpretacji chromatogramów są takie same
(wizualizacja chromatogramów, porównywanie
wartości Rf, pomiary ilościowe). W tym miejscu
jednak warto wymienić szereg ‘zalet
chromatografii cienkowarstwowej
w porównaniu z bibułową. Obok wspomnianej już
wcześniej możliwości stosowania
roznorodnych faz stacjonarnych w TLC istnieje
znacznie

większy asortyment substancji
rozwijających i wywołujących, ponieważ w
odróżnieniu od bibuły, stosowane sorbenty
nieorganiczne są odporne na silnie agresywne
związki, takie jak stężone kwasy, ługi, silne
utleniacze itp. Istotną zaletą TLC jest możliwość
szybkiego rozwijania chromatogramów.
Przeciętny czas rozwijania chromatogramu wynosi
ok. 1 godz. podczas gdy w chromatografii
bibułowej jest to proces często wielogodzinny.
Ponadto na ogół sprawność rozdziału techniką
TLC jest wyższa niż w chromatografii bibułowej.
Objawia się to w lepszym wykształceniu
plamek i mniejszych ich rozmiarach. Dzięki temu
osiąga się z reguły lepsze wyniki interpretacji
jakościowej i ilościowej analiz.

Elektroforeza
Elektroforeza jest zjawiskiem elektrokinetycznym,
w którym pod wpływem
przyłożonego pola elektrycznego przemieszczają
się makrocząsteczki obdarzone
niezrównoważonym ładunkiem elektrycznym.
Prędkość przemieszczania się naładowanej
elektrycznie makrocząsteczki zależy od jej
ładunku, rozmiaru, kształtu oraz oporów ruchu
środowiska. Wykorzystując te zależności można
dokonać szybkiej separacji różnych
makrocząsteczek przy zastosowaniu stosunkowo
prostych urządzeń i przy relatywnie niskim
nakładzie kosztów.

Te względy zadecydowały o powszechności
zastosowań technik
elektroforetycznych.
Głównym obszarem zastosowań elektroforezy są:
biochemia białek i kwasów
nukleinowych, biologia molekularna,
farmakologia, medycyna sądowa, weterynaria,
diagnostyka medyczna oraz kontrola jakości
żywności. Należy również wspomnieć, że
wykorzystanie technik elektroforetycznych
umożliwiło uzyskanie pełnej sekwencji DNA
człowieka w niedawno zakończonym projekcie
genomiki (ang. genomics). Wszystkie
powszechnie stosowane techniki
sekwencjonowania DNA w końcowym swym
etapie opierają
się bowiem o elektroforezę.

Ze względu na sposób umieszczenia nośnika
elektroforetycznego można wyróżnić
elektroforezę kapilarną, elektroforezę pionową
oraz elektroforezę poziomą.
Elektroforeza kapilarna. W elektroforezie
kapilarnej, określanej często skrótem
HPCE (ang. high performance capillary
electrophoresis) elektrolit wypełnia kapilarę
o wewnętrznej średnicy 50 - 100 μm i długości 20-
30 cm. Oba końce kapilary zanurzone są
w zasobnikach z odpowiednimi elektrolitami.
Sama kapilara wypełniona jest swobodnym
elektrolitem (elektroforeza swobodna) lub
porowatym nośnikiem (elektroforeza na nośniku).

Czas rozdziału
jednej próbki wynosi około 10-20 minut. Detekcja
rozdzielonych grup makrocząsteczek
realizowana jest u ujścia kapilary przy pomocy
detektora o konstrukcji zbliżonej do
przepływowego detektora stosowanego w
chromatografii cieczowej.
Elektroforeza pionowa - jest najpowszechniej
stosowną techniką. W technice tej
nośnik elektroforetyczny wypełnia szklane rurki
(elektroforeza rurkowa) lub znajduje się
pomiędzy dwoma płytkami rozdzielonymi
przekładkami dystansowymi (ang. spacer)
(elektroforeza płytowa). Na rysunku 1 pokazano
schematycznie oba rodzaje elektroforezy
pionowej.
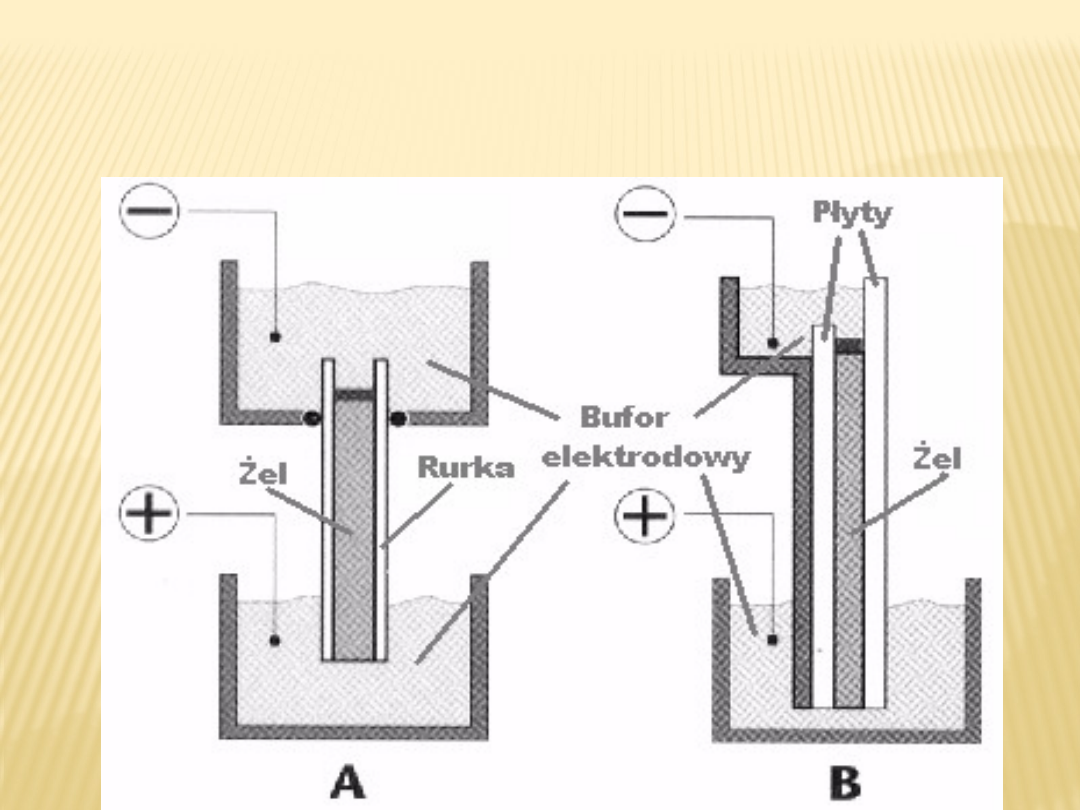
Na rysunku 1 pokazano schematycznie oba
rodzaje elektroforezy
pionowej.

A. elektroforeza rurkowa
B. elektroforeza płytowa
Jak łatwo zauważyć, górna część nośnika musi
być przykryta warstwą buforu
elektrodowego (elektrolitu). Rozwiązanie takie ma
naturalną tendencję do wyciekania
buforów z górnego naczynia, co wymaga uwagi
laboranta podczas trwania rozdziału. Brak
kontaktu elektrolitu z żelem powoduje przerwanie
obwodu elektrycznego i w związku z tym
przerwanie procesu elektroforezy.

Inną niedogodnością tego rozwiązania jest
trudność z odprowadzeniem ciepła generowanego
przez przepływający prąd. Dotyczy to szczególnie
elektroforezy rurkowej. W przypadku elektroforezy
płytowej możliwe jest odprowadzanie
ciepła przez ściankę kontaktującą się z jedną z
płyt. Zaletą tego typu rozwiązania jest zwykle
stosunkowo niska cena dostępnych na rynku
aparatów.
Elektroforeza pozioma - jest rodzajem
elektroforezy w którym nośnik umieszczony
jest w płaszczyźnie poziomej (rys. 2). Zaletą tego
rozwiązania jest brak wycieków elektrolitu
oraz możliwość łatwego odprowadzenia ciepła
generowanego w trakcie przepływu prądu.
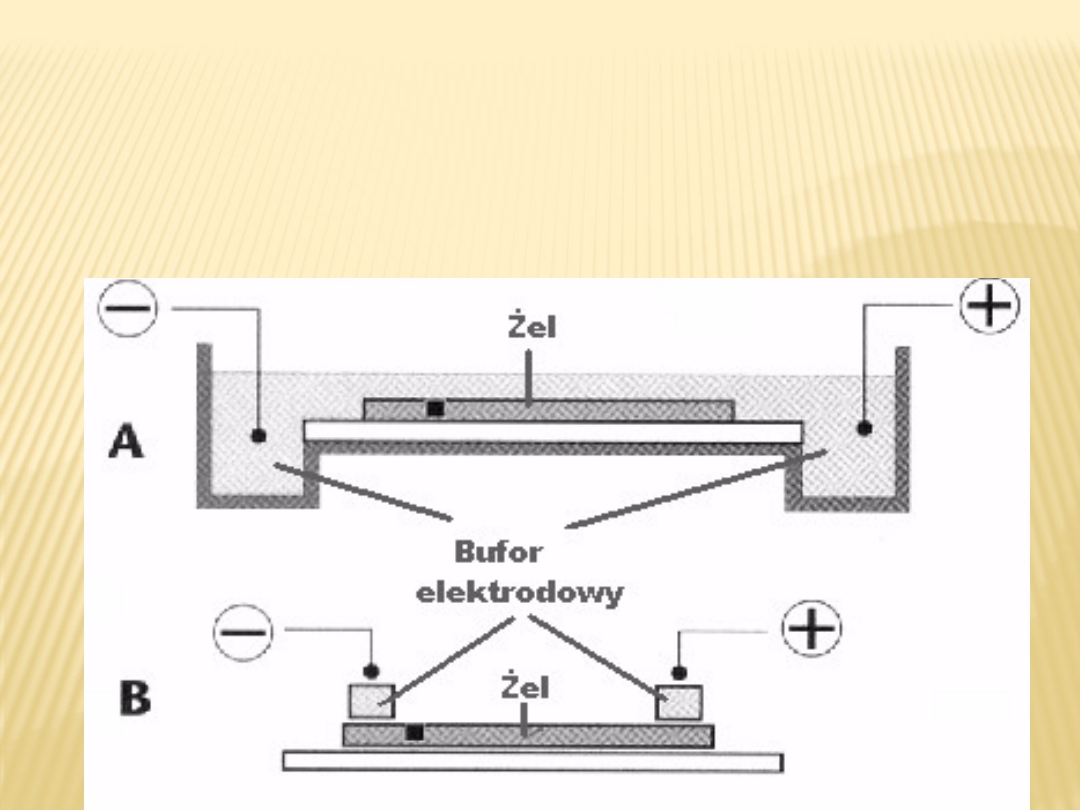
Elektroforeza półsucha, w której bufory
elektrodowe zamknięte są w zestalonej agarozie
lub
w warstwach bibuły filtracyjnej, pozwala ponadto
na znaczne ograniczenie zużycia
chemikaliów niezbędnych do przygotowania
buforów.

A. elektroforeza zanurzeniowa
B. elektroforeza półsucha



Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
Wyszukiwarka
Podobne podstrony:
Niekonwencjonalne metody rozdzielania w biotechnologii
metody rozdziału, Analityka semestr IV, Analiza Instumentalna
new Mechaniczne metody rozdziału składnikówCw8KaR, Studia, Jakość, OTŻ, OTŻ, KaRlos
CHROMATOGRAFIA CIECZOWA cz.2, INSTRUMENTALNE METODY ROZDZIAŁU I ANALIZY SUBSTANCJI - ŚREDNIOCIŚNIENI
Mechaniczne metody rozdziału składnikówCw8KaR, Studia, Jakość, OTŻ, OTŻ, KaRlos
Metody rozdzielania i oczyszczania substancji chemicznych, ~FARMACJA, I rok, chemia (ciul wie co), S
zwożdziak,instrumenty ochrony środowiska L,,NOWOCZESNE METODY ROZDZIELANIA I ZATEZANIA
Metody rozdzielania mieszanin, Dokumenty(1)
Mieszaniny i metody rozdzielania
Metody rozdziału mieszanin chemicznych strącanie, dekantacja,
Metody rozdzielania i oczyszczania zwi±zkówchemicznych, Technologia Żywnośći UR, I rok, ChemiaII
04. Metody rozdzielania, Technologia Chemiczna, Rok III, Semestr II, Instrumentalne metody analizy,
Metody rozdzielania substancji
nowoczesne metody rozdziału mieszanin PROJEKT
Metody rozdzielania mieszanin
37 Metody rozdziału i oczyszczania cieczy oraz ciał stałych
Metody rozdzielania substancji
więcej podobnych podstron