
ROLA cGMP W TRANSMISJI SYGNAŁÓW
ROLA cGMP W TRANSMISJI SYGNAŁÓW
I PATOGENEZIE CHORÓB
I PATOGENEZIE CHORÓB
NACZYNIOWYCH
NACZYNIOWYCH
NO- sytazy
NO- sytazy
nNOS(1), eNOS(2),
nNOS(1), eNOS(2),
iNOS(3)
iNOS(3)
NO
NO
receptor
receptor
GTP ATP
GTP ATP
CG – cGMP CA - cAMP
CG – cGMP CA - cAMP
PKG PKA
PKG PKA
VASP
VASP
PDE 1 - 8
PDE 1 - 8

Serce, mózg
Serce, mózg
mięśniówka
mięśniówka
gładka
gładka
ANP BNP NO
ANP BNP NO
GTP
GTP
pCG sCG
pCG sCG
cGMP cGMP
cGMP cGMP
Hamowanie Rozkrcz m.
Hamowanie Rozkrcz m.
gładkiej
gładkiej
czynności
czynności
m. sercowego
m. sercowego
i m. szkieletowych
i m. szkieletowych
Serce, mózg
Serce, mózg
mięśniówka
mięśniówka
gładka
gładka
Receptory
Receptory
adrenergiczne
adrenergiczne
ATP ATP
ATP ATP
pCA sCA
pCA sCA
cAMP cAMP
cAMP cAMP
Pobudzenie Ca Rozkurcz m. gładkiej
Pobudzenie Ca Rozkurcz m. gładkiej
Ca
Ca
czynności
czynności
m. sercowego
m. sercowego
i m. szkieletowych
i m. szkieletowych

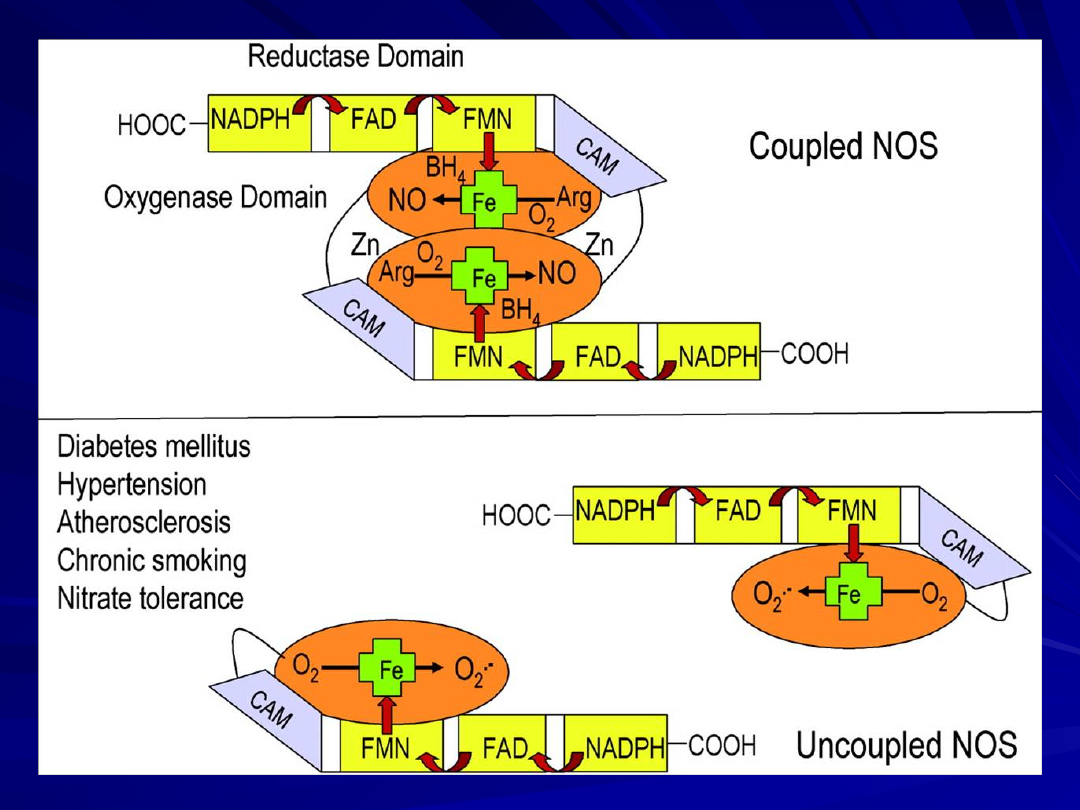
NO – syntaza śródbłonka
NO – syntaza śródbłonka
eNOS
eNOS
Czynniki rozprzęgające dipol
Czynniki rozprzęgające dipol
(eNOS – eNOS)
(eNOS – eNOS)
Cukrzyca
Cukrzyca
Nadciśnienie
Nadciśnienie
Miażdżyca
Miażdżyca
Chroniczne palenie
Chroniczne palenie
Tolerancja na nitraty
Tolerancja na nitraty
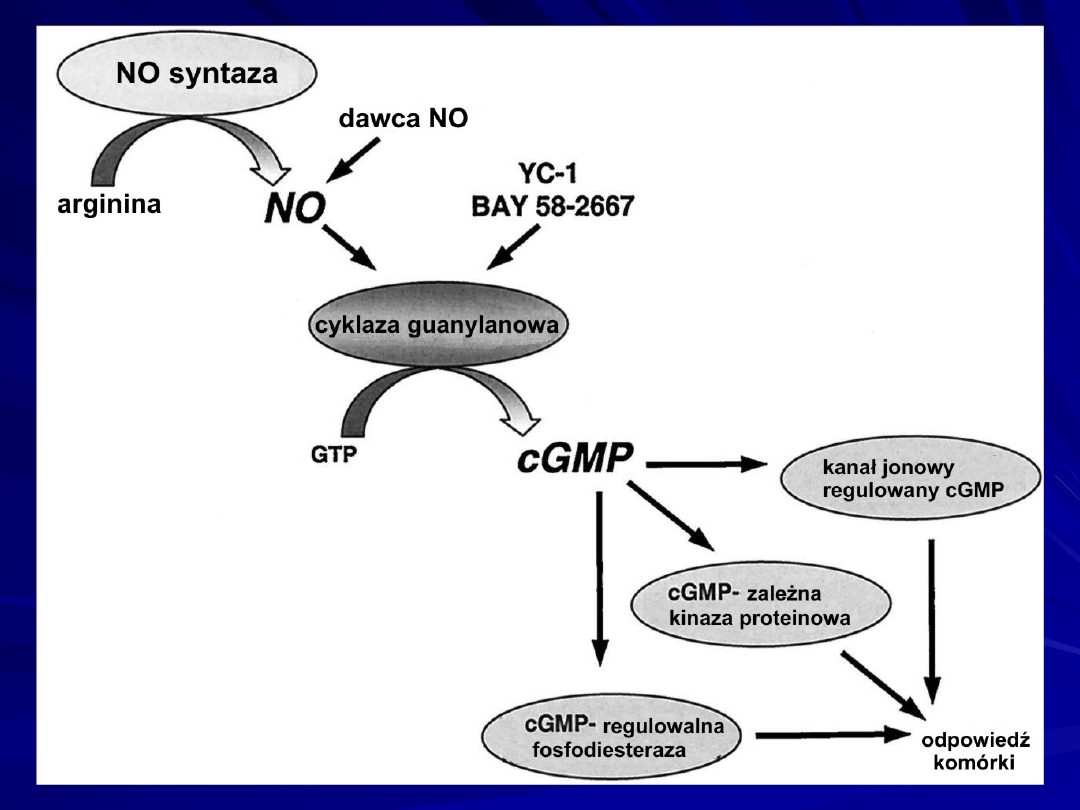

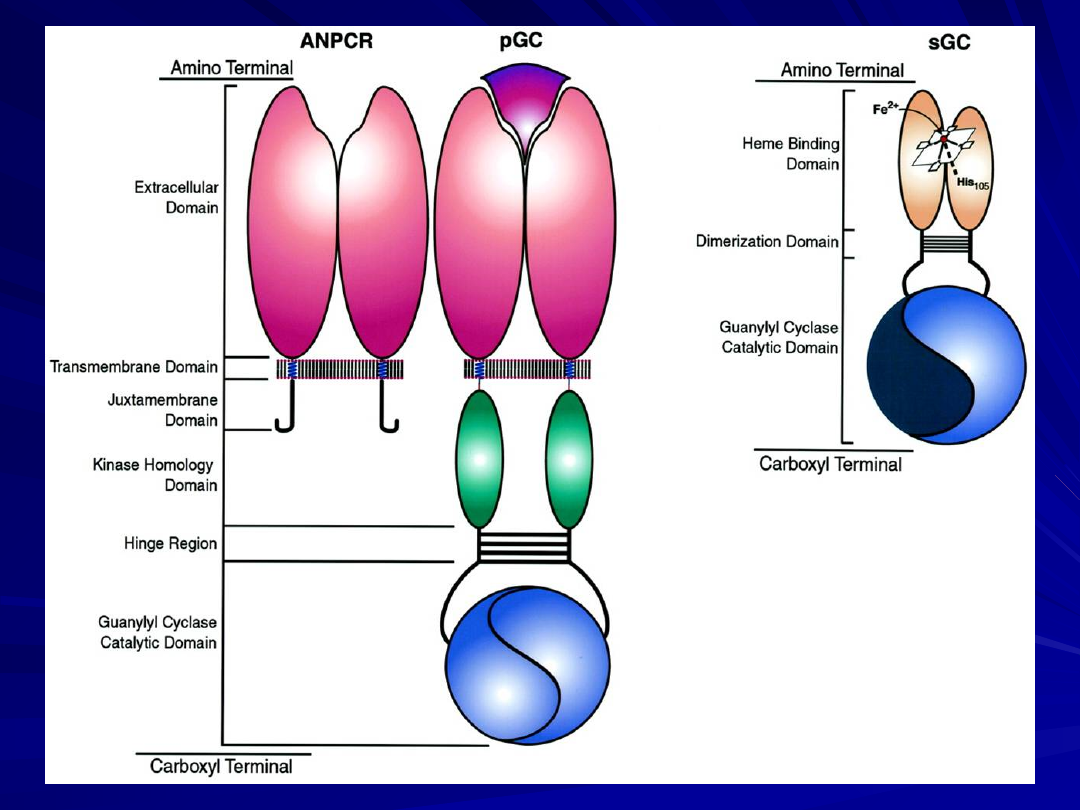
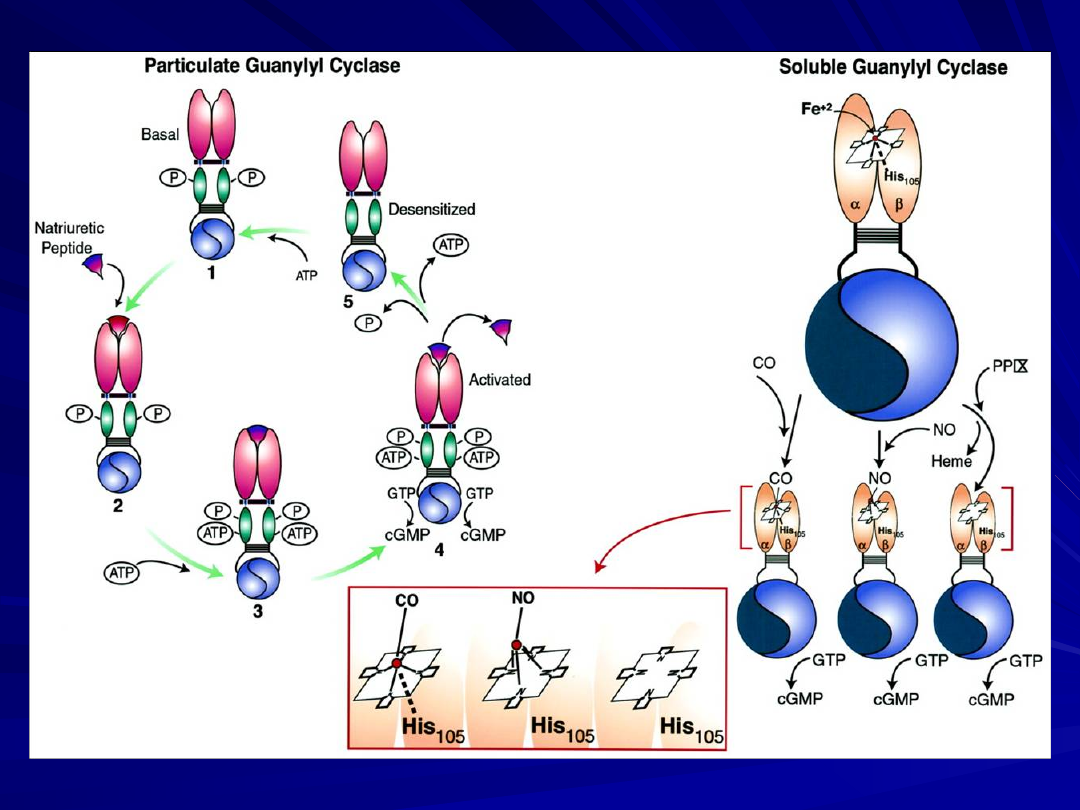
NO/cGMP kaskada sygnałów.
NO endogenny syntetyzowany przez NO- syntazy: eNOS i
nNOS
Nitraty - uwalniane z egzogennie stosowanych donatorów
NO - aktywuje CG i prowadzi do wzrostu poziomu cGMP.
cGMP jako II-przekaźnik moduluje
aktywność
:
cGMP -zależnych kinaz,
kanałów jonowych bramkowanych przez cGMP,
cGMP -regulowanych fosfodwuesteraz.
Wymienione efektory są ściśle związane z licznymi
funkcjami fizjologicznymi
układu sercowo – naczyniowego
układu nerwowego.
YC-1 and BAY 58-2667 reprezentują nową klasę aktywatorów
CG
- aktywowanej przez NO.

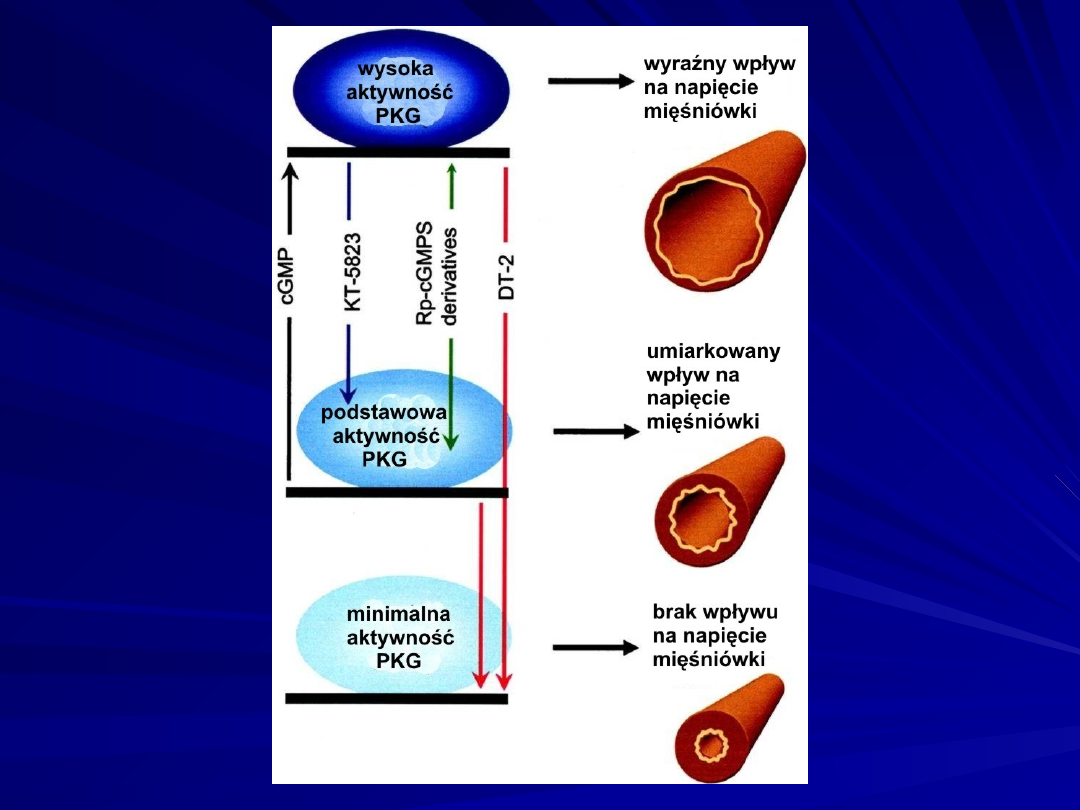
Nowy mechanizm regulacji naczyń związany z
Nowy mechanizm regulacji naczyń związany z
hamowaniem cGMP- zależnej kinazy proteinowej (PKG).
hamowaniem cGMP- zależnej kinazy proteinowej (PKG).
Peptyd DT-2 penetrujący błonę komórkową – inhibitor
Peptyd DT-2 penetrujący błonę komórkową – inhibitor
PKG.
PKG.
Konstytutywna aktywność PKG wywiera ciągłe modulujące działanie
na
toniczne napięcie naczyń wyzwalane nawet przy minimalnym poziomie
cGMP.
Wzrost poziomu cGMP powoduje dalszy wzrost aktywności kinazy
(High PKG Activity), nasilając wpływ modulujący tego enzymu.
Dostępne inhibitory, takie jak :
KT-5823 (strzałka niebieska)
pochodne Rp-cGMPS (strzałka zielona),
oraz Rp-8-pCPT-cGMPS i Rp-8-Br-PET-cGMPS,
odwracają aktywność kinazy PKG tylko do podstawowego
poziomu.
Pochodne Rp-cGMPS wywierają także częściowo stymulujące działanie na
kinazy
co przedstawia podwójna strzałka.
DT-2 (czerwona strzałka), hamuje nie tylko aktywność PKG stymulowanej
przez
cGMP ale także podstawową aktywność PKG, znosząc w ten sposób
regulację
naczyniową związaną z kinazą.
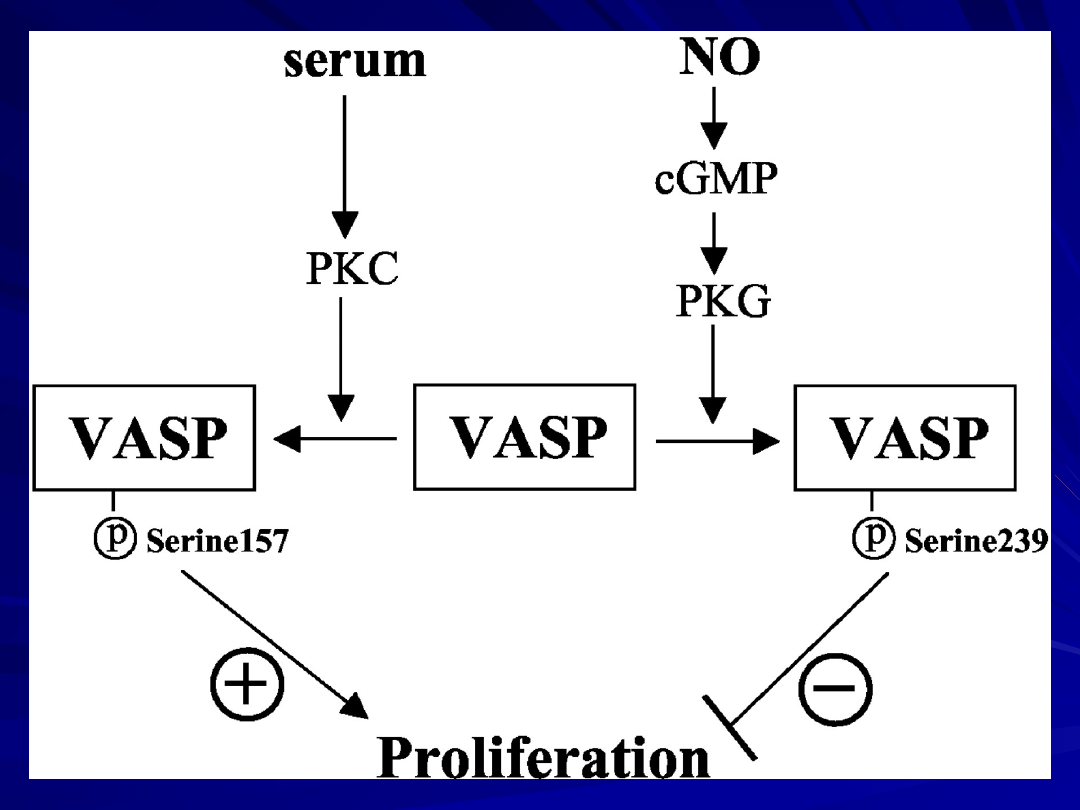

Identyfikacja VASP jako fosfoproteiny stymulującej
wazodylatację
(Vasodilator-stimulated phosphoprotein) oraz ustalenie,
że jest ona
substratem
dla cGMP- zależnej kinazy proteinowej (PKG)
Seryna 239 jest miejscem preferencyjnym dla
fosforylacji
przez PKG
dla cAMP- zależnej kinazy proteinowej (PKA)
Seryna 157 jest miejscem preferencyjnym dla
fosforylacji
przez PKA .

Funkcja VASP jako czynnika regulującego
proliferację komórek mięśniówki gładkiej SMC.
VASP spełnia funkcję modulatora wzrostu komórek
mięśniówki gładkiej poprzez indukowanie sygnałów
pozytywnych i negatywnych związanych z różnymi
miejscami fosforylacji VASP.
Fosforylacja VASP seryny 157 przy współudziale
PKA wyzwala
proliferację,
Fosforylacja VASP indukowana przez NO przy
współudziale
PKG w miejscu seryny 239 hamuje proliferację.

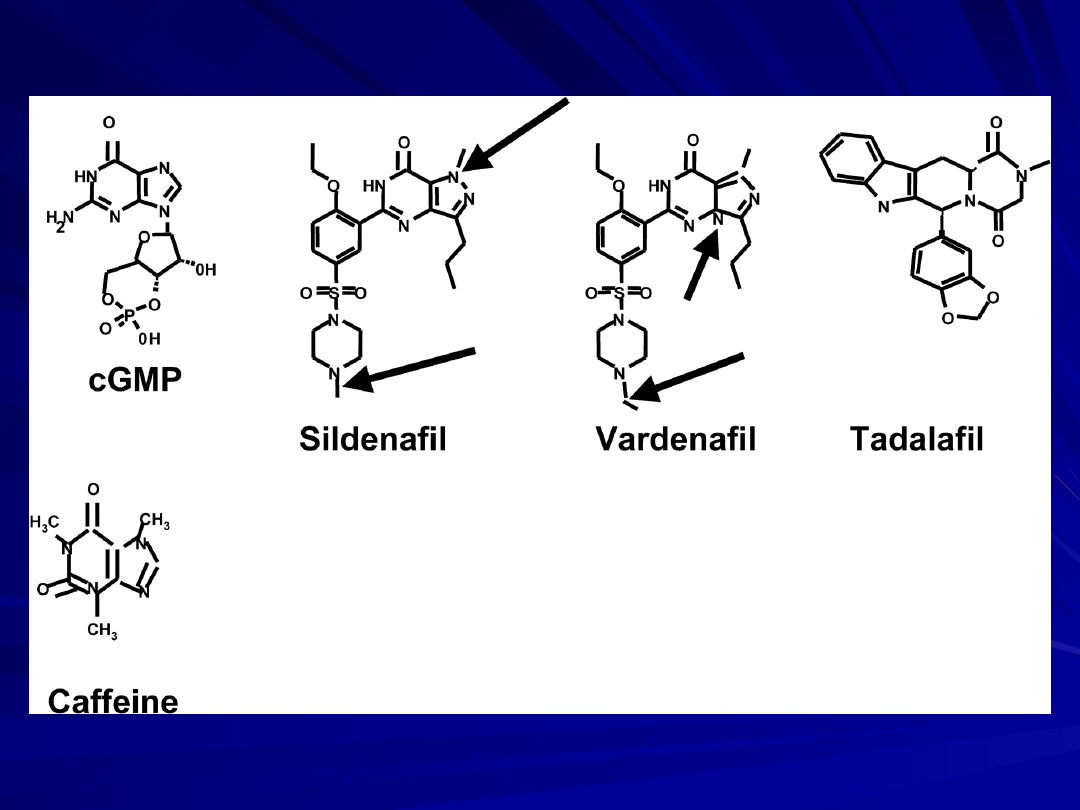
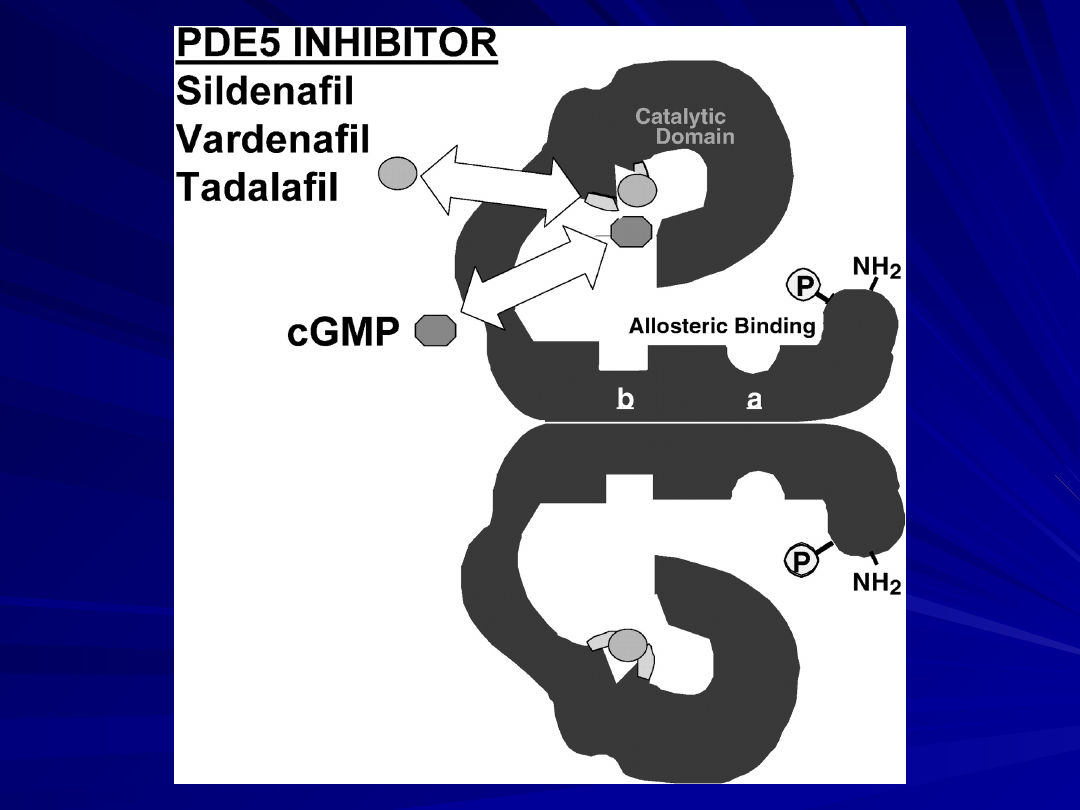
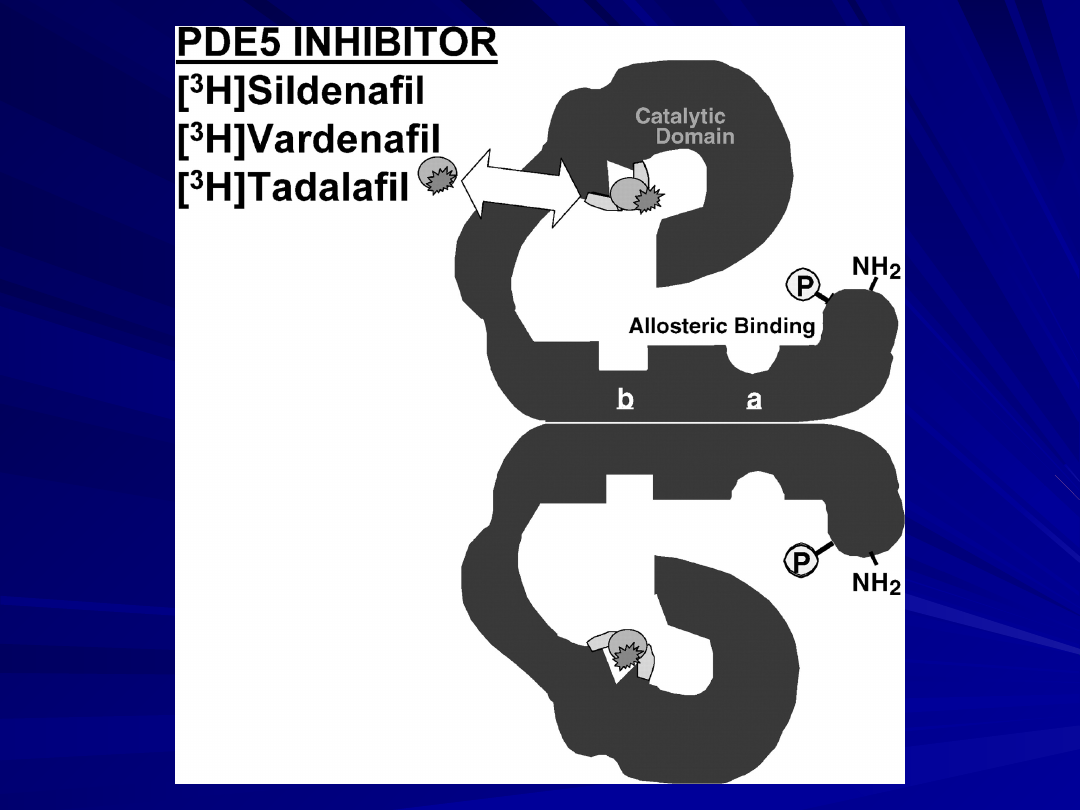
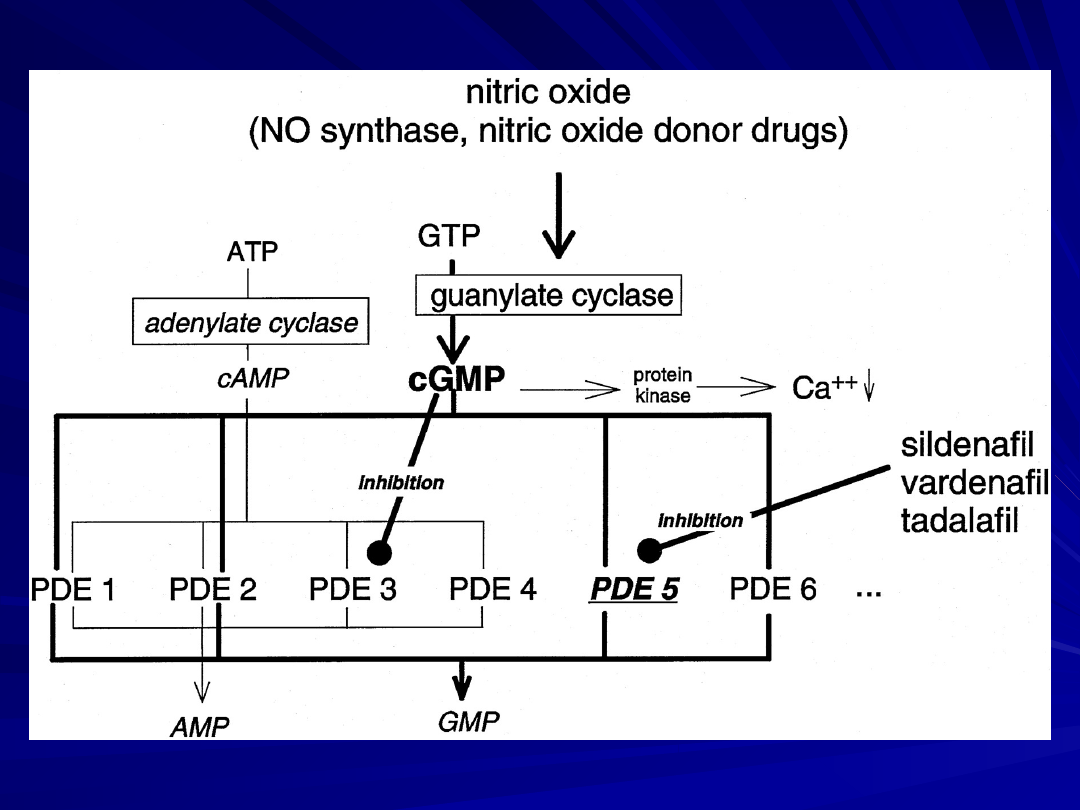
Inhibitory fosfodwuesterazy typu 5:
Nadciśnienie płucne – obrzęk płuc
Niewydolność m. sercowego
Sildenafil
Vardenafil
Tadalafil

Molekularne mechanizmy kreują
pogląd, że inhibitory PDE5 mają
działanie:
-
kardioprotekcyjne,
- antyhypertroficzne
- hamują remodeling
komórek mięśnia sercowego i
naczyń.
obniżają wewnątrzkomórkowy poziom wapnia i redukują
skurcz
naczyń i mięśnia sercowego
wykazują działanie antyhyperteroficzne związane z
obciążeniem
następczym antihypertrophic response to pressure
overload
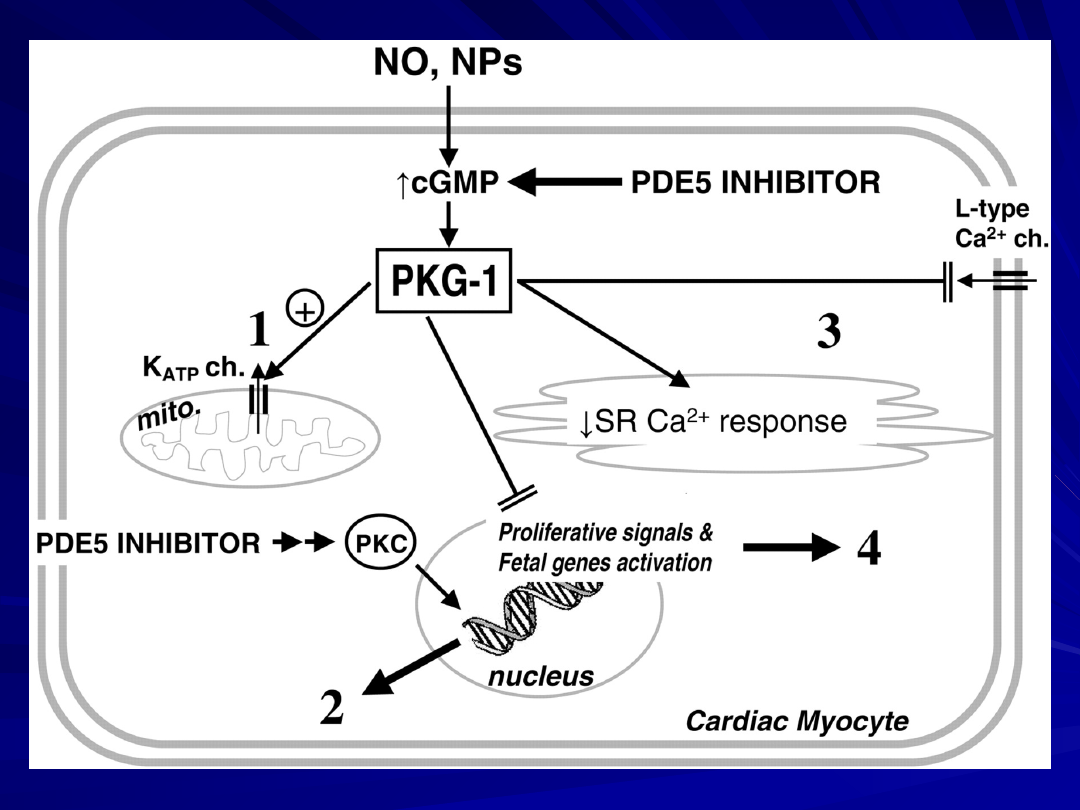
mito = mitochondrion;
ch = channel;
NPs = natriuretic peptides;
SR = sarcoplasmic reticulum;
PKC = protein kinase C.
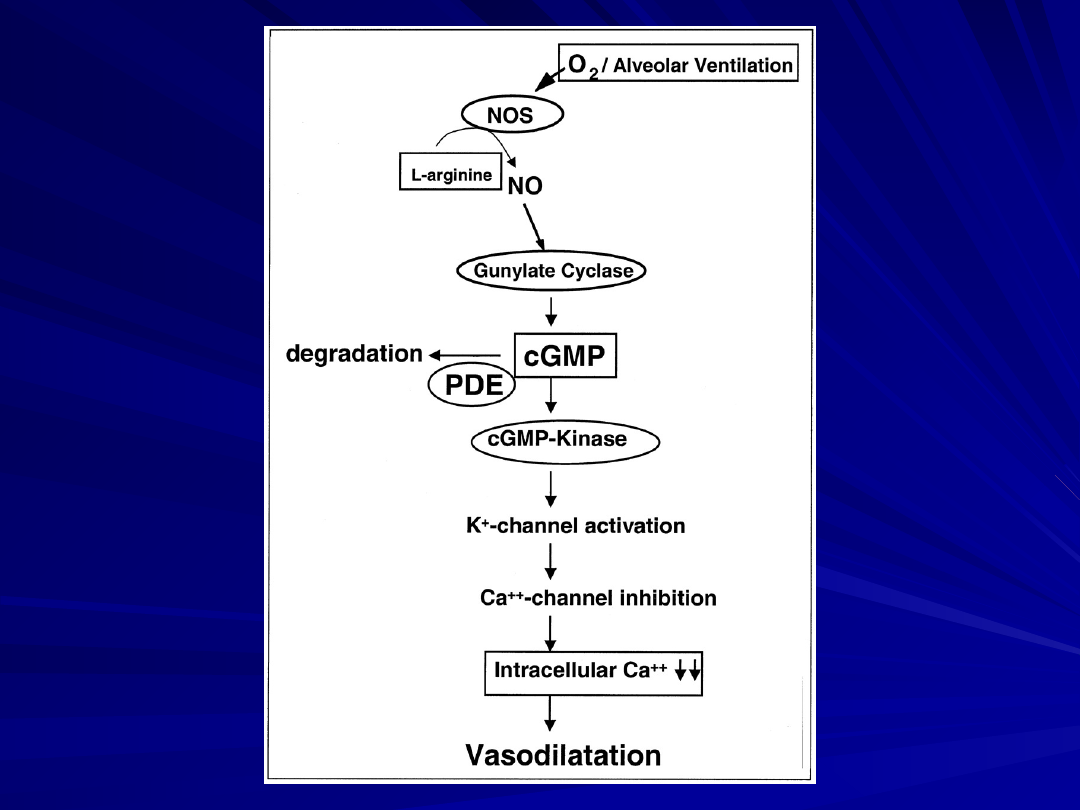



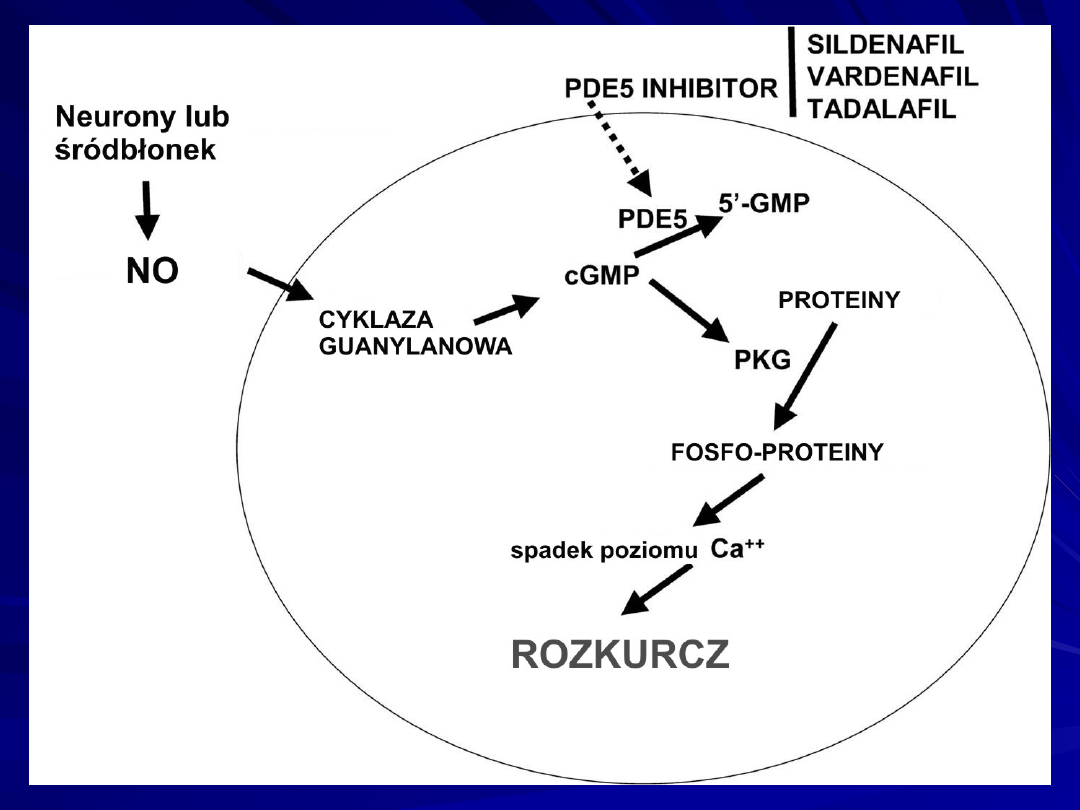
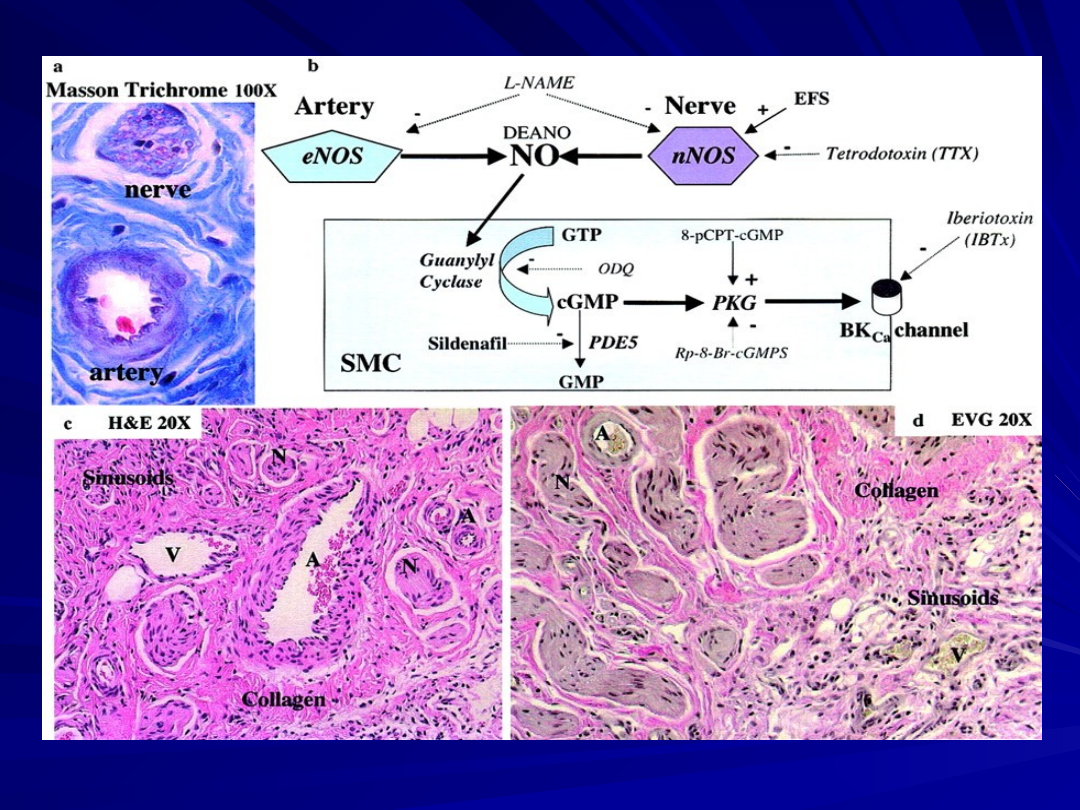
Scheme of nitric oxide (NO) metabolism pathway. In this
diagram the nitric oxide (NO) pathway is depicted.
In presence of oxygen (O2) and/or alveolar ventilation, NO
synthases (NOS) are activated and produce NO from L-
arginine via L-citrulline.
The NO activates soluble- and membrane-bound guanylate
cyclases, which synthesize cyclic guanylate monophosphate
(cGMP), which subsequently activates cGMP-kinase.
This enzyme—by activation of K+-channels and
subsequent Ca++-channel inhibition—evokes a reduction of
intracellular Ca++ concentration, finally resulting in
vasodilation.
The downstream effects of NO are limited by
phosphodiesterase (PDE)-induced degradation of cGMP.

Recently, the results of a double-blind, placebo-controlled
multicenter study demonstrated that daily inhaled iloprost
significantly improved exercise capacity, New York Heart
Association (NYHA) functional classification, dyspnea
scoring, and event-free survival over a three-month
observation period in patients with selected forms of PAH
and chronic thromboembolic PH.
Olschewski H, Simonneau G, Galie N, et al. Inhaled iloprost
for severe pulmonary hypertension. N Engl J Med.
2002;347:322–329.
cAMP= cyclic adenylate monophosphate
cGMP= cyclic guanylate monophosphate
GC= guanylate cyclase
HIV= human immunodeficiency virus
NO= nitric oxide NYHA= New York Heart Association
PAH= pulmonary arterial hypertension
PDE= phosphodiesterase
PH= pulmonary hypertension
PPH= primary pulmonary hypertension

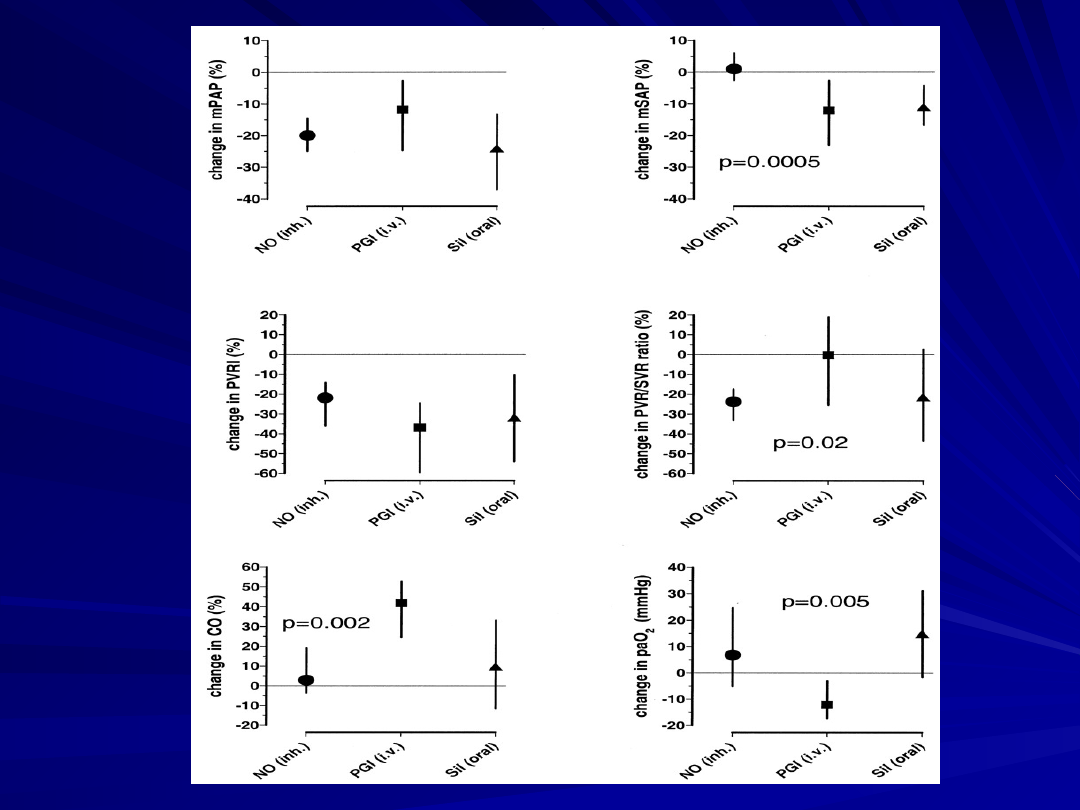
Hemodynamic and gas-exchange response to inhaled
nitric oxide (NO), infused PGI2, and oral sildenafil in
patients with lung fibrosis and pulmonary hypertension.
Deviations from preintervention baseline are displayed
for inhaled NO, infused prostacyclin (PGI iv), and oral
sildenafil (Sil oral).
CO = cardiac output;
mPAP = mean pulmonary arterial pressure;
mSAP = mean systemic arterial pressure;
PaO 2 = partial pressure of arterial oxygen (changes in
mm Hg);
PVRI = pulmonary vascular resistance index;
PVR/SVR ratio = ratio of pulmonary to systemic vascular
resistance
(Ghofrani et al., Lancet 2002;360:895–900).

The NO/cGMP axis represents a pivotal signaling pathway for
the lung circulation.
Phosphodiesterases, as regulators of the second messenger
response to endogenous NO, are thus of great therapeutic
potential for the treatment of lung circulatory disorders.
Among the clinically available PDE inhibitors, sildenafil is a
most promising agent for pulmonary vasodilation and long-
term antiremodeling in the lung vasculature of PAH patients.
Although orally administered, sildenafil does possess features
of pulmonary selectivity.
It may be favorably combined with other vasodilative and
antiproliferative agents.
Large trials, including a placebo-controlled phase III trial with
sildenafil in patients with PAH, are currently underway.

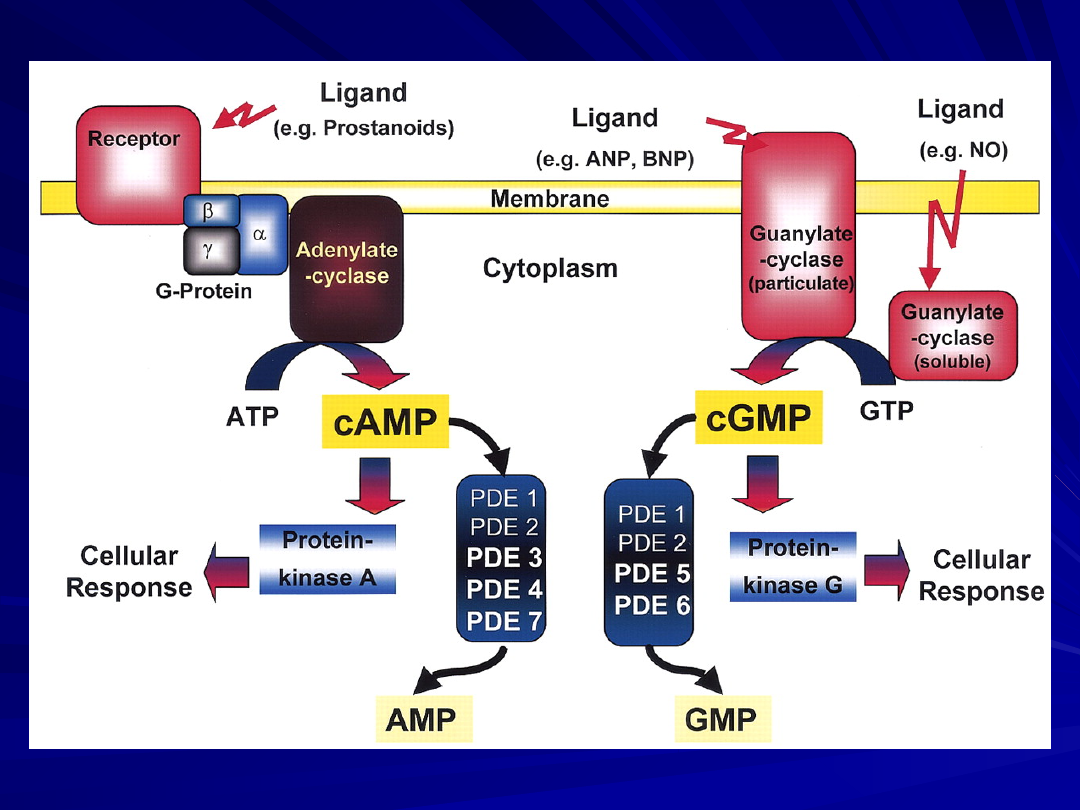
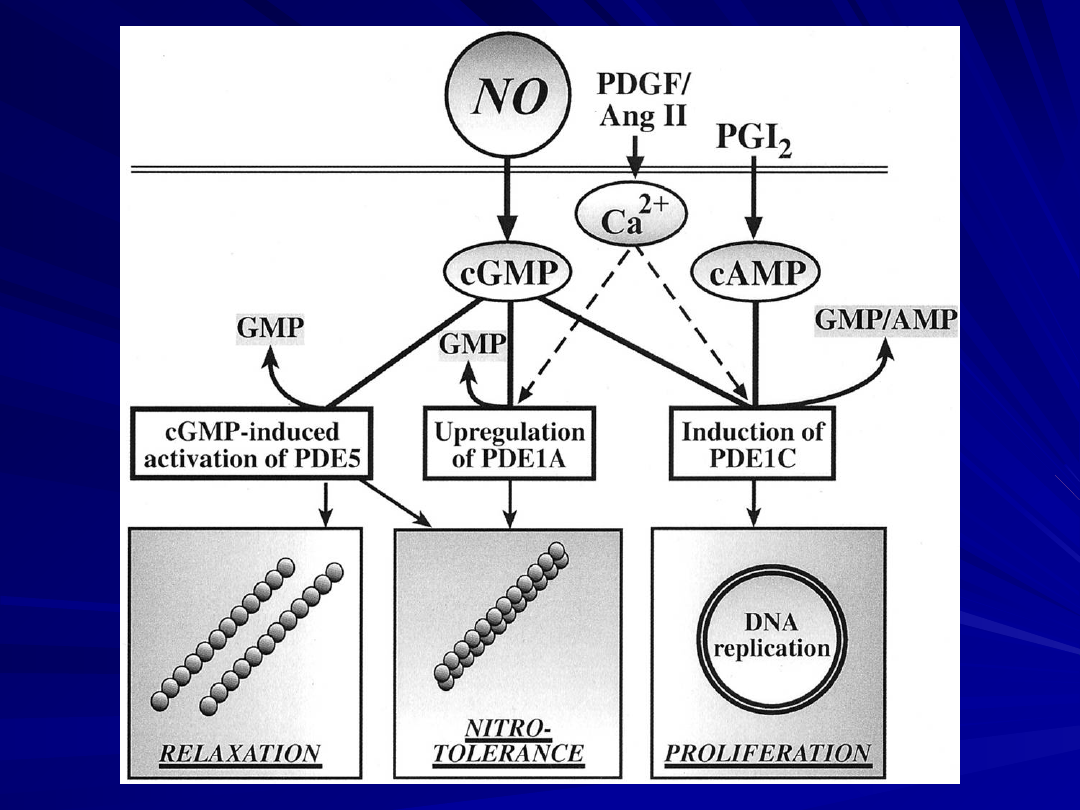
Intracellular signaling pathway of nitric oxide (NO),
prostanoids, and natriuretic peptides: role of
phosphodiesterases (PDEs).
Ligands (i.e., NO, atrial natriuretic peptide [ANP], brain
natriuretic peptide [BNP], and prostanoids) activate
membrane-bound or soluble cyclases.
Guanylate and adenylate cyclases generate cyclic
guanosine monophosphate (cGMP) and adenosine
monophosphate (cAMP) from GTP and ATP.
These intracellular second messengers, via activation of
protein kinases, induce cellular responses (i.e.,
vasodilation and anti-proliferation).
Phosphodiesterases limit the effects of the ligands by
degradation of second messengers cGMP and cAMP into
inactive GMP and AMP.
Thus, by inhibition of the PDEs, the PDE inhibitors augment
and prolong the cellular responses to NO, prostanoids, and
natriuretic peptides.

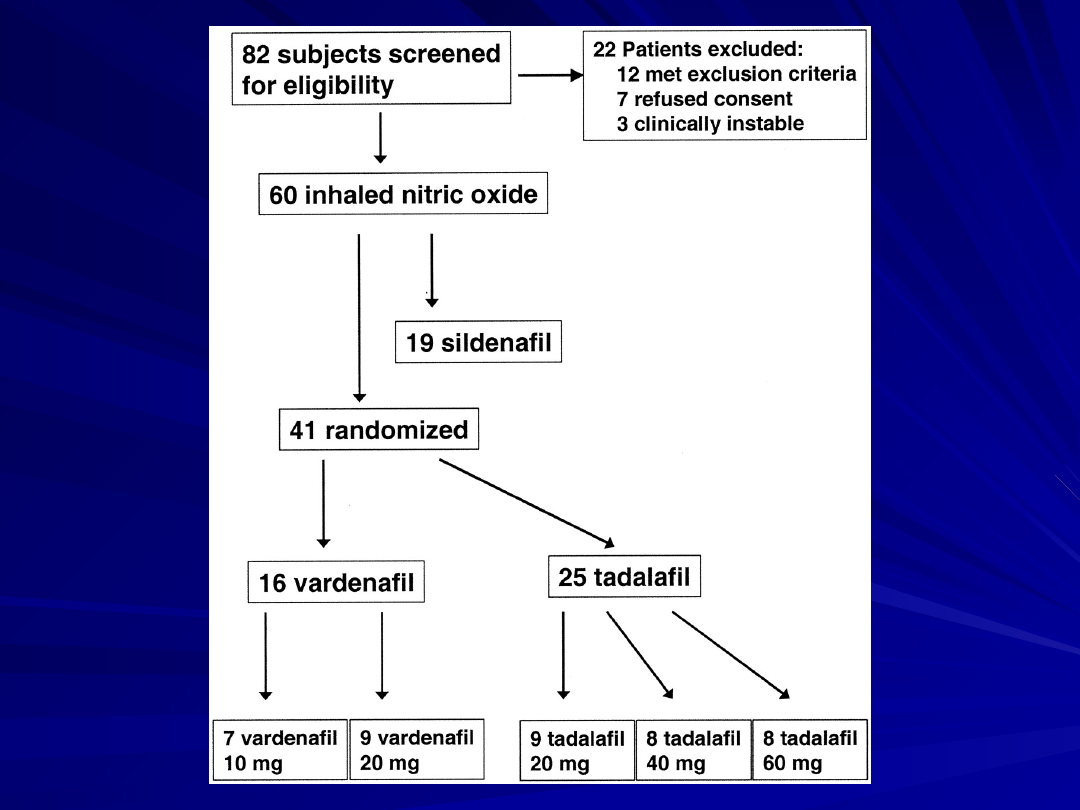
The present study is the first to compare the short-
termhemodynamic profiles of three different PDE5 inhibitors—
sildenafil, vardenafil and tadalafil—in a well-defined patient
collective suffering from chronic PAH.
Although vardenafil showed the most rapid onset of effects, this
substance lacked selectivity for the pulmonary circulation, which
was demonstrated for sildenafil and tadalafil, even at high doses
of the latter agent.
The pulmonary vasodilatory response to tadalafil appeared to be
the most long-lasting, as anticipated from previous studies in the
field of erectile dysfunction.
By contrast with sildenafil, vardenafil and tadalafil did not
improve arterial oxygenation.
Obviously, we cannot translate short-term effects into long-term
effects, because we know that long-term effects may be
significantly more efficacious than short-term effects, such as has
been observed with epoprostenol; however, the converse may also
occur.
These findings thus strongly support the notion that careful
evaluation of the pulmonary hemodynamic and gas exchange
effects of each new PDE inhibitor focusing on cGMP decay is to be
undertaken, despite common classification as PDE5 inhibitors.

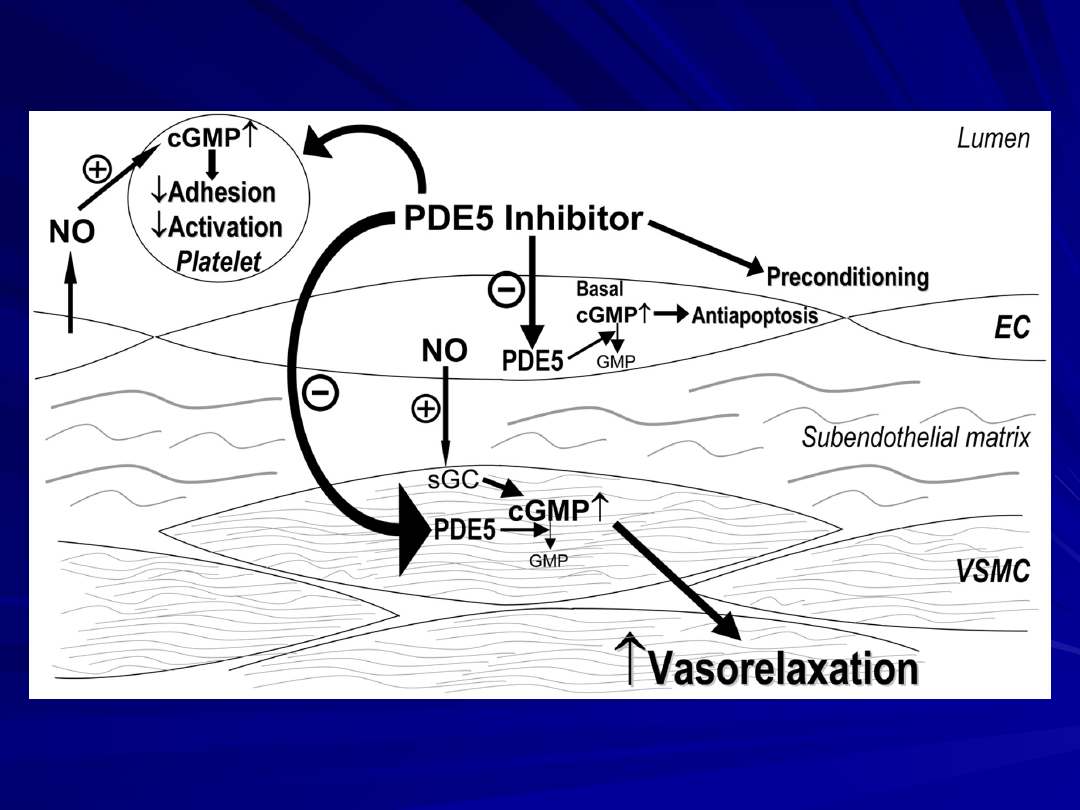
The pharmacologic mechanisms involving sildenafil and cGMP
at the vascular tissue/platelet interface.
EC = endothelial cells;
GMP = guanosine monophosphate, a catabolized product of
cGMP;
sGC = soluble guanylate cyclase;
VSMC = vascular smooth-muscle cells.

Sildenafil,
vardenafil, and tadalafil inhibitory PDE 5
W sposób zależny od stężenia powoduje rozkurcz mięśniówki
gładkiej tętnic i powoduje wzrost stężenia cGMP i
pozostaje bez wpływu na stężenie cAMP.
Usunięcie śródbłonka powoduje aż 45 krotne przesunięcie krzywej
dla sildenafilu i 21 krotne dla tadalafilu oraz aż 251 krotne dla
vardenafilu.
Maksymalna reakcja na sildenafil i tadalafil ulega odpowiednio
redukcji do 38 % i 53%. Maksymalna reakcja na vardenafil nie ulega
zmianie
Inhbitory NO – syntazy i inhibitory cyklazy guanylanowej i w
zmiatacze NO powoduje także obniżenie rozkurczowego działania
inhibitorów FDE 5.
Sildenafil, tadalafil i vardenafil potęgują znacznie rozkurczowe
działanie nitratów naturetycznego peptydu.
Sildenafil, tadalafil i vardenafil hamują skurcze naczyń wyzwalane
przez
CaCl
2
(0.01-5
mM) i fenylefrynę.
Ouabain, kw. cyclopiazonowy i Kalykulin nie wpływają na
wazodylatacyjne dzialanie inhibitorów FDE 5.
Wyniki te wskazują że tylko vardenafil, zmienia
Ca
2+
handling in the
rat aorta in addition to increasing cGMP
levels through inhibition of
PDE5 to cause relaxation.
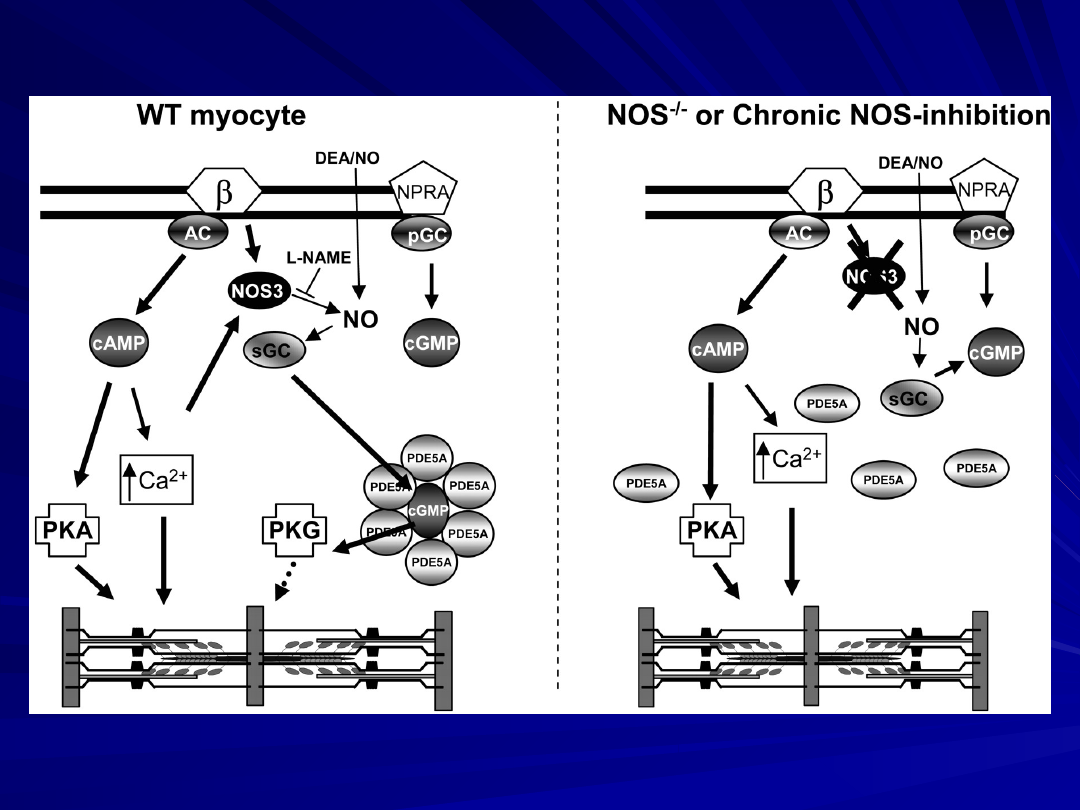

Model of NOS3-PDE5A coregulation of ß-adrenergic stimulated
contractility in the heart. In a wild-type (WT) normal myocyte
(left),
ß-adrenergic stimulation triggers adenylate-cyclase (AC)-
coupled activation of cAMP and NOS3/sGC generation of
cGMP.
cAMP enhances intracellular calcium and activates PKA to
enhance contractility.
cGMP signaling is compartmentalized by regional placement of
PDE5A, which targets the cGMP-PKG activity to a region
strategically linked to adrenergic regulation.
Acute PDE5A inhibition enhances localized cGMP and PKG
activity to blunt adrenergic stimulation.
Acute NOS3 blockade by L-NAME removes the required cGMP
substrate and thus efficacy of PDE5A inhibition, but exogenous NO
can still restore efficacy.
With genetic lack of NOS3 or with chronic NOS inhibition (right),
PDE5A moves away from z-bands (left).
This removes its physiologic regulation of acute
adrenergic signaling, and exogenous NO can no longer restore
the efficacy of PDE5A inhibition.
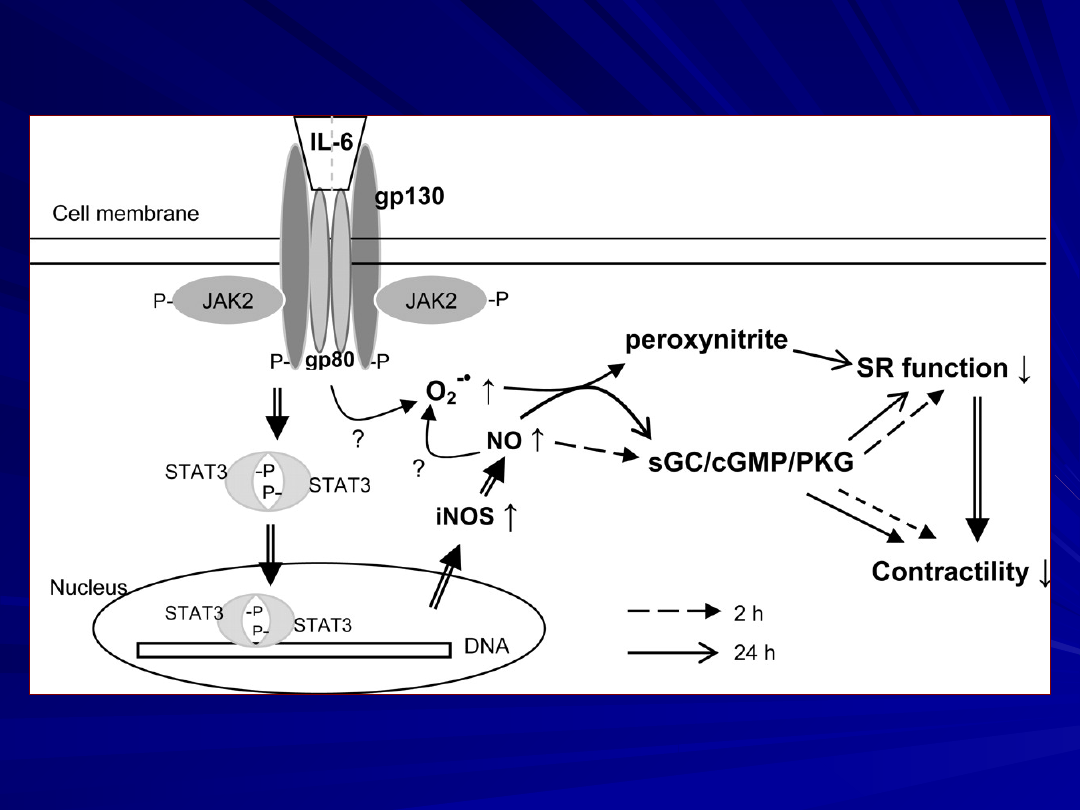

Diagram przedstawia komórkowe mechanizmy
pośredniczące w zależnym od czasu ekspozycji inotropowo -
ujemnym działaniu IL- 6 ARVM (in a time-dependent
manner)
Ekspozycja na 2 – 24 godzinne dzialanie IL-6 indukuje
zależne od iNOS/ NO - inotropowo ujemne działanie w którym
pośredniczy
JAK2/STAT3 (Yu et al. 2003, 2005).
Podczas wczesnej fazy działania (2 godzinnej ekspozycji na IL-6
dochodzi
do stymulacji sCG/ cGMP/PKG, która ma być odpowiedzialna za
działanie
inotropowo – ujemne.
Wydłużeniu ekspozycji do 24 godzin IL-6 wyzwala dwa mechanizmy
powoduje obniżenie kurczliwości
oraz wyzwala hamownie funkcji SR

In pulmonary arterial hypertension PAH patients, the three PDE5
inhibitors differ markedly in their kinetics of pulmonary
vasorelaxation (most rapid effect by vardenafil), their selectivity for
the pulmonary circulation (sildenafil and tadalafil, but not vardenafil),
and their impact on arterial oxygenation (improvement with sildenafil
only).
Careful evaluation of each new PDE5 inhibitor, when being
considered for PAH treatment, has to be undertaken, despite
common classification as PDE5 inhibitors.

The most commonly reported side effects of sildenafil can be
attributed to vasodilation, such as;
flushing,
nasal congestion,
headache (16%),
dizziness and hypotension,
relaxation of the lower esophageal sphincter resulting in
dyspepsia
and reflux-related symptoms

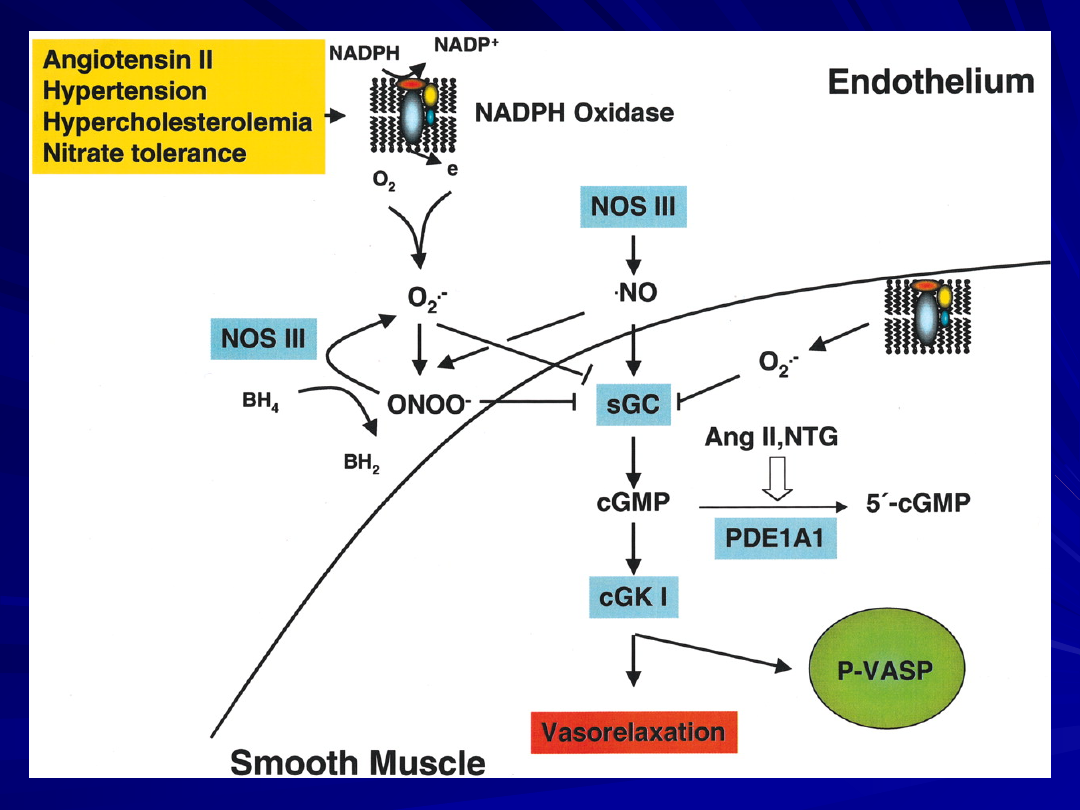
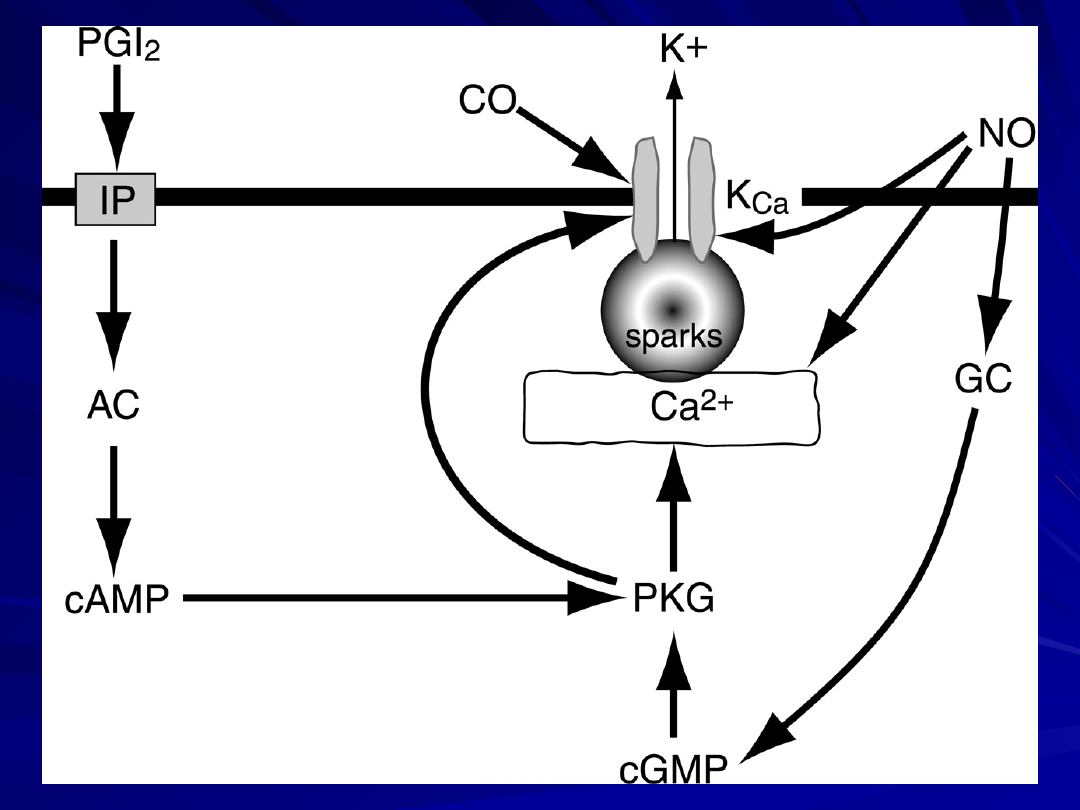
Schematyczny model potencjalnych mechanizmów
oddziaływania NO i prostacyclin (PGI2) na
działanie CO, wyzwalające proces hyperpolaryzacji
i
rozkurcz
mięśniówki gładkiej naczyń
AC - cyklaza adenylanowa; GC - cyklaza
guanylanowa; IP- prostacyclin receptor;
KCa, aktywowane Ca2+- kanały K+ .

Model of vascular smooth muscle PKG activity and its impact on
vascular tone. We propose that constitutive activity of PKG (Basal
PKG Activity) exerts continuous modulation of vascular tone even at
minimal cGMP levels.
Increased cGMP further stimulates the kinase (High PKG Activity),
enhancing its modulatory influence.
Available inhibitors, including KT-5823 (blue arrow) and the Rp-cGMPS
derivatives (green arrow), such as Rp-8-pCPT-cGMPS and Rp-8-Br-PET-
cGMPS, reverse cGMP-stimulated PKG activity to varying degrees, but
only toward basal levels.
Rp-cGMPS derivatives may also yield partial kinase stimulation as
indicated by the double-headed arrow. DT-2 (red arrow), on the other
hand, inhibits not only the cGMP-stimulated PKG activity but also a
substantial portion of the basal PKG activity, essentially abolishing
vasoregulation by the kinase.
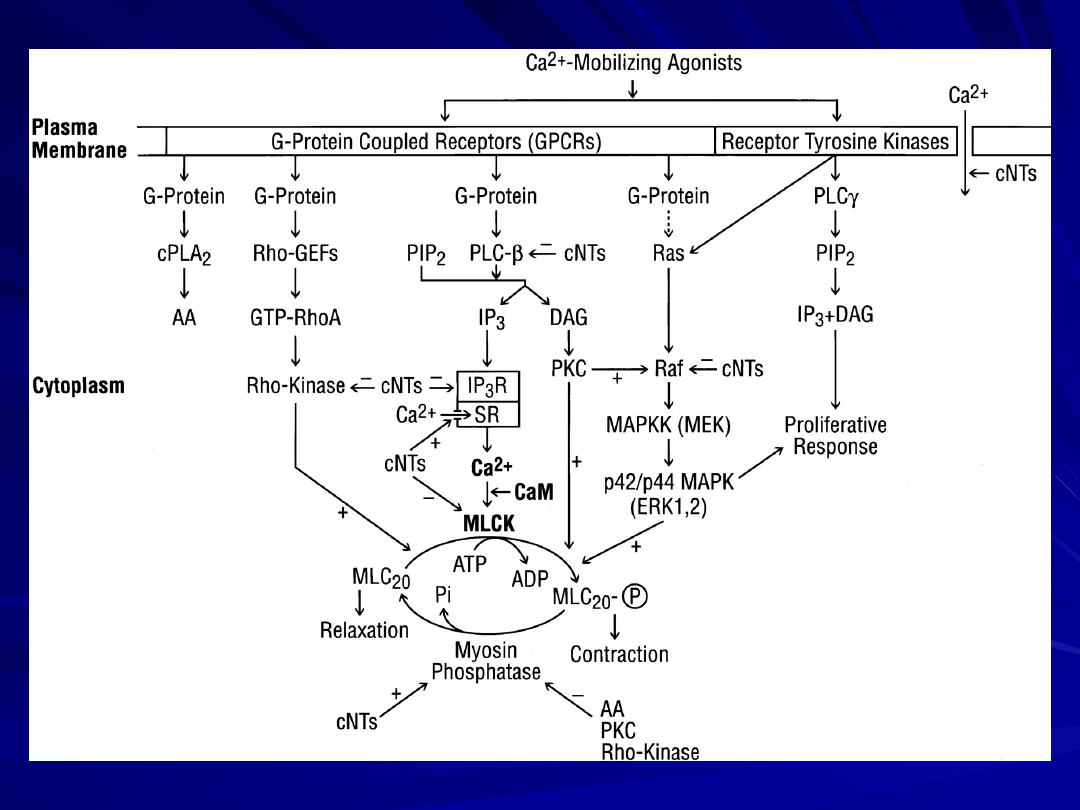

Scheme showing possible cross talk points of interaction between cyclic
nucleotides (cNTs (cAMP and cGMP)) and the IP
3
-Ca
2+
-, Ca
2+
-CaM-MLCK-,
MAP kinase-, Rho-kinase-, PKC-, and myosin phosphatase pathways in
smooth muscle.
Upon activation of smooth muscle by activation of the GPCRs through
Ca
2+
-mobilizing agonists the [Ca
2+
]
i
increases due to an influx of Ca
2+
through plasmalemmal Ca
2+
channels or IP
3
-mediated release from the
SR.
Ca
2+
binds to CaM and activates MLCK to phosphorylate MLC
20
resulting in contraction. Myosin is dephosphorylated by myosin
phosphatase.
Activation of G
i
-coupled receptors inhibits adenylate cyclases,
decreasing cAMP and inactivating PKA (not shown in the scheme).
Activation of GPCRs also leads to stimulation of cPLA
2
and the release
of AA for prostaglandin (PG) biosynthesis.
Activation of receptor tyrosine kinases leads to the stimulation of PLC
and Ras and subsequently to proliferative response. In addition to the
MLCK pathway, which comprises the major pathway in muscle
contraction, MLC
20
can also be directly phosphorylated by Rho-kinase,
PKC, and p42/p44 MAPK.
Inhibition of myosin phosphatase by AA, PKC, or Rho-kinase increases
MLC
20
phosphorylation and contraction. Several targets for cNTs
regulation have been reported, including the receptor, G proteins,
PLCß, IP
3
receptor, the Ca
2+
-pump in the SR , MLCK, Rho-kinase, MAP
kinase, myosin phosphatase, and the plasmalemmal Ca
2+
channel.
Cross talk between the cNTs and these targets could constitute the
biochemical mechanisms underlying relaxation in smooth muscle.
Abbreviations are the same as given in the text; (+) and (-), stimulation
and inhibition, respectively.

Model of vascular smooth muscle PKG activity and its impact on
vascular tone. We propose that constitutive activity of PKG
(Basal PKG Activity) exerts continuous modulation of vascular
tone even at minimal cGMP levels.
Increased cGMP further stimulates the kinase (High PKG
Activity), enhancing its modulatory influence.
Available inhibitors, including KT-5823 (blue arrow) and the Rp-
cGMPS derivatives (green arrow), such as Rp-8-pCPT-cGMPS and
Rp-8-Br-PET-cGMPS, reverse cGMP-stimulated PKG activity to
varying degrees, but only toward basal levels.
Rp-cGMPS derivatives may also yield partial kinase stimulation
as indicated by the double-headed arrow. DT-2 (red arrow), on
the other hand, inhibits not only the cGMP-stimulated PKG
activity but also a substantial portion of the basal PKG activity,
essentially abolishing vasoregulation by the kinase.

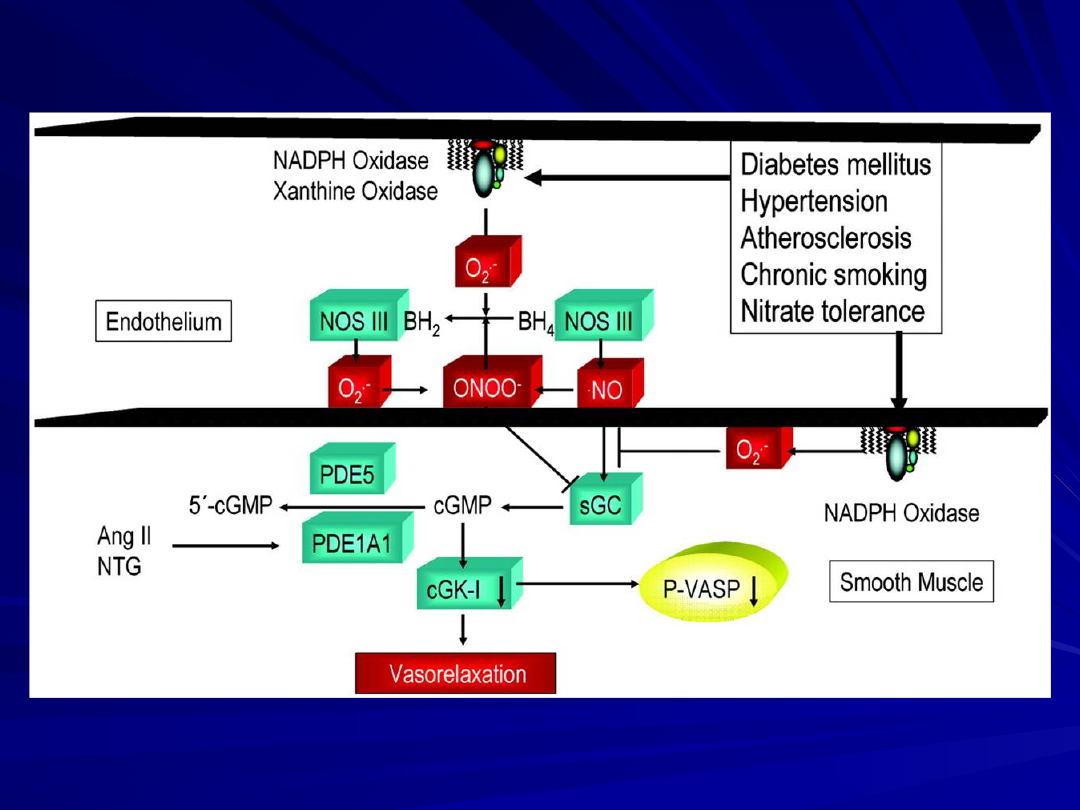
Schematic representation of the NO/cGMP/cGKI pathway of
vascular smooth muscle relaxation and mechanisms of its
inactivation by endothelial dysfunction. Also illustrated is the
analysis of NO/cGMP/cGKI action and endothelial function by
monitoring cGKI phosphorylation of Ser239 of the substrate
protein VASP. Under normal conditions, nitric oxide (NO),
synthesized by nitric oxide synthase (NOS) III, stimulates soluble
guanylate cyclase (sGC), increasing cGMP and thus stimulation of
cGMP-dependent protein kinase I (cGKI) and vasorelaxation.
This pathway can, however, be inhibited at several sites.
Interventions that reduce vascular oxidative stress such as
therapy with statins, Ang II receptor (AT1 subtype) blockers, ACE
inhibitors, or vitamins improves NO bioavailability by reducing
vascular superoxide production. In all cases, P-VASP served as a
reliable monitor of the NO/cGMP/cGKI pathway and endothelial
function.

Angiotensin II, hypertension, hypercholesterolemia, and
nitrate tolerance enhance vascular superoxide (O2·-)
production, which inactivates NO, diminishing cGKI action.
Both O2·- and the NO/O2·- reaction product peroxynitrite
(ONOO-) potently inhibit sGC.
Peroxynitrite can also uncouple NOSIII by oxidizing the
NOSIII cofactor tetrahydrobiopterin (BH4) to
dihydrobiopterin (BH2) and/or by oxidizing Zn thiolate
complexes within NOSIII.
Angiotensin II and nitroglycerin (NTG) therapy stimulate
the activity and expression of phosphodiesterase PDE1A1,
thus decreasing cGKI action and endothelium-dependent
and -independent vasodilation
while inducing supersensitivity to vasoconstrictors.

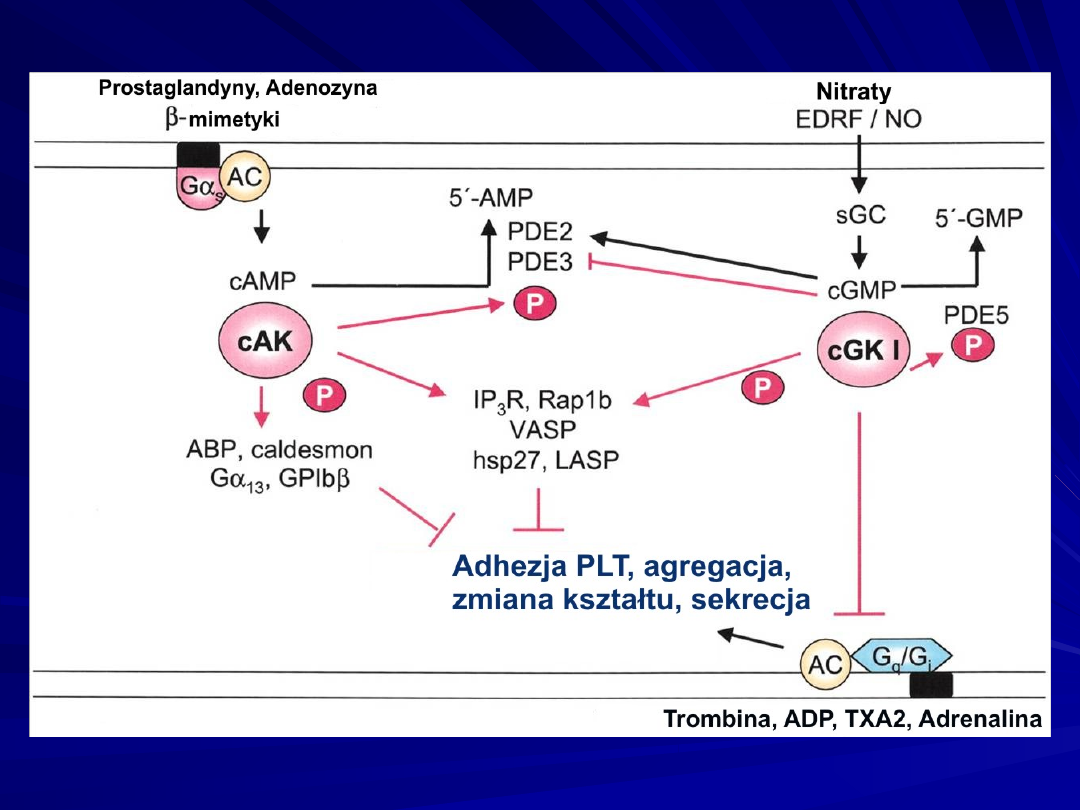
Mechanisms of cGKI inhibition of platelet activation by
phosphorylation (P) of substrate proteins (IP3 receptor, the
small GTPase Rap 1b, vasodilator-stimulated phosphoprotein
[VASP], heat shock protein [hsp]27, and the cGMP
hydrolyzing phosphodiesterase, PDE5) by inhibition of G-
protein-coupled (Gq/Gi) receptor complexes and by inhibition
of cAMP hydrolysis by PDE3. ABP indicates actin-binding
protein; AC, adenylate cyclase; cAK, cAMP-dependent protein
kinase; EDRF, endothelium-derived relaxing factor; G, G-
protein; GP, glycoprotein; IP3R, IP3 receptor; sGC, soluble
guanylate cyclase; and TXA2, thromboxane A2.

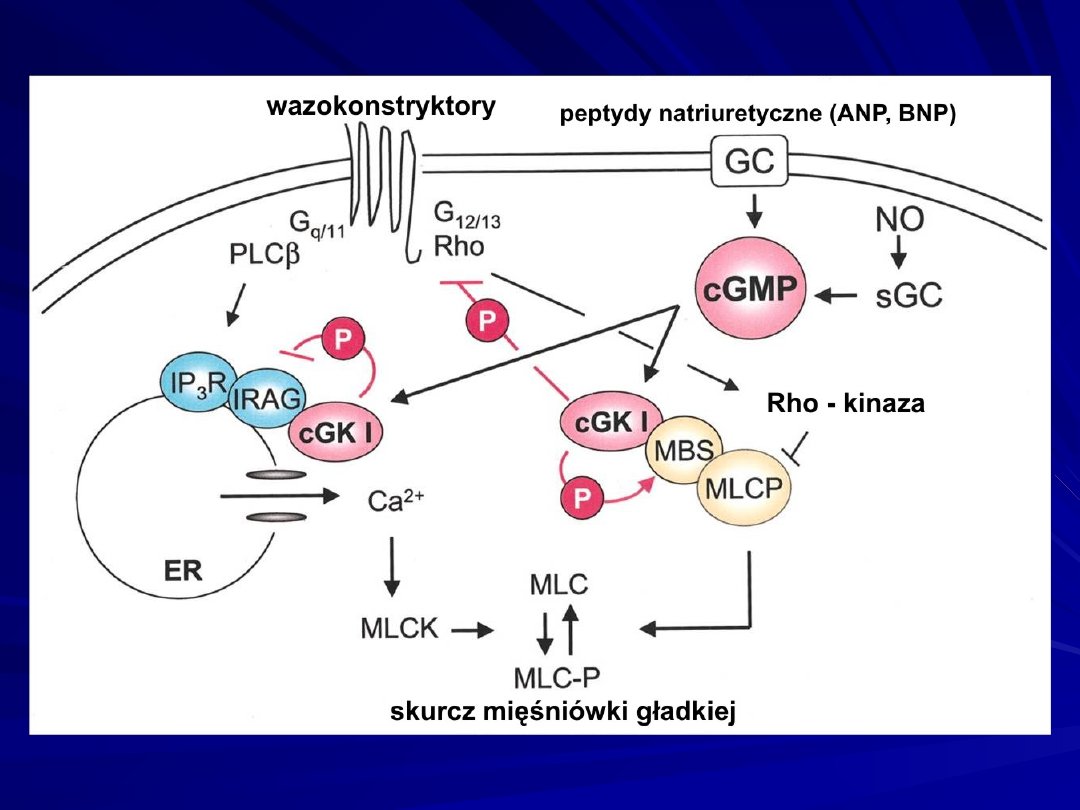
Mechanisms of cGKI inhibition of Ca2+ release (left) and Ca2+
sensitization (right) to inhibit myosin light chain (MLC)
phosphorylation and SMC contraction.
cGKI phosphorylation (P) of IRAG inhibits IP3/IRAG-mediated Ca2+
release from the endoplasmic reticulum (ER), thus inhibiting MLC
kinase (MLCK) and vasoconstriction.
cGKI phosphorylates Rho and interferes with Rho kinase inhibition of
MLCP, thus MLCP dephosphorylates MLC and enhances SMC
relaxation.
Binding of cGKI to substrates (eg, IRAG and the myosin-binding
subunit [MBS] of MLCP), which are also members of signaling
complexes or scaffolds, could be an important aspect of achieving
specificity of cGKI action.
G indicates G-protein; IP3R, IP3 receptor; NO, nitric oxide; PLC,
phospholipase C; and sGC, soluble guanylate cyclase.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
Wyszukiwarka
Podobne podstrony:
OPI wyklad 12 wersja 20080227 p Nieznany
32002r1606 pl wersja zweryfikowana przez dr
DRZEWA LIŚCIASTE wersja ostateczna
2 Pytania z przedmiotu prawo prawo rodzinne i opiekuńcze na kolkwium ustne w 2014r wersja ostatecz
MOTYWACJA Wykład 7nowa wersja1 [tryb zgodności]
Bibliografia ( wersja ostateczna), Prywatne
wersja ostateczna
PROJEKCIK ekonomika wersja3 ostateczna, Ochrona Środowiska, semestr VI, Ekonomika i finanse ochrony
Wykład PŁ, bio, Chemia, Biofizyka, Toksykologia, Chemia i Technologia Wody
Mikrobiologia opracowanie na podstawie części II Skryptu WAM wersja ostateczna wreszcie kurna!!! , Z
kalkulacja dochodowosci produktow?nkowych wersja ostateczna
kurs adobe photoshop po pl wersja multimed na cd opis instr przewodnik po adobe AJLT7MEQRU6AB4ZFOGRC
DYPLOMACJA CYFROWA wersja ostateczna, Studia
Edukacja Obywatelska wykłady dobra wersja
Leki p bólowe wersja ostateczna ostatecznej
Prawo miejscowe-referat wersja ostateczna, I SEMESTR, streszczenia na egzamin
więcej podobnych podstron