
Oznaczanie
aktywności
Wieloenzymowego
układu
fotosyntetycznego

2 fazy fotosyntezy
FAZA ŚWIETLNA
• Powstaje: NADPH
2
, ATP, O
2
• 2 rodzaje fotosyntetycznej fosforylacji:
1. Niecykliczna
-
H
2
O → O
2
-
NADP → NADPH
2
-
„Otwarty” transport elektronów → ATP
2. Cykliczna
-
„Zamknięty” transport elektronów → ATP
FAZA CIEMNA
• CO
2
→ węglowodany (cykl Calvina)
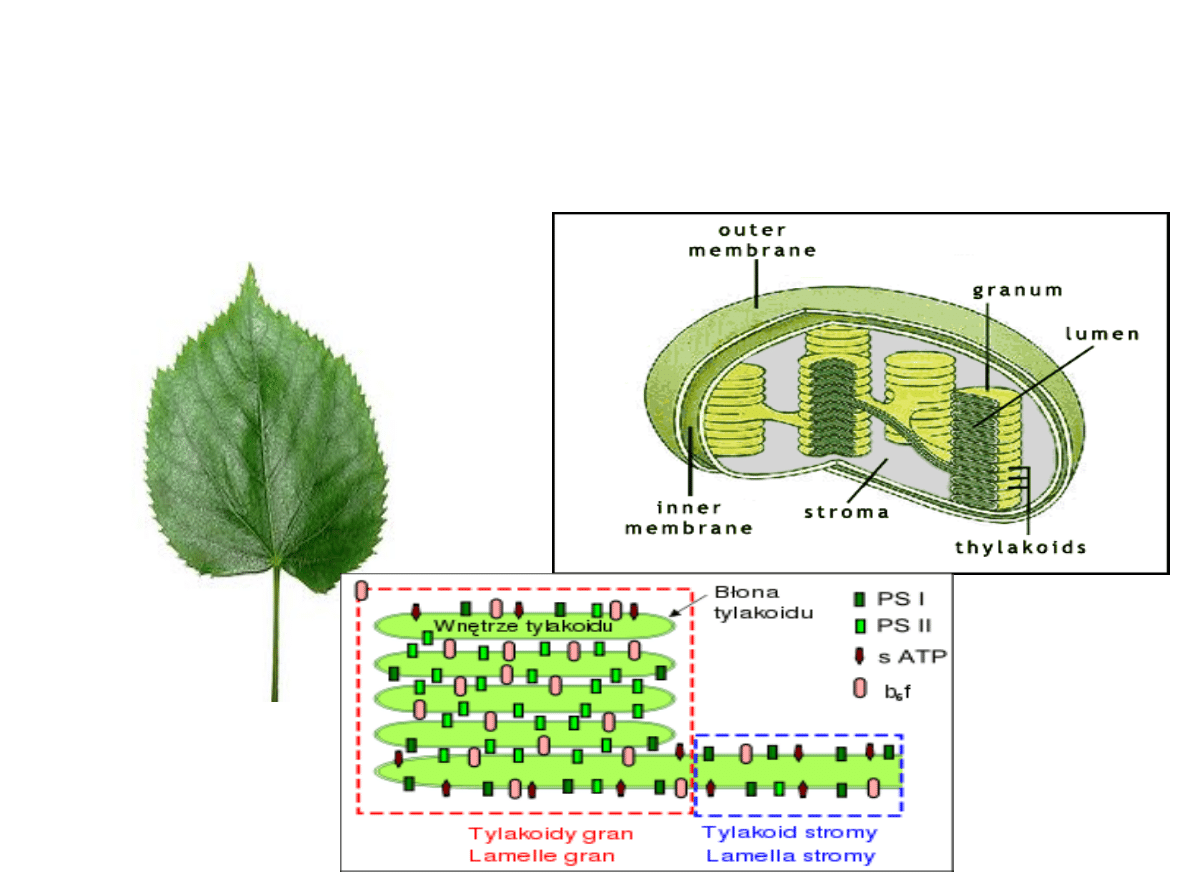
W tylakoidach gran
zlokalizowane są chlorofile
wraz z układami
fotosyntetycznymi .
Fotoukłady i anteny
Fotoukład - centra reakcji
oraz towarzyszące im anteny.
PSI
PSII
Anteny energetyczne -
kompleksy barwnikowo-
lipidowo-białkowe z
chlorofilami i barwnikami
pomocniczymi
po absorpcji kwantu światła
→stan wzbudzony barwników
przekazywany do centrum
reakcji fotochemicznej
(chlorofilu a)
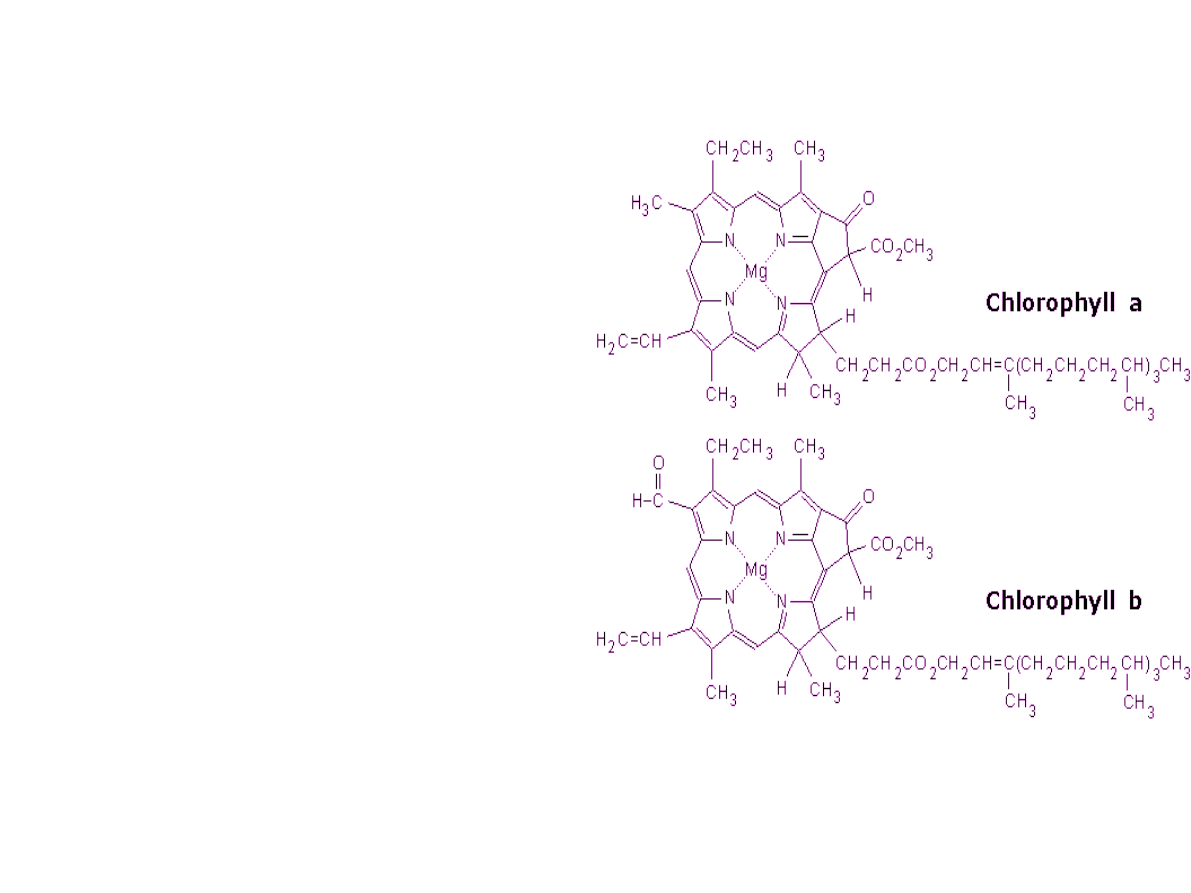
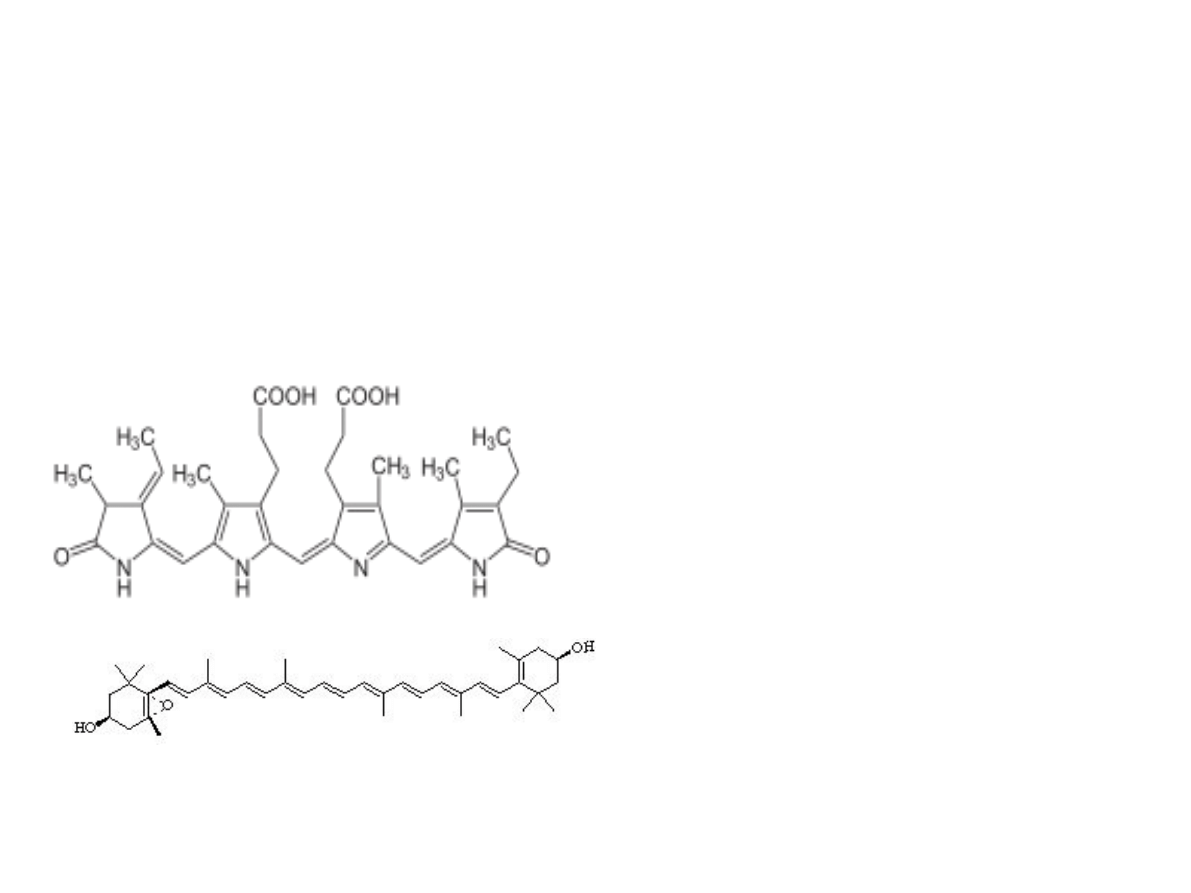
Strukturachemiczna chlorofilu a oraz
b
Centrum reakcji
fotochemicznej PSI i PSII
→
chlorofil a
PSII dodatkowo
chlorofil
b
→ przesunięcie jego
maksimum absorpcji w
kierunku fal krótszych
(światła niebieskiego) (tzw.
„kompleks zbierający
energię” - duża antena o
wysokiej zawartości chl b)
Chlorofile w tych dwóch
fotoukładach wykazują
inne maksima absorpcji:
dla PSI 700 nm (P-700)
dla PSII 680 nm (P-680).
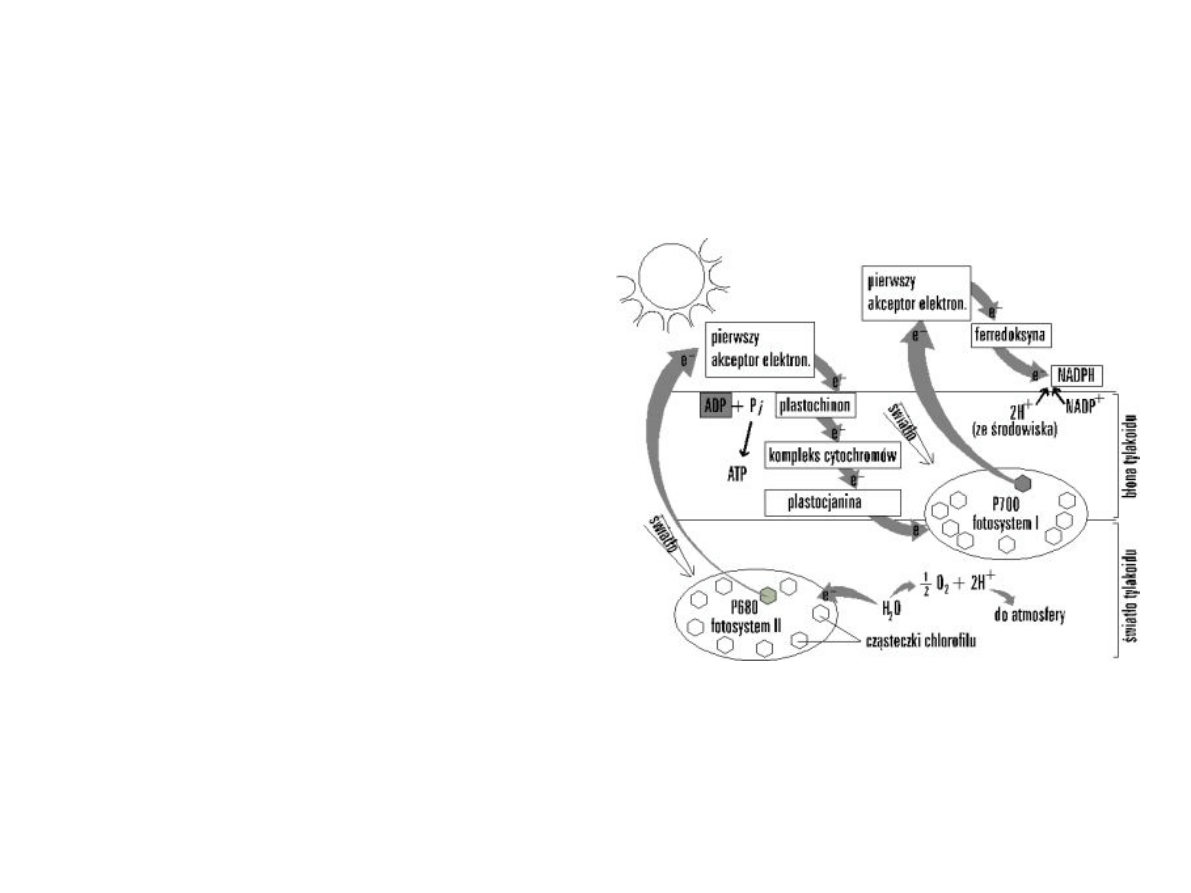
Reakcje fotochemiczne i
transport elektronów
Faza świetlna fotosyntezy
polega na wykorzystaniu
energii świetlnej do
wytworzenia związków
bogatych w energię: ATP,
NADPH
2
.
Niecykliczna fosforylacja –
1.
Redukcja NADP do NADPH
2
2.
Synteza ATP (protony ze stromy
do wnętrza tylakoidów →
gradient →ATPaza)
3.
Wydzielenie tlenu
Ten rodzaj fosforylacji był badany
w naszym ćwiczeniu
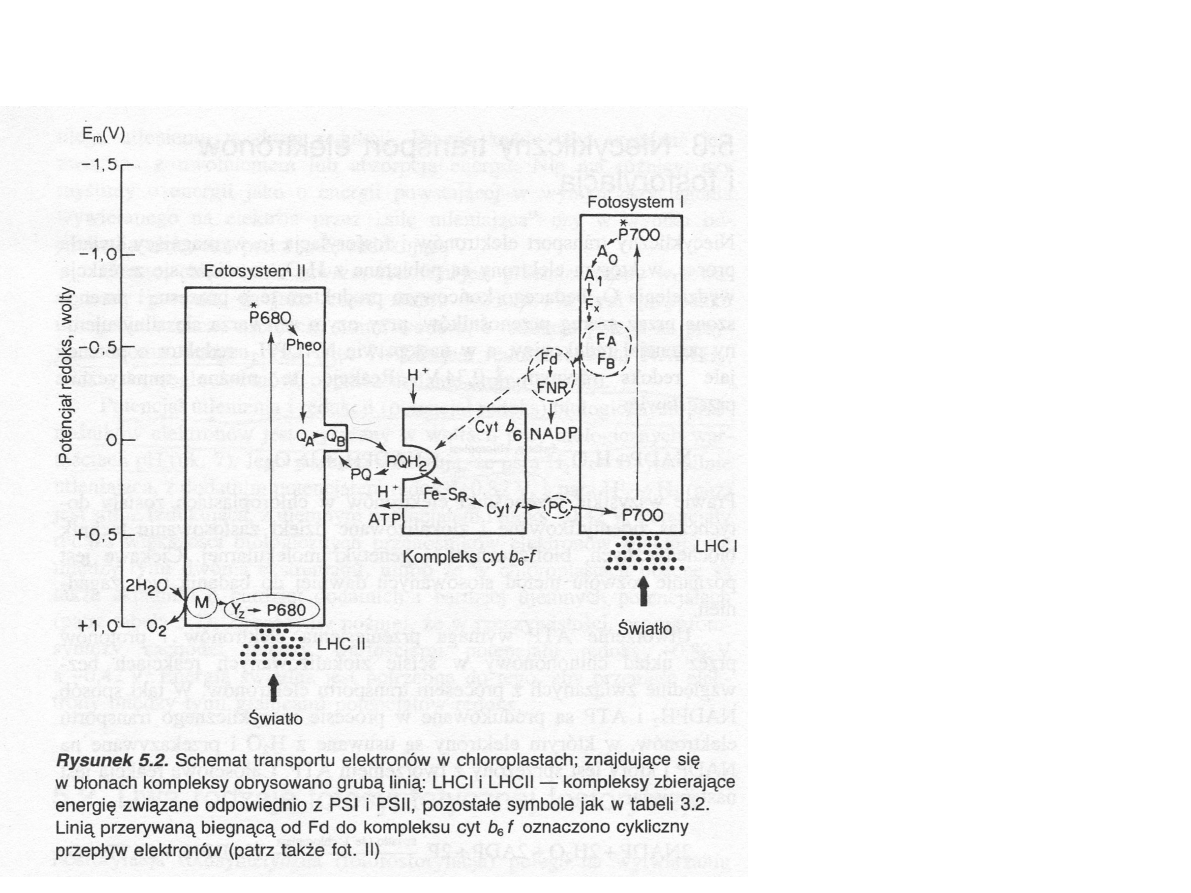
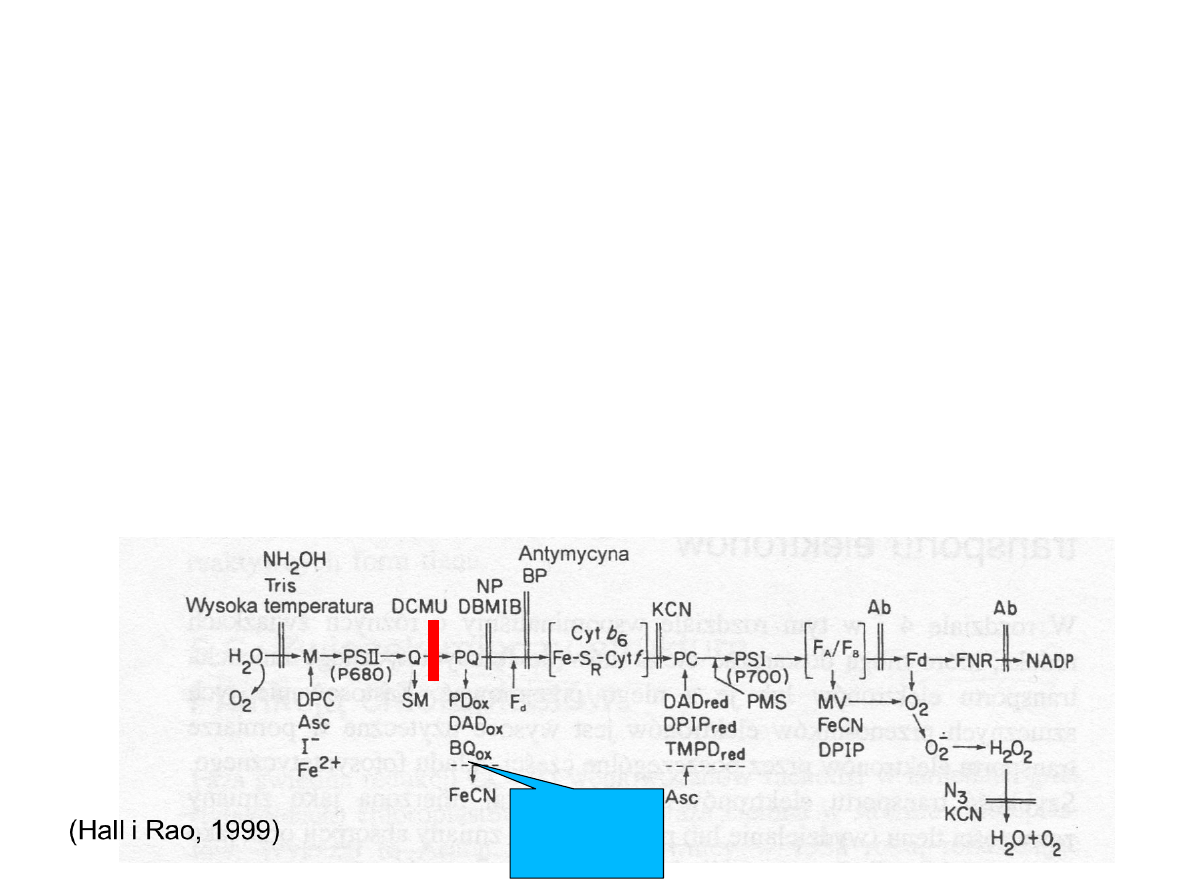
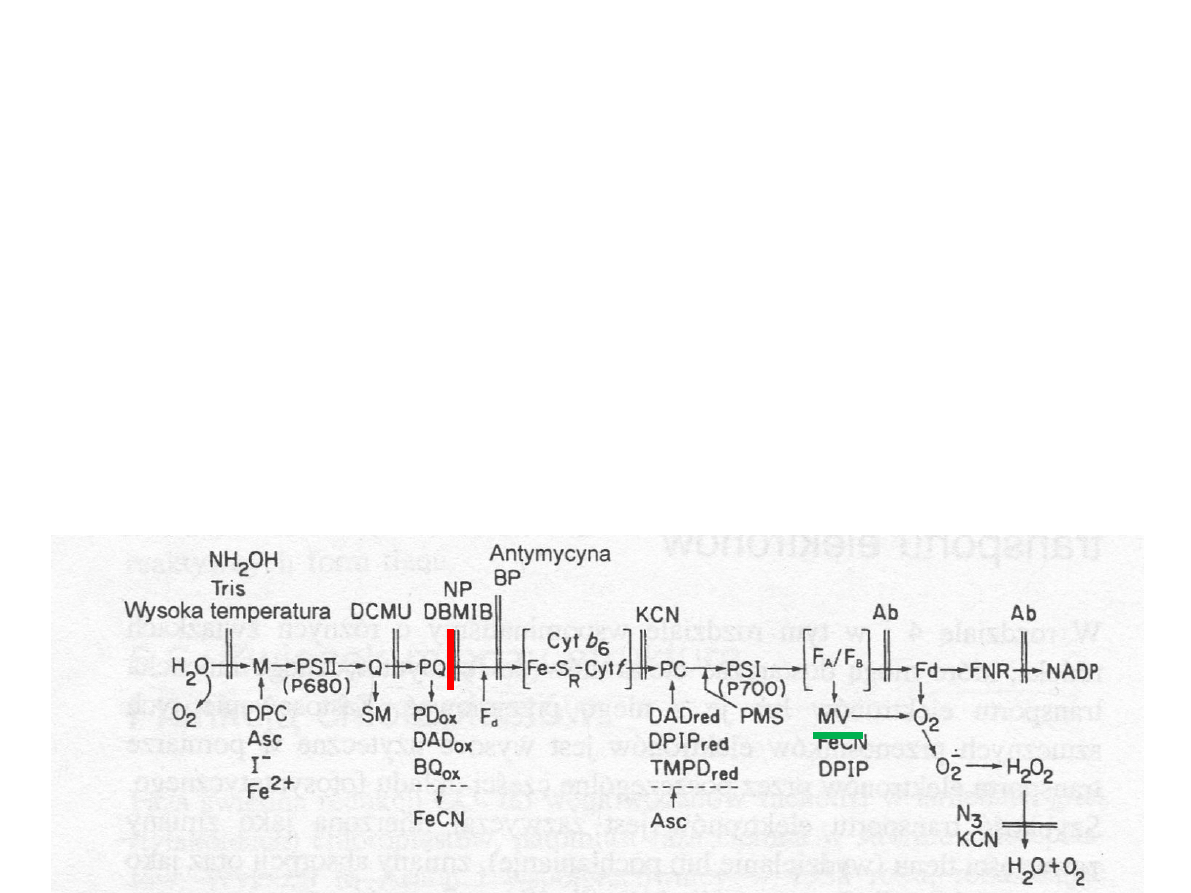
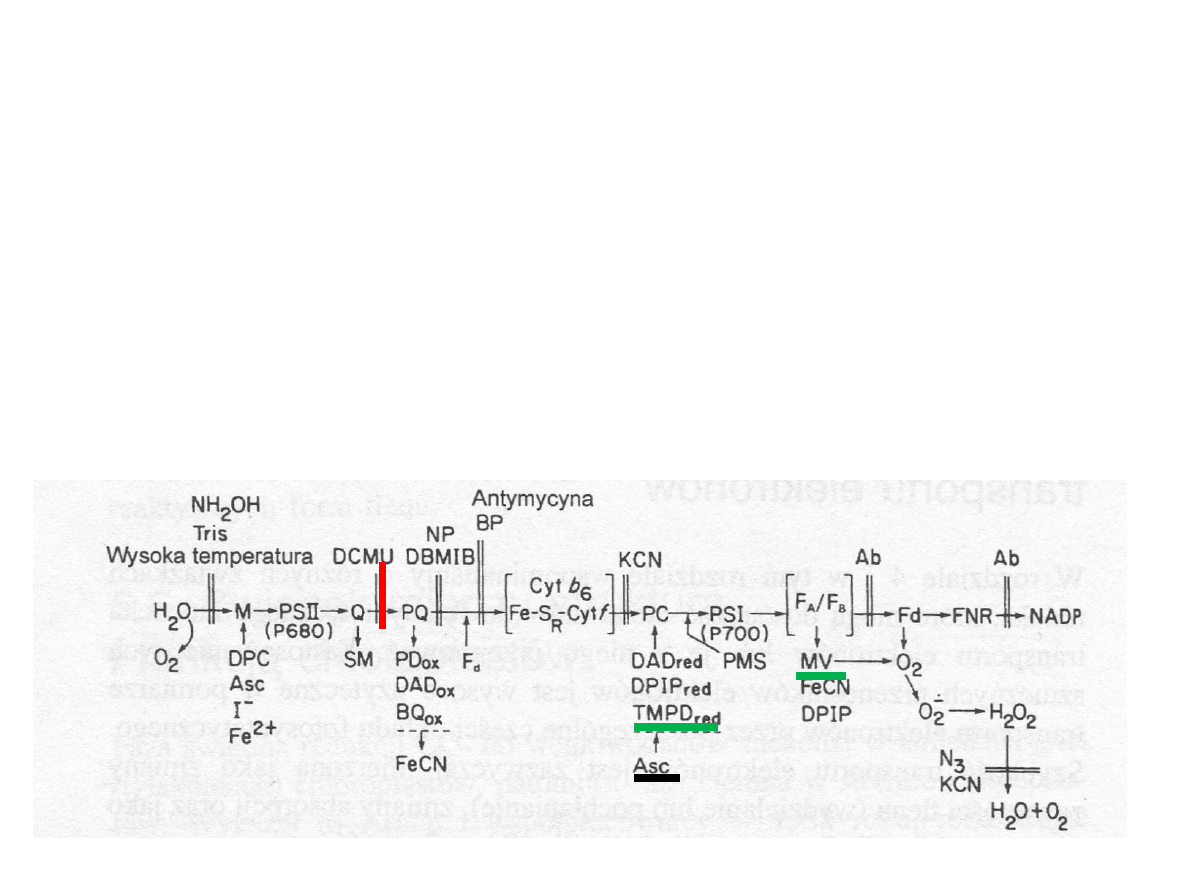
Transport elektronów i powstawanie
NADPH
2
M manganowo-białkowy
kompleks wydzielający tlen;
Y
Z
reszta tyrozynowa białka D1;
Pheo feofityna;
Q
A
, Q
B
,PQ plastochinony;
cyt b, cyt f cytochromy
Fe-S
R
bialko żelazowo-siarkowe
Rieskiego
PC plastocyjanina
A
0
chlorofil a
A
1
filochonon
F
X
, F
A
, F
B
centra Fe-S
Fd ferredoksyna
FNR reduktaza ferredoksyna –
NADP
(Hall i Rao, 1999)
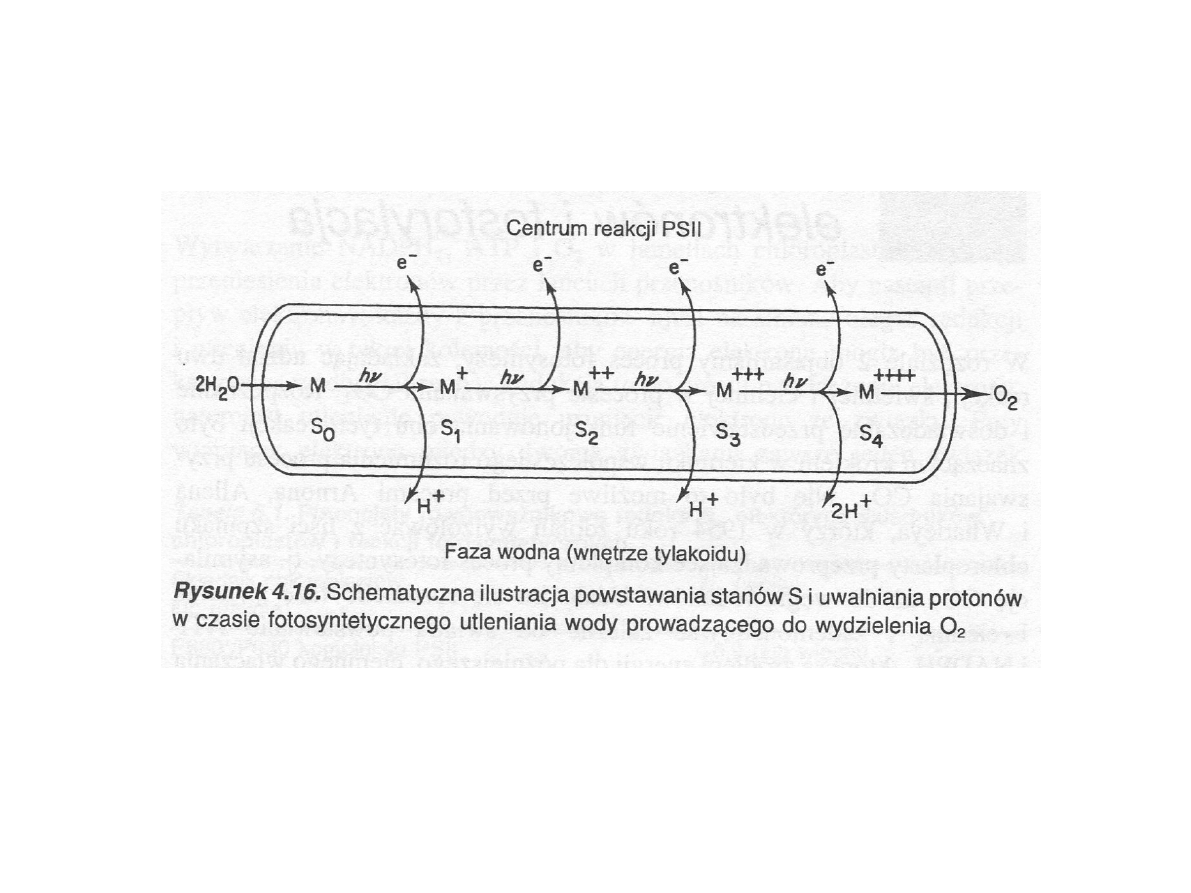
Wydzielanie tlenu (PSII)
(Hall i Rao, 1999)
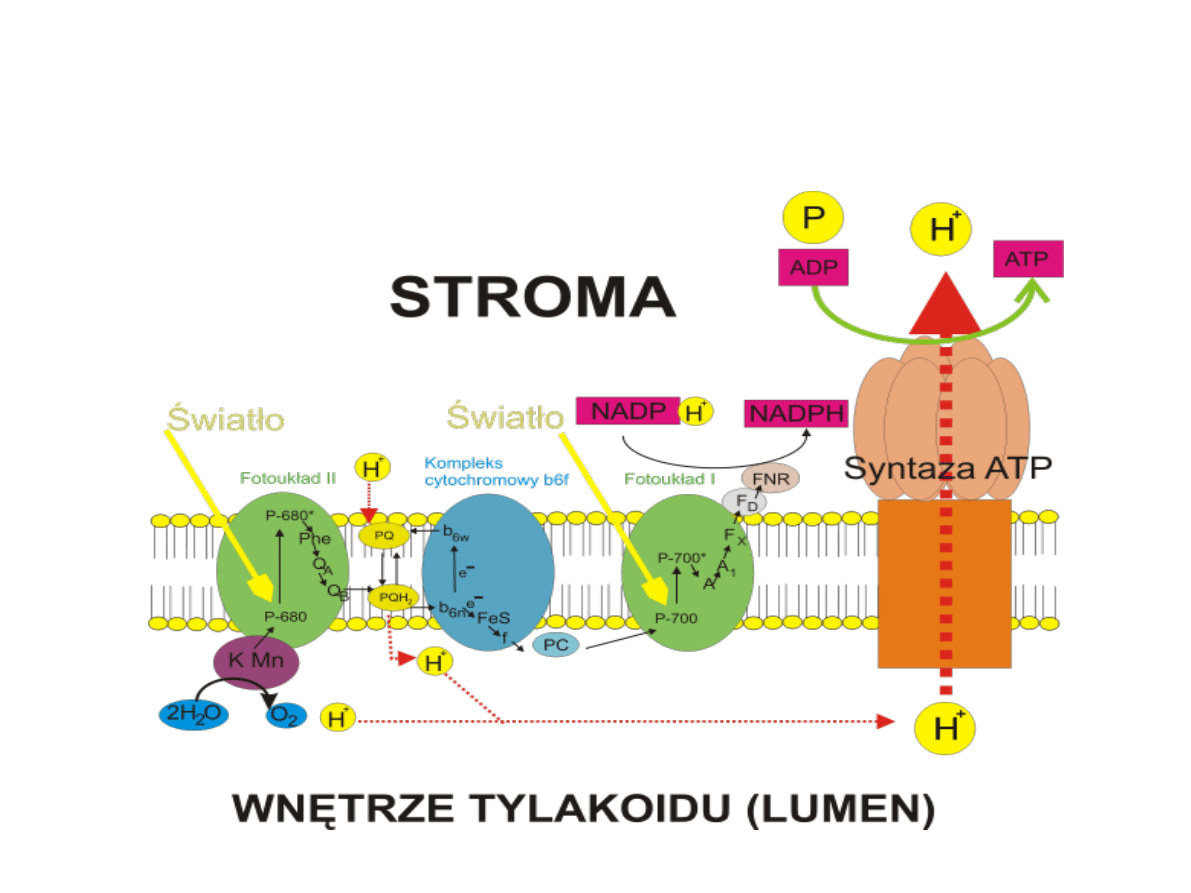
Synteza ATP
CF1
CF0

BADANIE

Układy badane w czasie
wykonywania ćwiczenia
Układ
fotosyntetyczny II
Układ
fotosyntetyczny I
Cały łańcuch
fotosyntetyczny

METODA
Pomiar wydzielania lub pochłaniania
tlenu
DAWNIEJ: Joseph Priestley (XVIII w.)
employees.csbsju.edu/SSAUPE/biol115/priestly.gif
Pomiar wydzielania lub pochłaniania
tlenu
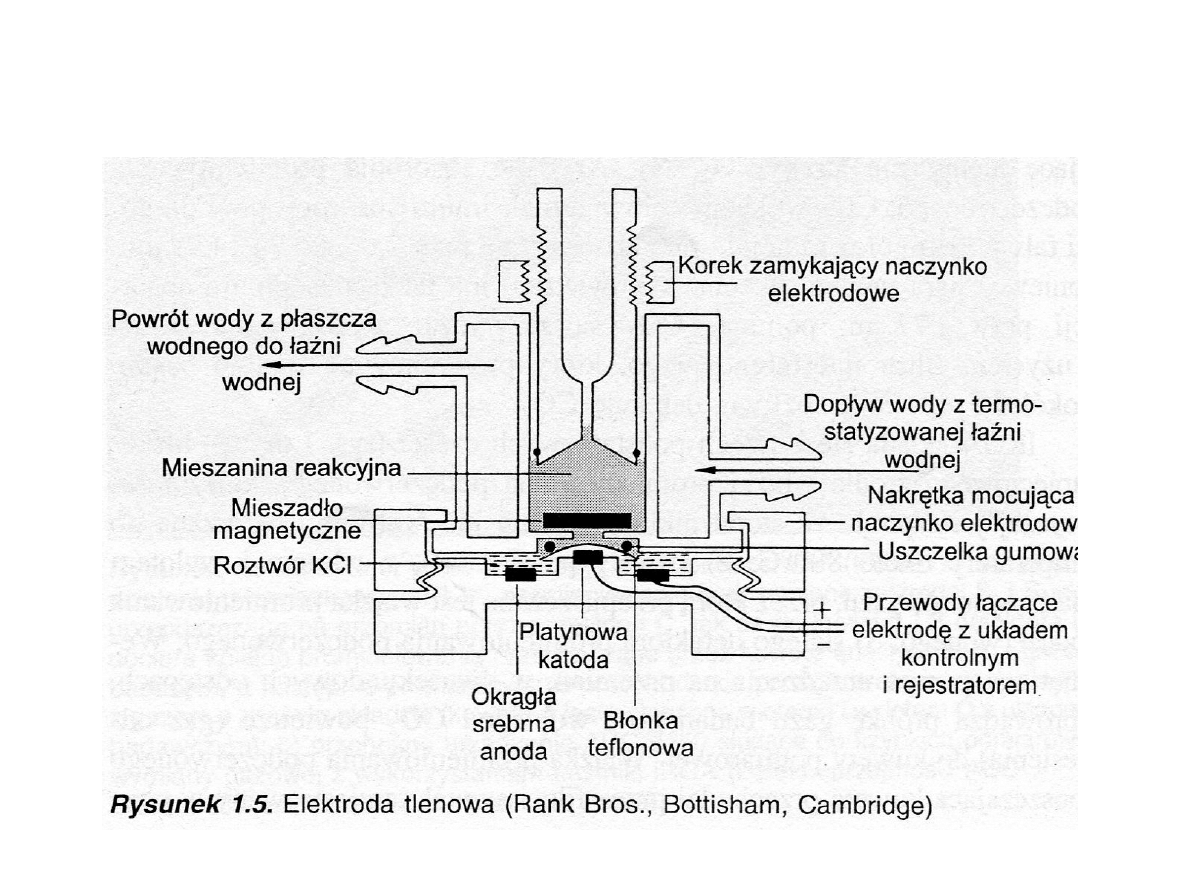
OBECNIE: Elektroda tlenowa (Clarka)
(Hall i Rao, 1999)

Schemat badania
1. Oznaczanie aktywności PSII
a.
Kontrola
b.
+ DCMU
c.
+ kwas linolenowy
2. Oznaczanie aktywności całego łańcucha
a.
+ metyloamina
b.
+ DBMIB
3. Oznaczanie aktywności PSI
a.
+ DCMU
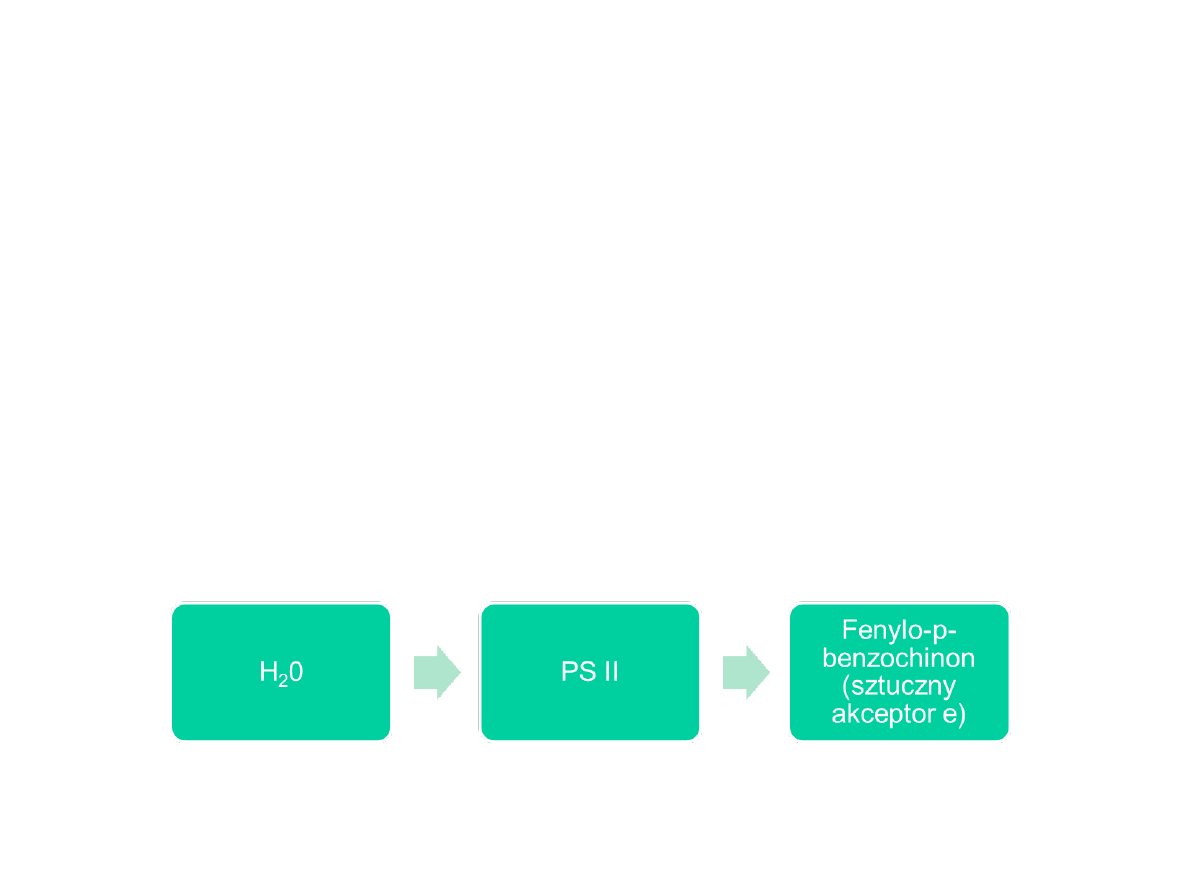
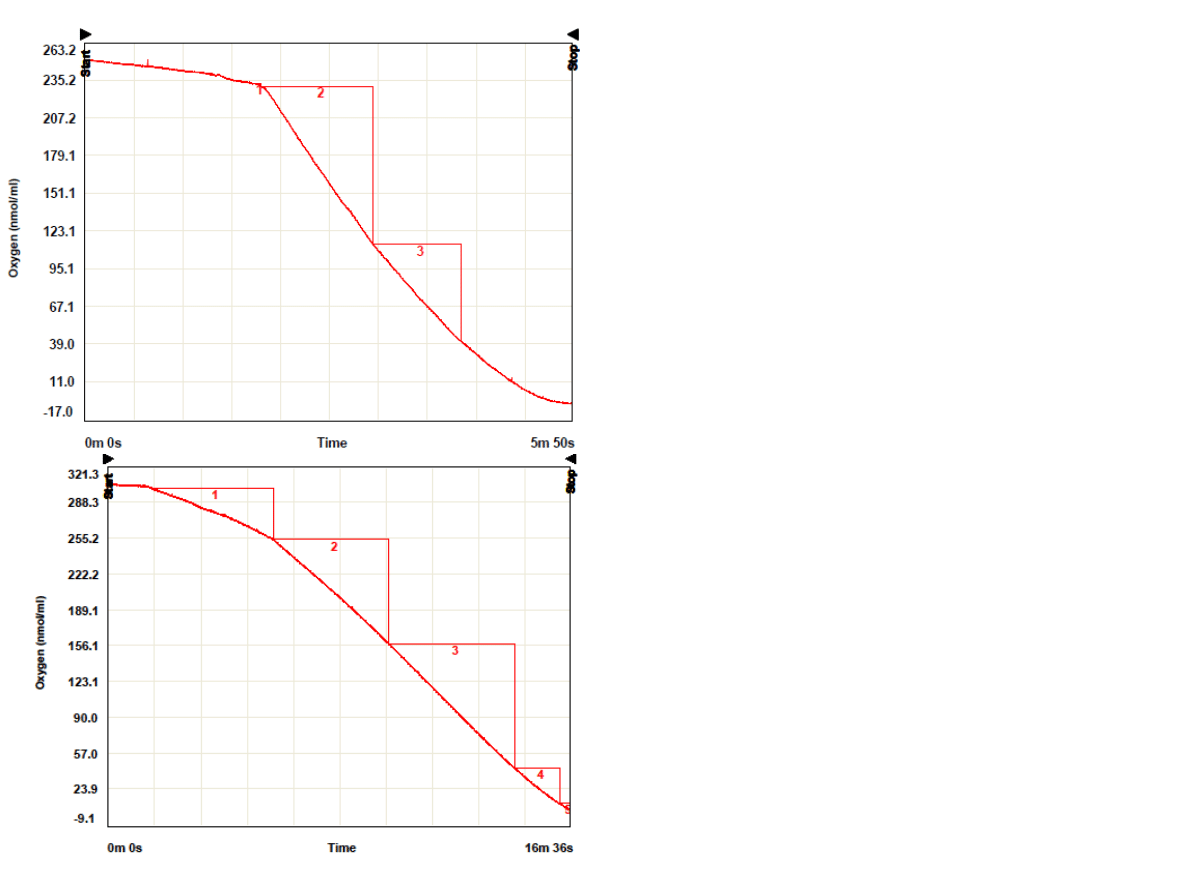
Oznaczanie aktywności PSII
KONTROLA
• Pomiar szybkości wytwarzania tlenu
• Donor e
-
:H
2
0
• Sztuczny akceptor: fenylo-p-benzochinon
•
odbiera e
-
z PSII, ale nie przekazuje ich na cytochromy
(zastępuje plastochinon) → możliwe oddzielenie PSII od PSI
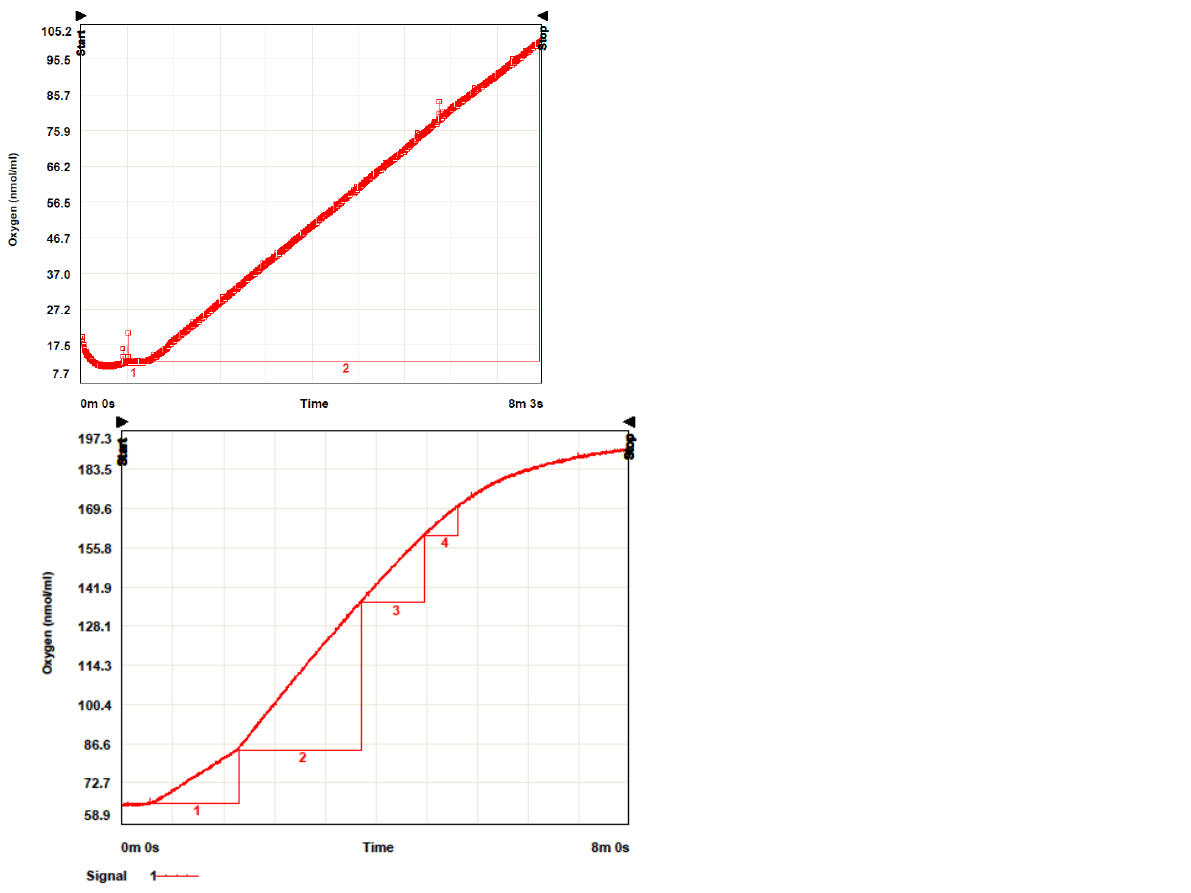
•Objętość dodawanej zawiesiny
chloroplastów: 7ul
•Stężenie chlorofilu wynosi
11,368 mg/ml
•Szybkość 22,78 O
2
*h
-1
*mg
-1
•Objętość dodawanej zawiesiny
chloroplastów
1. odc. 6ul
2. odc. 12ul
•Stężenie chlorofilu wynosi 7,8
mg/ml
•Szybkość (odc.1) 35,66 O
2
*h
-1
*mg
-
1
Oznaczanie aktywności PSII
+ DCMU
• Pomiar szybkości wytwarzania tlenu
• Donor e
-
:H
2
0
• Sztuczny akceptor: fenylo-p-benzochinon
•
odbiera e
-
z PSII, ale nie przekazuje ich na cytochromy
(zastępuje plastochinon) → możliwe oddzielenie PSII od PSI
• DCMU → inhibitora PSII, który blokuje miejsce
przyłączenia plastochinonu w PSII uniemożliwiając
transport e
-
na PSI
Sztuczny
akceptor
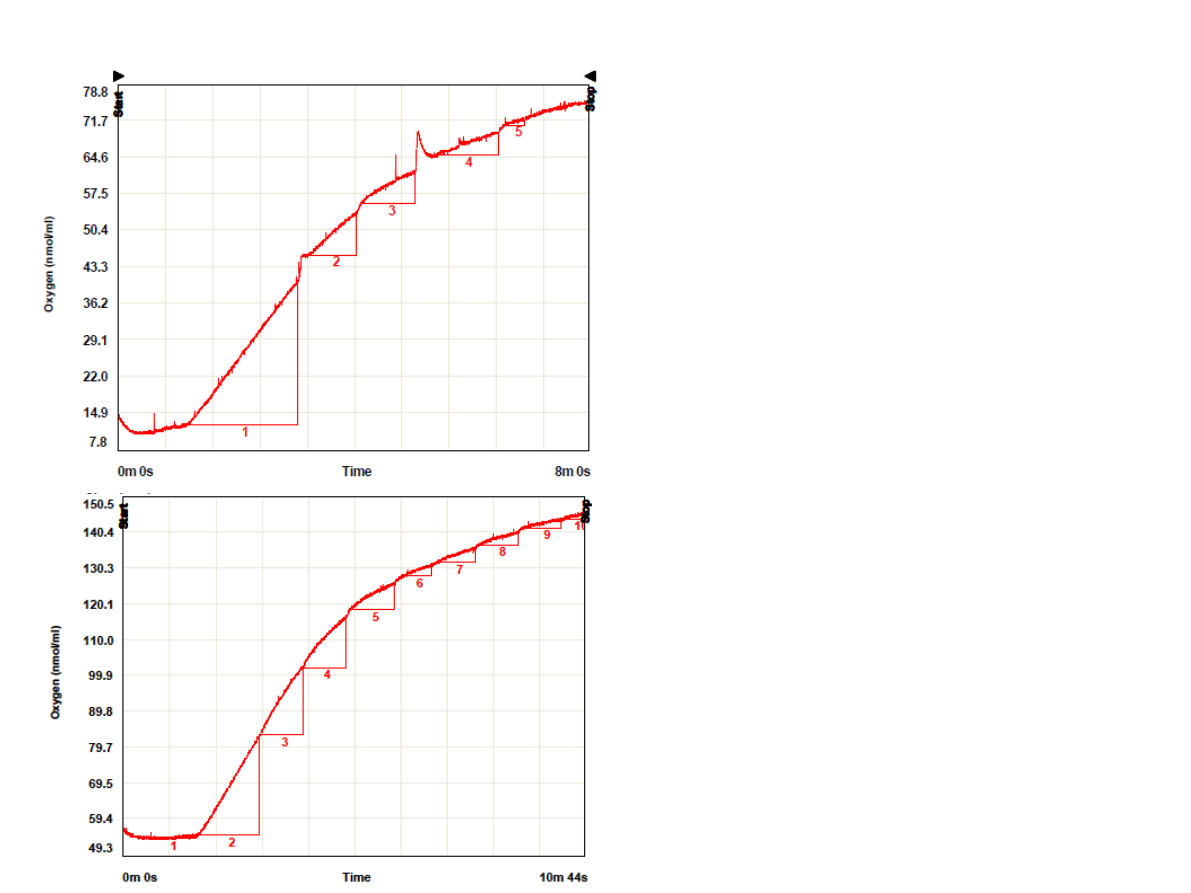
DCMU dodawano w
objętości 5ul w
odstępach ok. 1
minutowych
Odc. 3 +DCMU 5ul (kolejne odc.
+5ul)
•Punkty na wykresie
odpowiadają spadkowi szybkości
wydzielania tlenu przy
dodawaniu kolejnych porcji 5ul
DCMU
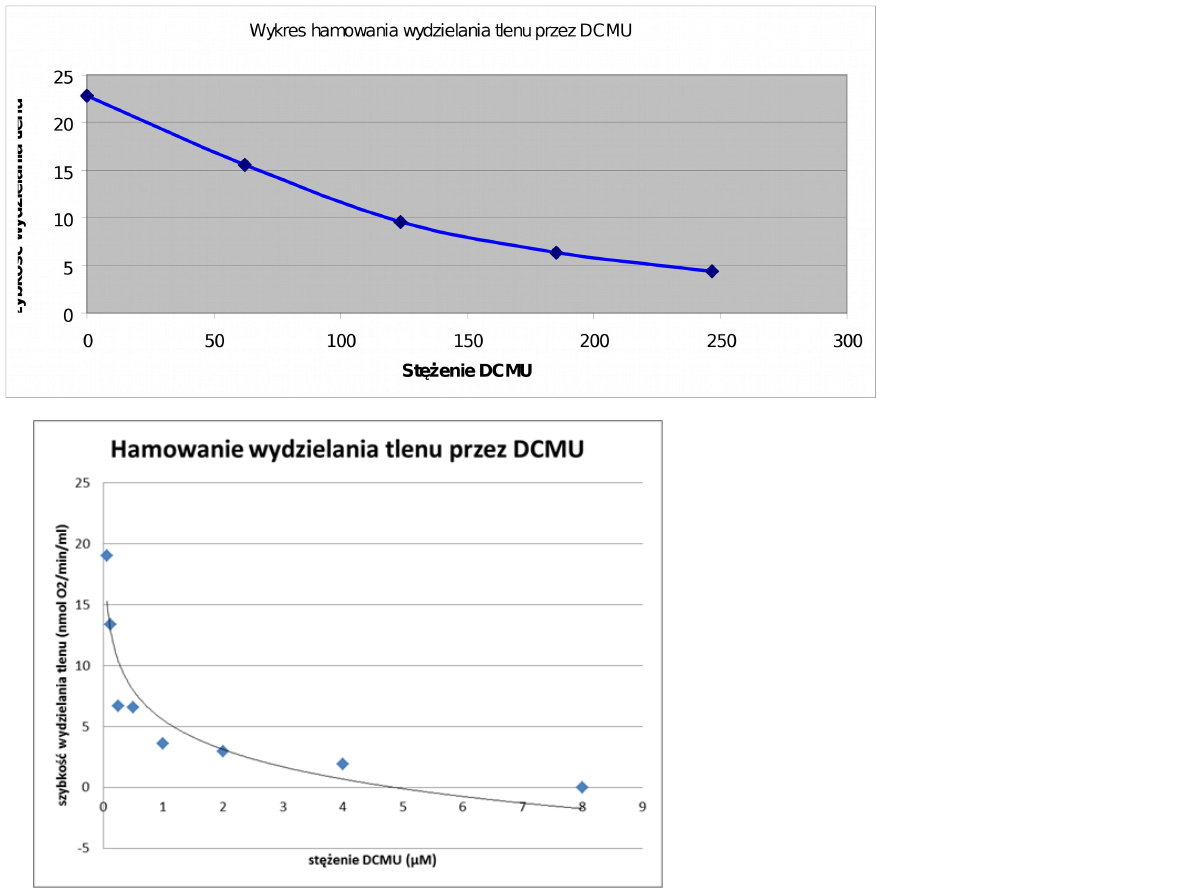
•Stężenie DCMU przy którym
obserwuje się hamowanie
reakcji w 50% wynosi 103 nM.

Oznaczanie aktywności PSII
+ kwas linolenowy
• Pomiar szybkości wytwarzania tlenu
• Donor e
-
:H
2
0
• Sztuczny akceptor: fenylo-p-benzochinon
•
odbiera e
-
z PSII, ale nie przekazuje ich na cytochromy
(zastępuje plastochinon) → możliwe oddzielenie PSII od PSI
• Kwas linolenowy → jego ogon hydrofobowy posiada
zdolność do penetracji i niszczenia błon lipidowych
1. etap: zwiększenie dostępności światła do błon tylakoidów i
przyspieszenie reakcji
2. etap: degradacja układu i zahamowanie reakcji
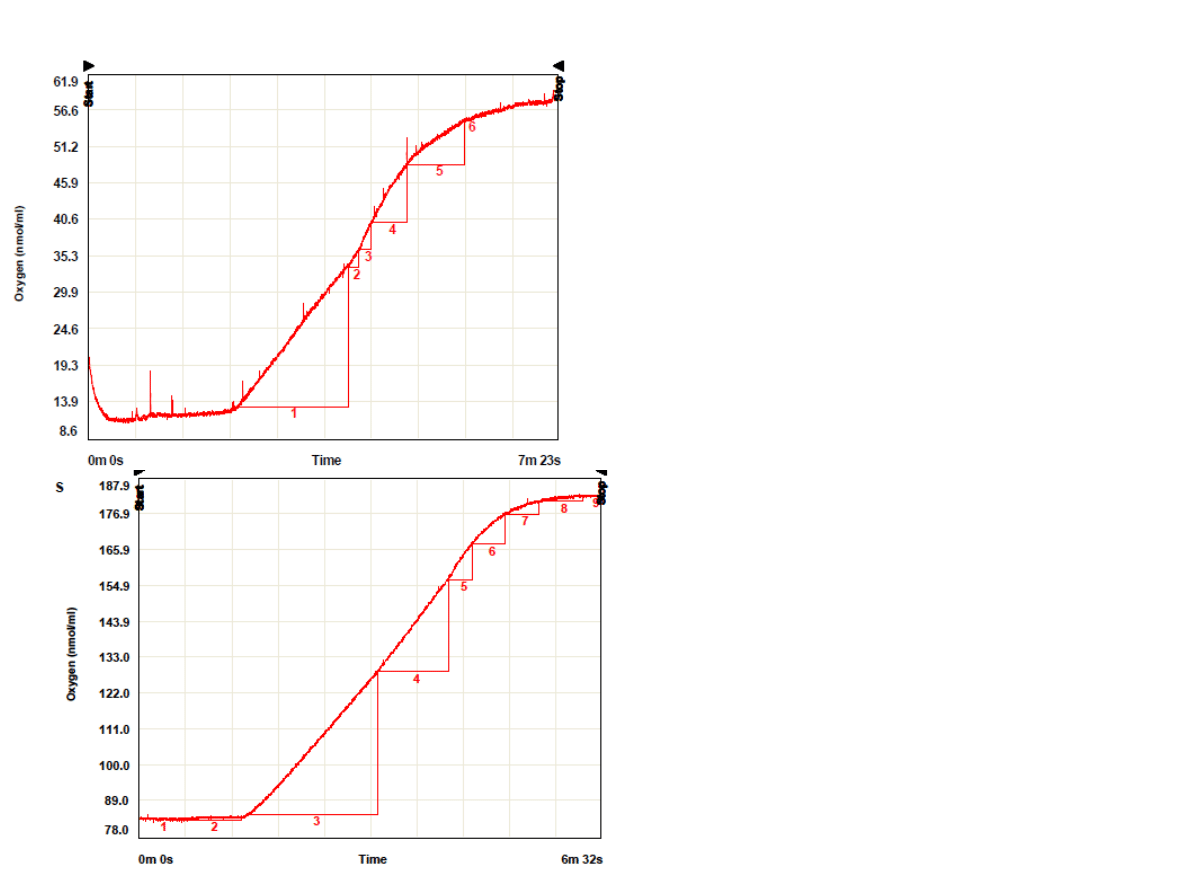
•Przyspieszenie reakcji po
dodaniu kwasu linolenowego:
etapy 2 oraz 3
•Hamowanie reakcji: etapy 4
oraz 5
•Całkowite zahamowanie
reakcji od etapu 6
•Przyspieszenie reakcji po
dodaniu kwasu linolenowego:
etapy 1-5 (c kw. linol.=25ug/ml)
•dodanie drugiej porcji
•Hamowanie reakcji: etapy 5-9
(c=50ug/ml)
•Całkowite zahamowanie reakcji
od etapu 8

Układ
pomiarowy
PSII
Szybkość reakcji
O
2
*h
-1
*mg
-1
chlorofilu
% kontroli, stopień
hamowania lub
stymulacji
KONTROLA
22,78
100%
49,21
100%
33,27
100%
35,41
100%
+DCMU
(całkow.
zaham. przy
c= 0,16
µmol/ml)
Szybkość reakcji maleje wykładniczo wraz ze stężeniem
inhibitora
[przy stęż. 246nM: 4,4 (19,3%)]
[48,7 (99%); 34,3 (70%); 17,1 (35%); 12,1 (25%); 10,6
(22%); 8,7 (18%0; 6,4 (13%); 0 (0%)]
[23,96 (72%); 13,5 (40%); 6,7 (20%)]
[19,7 (56%); 12,4 (35%)]
+kwas
linolenowy
(c= 0,089 –
0,178 µmol/ml)
Stymulacja 31,47
73,71% (?)
Hamowanie 3,88
78,6% (?)
Stymulacja 72,82
116%
Hamowanie 0
100% hamowania
Stymulacja 40,92
151,12%
Hamowanie -1,81
100% hamowania
Stymulacja 34,82
109,14%
Brak danych
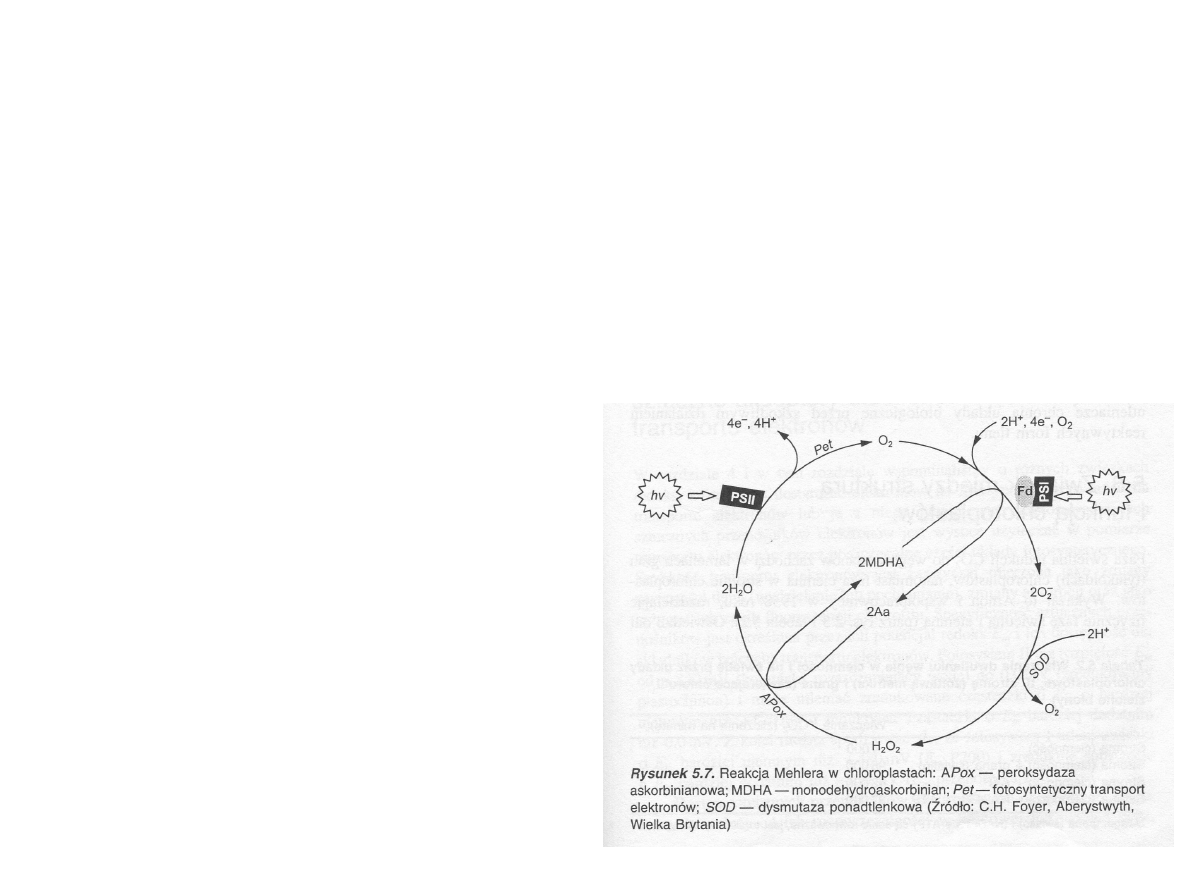
Pseudocykliczny transport
elektronów
Reakcja Mehlera
Przeniesienie e- bezpośrednio z kompleksu PSI na cząsteczkę tlenu
(powstaje anionorodnik ponadtlenkowy)
2 MV
+
+ 2O
2
→ 2 MV
2+
+ 2 O
2.-
Anionorodnik ponadtlenkowy przekształca się w nadtlenek wodoru w
wyniku reakcji katalizowanej przez miedziano-cynkową dysmutazę
ponadtlenkową.
2 O
2.-
+ 4H
+
→ 2 H
2
O
2
+ 2O
2
Redukcja nadtlenku wodoru zachodzi dzięki
tylakoidalnej peroksydazie askorbinianowej,
która jednocześnie powoduje utlenienie
askorbinianu
(powstaje monodehydroaskorbinian -MDHA).
2 H
2
O
2
→ 2 H
2
O + O
2

Oznaczanie aktywności całego
łańcucha +metyloamina
• Pomiar szybkości pobierania tlenu
• Donor e
-
:H
2
0
• Sztuczny akceptor: metylowiologen (reakcja
Mehlera)
• Czynnik rozprzęgający: metyloamina
• Zatrzymuje syntezę ATP: ułatwia ruch protonów
przez błony → ogranicza gradient protonów
• Możliwy pomiar fosforylacji niecyklicznej
(zablokowana fosforylacja cykliczna, w której
powstaje tylko ATP)
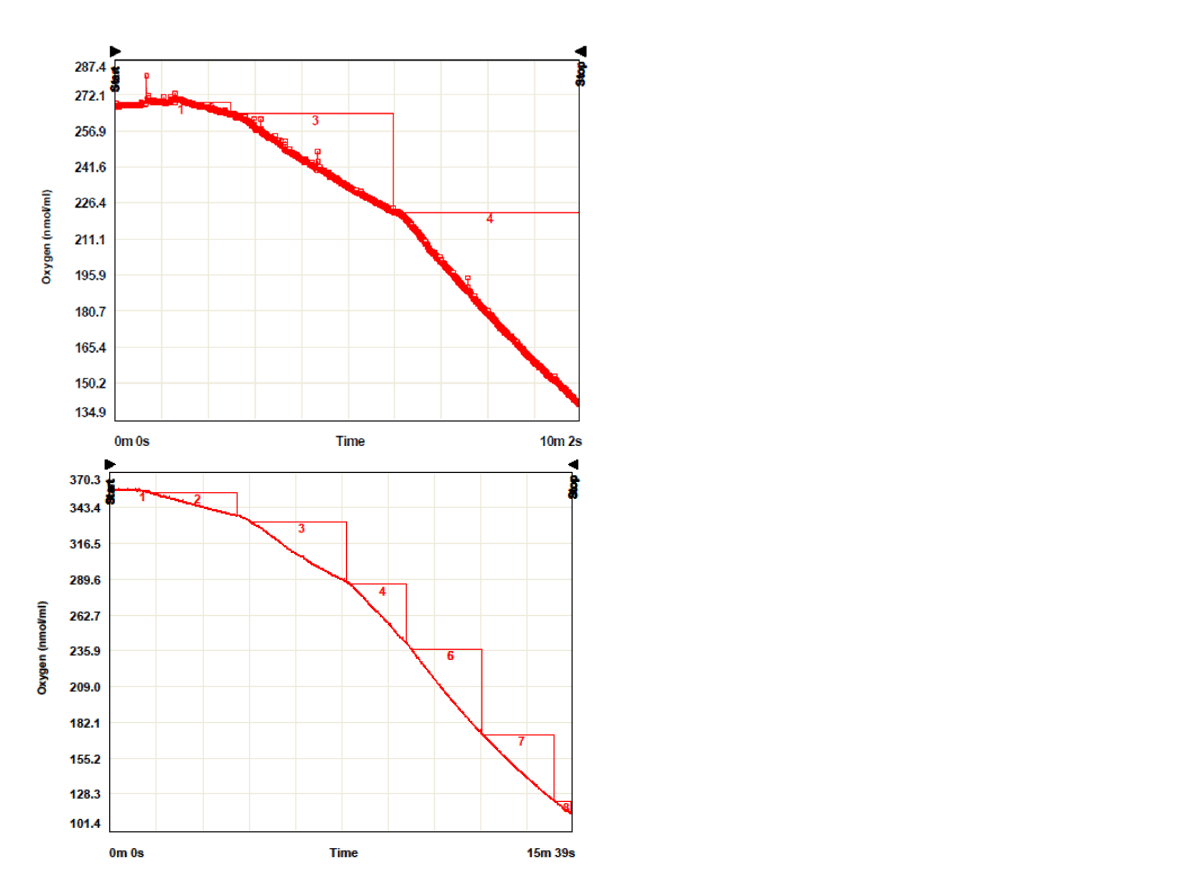
Metyloamina c=3mM
Odc. 3 +metyloamina
Odc. 4, 6 + kolejne porcje
chloroplastów
Oznaczanie aktywności całego
łańcucha
+DBMIB
• Pomiar szybkości pobierania tlenu
• Donor e
-
:H
2
0
• Sztuczny akceptor: metylowiologen (reakcja
Mehlera)
• Inhibitor: DBMIB
• hamuje utlenianie PQ, zatem uniemożliwia transport
e
-
z PQ do kompleksu cytochromów bf, blokując PSI
2ul 5mM DBMIB (c=0,01µM)
Odc4 +DMBIB

Cały łańcuch
Układ pomiarowy
Szybkość reakcji
O
2
*h
-1
*mg
-1
chlorofilu
% kontroli, stopień
hamowania lub
stymulacji
+ metyloamina
(bez -2,7) -6,39
137,13% stymulacja
(bez -14,88) -36,35
244% stymulacja
(bez -18,8) -21,81
115,98% stymulacja
+DBMIB
(bez -14,51) -0,34
2,34% hamowanie
(bez -16,69), -1,11
6,65% hamowanie
(bez -12,2) -2,77
22,73% hamowanie
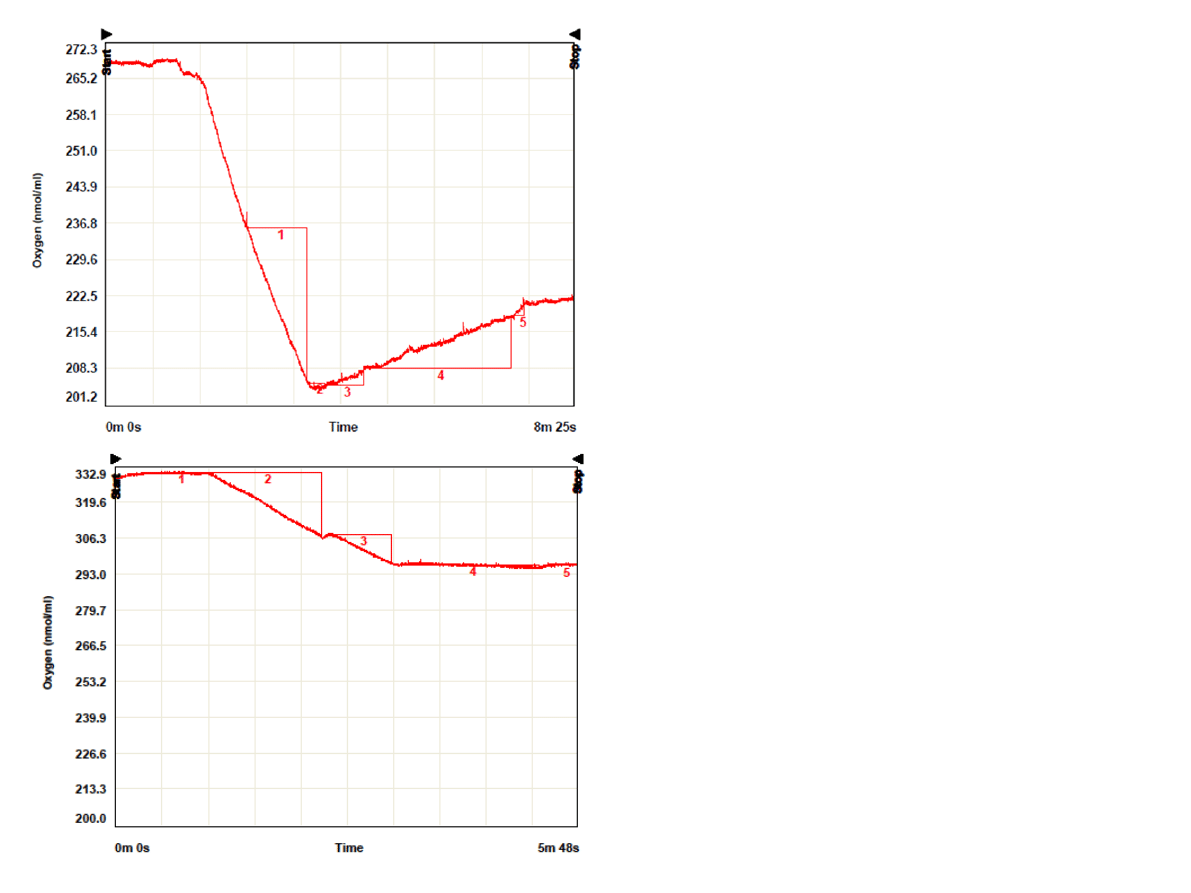
Oznaczanie aktywności PSI
• Pomiar szybkości pobierania tlenu
• Donor e
-
:TMPD (+askorbinian – pozwala utrzymywać
TMPD w formie zredukowanej)
• Sztuczny akceptor: metylowiologen (reakcja
Mehlera)
• Inhibitor PSII: DCMU
•3ul 8mM DCMU
(c=0,012umol/ml)

PSI
Układ pomiarowy
Szybkość reakcji
O
2
*h
-1
*mg
-1
chlorofilu
% kontroli, stopień
hamowania lub
stymulacji
DCMU
-36,31
Oznaczanie aktywności
(bez stymulacji, bez
inhibicji)
-29,45
-43,01

Bibliografia
• Hall, D.O., Rao K.K. (1999). Fotosynteza. WNT.
• Garstka, M. Strukturalne podstawy reakcji świetlnych fotosyntezy.
Postępy Biologii Komórki 34 (2007) 445-476.
• Hipkins M. F., Baker N. R. Photosynthesis energy trunsduction. A
practical approach. str. 117-154.
• Nicholls D., Ferguson, S. (1995) Bioenergetyka 2. PWN: str. 199-
211.
• Kopcewicz J., Fizjologia roślin str. 272-291 (PWN, 2009)
• Internetowe źródła rysunków (slajdy 1-8, 9)
http://www.helpsavetheclimate.com/photosynthesis.html,
http://pl.wikipedia.org/wiki/Tylakoid,
http://pl.wikipedia.org/wiki/Wiolaksantyna,
http://pl.wikipedia.org/wiki/Fikocyjanina , http://www.food-
info.net/pl/colour/chlorophyll.htm,
http://www.gdynia.mm.pl/~drake87/drake87/3/36/3603001.htm,
http://pl.wikipedia.org/wiki/Fotosynteza,
http://pl.wikipedia.org/wiki/Plik:Fotouk%C5%82ad_1.svg,
http://pl.wikipedia.org/wiki/Fosforylacja_fotosyntetyczna,
http://owocewarzywakwiaty.pl/warzywa/artykuly/a/pokaz/c/article/ar
t/mszyce-i-wciornastki-grozne-na-grochu.html

Dziękujemy!
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
Wyszukiwarka
Podobne podstrony:
Przemoc w mediach prezentacja wersja koncowa 2
teoria gospodarki publicznej - wszystkie wyklady (moja wersja), PREZENTACJA
sciagi technika moja wersja
moja wersja ped mini
moja wersja
Laborki, różne, projekt, projekt z zarzadz moja wersja2 (deleted 493bcab4 13515 774bdec2)
elektrorafinacja miedzi wersja koncowa
Tematy do przygotowania prezentacji multimedialnych do oceny końcowej z kursu
moja wersja genetyczna
prezentacja karpaty lepsza wersja
Laborki, różne, projekt projekt z zarzadz moja wersja2 (deleted 493bcab4-13515-774bdec2)
Test 2 ściąga alfabetycznie, moja wersja
To moja wersja wydarzeń
Wersja końcowa
Raport z wyszukiwania - wersja końcowa, Studia INiB, Projekty profesjonalne 1
moja wersja ...sadowka27.01.2012, VI rok, Genetyka, gena-prezki, 15 - Medycyna sądowa, giełdy, Giełd
motyw matki prezentacja chomik, moja prezentacja
Patomorfologia jamy ustnej 2008 II koło moja wersja, 3 rok stoma, PJU, PJU 2 kolo
ćwiczenie 7 moja wersja
więcej podobnych podstron