
Elektrochemia

Ogniwa galwaniczne
• Charakterystyczną właściwością chemiczną metali
jest ich zdolność do oddawania elektronów w
reakcjach chemicznych i tworzenia dodatnio
naładowanych jonów. Im łatwiej atomy metali
przechodzą w stan jonowy tym energiczniej
wchodzą w reakcję z innymi pierwiastkami a więc
tym większa jest ich reaktywność chemiczna.
• Metale bardziej reaktywne są w stanie wypierać ze
związków chemicznych metale mniej reaktywne.
Szczególnie jest to widoczne w roztworach
• Cu
2+
+ SO
42-
+ Zn
0
Cu
0
+ Zn
2+
+ SO
42-

• Na granicy faz występuje zawsze skok potencjału
elektrycznego. Powstawanie skoku potencjału na
granicy faz jest wynikiem niejednakowo łatwego
przekraczania
tej
granicy
przez
różne
naładowane cząstki, takie jak jony dodatnie,
ujemne czy elektrony. Utworzona różnica
potencjałów
przyspiesza
ruch
cząstek
wolniejszych,
hamując
równocześnie
ruch
cząstek szybszych, aż do mementu kiedy te
szybkości wyrównają się, a więc kiedy zostanie
osiągnięty stan równowagi
.
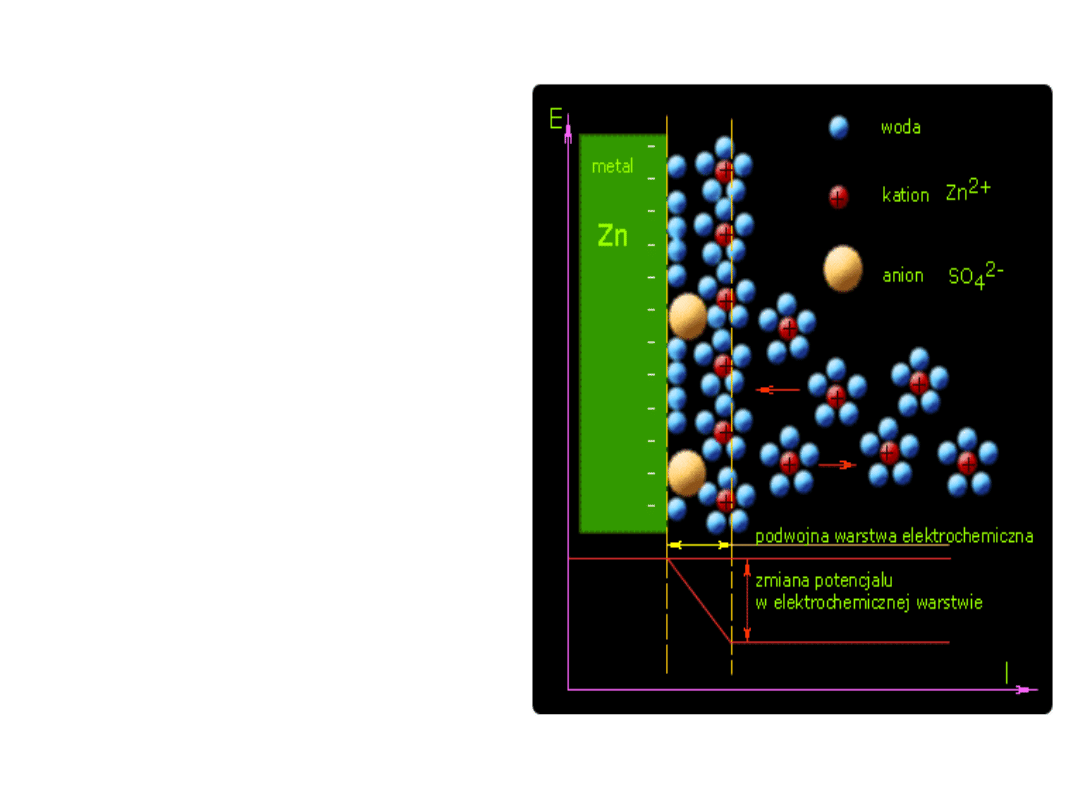
• Pod wpływem przyciągania
wywołanego przez dipolowe
cząsteczki wody, metal
zależnie od reaktywności
chemicznej, mniej lub bardziej
intensywniej przechodzi w
stan jonowy, tzn. wysyła do
roztworu swoje jony. Na
skutek tego metal ładuje się
ujemnie.
Obecne w roztworze jony
dodatnie metalu (kationy) są
solwatowane (otoczone
cząsteczkami rozpuszczalnika)
wykazują dążność do
gromadzenia się w pobliżu
ujemnie naładowanej
powierzchni metalu, zatem w
pobliżu tej powierzchni tworzy
się warstwa ładunku
dodatniego. Część jonów
ulega na powierzchni metalu
rozładowaniu i przejściu w
stan metaliczny.
• Między powierzchnią metalu a powierzchnią roztworu na
granicy zetknięcia się dwu faz wytwarza się elektryczna
warstwa podwójna i powstaje pewna różnica potencjałów
nazywana potencjałem elektrochemicznym.
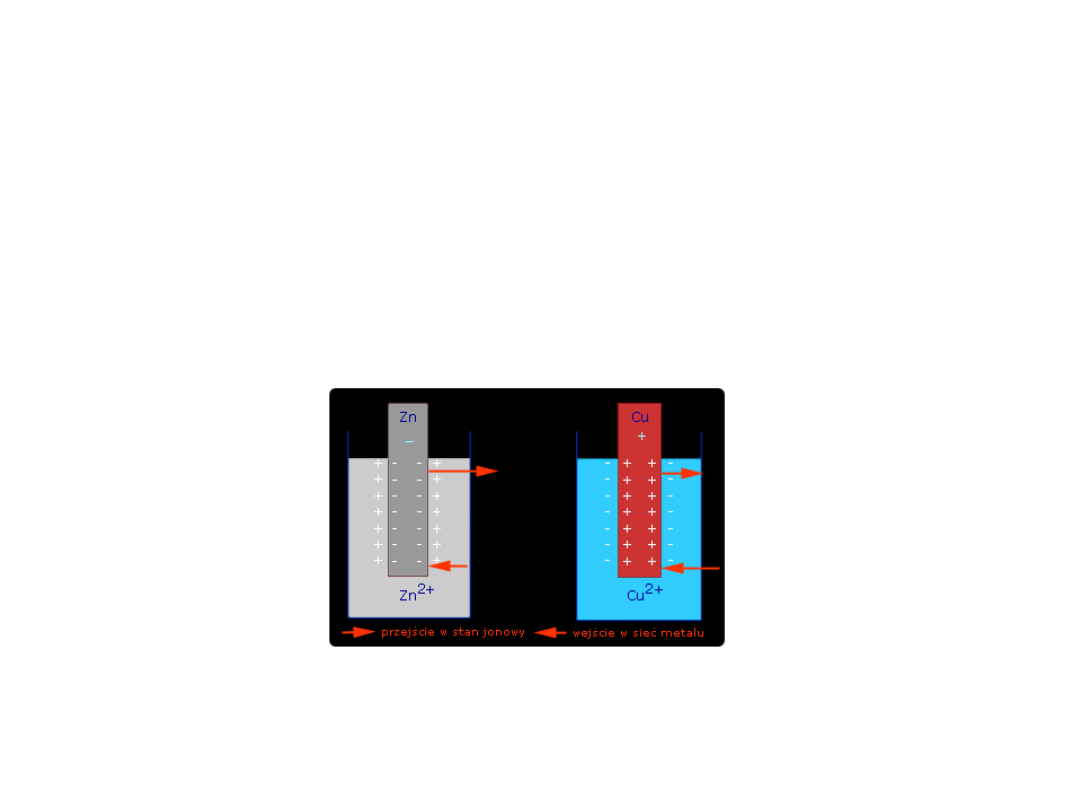
• Taki układ składający się z fazy metalicznej (metalu –
przewodnika I rodzaju) i otaczającego ją roztworu
elektrolitu ( przewodnika II rodzaju) nosi nazwę elektrody
(półogniwa).
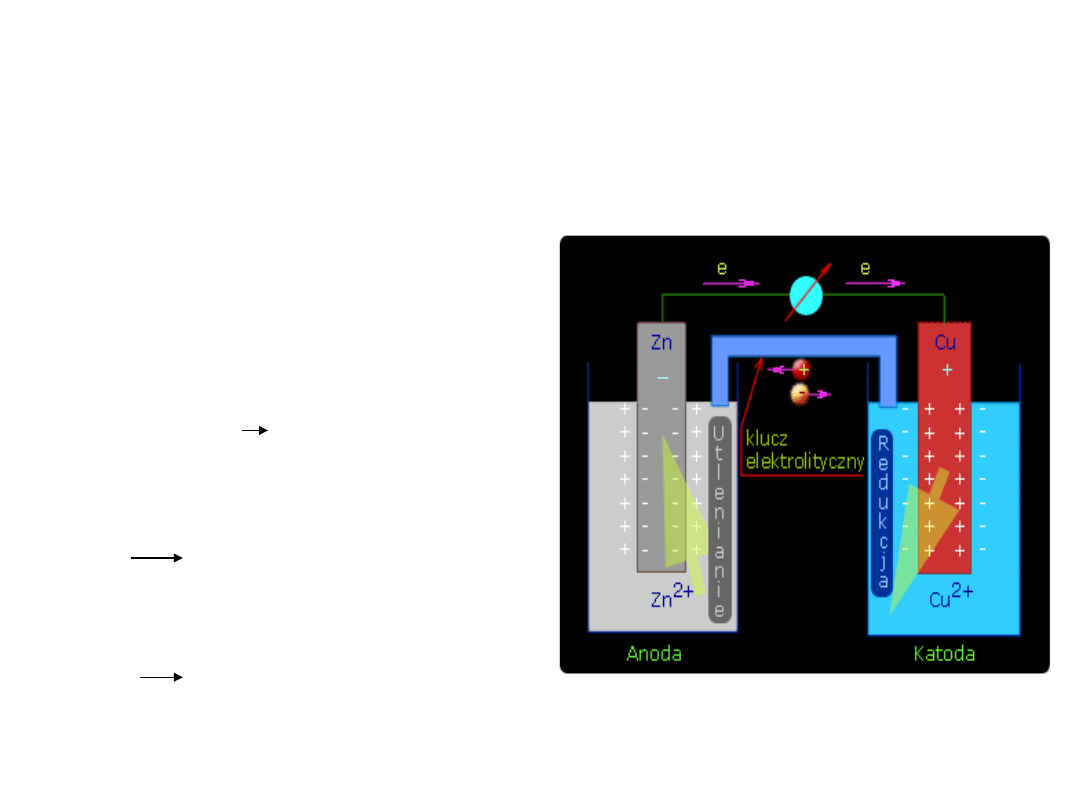
Schemat ogniwa galwanicznego
• Jeśli oba półogniwa zostaną
połączone kluczem
elektrolitycznym to
zaobserwujemy zmianę potencjału
równowagowego elektrod – taki
układ elektrod nazywamy ogniwem
galwanicznym
• Ogniwo Daniella
Zn
(s)
+ Cu
2+(aq)
Zn
2+(aq)
+ Cu
(s)
na płytce cynkowej zachodzi
utlenianie – więc stanowi ona
anodę
Zn
(s)
Zn
2+
+ 2e
Na płytce miedzianej zachodzi proce
redukcji – więc stanowi ona katodę
Cu
2+
Cu + 2e
Ogniwo Daniella
• Schemat ogniwa
• Potencjał ogniwa
• E=+0,3419-(-0,763)=1,105V
Cu
Cu
Zn
Zn
2
2
2
0
/
2
0
/
/
/
log
2
059
,
0
log
2
059
,
0
2
2
2
2
Zn
E
Cu
E
E
E
E
E
Zn
Zn
Cu
cu
Zn
Zn
Cu
Cu

• Wielkością charakteryzującą ogniwo
galwaniczne, jest różnica potencjałów
między elektrodami (ściślej różnica
potencjałów wewnętrznych przewodów
łącznikowych), wtedy gdy ogniwo jest w
równowadze, a więc, gdy nie płynie przez
nie prąd wypadkowy (ogniwo otwarte).
Wielkość ta nazywa się siłą
elektromotoryczną ogniwa i oznaczana
jest symbolem SEM lub E.
• Siła elektromotoryczna ogniwa, E, jest miarą
zdolności reakcji ogniwa do spowodowania
przepływu elektronów przez obwód.
Siła elektromotoryczna ogniwa
Pomiar SEM
• SEM ogniwa definiuje się jako różnicę potencjałów elektrody
dodatniej (o wyższej wartości potencjału E
Me(I)
) i ujemnej E
Me(II)
dla ogniwa otwartego, czyli takiego, w którym obwód
elektryczny nie jest zamknięty, a opór miedzy biegunami
ogniwa jest nieskończenie wielki.
SEM = E
Me(I)
- E
Me(II)
= E
• Zjawiska zachodzące na granicy faz metal- roztwór są źródłem
potencjału, którego wielkość określa równanie Nernsta.
E
0
- potencjał normalny elektrody odpowiadający
R – stała gazowa =8,1343 J/mol*K
T- temperatura (K)
n – liczba elektronów biorących udział w reakcji
F – stała Faraday’a = 96500 C
2
4
2
3
/
/
Sn
Sn
Fe
Fe
E
E
E
red
utl
nF
RT
E
E
ln
0

• Równanie Nernsta wyraża potencjał dowolnej elektrody.
Jest to wielkość, której absolutnej wielkości nie można
zmierzyć ani obliczyć teoretycznie.
• Można ją wyrazić liczbowo w odniesieniu do innej
elektrody, mierząc SEM ogniwa utworzonego z badanej
elektrody i elektrody porównawczej.
2
4
/
0
/
2
3
/
0
/
ln
2
ln
2
4
2
4
2
3
2
3
Sn
Sn
F
RT
E
E
Fe
Fe
F
RT
E
E
Sn
Sn
Sn
Sn
Fe
Fe
Fe
Fe
4
2
2
2
2
3
/
0
/
0
ln
2
2
4
2
3
Sn
Fe
Sn
Fe
F
RT
E
E
E
Sn
Sn
Fe
Fe
• Potencjałem standardowym elektrody jest siła
elektromotoryczna ogniwa, w którym drugą elektrodą jest
elektroda wodorowa.
• Elektrodzie wodorowej przypisuje się potencjał równy
zero.
• Jeśli stwierdzimy, że badana elektroda jest anodą, to jej
potencjał jest ujemny, jeśli katodą – to jej potencjał jest
dodatni.
• Np. aby wyznaczyć potencjał standardowy elektrody
cynkowej mierzymy potencjał ogniwa
V
E
Pt
H
H
Zn
Zn
s
g
aq
aq
s
76
,
0
0
2
2
V
Zn
Zn
E
V
Zn
Zn
E
H
H
E
76
,
0
/
76
,
0
/
/
2
0
2
0
2
0

Szereg napięciowy metali
•
Potencjał normalnej elektrody wodorowej równa się
zeru to zmierzona wartość SEM jest normalnym
względnym potencjałem danej elektrody.
• Potencjały elektrodowe uszeregowane wg rosnących
wartości noszą nazwę szeregu napięciowego
metali.
• Metal o ujemnej wartości potencjału
standardowego wykazuje termodynamiczną
dążność do redukowania jonów wodorowych w
roztworze.
• Jony metalu o dodatniej wartości potencjału
standardowego maja tendencję do redukowania
jonów wodorowych.
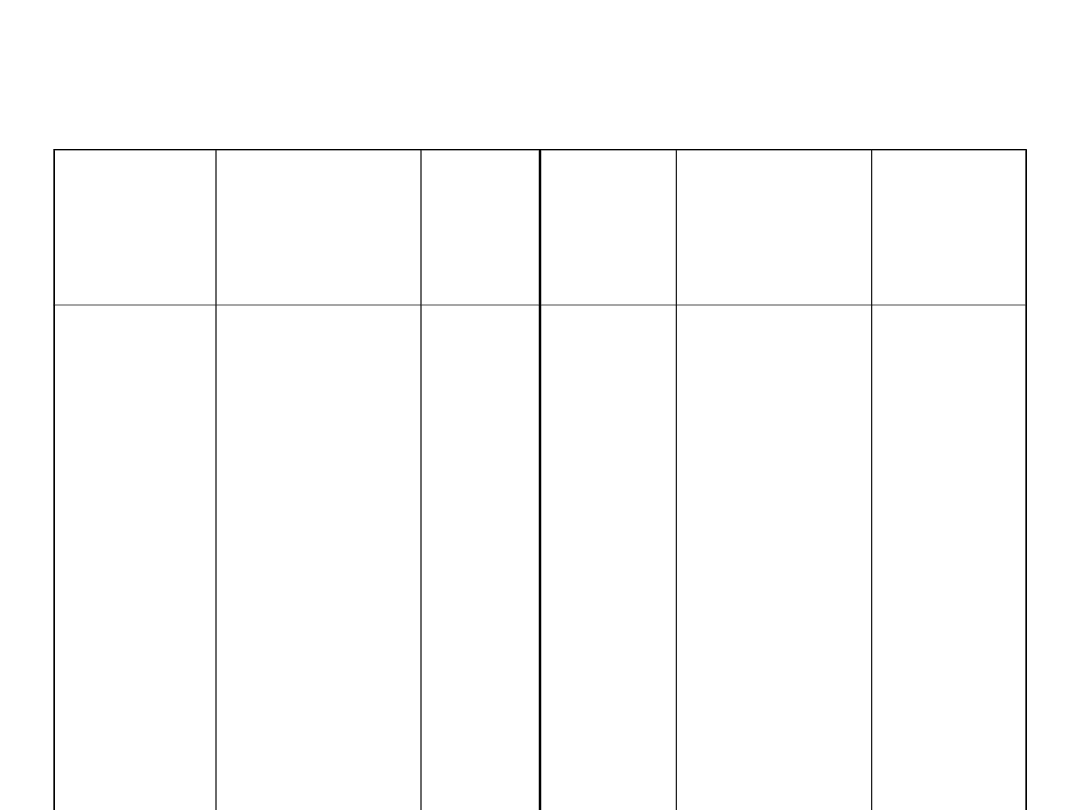
Szereg napięciowy metali
elektrod
a
Proces
przebiegają
cy na
elektrodzie
Eº, V
elektro
da
Proces
przebiegaj
ący na
elektrodzie
Eº, V
Li
+
/Li
K
+
/K
Ba
2+
/Ba
Ca
2+
/Ca
Na
+
/Na
Mg
2+
/Mg
Al
3+
/Al
Mn
2+
/Mn
Zn
2+
/Zn
Cr
3+
/Cr
Li
+
+e↔Li
K
+
+e↔K
Ba
2+
+2e↔Ba
Ca
2+
+2e↔Ca
Na
+
+e↔Na
Mg
2+
+2e↔Mg
Al
3+
+3e↔Al
Mn
2+
+2e↔Mn
Zn
2+
+2e↔Zn
Cr
3+
+3e↔Cr
-
3,040
1
-2,931
-2,912
-2,866
-2,714
-2,372
-1,662
-1,180
-0,763
-0,744
Fe
2+
/Fe
Cd
2+
/C
d
Ni
2+
/Ni
Pb
2+
/Pb
Fe
3+
/Fe
H
+
/H
2
Cu
2+
/C
u
Cu
+
/C
u
Ag
+
/Ag
Au
3+
/A
u
Fe
2+
+2e↔Fe
Cd
2+
+2e↔Cd
Ni
2+
+2e↔Ni
Pb
2+
+2e↔Pb
Fe
3+
+3e↔Fe
2H
+
+2e↔H
2
Cu
2+
+2e↔Cu
Cu
+
+e↔Cu
Ag
+
+e↔Ag
Au
3+
+3e↔Au
-0,447
-0,4030
-0,257
-0,262
-0,037
0,00
+0,349
+0,521
+0,799
6
+1,498

Termodynamika ogniw
elektrochemicznych
• W czasie gdy w ogniwie galwanicznym zachodzi reakcja
chemiczna, ogniwo może dostarczać pracy elektrycznej.
• Pracę te możemy obliczyć przez pomnożenie różnicy potencjałów
obu elektrod przez ładunek, który przepływa pomiędzy nimi.
Praca ta jest oddawana przez ogniwo, więc ma wartość ujemną.
W = -qE
• Napięcie pomiędzy elektrodami ogniwa jest zależne od natężenia
prądu. Obniża się ono w miarę wzrostu natężenia pobieranego
prądu i rośnie do pewnej wartości granicznej E (siły
elektromotorycznej). Praca wykonana wówczas przyjmuje
największą wartość, jaką można uzyskać przy przepływie danego
ładunku.
• Ogniwo pracuje wtedy w sposób odwracalny, a elektryczna praca
maksymalna stanowi miarę zmian entalpii swobodnej ogniwa
ΔG.
ΔG=-qE
ΔG=-nFE

Rodzaje ogniw
• Ogniwa pierwotne - po wyczerpaniu nie nadają się do
dalszego użytkowania, drugie można regenerować przez
ładowanie – ogniwo Lecklanche'go
• Ogniwa wtórne – akumulatory ołowiowy, Proces ładowania
akumulatora ołowiowego (elektroliza):
katoda (-) Pb
2+
+ 2e→Pb
anoda (+) Pb
2+
+2H
2
O→PbO
2
+4H
+
+2e
• Proces rozładowywania akumulatora ołowiowego (praca
akumulatora jako ogniwa)
anoda (-) Pb → Pb
2+
+ 2e
katoda (+) PbO
2
+4H
+
+2e →Pb
2+
+2H
2
O
• niklowo-żelazowy (Edisona) – mniej wrażliwy na wstrząsy i
brak konserwacji, srebrowo-cynkowy.
Zn
ZnCl
Cl
NH
MnO
C
2
4
2

• Ogniwa paliwowe (generatory elektrochemiczne)
– reakcje spalania gazów są reakcjami redox,
energia ,która powstaje w wyniku spalania ulega
bezpośrednio przemianie w energię elektryczną.
• W ogniwie wodorowo-tlenowym paliwem jest
wodór, utleniaczem czysty tlen.
• Na potrójnej granicy: gaz-ciecz-ciało stałe
zachodzi reakcja łączenia tlenu z wodorem
anoda (-) H
2
→2H
+
+2e
katoda (+) 2H
+
+2e+½O
2
→H
2
O
• Powstająca woda jest usuwana na zewnątrz, ale
jej część rozcieńcza elektrolit co jest jedną z wad
ogniw paliwowych.
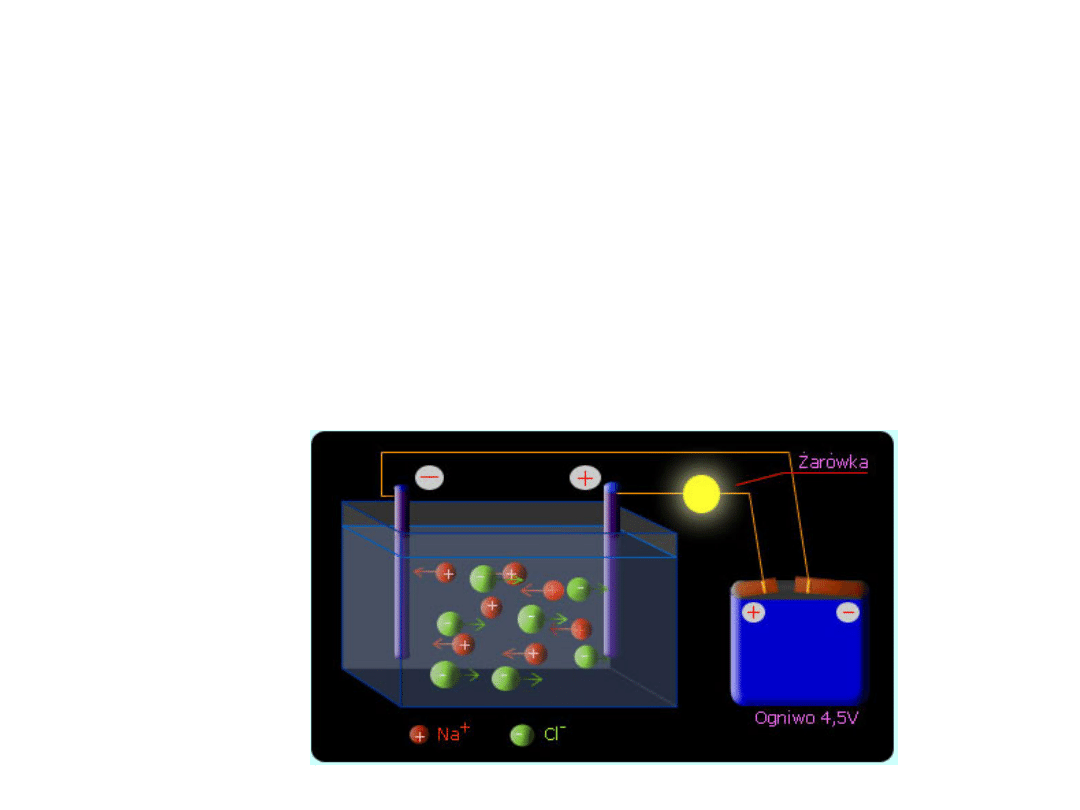
ELEKROLIZA
• Elektroliza jest procesem wymuszonym, który przebiega w
przewodniku elektrolitycznym, gdzie nośnikami ładunków
elektrycznych są zarówno jony dodatnie (kationy) jak i
ujemne (aniony).
• Ruch ładunków elektrycznych jest wymuszony poprzez
podłączenie zewnętrznego źródła prądu stałego do
elektrod zanurzonych w ciekłym przewodniku jonowym.
• Proces elektrolizy zachodzi w stopionych solach i
roztworach wodnych kwasów, zasad oraz soli
• Elektroda połączona z ujemnym biegunem prądu to
katoda – zachodzi na niej proces redukcji
• Elektroda połączona z dodatnim biegunem prądu to
anoda – zachodzi utlenianie
• Jony ujemne poruszają się w kierunku do anody, a
ujemne do katody
• Ruch elektronów podczas elektrolizy odbywa się od
katody do anody, natomiast w ogniwach od anody do
katody.
• Reakcje elektrodowe:
Katoda(-) Cu
2+
+2e Cu
2H
+
+ 2e H
2
anoda(+) 2Cl
-
- 2e Cl
2
2
H
2
O – 4e O
2
+ 4H
+

• Elektroliza zachodzi tylko wówczas gdy do elektrod przyłożone
jest napięcie wyższe niż pewna wartość charakterystyczna dla
danego układu – to najniższe napięcie konieczne dla wywołania
elektrolizy nazywamy napięciem rozkładowym.
• W praktyce wartość napięcia rozkładowego jest powiększona o
tzw. nadnapięcie.
• Na wartość nadnapięcia ma wpływ: szybkość dyfuzji jonów w
roztworze, oraz praca ich wyładowania na elektrodach.
U
rozł.
= E
A
– E
k
+ η
K
- η
A
+ I·R
E
k
– odwracalny potencjał katody (określony wzorem Nernsta)
E
A
– odwracalny potencjał anody
• Obliczając napięcie elektrolizy należy pamiętać, że nadnapięcie
redukcji jest zwykle ujemne ( nadnapięcie katodowe powoduje
zmniejszenie ujemnego potencjału katody w stosunku do stanu
równowagowego), a w przypadku utlenienia dodatnie
(nadnapięcie anodowe zwiększa potencjał, przy którym
przebiega proces anodowy).
• Na ogół nadnapięcie jest podawane jako wartość bezwzględna

• Nadnapięcie zależy od materiału
elektrody, i jej powierzchni, temperatury
i gęstości prądu (stosunek natężenia
prądu do powierzchni elektrody).
• Nadnapięcie spowodowane różnicą
stężeń nazywamy stężeniowym
• Nadnapięcie wywołane procesem
wydzielania gazów- gazowym.
• Nadnapięcie spowodowane
właściwościami metalu elektrody –
nadnapięcie metalu

• Elektroliza może być wykorzystywana do wydzielenia jednego
metalu z mieszaniny jonów różnych metali, jak i do rozdzielenia i
oznaczania kilku metali występujących obok siebie. Jest to możliwe
wtedy gdy różnice miedzy potencjałami wydzielania
poszczególnych metali są duże.
• Potencjał wydzielania jest to potencjał elektrody, który należy
przekroczyć, aby uzyskać mierzalny przebieg danej reakcji
elektrodowej.
η – nadnapięcie danego procesu elektrodowego
E –odwracalny potencjał elektrody
• Potencjał wydzielania odnosi się do danego jonu, a napięcie
rozkładowe do związku.
• Im większe jest napięcie rozkładowe, tym trudniej jest dany metal
wydzielić
• W przypadku potencjałów wydzielania jest odwrotnie. Jeżeli w
roztworze znajduje się kilka substancji mogących ulegać
rozkładowi elektrolitycznemu, to najpierw wydziela się na katodzie
ten pierwiastek, któremu odpowiada najbardziej dodatni potencjał
wydzielania
E

Prawa elektrolizy
I prawo - masa substancji wydzielonej podczas
przepływu prądu w reakcji katodowej lub anodowej jest
proporcjonalna do ilości elektryczności, która przepłynęła
przez elektrolizer.
II prawo- jednakowe ilości elektryczności przepływające
przez
roztwory
różnych
elektrolitów
wydzielają
równoważne ilości wagowe pierwiastków (proporcjonalne
do równoważników chemicznych tych substancji), przy
czym 96500 kulombów wydziela jeden gramorównoważnik
dowolnego pierwiastka.
kIt
Q
k
Q
nF
M
m
C
const
k
Eq
k
Eq
stąt
Eq
Eq
m
m
96500
2
2
1
1
2
1
2
1
• Stała Faradaya F= 96500C, jest to
ładunek potrzebny do wydzielenia jednego
gramorównoważnika chemicznego
substancji.
• Łącząc oba prawa otrzymujemy zależność
t
I
nF
M
nF
MQ
m

Korozja
• Korozją nazywamy uszkodzenia tworzyw stałych
wskutek działania czynników chemicznych.
(rdzewienie żelaza, pokrywanie się nalotem
miedzianych dachów, wyrobów z cynku i
aluminium).
• Korozją jest również rozkruszanie betonu pod
wpływem soli nieorganicznych.

Korozja metali
• Korozja chemiczna – jest wynikiem reakcji
zachodzących między metalem a środowiskiem
agresywnym nie mającym cech elektrolitu –
suche, gorące gazy i ciecze (np. korozja stali
pod wpływem gazów spalinowych).
• Cechą charakterystyczną jest to, że utlenianie
metalu i redukcja utleniacza oraz powstawanie
produktu reakcji chemicznej zachodzi w
jednym miejscu na powierzchni metalu bez
przepływu swobodnych elektronów przez
granicę faz.
• Fe +2HCl → FeCl
2
+ H
2

Korozja elektrochemiczna metali
• Korozja elektrochemiczna – zachodzi pod
wpływem elektrolitów.
• Jej mechanizm związany jest z przepływem
elektronów przez granicę faz: metal-środowisko
• Przykład – korozja stali:
Anoda Fe → Fe
2+
+ 2e
Fe
2+
→ Fe
3+
+ e
Katoda O
2
+ 2H
2
O + 4e → 4OH
-
Fe
2+
+ 2OH
-
→ Fe(OH)
2
2Fe(OH)
2
+ ½ O
2
+ H
2
O → 2Fe(OH)
3

• Ogniwo stężeniowe typu oksydacyjnego- powstaje
przy nierównym dopływie tlenu do metalu:
- anoda – strefa gdzie jest niższe stężenie tlenu
Fe → Fe
2+
+ 2e
- katoda - O
2
+ 2H
2
O + 4e → 4OH
-
• Ogniwo naprężeniowe – powstaje przy zetknięciu z
elektrolitem materiału, który znajduje się pod
działaniem naprężeń
naprężenia mogą być spowodowane:
- różnicami w budowie krystalicznej metalu- np. w
wyniku odkształceń mechanicznych- korozja
zmęczeniowa
-różnicami składu chemicznego na granicy ziaren i
wewnątrz nich( na granicy ziaren metal jest bardziej
podatny na korozję- korozja mikrokrystaliczna
• Ogniwo temperaturowe – występuje wówczas gdy
różne części metalu są zanurzone w elektrolicie,
który ma różną temperaturę

• Korozja atmosferyczna- zachodzi gdy, ma
miejsce
kondensacja
pary
wodnej
na
powierzchni metalu, korozję przyspieszają
zanieczyszczenia powietrza takie jak tlenki
siarki, azotu, sadza, pył węglowy.
• Korozja wżerowa jest wynikiem powstawania
ogniwa aktywacyjno-pasywacyjnego, które
tworzy się na skutek uszkodzenia warstewki
pasywacyjnej na powierzchni metalu, jeśli w
układzie znajduje się czynnik podtrzymujący
proces katodowy (tlen)
• Korozja elektrolityczna – jest spowodowana
przepływem prądu stałego, ulegają jej
elementy znajdujące się w gruncie

Ochrona metali przed korozją
• Najważniejsze metody ochrony antykorozyjnej:
a) elektrochemiczna ochrona katodowa i
protektorowa
b) metaliczne i niemetaliczne powłoki ochronne
c) dyfuzyjne ulepszanie powierzchni metali
(wytwarzanie
powierzchni stopowych)
d) stosownie inhibitorów

• Ochrona katodowa – polega na podłączeniu elementów
konstrukcji narażonych na korozję ujemnego bieguna prądu
stałego o niewielkim napięciu (1-2V). Anodą może być złom
żelazny lub nierozpuszczalna elektroda grafitowa.
• Elektrochemiczna ochrona protektorowa –polega na
podłączeniu metalu chronionego np. żelaza z blokiem metalu
mniej szlachetnego np. cynk, magnez.
• Powłoki z metalu mniej szlachetnego zapewniają oprócz izolacji
od tlenu i wilgoci również ochronę protektorową.
• Powłoki niemetaliczne izolują powierzchnie metalu od dostępu
tlenu i wilgoci (farby i lakieru).
• Powierzchnie stopowe – uzyskuje się poprzez galwaniczne
powlekanie metali, które zachodzi w rozpuszczalniku złożonego
ze stopionych fluorków metali alkalicznych i metali ziem
alkalicznych z dodatkiem fluorku metalu tworzącego
powierzchnię stopową.
• Inhibitory korozji – substancje silnie adsorbujące się na
powierzchni metali, które w ten sposób blokują dostęp jonów
wodorowych. Są to związki powierzchniowo czynne,
wielkocząsteczkowe, związki trudno rozpuszczalne tworzące
osady z jonami metalu.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
Wyszukiwarka
Podobne podstrony:
09 ul urz elektr bud elektryczne
Elektrochemia bud
Strona tytułowa budynek 5 I etap, TBS Wrocław Wojanowska, Etap I, ETAP I - PROJEKT WYK, Instalacje
Strona tytułowa budynek 6, TBS Wrocław Wojanowska, Etap I, ETAP I - PROJEKT WYK, Instalacje elektryc
PW Opis budynek 3, TBS Wrocław Wojanowska, Etap I, ETAP I - PROJEKT WYK, Instalacje elektryczne, Bud
Domowe urządzenia elektryczne-bud.obsł.konser.odkurz.suszar, ETI Edukacja technicyno inf,, KONSPEKTY
PW Opis budynek 4, TBS Wrocław Wojanowska, Etap I, ETAP I - PROJEKT WYK, Instalacje elektryczne, Bud
PW Opis budynek 5, TBS Wrocław Wojanowska, Etap I, ETAP I - PROJEKT WYK, Instalacje elektryczne, Bud
PW Opis budynek 6, TBS Wrocław Wojanowska, Etap I, ETAP I - PROJEKT WYK, Instalacje elektryczne, Bud
PW Opis budynek 2, TBS Wrocław Wojanowska, Etap I, ETAP I - PROJEKT WYK, Instalacje elektryczne, Bud
PW Opis budynek 7, TBS Wrocław Wojanowska, Etap I, ETAP I - PROJEKT WYK, Instalacje elektryczne, Bud
PW Opis budynek 1, TBS Wrocław Wojanowska, Etap I, ETAP I - PROJEKT WYK, Instalacje elektryczne, Bud
09 ul urz elektr bud elektryczne
więcej podobnych podstron