
"Ogniwa paliwowe
(DMFC; MCFC; SOFC)"

Spis treści:
• Historia
• Typy ogniw paliwowych
• Zasada działania
• Ogniwa paliwowe DMFC
• Ogniwa paliwowe MCFC
• Ogniwa paliwowe SOFC
• Zastosowania
• Wady zalety
• Bibliografia

Korzeni tej technologii należy się doszukiwać
jeszcze w XIX wieku, ale dopiero dziś
zaczyna ona przynosić owoce. Sir William
Grove, brytyjski sędzia i uczony
skonstruował już w 1839 roku pierwsze
ogniwo paliwowe. W pierwszym ogniwie
paliwowym, jego wynalazca wykorzystywał
reakcję łączenia wodoru z tlenem do
bezpośredniego wytwarzania prądu
elektrycznego. Ogniwo takie nie ma części
ruchomych, działa bezszumowo, a jego
jedyną substancją odpadową jest woda.
Wiele lat potem naukowcy z NASA
wykorzystali tę genialnie prostą ideę i
rozwinęli technologię do poziomu
umożliwiającego wykorzystanie jej w
pojazdach kosmicznych Apollo, Gemini,
Skylab i innych, aby produkować energię
elektryczną i wodę pitną.
Historia Ogniw Paliwowych

Jeszcze pod koniec lat 80-tych ogniwa paliwowe
lekceważono - z powodu ich wysokiej ceny. Koszt
takich urządzeń był, niestety, astronomiczny i
sięgał 100.000 dolarów za kilowat. Teraz sytuacja
zmienia się w szybkim tempie, zwłaszcza dzięki
istotnym zaletom ekologicznym. Specjaliści
oceniają, że zastąpienie tradycyjnych metod
wytwarzania energii elektrycznej z węgla przez
ogniwa paliwowe powinno zmniejszyć emisję
dwutlenku węgla o 40% - 60%, zaś emisję tlenków
azotu o 50% - 90%.

Typy ogniw paliwowych
• AFC – Alkaliczne ogniwo paliwowe
• PAFC – ogniwa paliwowe z kwasem fosforowym
• SOFC – ogniwa paliwowe ze stałym tlenkiem
• MCFC – ogniwa paliwowe ze stopionym węglem
• PEMFC – ogniwa paliwowe z wymienną
membraną
• DMFC – metanolowe ogniwa paliwowe z
bezpośrednim zasilaniem
• RFC – regenetarywne ogniwa paliwowe

Typ ogniwa
Elektrolit
Paliwo
Temperatur
a pracy
[°C]
Spraw
ność
[%]
Zastosowania
PEM (Proton
Exchange
Membrane)
polimer w
stanie
stałym
wodór
75
35-60
- urządzenia UPS
- baterie przenośne
- elektrownie małej mocy -
generatory energii i ciepła
- przemysł motoryzacyjny
AFC (Alkaline
Fuel Cell)
roztwór
KOH
wodór
poniżej 80
50-70
- militarne
- kosmonautyka
DMFC (Direct
Metanol Fuel
Cell)
polimer w
stanie
stałym
- metanol
- roztwór metanolu i
wody
75
35-40
- urządzenia przenośne
- baterie
PAFC (Phosphoric
Acid Fuel Cell)
kwas
fosforowy
wodór
210
35-50
- generatory stacjonarne
MCFC (Molten
Carbonate Fuel
Cell)
stopiony
węglan
Li/K
- wodór, metanol,
metan, biogaz, gaz LPG
i inne
- gazy hydrokarbonowe
- reforming wewnętrzny
650
40-50
- duże elektrownie i
generatory
- urządzenia CHP
(Combined Heat & Power)
SOFC (Solid
Oxide Fuel Cell)
ceramika
tlenkowa
- wodór, metanol,
metan, biogaz, gaz LPG
i inne
- gazy hydrokarbonowe
- reforming wewnętrzny
650-1000
45-
60/85
- duże elektrownie i
generatory
- urządzenia CHP
(Combined Heat & Power)
Rodzaje ogniw paliwowych

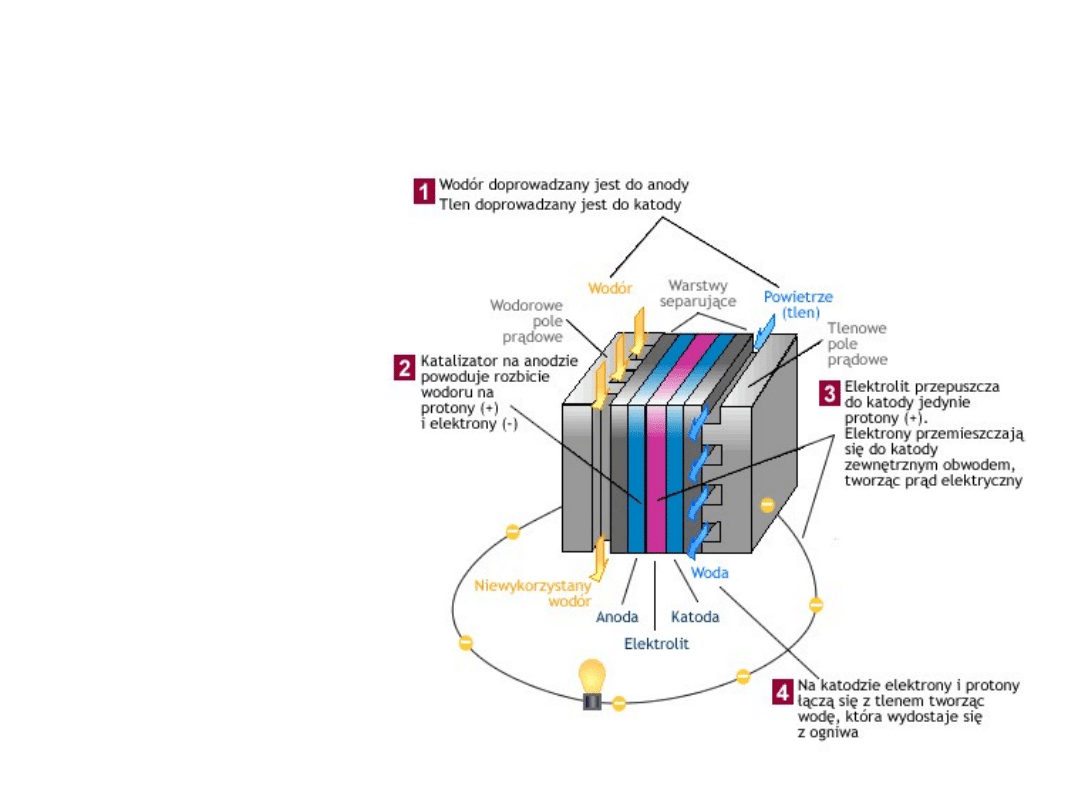
Zasada działania
• Ogniwo paliwowe zbudowane jest z dwóch elektrod: anody i
katody. Elektrody odseparowane są poprzez elektrolit
występujący w formie płynnej lub jako ciało stałe. Elektrolit
umożliwia przepływ kationów, natomiast uniemożliwia
przepływ elektronów.
• Reakcja chemiczna zachodząca w ogniwie polega na
rozbiciu wodoru na proton i elektron na anodzie, a
następnie na połączeniu substratów reakcji na katodzie.
Procesom elektrochemicznym towarzyszy przepływ
elektronu od anody do katody z pominięciem
nieprzepuszczalnej membrany. W wyniku elektrochemicznej
reakcji wodoru i tlenu powstaje prąd elektryczny, woda i
ciepło.
• Paliwo - wodór w stanie czystym lub w mieszaninie z innymi
gazami - jest doprowadzany w sposób ciągły do anody, a
utleniacz - tlen w stanie czystym lub mieszaninie
(powietrze) - podawany jest w sposób ciągły do katody.
Zasada działania
• Rekcja anodowa:
• Rekcja katodowa:
e
H
H
4
4
2
2
O
H
e
H
O
2
2
2
4
4

Ogniwo paliwowe zasilane
bezpośrednio metanolem-Direct-
Methanol Fuel Cell
(DMFC)
• Elektrolitem w ogniwie DMFC jest spolimeryzowany fluorkowany
kwas sulfonowy w postaci membrany pokrytej porowatą platyną
(katalizator). Anoda natomiast, jako katalizatory, ma oprócz
platyny (Pt) również ruten (Ru), których zadaniem jest
chemisorpcja metanolu i wody oraz elektrochemiczne pozbawienie
ich elektronów. Platyna rozkłada metanol, a ruten cząsteczkę
wody.
• Elektrochemiczne reakcje zachodzące w ogniwie DMFC są
następujące:
– Anoda: CH3OH + H2O → CO2 + 6H+ + 6e
– Katoda: ½ O2 + 6H+ + 6e → 3H2O
– W sumie: CH3OH + ½ O2 → CO2 + 2H2O
• Ogniwo zasilane bezpośrednio metanolem pracuje w temperaturze
• t = 90-120 °C.
• Teoretycznie z 1 dm3 metanolu można uzyskać 5 kWh energii
elektrycznej, ponieważ jednak ogniwa te mają na razie sprawność
ok. 20-34%, więc uzyskuje się 1,7 kWh/dm3

Ogniwa DMFC posiadają polimerową membranę,
taką jak ogniwa PEM. Różnica pomiędzy ogniwem DMFC, a
ogniwem PEM tkwi w konstrukcji anody, która w ogniwie
DMFC pozwala na dokonanie wewnętrznego reformingu
metanolu i uzyskanie wodoru do zasilania ogniwa. Ogniwa
DMFC eliminują problem składowania paliwa, są atrakcyjne
dla aplikacji przenośnych ze względu na niską temperaturę
zachodzącej reakcji (około 80 stopni Celsjusza). Ogniwo
DMFC charakteryzuje niższa sprawność w porównaniu do
ogniwa PEM i wynosi 40%. Ogniwa DMFC używane są do
budowy baterii dla urządzeń przenośnych i oferują
wydajność nieosiągalną dla standardowych baterii -
notebook zasilany 250 ml zbiornikiem metanolu, pracuje
przez 12 godzin co jest nieosiągalne dla zwykłych baterii o
podobnej masie/objętości.

DMFC zastosowania
Zastosowania przenośne;
laptopy, kamery cyfrowe,
ładowarki do komórek
itp.
DMFC do laptopa,
Smart Fuel Cells
Ładowarka baterii do
laptopa,
Smart Fuel Cell.

DMFC zastosowania
Zaletą jest krótki czas
“ładowania” ogniwa;
akumulatorki ładuje się kilka
godzin.
Cele:
1) maksymalizacja gęstości
mocy z objętości systemu
ogniw
2) obniżenie ceny
Ładowarka baterii do komórek na bazie
ogniwa metanolowego, Mechanical
Technologies

Futurystyczny e-book LG ma być wzorem ekologicznego
komputera. Może być zasilany zarówno metanolem, jak
i... gazem ziemnym, a obraz wyświetlany jest na ekranie
OLED.

• Pojawienie się polimerowych ogniw paliwowych pozwoliło znacznie
zminiaturyzować ich rozmiary. Potencjalnie nadawały się one już do
zasilania urządzeń przenośnych, ale wciąż problemem było
dostarczanie wystarczającej energii potrzebnej do zasilania
notebooków i telefonów komórkowych. Laptop musi bowiem pracować
minimum przez 2–3 godziny i potrzebuje przy tym około 20–30 W
mocy, a chwilowo, w zależności od obciążenia, zużywa nawet do 70 W.
Z kolei telefon komórkowy potrzebuje do 5 W mocy i w stanie
czuwania musi pracować minimum przez kilka dni (oczywiście w tym
czasie powinien umożliwić przeprowadzenie co najmniej kilku godzin
rozmów). Oprócz tego ogniwa paliwowe do urządzeń przenośnych
muszą być lekkie i umożliwiać łatwe uzupełnianie paliwa.
• Na początku tego wieku pojawiły się nowoczesne polimerowe ogniwa
paliwowe zasilane roztworem metanolu (alkoholu metylowego). Noszą
one nazwę ogniw DMFC (Direct Methanol Fuel Cell) i cechują się
znacznie mniejszymi rozmiarami oraz wyższą wydajnością niż ogniwa
polimerowe poprzednich generacji. Reakcja utleniania w DMFC jest na
tyle powolna i można ją w dość precyzyjny sposób kontrolować, że
zasilany nimi telefon komórkowy bez problemu może działać przez co
najmniej tydzień.
• Ogniwa paliwowe nie są jeszcze tak małe i tanie, aby wprowadzić je
do seryjnej produkcji. Niemniej z roku na rok pokazywane prototypy są
mniejsze i coraz bardziej wydajne. Nad rozwojem technologii DMFC
pracują głównie takie firmy, jak: Toshiba, Panasonic, Hitachi, NEC,
Casio, Motorola, Samsung i LG.

Ogniwo paliwowe ze stopionymi
węglanami - Molten carbonate
fuel cell (MCFC)
Elektrolit w postaci stopionego węglanu to zazwyczaj
węglan litu i potasu (Li2CO3/K2CO3) lub litu i sodu
(Li2CO3/Na2CO3) w osnowie ceramicznej z ceramiki na
bazie aluminium (LiAlO3). Z powodu bardzo wysokich
temperatur pracy (600 - 700°C) kinetyka katody (szybkość
reakcji) jest drastycznie poprawiona w porównaniu do
PEMFC i PAFC, więc nie potrzeba szlachetnych metali jako
katalizatorów. Na katodzie jest zazwyczaj tlenek niklu, ale
bada się również materiały na bazie tlenku litu. W anodzie
wykorzystuje się zazwyczaj stopy niklowo aluminiowe lub
niklowo chromowe. Reakcje elektrodowe i sumaryczne są
ukazane poniżej.
Utlenienie wodoru na anodzie:
H2 + (CO3)2- → H2O + CO2 + 2e-
Redukcja tlenu na katodzie:
CO2 + ½O2 + 2e- → (CO3)2-
Sumaryczna reakcja w MCFC:
H2 + ½O2 → H2O

Są to wysoko temperaturowe ogniwa paliwowe pracujące w
temperaturze ok. 600 ˚C. Ich główną wadą jest korozja. Ogniwa ze
stopionymi węglanami przeszły swój pierwszy wielki test w latach
1996-1997 w Santa Clara w USA, gdzie firma Energy Research Corp.
(dzisiaj znana jako FuelCell Energy) zainstalowała duże urządzenie o
mocy elektrycznej 2 MW (ogniwo ERC Direct FuelCell). W trakcie pracy
moduł zachowywał się dobrze, jednak po jakimś czasie doszło do
awarii. Dalsze testy prowadzono na odbudowanej wersji o mniejszej
mocy 1 MW
Systemy MCFC. Po lewej 2MW jednostka na gaz węglowy. Po
prawej kilka 250 kW jednostek pracujących obecnie w Japonii i w
USA.

Ogniwo paliwowe z zestalonym
elektrolitem tlenkowym - Solid-
oxide fuel cells (SOFC)
Elektrolitem w SOFC jest zestalony, nieporowaty tlenek metalu,
zazwyczaj Y2O3 stabilizowany 8-10 % molowymi ZrO2. Przewodnictwo
jonowe w elektrolicie jest zapewnione przez jony tlenu (O2-).
Wykorzystanie substancji stałej jako elektrolitu czyni system
stabilniejszym i bezpieczniejszym niż w przypadku MCFC. Nie powstają
przecieki, a ogniwu można nadać różne kształty, jak rurowy, planarny,
monolityczny.
Zazwyczaj temperatura pracy wynosi około 1000 °C, ale jest
pożądane skonstruowanie ogniwa pracującego w niższej temperaturze,
około 650 °C. To oczywiście obniża przewodność obecnie stosowanych
materiałów elektrolitycznych. Tak jak w MCFC nie potrzeba drogich
metali na elektrody, bo kinetyka jest wystarczająco szybka w tych
temperaturach. Zazwyczaj anoda jest na bazie ceramik niklowych lub
kobaltowych (Co-ZrO2 lub Ni-ZrO2), a katoda to LaSrMnO3
stabilizowane Y2O3.. Reakcje elektrodowe ukazane są poniżej.
Utlenienie wodoru na anodzie:
H2 + O2 → H2O + 2e-
Redukcja tlenu na katodzie:
½O2 + 2e → O2-
Sumaryczna reakcja w SOFC:
H2 + ½O2 → H2O

Największe ogniwo SOFC na świecie (moc 250 KW)
wyprodukowane przez Siemens Westinghouse we współpracy
z Kinetrics, Ontario Power Generation i inne organizacje.
Z powodu pracy w wysokiej temperaturze nie potrzebują drogich katalizatorów
jak to ma miejsce w ogniwach z membraną do wymiany protonów. Oznacza to
ze nie są wrażliwe na zanieczyszczenia tlenkiem węgla co czyni je dosyć
elastycznymi jeśli chodzi o rodzaj paliwa

MCFC oraz SOFC są to ogniwa
wysokotemperaturowe i pracują z wysokimi
wydajnościami, szczególnie wtedy kiedy
ciepło przez nie wytworzone i/lub gdy ogniwo
jest zintegrowane z turbina gazowa
( rozwiązanie to spotyka się z coraz
większym zainteresowaniem ). Obydwie
technologie zaprojektowane są na moce
granicach od 250 kW do wielu MW. Na chwile
obecna SOFC jest jeszcze wiele lat do tyłu
jeśli chodzi o zaawansowanie technologiczne,
ale do końca obecnej dekady powinno być
mocnym konkurentem na rynku, sądząc po
liczbie organizacji zaangażowanych w rozwój
tej technologii

Zastosowania
• Systemy
stacjonarne –
generatory energii
elektrycznej i
ciepła CHP,
elektrownie małej
mocy

Zastosowania
• Środki transportu,
komunikacja

Zastosowania
• Urządzenia
przenośne, baterie
małej mocy
• Robotyka

Zalety ogniw paliwowych
• Sprawność bezpośredniej konwersji energii chemicznej paliwa
w energię elektryczną nie podlega ograniczeniu wynikającemu
z teorii silników cieplnych
• Wysoka sprawność produkcji energii elektrycznej
• Niski poziom hałasu
• Możliwość stosowania różnych rodzajów paliw
• Technologia bezpieczna dla środowiska naturalnego ponieważ
podstawowym produktem ubocznym jest woda, a emisja CO
2
zachodzi tylko w przypadku wykorzystywania paliw
węglowodorowych (CO
2
jest produktem ubocznym reformingu)
• Nie istnieje problem emisji tlenków siarki i azotu (występują w
śladowych ilościach)
• Brak ruchomych części pracujących w trudnych warunkach
• Możliwość pracy przy szerokim zakresie obciążeń
• Możliwość ciągłej pracy (o ile jest dostęp do paliwa i
utleniacza)

Wady ogniw paliwowych
• Niskie napięcie prądu uzyskiwane z
pojedynczego ogniwa (<1V)
• Drogie materiały na katalizatory
• Stosunkowo niewielkie moce uzyskiwane z
modułu
• Produkcja jedynie prądu stałego (czasami jest to
zaletą)
• Podatność na wpływ zanieczyszczeń zawartych
w paliwie (zanieczyszczenia zmniejszają
żywotność ogniw zatykając porowate elektrody
przez co zmniejszają ich wydajność prądową)
• Trudności z produkcją, magazynowaniem i
dystrybucją paliwa (wodoru)

Bibliografia
•
http://pl.wikipedia.org/wiki/Ogniwo_paliwowe_zasilane_bezpo%C5%9Brednio_metanolem
•
http://www.ogniwa-paliwowe.com/
•
http://gadzetomania.pl/2008/05/21/sharp-potwierdzil-prace-nad-metanolowa-bateria-dmfc/
•
http://www.imiue.polsl.pl/dane/mylinks/ogniwa/index.html
•
http://www.mif.pg.gda.pl/knf/index.php?strona=dzialalnosc&podstrona=SOFC
•
http://www.fuw.edu.pl/~gaj/PodstawyFizyki2/ogniwopaliwowe_gslowinski_seminarium1.pdf
•
http://www.elportal.pl/pdf/k03/77_66.pdf
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
Wyszukiwarka
Podobne podstrony:
Ogniwa paliwowe metanolowe
Ogniwa paliwowe zasilane ciekłym metanolem
Ogniwa paliwowe
Ogniwa paliwowe
Badanie ogniwa paliwowego i elektrolizera typu PEM
ET ogniwa paliwowe
Ogniwa Paliwowe 4, Biopaliwa, Energia, Ogniwa paliwowe
ogniwo metanolowe by Slupski, Energetyka AGH, semestr 5, V Semestr, Konwersja Energii, LABORKI, Ćwi
ogniwa paliwowe
Mikrobiologiczne ogniwa paliwowe przetwarzające ścieki organiczne bezpośrednio w elektryczność
1 Ogniwa paliwowe
Ogniwa paliwowe
elektroenergetykacykl1, Ogniwa paliwowe - rozdziały
ABG WYKŁAD 9 Ogniwa paliwowe 1
17 Ogniwa paliwowe
Ogniwo paliwowe metanolowo - powietrzne, Energetyka AGH, semestr 5, V Semestr, Konwersja Energii, L
Ogniwa Paliwowe 1, Biopaliwa, Energia, Ogniwa paliwowe
Ćwiczenie 4 Ogniwo Paliwowe Metanolowo Powietrzne Sprawozdanie
więcej podobnych podstron