
Choroby genetyczne
zwierząt
Przedmiot fakultatywny
II rok weterynarii
Urszula Kosior-Korzecka
Zakład Patofizjologii
Katedra Przedklinicznych Nauk Weterynaryjnych
Wydział Medycyny Weterynaryjnej
Uniwersytet Przyrodniczy w Lublinie

Program zajęć
Ćwiczenie 1.
Mechanizmy zaburzeń epigenetycznych, autosomalnych recesywnych i dominujących
oraz sprzężonych z płcią. Mechanizmy dziedziczenia chorób autosomalnych i sprzężonych z
płcią. Zależność fenotyp-genotyp w chorobach monogenowych na przykładzie talasemii i SCID-X.
Sposoby postępowania ze zwierzętami chorymi i eliminacja nosicieli. Choroby genetyczne
zwierząt, ważne z klinicznego i gospodarczego punktu widzenia Analiza mikromacierzy DNA,
jako nowe narzędzie seryjnego badania ekspresji genów. Polimorfizm antygenów I i II klasy MHC
a odporność i podatność na wybrane choroby infekcyjne i pasożytnicze. Białka histonowe w
naprawie uszkodzonego DNA. SNP (single nucleotide polymorphism) - najnowsza metoda
diagnozowania chorób genetycznych
Ćwiczenie 2.
Choroby
genetyczne
zwierząt
powodowane
przez
mutacje
chromosomalne
strukturalne i liczbowe.
- Morfologia i diploidalna liczba chromosomów u wybranych gatunków zwierząt gospodarskich
i towarzyszących; typy mutacji chromosomalnych strukturalnych i liczbowych występujące u
zwierząt; częstość występowania chorób warunkowanych przez mutacje chromosomowe
strukturalne
u
zwierząt
hodowlanych
w Polsce; oznaczanie kariotypu i zasady opisu kariogramu; zastosowanie badań kariotypu u
zwierząt gospodarskich. Etiologia i patogeneza wybranych chorób warunkowanych przez mutacje
chromosomowe strukturalne u zwierząt: translokacja robertsonowska u krów, owiec, świń i lisów.
Odwrócenie
płci
u
psów
i koni. Choroby uwarunkowane przez mutacje chromosomowe liczbowe u zwierząt: Monosomia
chromosomu
X
u klaczy. Trisomie autosomalne u bydła i koni. Zaburzenia dojrzewania jądrowego oocytów u
bydła i świń prowadzace do zaburzeń chromosomalnych liczbowych (powstawanie oocytów
diploidalnych).
Znaczenie mutacji chromosomalnych strukturalnych w patogenezie chorób nowotworowych
u zwierząt. Uniparentalna disomia oraz imprinting genomowy w patogenezie aberracji
chromosomowych
u zwierząt.
- Izolacja i zakładanie hodowli limfocytów, indukcja proliferacji w hodowli limfocytów –
przygotowanie hodowli do analizy kariotypu – ćwiczenie praktyczne.
- Oznaczanie kariotypu świni w dzielących się mitotycznie (PHA) limfocytach krwi –ćwiczenie
praktyczne).
- Analiza liczby chromosomów w oocytach świń hodowanych in vitro w celu eliminacji oocytów
diploidalnych - ćwiczenie praktyczne.

Ćwiczenie 3.
Etiologia i patogeneza autosomalnych chorób genetycznych u zwierząt
warunkowanych przez mutacje genowe.
Typy mutacji genowych. Etiologia i patogeneza wybranych chorób monogenowych
autosomalnych recesywnych u zwierząt: BLAD; CLAD; DUMPS; PSS; niedokrwistość hemolityczna u
psów wywołana niedoborem kinazy pirogronianowej; choroba Andersena u kotów;
mukopolisacharydoza u psów i kotów. Etiologia i patogeneza wybranych chorób monogenowych
autosomalnych dominujących u zwierząt: hipercholesterolemia u świń i królików; porfiria u świń.
Choroby powodowane przez mutacje autosomalne z niepełną dominacją: sferocytoza u bydła;
choroba von Willebranda u dobermanów (typ IB). Techniki biologii molekularnej umożliwiające
diagnozowanie i/lub wykrywanie nosicielstwa choroby monogenowej - PCR, RFLP, Real-Time PCR.
Wykorzystanie technik PCR i RFLP
do wykrywania nosicielstwa na przykładzie BLAD, DUMPS i PSS.
Izolacja DNA z limfocytów krów, amplifikacja fragmentu genu podjednostki CD18 beta-
integryny metodą PCR i elektroforetyczny rozdział produktów amplifikacji w żelu
agarozowym – ćwiczenie praktyczne.
Ćwiczenie 4.
Choroby monogenowe sprzężone z płcią.
Chromosomy płci u ssaków i ptaków; dziedziczenie i determinacja płci u ssaków i ptaków;
inaktywacja chromosomu X; determinacja płci przy udziale genów autosomalnych oraz
zlokalizowanych w chromosomach płci; cechy sprzężone z płcią. Etiologia i patogeneza chorób
genetycznych monogenowych sprzężonych z płcią u zwierząt: zespół Alporta u psów; pierwotna
hiperoksaluria u kotów; ograniczenie owulacji u kur; SCID-X u psów; zespół Menkesa u psów i owiec;
dystrofie mięśniowe u psów i kotów; hemofilia A u koni, psów, kotów, świń i owiec; hemofilia B u
psów i kotów. Wykorzystanie analizy rodowodów w eliminacji chorób sprzężonych z płcią w stadzie
- zadania genetyczne. Zaburzenia procesu formowania się płci.
Wybarwianie chromosomów płci w komórkach nabłonkowych lub komórkach krwi świń -
ćwiczenie praktyczne

Ćwiczenie 5.
Etiologia i patogeneza wybranych chorób genetycznych u bydła i koni
genetyczne podstawy rozwoju BSE
wieloczynnikowe i jednoczynnikowe choroby genetyczne koni
genetyczna podatność na nowotwory u koni o siwym umaszczeniu (czerniaki)
markery chorób nowotworowych u koni
Etiologia i patogeneza chorób genetycznych u kotów i psów.
struktura genomu psów a podatność na wybrane choroby
rasowa podatność genetyczna na rozwój cukrzycy I i II typu
sercowo-naczyniowe i hematologiczne choroby genetyczne
neurologiczne choroby genetyczne
choroby przewodu pokarmowego o podłożu genetycznym
testy DNA do rozpoznawania chorób genetycznych u psów
oznaczanie ryzyka chorób genetycznych psów w oparciu o analizę rodowodową na
przykładzie dysplazji stawu biodrowego
Ćwiczenie 6.
Etiologia i patogeneza chorób genetycznych świń, owiec i kóz.
Uwarunkowania genetyczne determinujące podatność na rozwój chorób
nowotworowych, plenność i wydajność mięsną świń, owiec i kóz.
- manipulacje w genie IGF2 jako sposób poprawy wydajności mięsnej świń
genetyczna oporność i podatność owiec na chłoniaki
genetyczne uwarunkowania wielokrotnych owulacji u owiec
hipercholesterolemia u świń
rodzinne wole u owiec i kóz
Dziedziczne niedobory immunologiczne u zwierząt. Genetyczna kontrola
odporności na choroby.
genetyczne podstawy odporności wrodzonej
- przykłady dziedzicznych niedoborów immunologicznych
Transformacja blastyczna limfocytów wyizolowanych z krwi psa zdrowego i psa ze
SCID-X in vitro – ćwiczenie praktyczne.

Ćwiczenie 7.
Genetyczne podstawy nowotworzenia
aneuploidalność w komórkach nowotworowych psów
znaczenie mutacji w protoonkogenach i genach supresorowych w rozwoju wybranych nowotworów
u zwierząt gospodarskich i towarzyszących
znaczenie translokacji wzajemnej w patomechanizmach rozwoju białaczek
depresja inbredowa
Terapia chorób uwarunkowanych genetycznie.
Stosowane i aktualnie opracowywane terapie genowe;
Zwierzęta transgeniczne jako modele chorób występujących u człowieka;
Zwierzęta transgeniczne w produkcji biopreparatów.
Ćwiczenie 8.
Test zaliczeniowy

Choroba genetyczna
to upośledzające sprawność życiową
odchylenie
od stanu prawidłowego, które przekazywane jest jako cecha
dziedziczna z pokolenia na pokolenie,
lub
które powstaje de novo na skutek zmian i zaburzeń
w mechanizmach przekazywania cech dziedzicznych
(i może być również przekazywane potomstwu, jako cecha
dziedziczna).

Obecnie znamy około 3500 różnych chorób genetycznych.
Dzielimy je na 3 główne kategorie:
jednogenowe
- będące wynikiem mutacji w jednym tylko genie.
Choroby jednogenowe przekazywane są zgodnie z prawami Mendla i
uwarunkowane treścią informacyjną jednego genu, tj. w obrębie pary
alleli, występujących w określonym locus genowym. Wśród tych chorób
wyróżnia się autosomalne recesywne, autosomalne dominujące i
sprzężone z chromosomem płciowym żeńskim X (określane, jako
sprzężone z płcią);
wielogenowe
- będące wynikiem mutacji w wielu genach,
warunkowane współdziałaniem wielu genów umiejscowionych w wielu loci.
Choroby te nie są przekazywane zgodnie z prostym dziedziczeniem wg
schematu Mendla. Niejednokrotnie objawy tych chorób występują na
skutek interakcji z czynnikami środowiska i ujawniają się dopiero wówczas,
gdy nasilenie działania tych czynników osiągnie pewną wartość progową;
chromosomowe
- będące wynikiem mutacji na poziomie całych
pakietów informacji genetycznej.

Jednostkami
chorobowymi
łączonymi
z
mutacjami
w mtDNA są:
- neuropatia nerwu wzrokowego;
-encefalopatia mitochondrialna z kwasicą mleczanową i epizodami
udaropodobnymi;
- dziedziczna mateczna miopatia;
- niektóre typy kardiomiopatii;
-ataksja neurogenna;
-cukrzyca insulinoniezależna;
- cukrzyca insulinozależna;
- barwnikowe zwyrodnienie siatkówki;
- choroby neurodegeneracyjne wieku podeszłego.

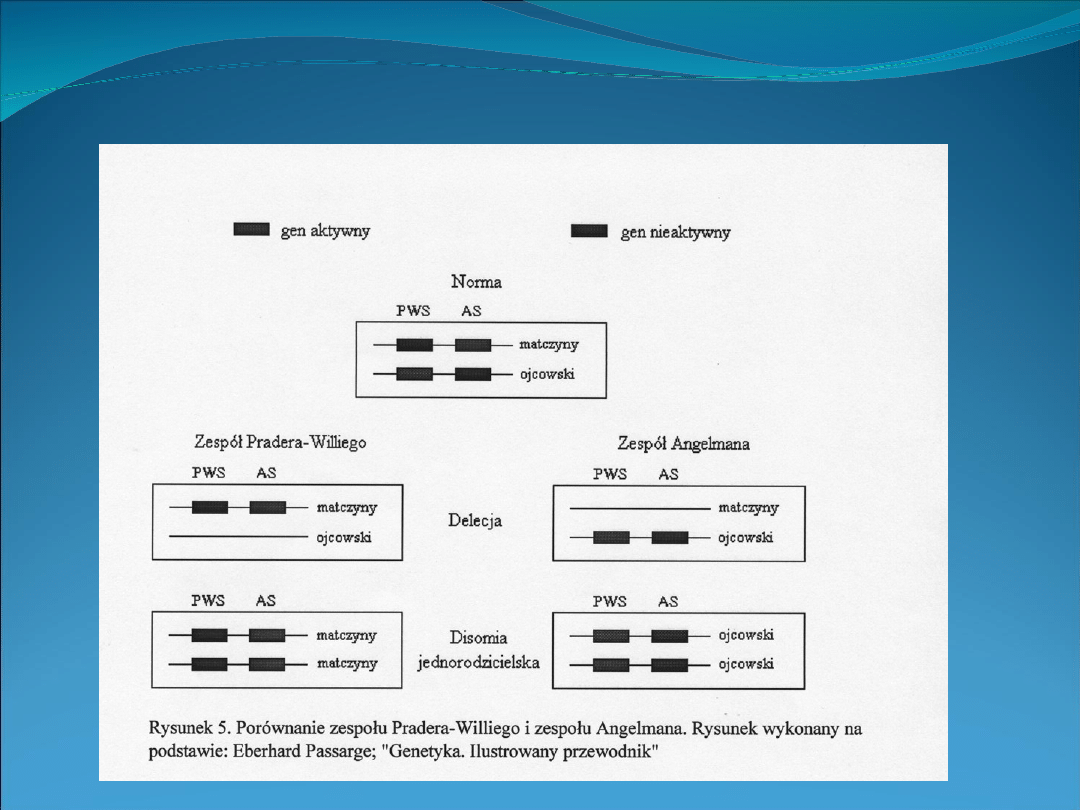
Epigenetyczne dziedziczenie chorób
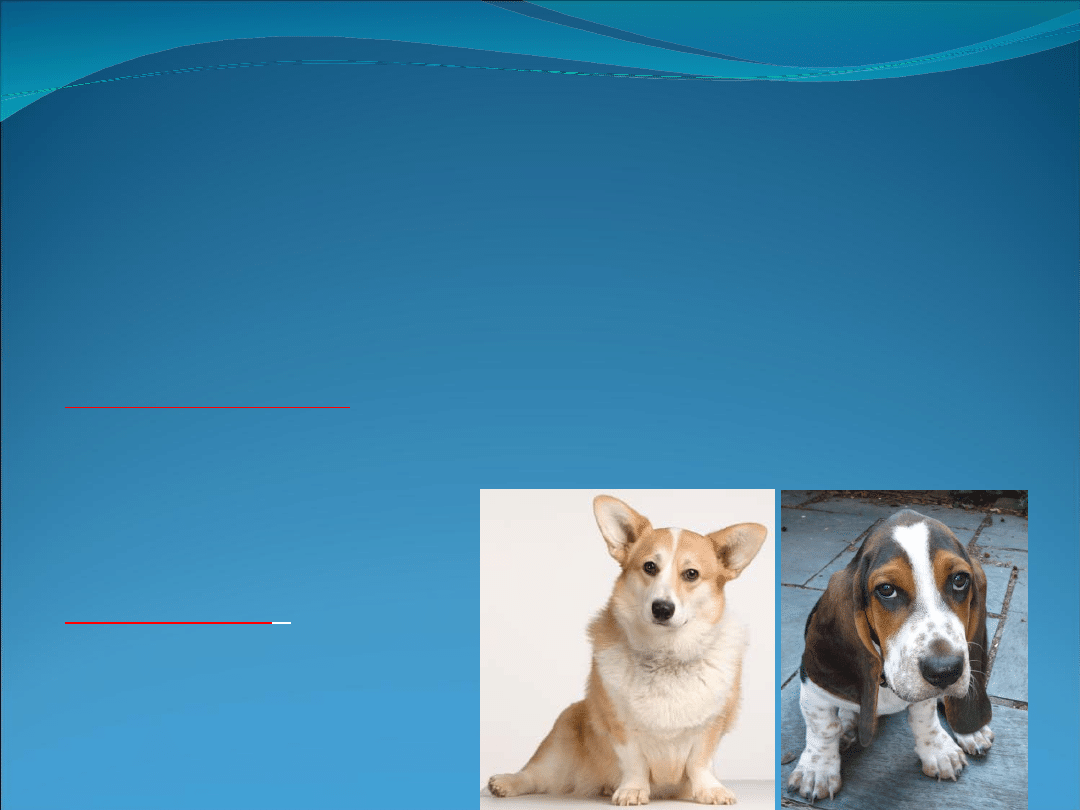
SCID-X
Ciężki, sprzężony z płcią, złożony niedobór odporności u psów
(SCID-X)
Defekt genetyczny
: mutacja w genie kodującym łańcuch gamma
białkowego receptora interleukiny 2. IL-2 stanowi czynnik wzrostu
dla limfocytów T i B, wzmaga aktywność komórek NK oraz
przyspiesza dojrzewanie tymocytów.
Delecja 4 pz, peptyd 21 aa (prawidłowy – 373 aa).
Dziedziczenie
: recesywne,
sprzężone z chromosomem X.
Rasy
: Welsh Corgi, basset

SCID-X
Cechy patologiczne:
mała dysplastyczna grasica (chorych psów osiąga 10% prawidłowej wielkości);
zanik węzłów chłonnych;
obniżona liczba limfocytów we krwi;
brak lub znaczące obniżenie blastogennej odpowiedzi limfocytów na mitogeny
i specyficzne antygeny - limfocyty T nie ulegają transformacji blastycznej
pod wpływem PHA (fitohemaglutyniny), a limfocyty B pod wpływem miogenu
ze szkarłatki.;
hypogammaglobulinemia lub agammaglobulinemia. Poziom IgM w surowicy
może być prawidłowy, ale poziom IgG jest dramatycznie niższy.
Zdarza się, że objawy choroby pojawiają się u suk nosicielek, jeżeli zmutowany
gen znajduje się na aktywnym chromosomie X (próby leczenia ludzką IL-2).
Niedobory enzymatyczne szlaku
glikolitycznego
Jest to grupa dziedzicznych enzymopatii. Ich przyczynę stanowi
niedobór lub brak któregoś z enzymów szlaku glikoli tycznego w
erytrocytach.
Wspólnym
objawem
tych
chorób
jest
NIEDOKRWISTOŚĆ
HEMOLITYCZNA
związana z drastycznie skrócona długością życia
erytrocytów,
retikulocytozą
i żółtaczką.

Niedokrwistość hemolityczna u psów
wywołana niedoborem kinazy pirogronianowej
Defekt genetyczny: mutacja w genie kodującym
kinazę
pirogronianową (PK).
Dziedziczenie: autosomalne recesywne.
Rasy: basenji, beagle, teriery.

Niedobory enzymatyczne szlaku
glikolitycznego
Niedokrwistość hemolityczna u psów wywołana niedoborem
kinazy pirogronianowej.
Defekt
genetyczny:
mutacja
w
genie
kodującym
kinazę
pirogronianową (PK). Niedobór tego enzymu upośledza znacznie
proces
glikolizy
w
erytrocytach.
Powoduje
to zmniejszenie syntezy ATP, co w konsekwencji narusza integralność
błony erytrocytów. (PK jest jedynym źródłem NADPH w erytrocytach
koniecznego
do redukcji glutationu. Zredukowany glutation jest ważnym
antyoksydantem chroniącym przed RFT lipidy i białka błony
komórkowej. Przy jego braku lub niedoborze, narasta stres
oksydatywny i dochodzi do uszkodzeń błony i utraty jej integralności.
Dziedziczenie: autosomalne recesywne.

Niedobory enzymatyczne szlaku
glikolitycznego
Niedokrwistość hemolityczna u psów wywołana niedoborem kinazy
pirogronianowej.
Objawy: powiększenie obwodu brzucha, powiększenie śledziony,
osłabienie , żółtaczka, zwiększenie stężenia pośredniej bilirubiny,
skrócenie czasu życia erytrocytów, retykulocytoza, hemoglobinemia,
niskie stężenie haptoglobiny w osoczu (tworzy ona kompleks z
produktami rozpadu Hb, zwłaszcza z hemem, który usuwany jest przez
watrobę, co stanowi ochronę dla nerek), wtórna hemochromatoza,
zwłóknienie szpiku i stwardnienie kości. Krwinki z niedoborem PK są
bardziej podatne na osmolizę (rozpad w warunkach obniżonego ciśnienia
osmotycznego). Nosiciele charakteryzują się częściowym niedoborem PK.
Rasy: basenji, beagle, teriery.
Od 1995 r. istnieje test genetyczny w kierunku wykrywania psów z
niedoborem PK opracowany przez Whitney i wsp.

Hiperlipoproteinemia I u psów. Niedobór lipazy
lipoproteinowej. Hipertriacyloglicerolemia.
Hiperchylomikronemia.
Defekt genetyczny: mutacja w genie kodującym lipazę
lipoproteinową.
Dziedziczenie: autosomalne recesywne.
Za transport wszystkich lipidów (zawartych w pokarmie) do układu
krążenia odpowiedzialne są chylomikrony.
Lipaza lipoproteinowa katalizuje rozpad chylomikronów oraz VLDL
do tzw. resztkowych lipoprotein. Istnieje dodatnia korelacja
pomiędzy aktywnością LPL a zdolnością tkanek do wbudowywania
kwasów tłuszczowych z triacylogliceroli Lp.
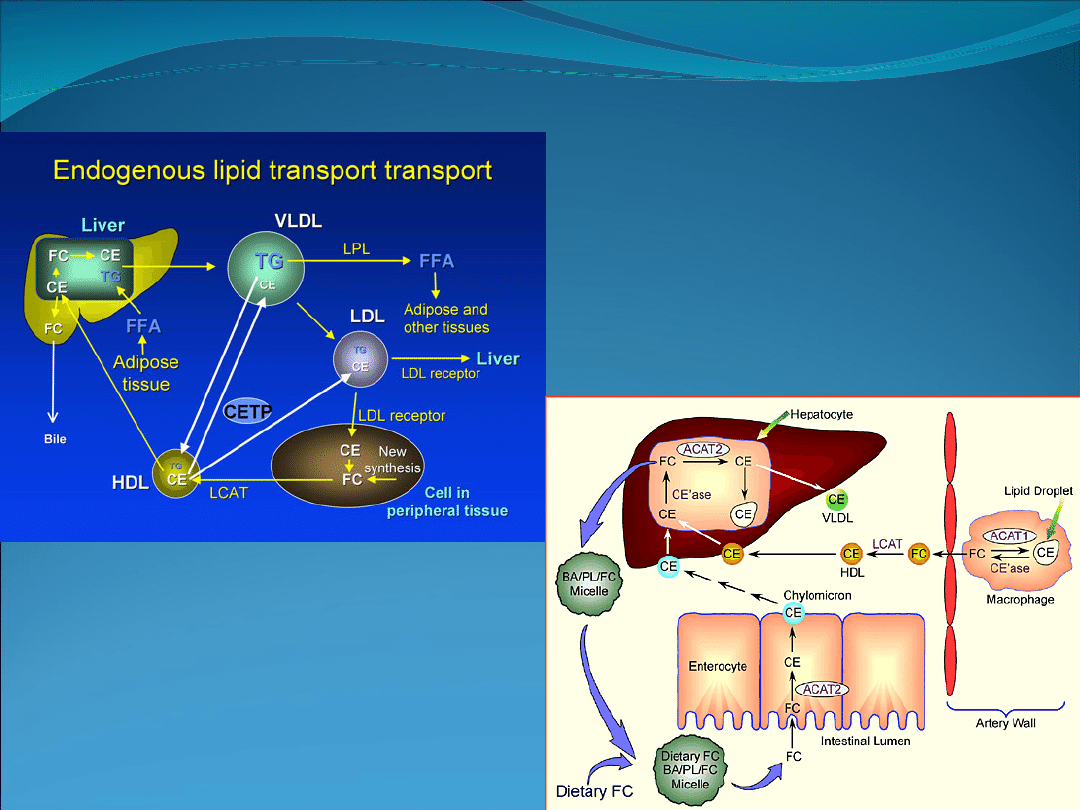
Hiperlipoproteinemia I u psów. Niedobór lipazy
lipoproteinowej. Hipertriacyloglicerolemia.
Hiperchylomikronemia.

Hiperlipoproteinemia I u psów. Niedobór lipazy
lipoproteinowej. Hipertriacyloglicerolemia.
Hiperchylomikronemia.
Dziedziczny niedobór LPL charakteryzuje się bardzo powolnym klirensem
chylomikronów z krążenia, co prowadzi do odbiegających od normy
dużych
stężeń
chylomikronów
w osoczu. Odnotowuje się także:
- wysokie stężenie endogennych triacylogliceroli (obecnych w VLDL);
- zmniejszone stężenie frakcji LDL i HDL.
Ten stan może być dodatkowo indukowany dietą wysokotłuszczową.
Koryguje się go dietą o małej zawartości tłuszczu i zwiększeniem w
karmie ilości złożonych węglowodanów.
U osobników homozygotycznych recesywnych stwierdza się całkowity
brak enzymu, natomiast u osobników heterozygotycznych zachodzi
prawidłowa lipoliza chylomikronów.
Stwierdza się odkładanie chylomikronów w makrofagach skóry,
komórkach Browicza-Kupfera i rogówce.
Rasy: Beagle

ZESPÓŁ ALPORTA
Defekt genetyczny:
Mutacja w 35 eksonie genu (COL4A5)
kodującego łańcuch alfa 5 kolagenu typu IV. Skutkiem mutacji jest
nieprawidłowa budowa domeny Nc1 (skrócenie sekwencji
aminokwasowej) białka kolagenu typu IV.
Dziedziczenie
: recesywne, sprzężone z płcią. Z powodu kojarzenia
zwierząt w pokrewieństwie i późne pojawienie się objawów choroba
ta może wystąpić także u suk, homozygotycznych pod względem
zmutowanego genu. Suki jednak nie giną, chociaż ulegają
znacznemu wyniszczeniu.
Przyczyną choroby jest nieprawidłowa budowa białka kolagenu IV.
Kolagen typu IV znajduje się w kłębkach nerkowych oraz błonach
podstawowych
wszystkich
komórek
nabłonkowych
i
śródbłonkowych.

ZESPÓŁ ALPORTA
Objawy pojawiają się dopiero około 4 roku życia.
Występuje brak apetytu, chudnięcie i wymioty.
Następnie stwierdza się:
- niezagęszczanie moczu;
- białkomocz;
- krwiomocz;
- zapalenie kłębków nerkowych;
- niewydolność nerek;
- postępujące wyniszczenie;
- osłabienie słuchu.
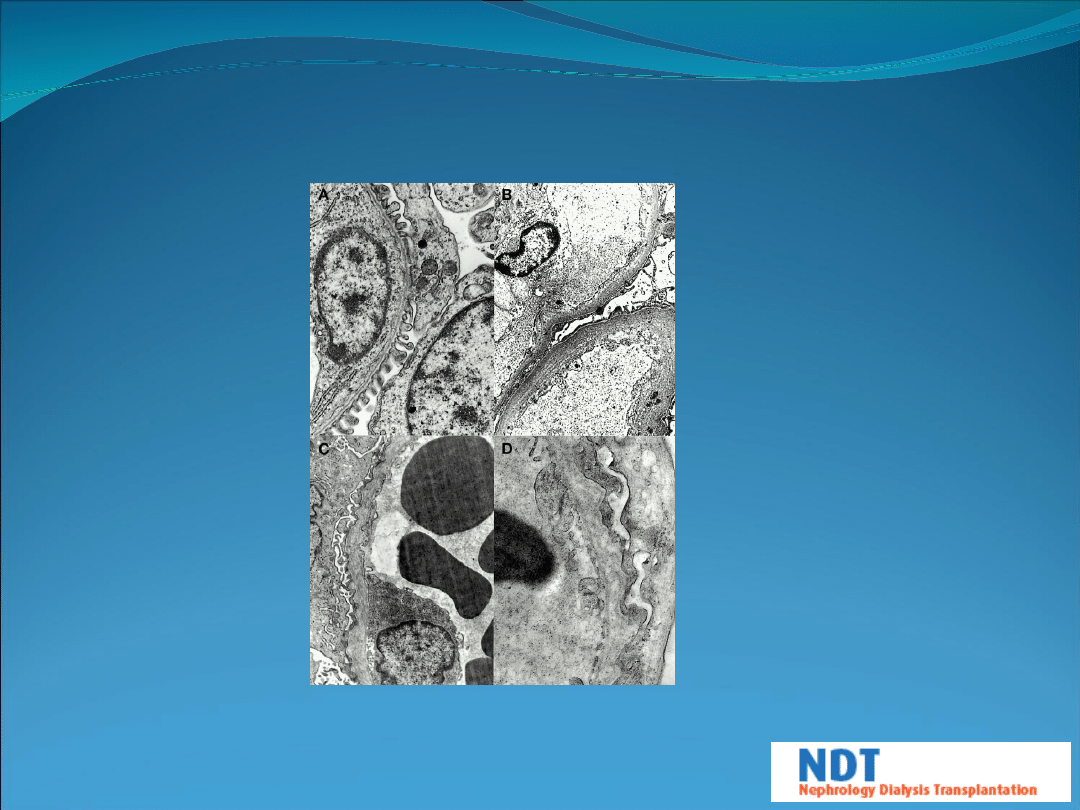
Ultrastructural appearance of glomerular basement membrane from affected
Dalmatians with autosomal dominant Alport syndrome: (A) normal membrane
in 35‐day‐old embryo (×5700); (B) lamellated membrane with fusion of
overlying foot processes in adult dog (×1850); (C) irregular thickened
lamellated membrane with subepithelial frilling and fusion of foot processes
in adult dog (×1850); and (D) membrane showing irregular basket weave
appearance in adult dog (×5700).
Hood J C et al. Nephrol. Dial. Transplant.
2002;17:2094-2098
© European Renal Association–European Dialysis and Transplant Association

ZESPÓŁ ALPORTA
W badaniach mikroskopowych, po przeprowadzeniu biopsji nerek,
stwierdza się:
- atrofię kłębków nerkowych;
- torbielowate rozszerzenie torebkowych przestrzeni Bowmana.
Rokowanie jest złe, ale zgon można opóźnić przez zmianę diety na
niskobiałkową.
Rasy: bullterier i samojed.

ZESPÓŁ ALPORTA
Hemofilia B u psów i kotów (choroba
Christmas).
Defekt genetyczny:
tranzycja (mutacja zmiany sensu) A-G w
nukleotydzie 1477
w genie kodującym IX czynnik krzepnięcia krwi. Prowadzi to do
zamiany kwasu glutaminowego na glicynę w kodonie 379 w białku
czynnika IX.
Ta pojedyncza substytucja aminokwasowa znacząco
zmienia strukturę trzeciorzędową cząsteczki czynnika IX, co prowadzi
do utraty jego aktywności.
Druga możliwość –
delecje w genie kodującym czynnik IX.
Dziedziczenie: recesywne, sprzężone z płcią.

Hemofilia B występuje
rzadziej,
niż hemofilia A.
Objawy są podobne.
Hemofilię B opisano u 20 ras psów oraz u kotów.
Częściej,
niż w przypadku hemofilii A
spotyka się przypadki choroby u
suk
.
Jednakże w przeciwieństwie do hemofilii A, w której występują lekkie,
średnie
i ciężkie niedobory czynnika VIII,
większość opisanych u zwierząt
przypadków hemofilii B charakteryzuje mniejszy niż 5% poziom
czynnika IX.
Badania wykazały występowanie 2 grup pacjentów:
- z nieoznaczalnym poziomem czynnika IX;
-z normalną ilością zmutowanego (nieaktywnego) czynnika IX.
Ciężkość krwawienia zależy od typu mutacji (tranzycja, czy delecja)
, ale
jest zwykle proporcjonalna do stopnia niedoboru czynnika IX.

Nasilenie objawów klinicznych hemofilii B
w znacznym stopniu uzależnione jest
od wielkości psa. (!!!!!!!!!!!!!!!!!!!!!!!!!!!)
U małych ras
(teriery, cocker spaniel, owczarek szetlandzki, buldog
francuski)
jest lekkie lub średnie.
Ciężka postać występuje u dużych ras
(bernardyn, Alaskan
malamut, owczarek staro angielski, owczarek niemiecki).
Hemofilia B objawia się głównie:
- występowaniem krwiaków;
- wylewami krwawymi do jam stawowych;
- krwotokami z układu pokarmowego lub do jam ciała.
W przypadku łagodnej formy psy osiągają dojrzałość płciową i
mogą przekazać chorobę potomstwu.
Diagnostyka podobna, z tą różnicą, że stwierdza się obniżony
poziom czynnika IX.
Niezgodność grup krwi i konflikt
serologiczny
u kotów
Przez lata hodowcy kotów borykali się z problemem
niewyjaśnionej śmiertelności wśród kocich noworodków,
która dotykała jedne rasy częściej od innych.
Dopiero badania w latach 80-tych ubiegłego wieku nad
grupami krwi
u kotów wykazały, że jednym z powodów
syndromu
słabnących kociąt (Fading Kitten Syndrome)
jest
izoerytroliza noworodków
, wywoływana
przez niezgodność
grupy krwi matki i jej potomstwa.
Blue-eyed cats with white fur have a higher incidence of
genetic deafness.

U kotów występują
trzy grupy krwi:
A
(najbardziej powszechna);
B
(częsta u niektórych ras);
AB
(niezależnie od rasy występująca bardzo rzadko).
Grupa krwi jest determinowana genetycznie inaczej, niż u człowieka.
U kotów
gen odpowiedzialny za grupę krwi A jest dominujący w
stosunku do genu na grupę B.
Oznacza to, że
tylko kot posiadający
dwa allele warunkujące grupę B będzie miał grupę krwi B
.
Kot z grupą krwi A może być zarówno homozygotą (posiadać dwa allele
A), jak i heterozygotą (posiadać jeden allel A i jeden allel B).
Trzeci rodzaj grupy krwi występującej u kotów,
grupa AB
, jest jeszcze
nie w pełni poznany. Czynnikiem determinującym tę grupę krwi jest
osobny allel ,
recesywny w stosunku do A, ale dominujący w stosunku do B.

Grupa krwi A
występuje najczęściej w populacji kotów
domowych zarówno krótko-, jak i długowłosych,
przy czym u tych osobników
bardzo rzadko
stwierdzano
w surowicy duże stężenie naturalnych przeciwciał.
Odwrotną sytuację stwierdzono u dużo mniejszej
liczby
kotów
z grupą krwi B,
u których bardzo często w
surowicy
krwi
występuje
duże
stężenie
naturalnych przeciwciał anty-A.
Wśród kotów rasowych stwierdza się znaczne różnice
w częstości występowania określonych grup krwi z
powodu stosowania długotrwałej selekcji skierowanej
na
różne
cechy.
U kotów w razie przetoczenia krwi niezgodnej grupowo
okres życia erytrocytów znacznie się skraca i trwa
od
kilku
godzin
do kilku dni
, podczas gdy normalna długość życia
krwinek czerwonych u kotów wynosi
4-5 tygodni.
Transfuzje takie mogą wywołać ostrą reakcję
organizmu,
szczególnie,
gdy
erytrocyty
z grupą A zostały (nawet pierwszy raz) zmieszane z
krwinkami grupy B.

Identyfikacja grup krwi u kotów i psów umożliwia rozpoznanie i
zapobieganie zjawisku ERYTROLIZY NOWORODKÓW.
Do izoelektrolizy, czyli niedokrwistości hemolitycznej dochodzi, gdy
nowonarodzone kocieta posiadają inną grupę krwi (A lub AB,) niż matka
(B).
Ssac siarę otrzymują jednocześnie przeciwciała skierowane przeciwko
własnym czerwonym krwinkom,
które są niszczone
, gdy tylko przeciwciała dostaną się do krwiobiegu
kociąt.
Choroba ta jest największym problemem
w hodowli kotów – tzw. syndrom
słabnących kociąt, u których często występuje grupa B.
Do erytrolizy dochodzi wtedy, gdy kocięta z grupą krwi A (pochodzące od
ojca z grupą A) ssą siarę od matki z grupą B.
W siarze kotek z grupą krwi B
znajdują się naturalne przeciwciałą anty-A, które po wchłonięciu się z
przewodu pokarmowego kociąt wiążą się z ich erytrocytami, wywołując:
- żółtaczkę,
- bilirubinurię,
- niedokrwistość ,
- śmierć w ciągu kilku dni.
Krzyżówka przedstawiająca dziedziczenie grup krwi u kotów
Kotka
Grupa krwi
A
Grupa krwi B
Genotyp:
AA
Ab
bb
Kocur Grupa
krwi A
AA
AA - grupa A
AA - grupa A
Ab - grupa A
Ab - grupa A
Konflikt
Ab
AA - grupa A
Ab - grupa A
AA - grupa A
Ab - grupa A
bb - grupa B
Ab - grupa A
Konflikt
bb - grupa B
Grupa
krwi B
bb
Ab - grupa A
Ab - grupa A
bb - grupa B
bb - grupa B

A litter of kittens with neonatal isoerythrolysis. Note the
jaundiced (yellow) noses and bloody tip of the tail of the white kitten.

Okresowe porażenie u koni „quarter” związany z nadmiarem
potasu.
HYPP – hyperkalemic periodic paralysis.
Defekt genetyczny
: mutacja typu transwersja (C-G) w regionie S3
podjednostki genu, prowadząca do zmiany sekwencji aminokwasów (Phe-Leu) –
zmaina sensu; w białkowym kanale sodowym komórek dojrzałych mięśni
szkieletowych. Istnieje test genetyczny umożliwiający wykrywanie heterozygot.
Dziedziczenie:
autosomalne dominujące. Chorują głównie heterozygoty, gdyż
homozygoty dominujące we wczesnym wieku źrebięcym giną z powodu
trudności
z
oddychaniem
i porażeniem dużych partii mięśni.
Choroba ta występuje najczęściej u koni amerykańskich biegających na ćwierć
mili.
Objawy to: okresowe pęczkowe drżenie i skurcze mięśni, osłabienie, skłonność
do przyjmowania pozycji leżącej oraz nadmiar potasu we krwi i czasem
niewydolność oddechowa, związana z porażeniem mięśni krtani i gardła. Objawy
mogą wystąpić lub nasilić się po podaniu paszy bogatej w potas (lucerna).
Potencjalne następstwa ataków to otarcia skóry, bezwiedne upadki i związane z
tym kontuzje. Okresowy paraliż obejmuje podczas ataku duże partie mięśni
konia, a ponieważ większość opisanych przypadków z lekkimi objawami
to osobniki heterozygotyczne, sugeruje to, że osobniki homozygotyczne pod
względem tej dominującej anomalii mogą mieć znacznie bardziej nasilone
objawy.
Ponadto u osobników obarczonych tą anomalią podczas stosowania anestezji
halotanowej mogą wystąpić objawy hipertermii złośliwej. W leczeniu stosuje się
fenytoinę, która działa jako środek antykonwulsyjny i jest skuteczna przez długi
okres po jej zastosowaniu.

Choroba Krabbego u
psów
Defekt genetyczny:
mutacja w genie kodującym beta-galaktozydazę, znosząca lub
zmniejszająca aktywność tego enzymu.
Dziedziczenie:
autosomalne recesywne.
Jest to sfingolipidoza związana ze spichrzaniem w komórkach układu nerwowego
galaktozyloceramidu.
Galaktozyloceramid - złożony lipid, który nie ulega degradacji ze względu na brak
aktywności enzymu lizosomalnego – beta-galaktozydazy, odpowiedzialnego za
rozkład do beta-galaktozy oraz ceramidu.
Brak degradacji galaktozyloceramidu prowadzi z jednej strony do gromadzenia w
komórkach
n
ie rozłożonego galaktozyloceramidu, a z drugiej strony do braku ceramidu jako
substratu
do syntezy sfingozyny i sfingomieliny.
W efekcie u osobników chorych występuje prawie całkowity brak mieliny.

Choroba Krabbego u
psów
Objawy:
początek choroby w młodym wieku,
choroba poczatkowo ma charakter zaburzeń mentalnych,
prowadzi do paraliżu i śmierci.
Pierwsze objawy kliniczne leukodystrofii globoidalnej
pojawiają
się
u dotkniętych nią psów w wieku 1-3 miesięcy. Należą
do
nich
ataksja
oraz porażenie tylnych kończyn. W dalszym przebiegu
choroby następuje atrofia mięśni oraz degeneracja
neurologiczna. Ze względu na brak możliwości leczenia
chore zwierzęta są usypiane w wieku 10 miesięcy.

Choroba Krabbego u
psów
W Wielkiej Brytanii u dorosłych białych terrierów West
Highland
przed dopuszczeniem do reprodukcji wykonywane są testy
DNA w celu wykrywania i eliminacji choroby Krabbego w
hodowlach.

Mukopolisacharydoza typu I u psów (i kotów).
Niedobór alfa-L-iduronidazy. Zespół Hurler/Scheiego
.
Defekt genetyczny:
mutacja w genie kodującym alfa-L-iduronidazę
– enzym lizosomalny degradujący dwa z 7 metabolitów GAG.
Dziedziczenie:
autosomalne recesywne.
Przyczyną choroby jest niedobór enzymu lizosomalnego alfa-L-
iduronidazy, odpowiedzialnego za degradację GAG. Na skutek tego
u chorych zwierząt, głównie w komórkach wątrobowych, dochodzi
do spichrzania dwóch z t metabolitów GAG. Są to: siarczan
dermatanu (DS.) oraz siarczan heparanu (HS). Oba te metabolity
są obecne w moczu chorych z mukopoisacharydozą typu I, co jest
wykorzystywane w diagnostyce.

Dziedziczna głuchota u psów
dalmatyńskich
Rodzaj defektu genetycznego nie jest znany.
Choroba dziedziczona jest autosomalnie recesywnie.
Objawy:
- wrodzona głuchota;
- anomalie barwy oczu (oczy niebieskie);
- występowanie od urodzenia ciemnych łat (a nie
charakterystycznych
dla dalmatyńczyków plamek).

Dziedziczna głuchota u psów
dalmatyńskich
Częstość występowania dalmatyńczyków z dziedziczną
głuchotą
w Norwegii wynosi 3,6%, natomiast w USA jest znacznie
wyższa
(w Polsce – brak danych).
Fakt ten tłumaczy się prowadzoną przez hodowców
norweskich selekcją mającą na celu wykluczenie osobników
z niebieskimi oczami
i nietypowymi dla dalmatyńczyków łatami, ponieważ cechy
te są niezgodne ze wzorcem rasy.

Translokacja albo fuzja robertsonowska
chromosomu 1/29 u krowy
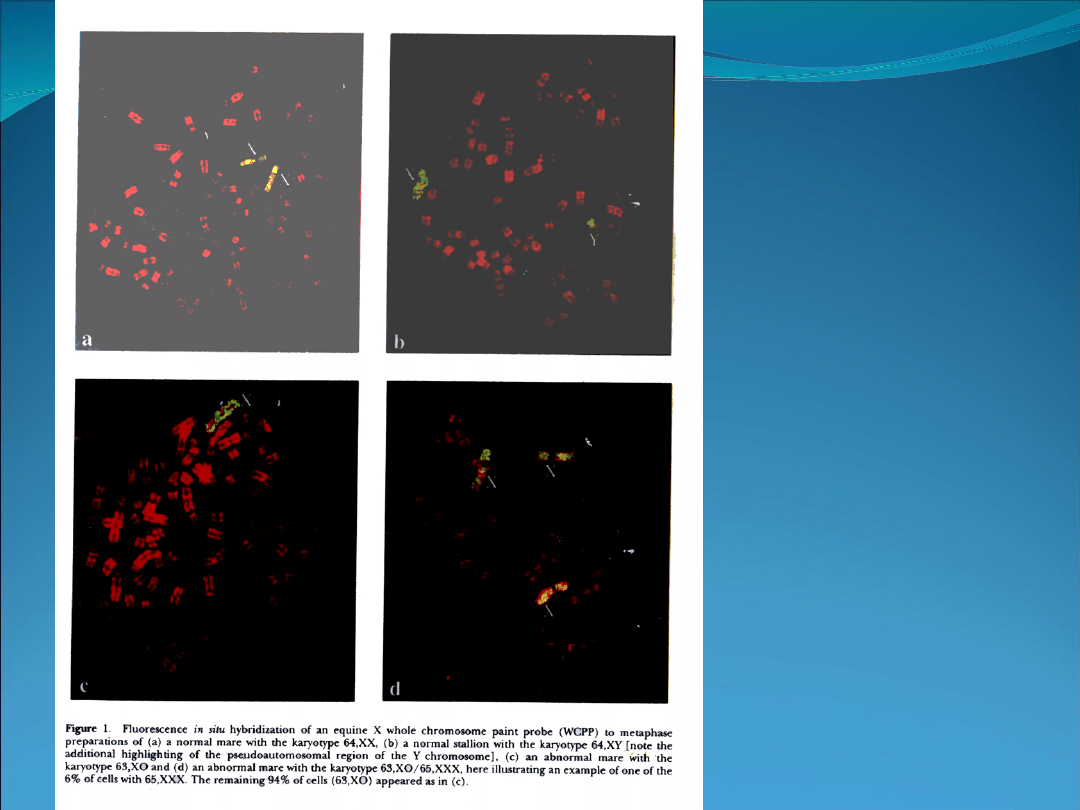
Kariotyp (chromosomy
w płytce metafazowej)
pochodzące od:
a.klaczy (64,XX)
b.ogiera (64,XY)
c.klaczy z monosomią
chromosomu X (63,X0)
d.klaczy z trisomią
chromosomu X
(65,XXX)
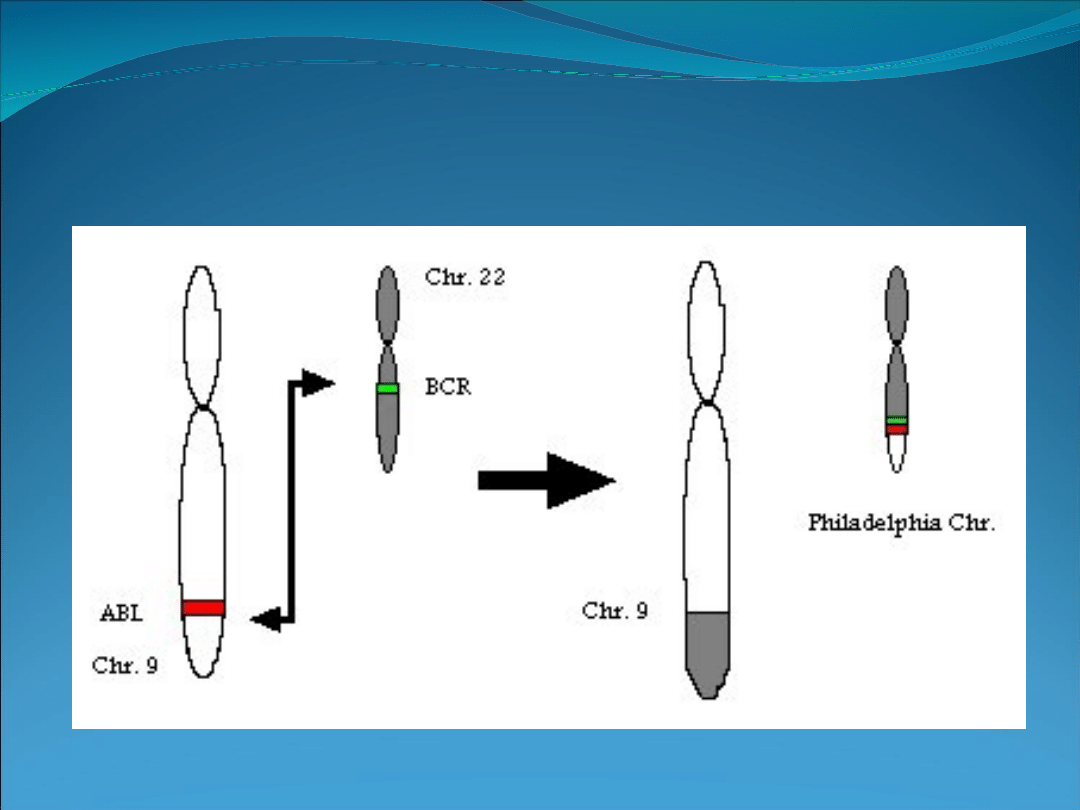
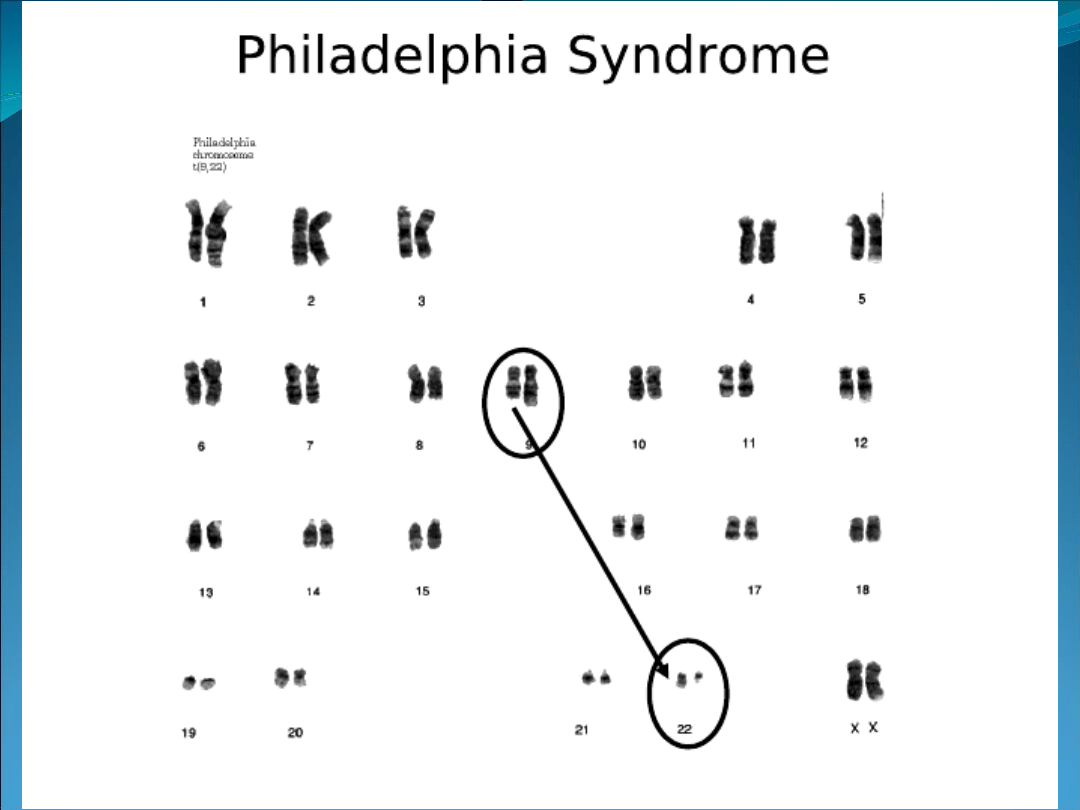
Genetyczne uwarunkowania przewlekłej białaczki szpikowej
(translokacja wzajemna prowadząca do utworzenia
chromosomu Philadelphia 1).
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
Wyszukiwarka
Podobne podstrony:
Choroby genetyczne zwierząt
267 Ustawa o ochronie zdrowia zwierząt oraz zwalczaniu chorób zakaźnych zwierząt
KODEKS ETYKI, vet, Choroby zak zwierząt, Semestr ogólny
WYKAZ CHOROB ZAKAZNYCH ZWIERZAT PODLEGAJACYCH OBOWIAZKOWI ZWALCZANIA
choroby genetyczne zespoly meta Nieznany (2)
ćw.4 - interna od dr Radwińskiej, weterynaria, Choroby wewnętrzne zwierząt gospodarskich
choroby genetyczne tabelka, I rok, I rok, gieldy, pen, medycyna, 1 semestr, Biologia medyczna, Genet
immunoprofilaktyka chorób zakaźnych zwierząt, Studia - materiały, Zwierzęta laboratoryjne
Choroby genetyczne
ROZDZIAL VII CHoroby genetyczne
PYTANIA EGZAMINACYJNE Z PRZEDMIOTU CHOROBY WEWNĘTRZNE ZWIERZĄT GOSPODARSKICH
Choroby genetyczne zadania z kolokwium
wykłady choroby, genetyka, moja prezentacja
genetyka zwierzątx
więcej podobnych podstron