
TEORIE
KWASÓW I ZASAD

Wykład 2 – Teorie kwasów i zasad
Kwasy i zasady
... trochę historii

Al kalja (arabski) =
ekstrakt wodny z
popiołu roślinnego
Substancje, które:
• ich roztwory są
„śliskie”
• zmieniają barwę
lakmusu z czerwonej
na niebieską
• usuwają tłuszcze
(oleje)
ZASADY
(alkalia)
Wykład 2 – Teorie kwasów i zasad
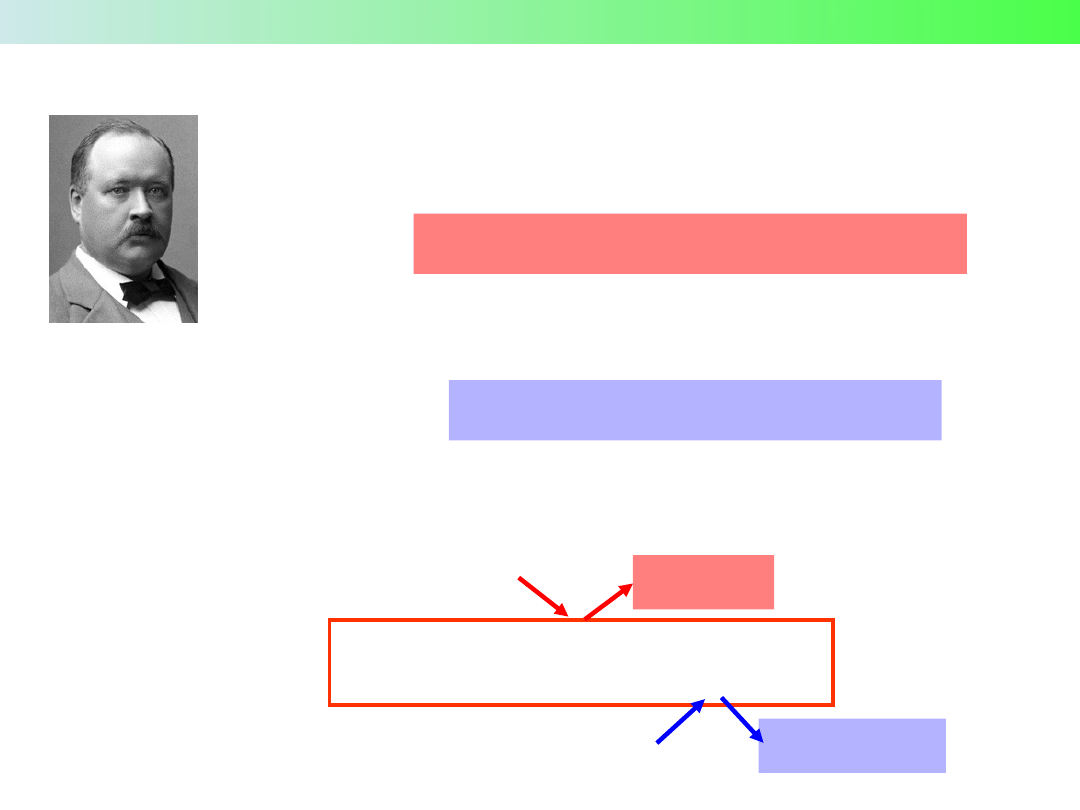
Pierwszym, który nazwał takie substancje kwasami bądź zasadami
(alkaliami) był Robert Boyle (1627–1691)
Nicholas Lemery (1645-1715 ) opisywał kwasy jako indywidua o ostrych
spiczastych atomach, które sprawiają wrażenie nakłuwania skóry, natomiast
alkalia jako zbudowane z okrągłych cząstek, co sprawią, że odczuwamy je jako
śliskie i mydlane. Gdy kwasy i zasady mieszają się ostre igiełki kwasu zagłębiają
się w porowate globulki alkaliów tworząc sole, które ani nie kłują ani nie są śliskie
w dotyku.
Acetum (łac.) = kwaśny
Acid (ang.) = kwas
„Smakosze octu”
Substancje, które:
• mają „kwaśny”
smak
• zmieniają barwę
lakmusu z
niebieskiej
na czerwoną
• roztwarzają metale
KWASY
- znane już w
starożytności (ocet, kwaśne wino)
Robert Boyle

Wykład 2 – Teorie kwasów i zasad
I. Teoria Arrheniusa
Karykatura Arrheniusa
„Naładowane piłki do krykieta.”
Svante August
Arrhenius
(1859–1927)
Nobel 1903
Rok 1883 – S.A.Arrhenius – Praca doktorska
– wyjaśnienie przewodnictwa
elektrycznego roztworów kwasów, zasad i
soli.
Podczas rozpuszczania w wodzie,
kwasy, zasady lub sole rozpadają się
na naładowane elektrycznie cząstki,
nazwane wiele lat wcześniej przez
Michaela Faradaya, „jonami”.
ELEKTROLITY to substancje które po
stopieniu lub rozpuszczeniu rozpadają się
na jony.
DYSOCJACJA ELEKTROLITYCZNA (jonowa)
to proces rozpadu cząsteczek związków
chemicznych na jony pod wpływem
rozpuszczalnika.
Svante Arrhenius:
TEORIA KWASÓW I ZASAD
KWASY
– substancje od których w roztworze wodnym
odłącza się jon wodorowy:
H
+
ZASADY
– substancje od których w roztworze wodnym
odłącza się jon wodorotlenowy:
OH
−
Powyższe definicje mają ścisły związek z autodysocjacją wody
– podwyższają stężenie jednego z produktów tej dysocjacji.
H
2
O H
+
+
OH
−
Jeżeli substancja podwyższa stężenie
KWAS
Jeżeli substancja podwyższa stężenie
ZASADA
HCl, HNO
3
, H
2
SO
4
, H
3
PO
4
,
NaOH, KOH, Ca(OH)
2
,
Wykład 2 – Teorie kwasów i zasad

Wykład 2 – Teorie kwasów i zasad
II. Teoria Brønsteda i Lowry’ego (1923 r.)
Johannes Brønsted
(1879-1947)
Thomas
Lowry
(1874-1936)
Definicja kwasu i zasady oparta na wymianie protonu:
KWAS
– DONOR PROTONU
(substancja która może oddać proton)
ZASADA
– AKCEPTOR PROTONU
(substancja która może przyłączyć proton)
SPRZĘŻONE kwasy i zasady
H
+
Wykład 2 – Teorie kwasów i zasad
–
+
AUTOPROTOLIZA WODY
H
2
O H
+
+ OH
−
Samorzutna dysocjacja (autodysocjacja)
niewielkiej części cząsteczek wody:
Jon H
+
przyłącza się do cząsteczki wody
tworząc jon oksoniowy (oksonium) H
3
O
+
+
H
3
O
+
H
+
+ H
2
O H
3
O
+
Reakcja sumaryczna:
2H
2
O H
3
O
+
+ OH
−
jon oksoniowy
Reakcja ODWRACALNA
Wymiana protonu pomiędzy
dwoma cząsteczkami wody
H
O
H
O
H
H
–
KWAS
ZASADA
Wykład 2 – Teorie kwasów i zasad
KWAS
– DONOR PROTONU
(substancja która może oddać proton)
ZASADA
– AKCEPTOR PROTONU
(substancja która może przyłączyć
proton)
HCl + H
2
O = H
3
O
+
+ Cl
−
HA = H
+
+ A
−
KWAS
ZASADA
sprzężona z kwasem HA
Przykład:
KWAS
ZASADA
ZASADA
KWAS
NH
3
+ H
2
O = NH
4
+
+ OH
−
KWAS
ZASADA
ZASADA
KWAS
sprzężenia
Wykład 2 – Teorie kwasów i zasad
KWAS
– DONOR PROTONU
(substancja która może oddać proton)
ZASADA
– AKCEPTOR PROTONU
(substancja która może przyłączyć
proton)
Problem: Dlaczego w reakcji
HCl + H
2
O = H
3
O
+
+ Cl
−
proton przechodzi od HCl
do H
2
O ?
MOC KWASÓW I ZASAD
Słaby kwas
trudno oddaje proton
Mocny kwas
łatwo oddaje proton
Mocna zasada
mocno wiąże proton
Słaba zasada
słabo wiąże proton
H
+
H H
Cl
O
H
–
słabsze
wiązanie
mocniejsze
wiązanie
Mocny kwas
Słaba zasada
Mocny kwas
jest sprzężony ze
słabą
zasadą
Słaby kwas
jest sprzężony z
mocną
zasadą
... i odwrotnie
HCl + H
2
O = H
3
O
+
+ Cl
−
KWAS
ZASADA
ZASADA
KWAS

Wykład 2 – Teorie kwasów i zasad
KWAS
– DONOR PROTONU
(substancja która może oddać proton)
ZASADA
– AKCEPTOR PROTONU
(substancja która może przyłączyć
proton)
HCl + H
2
O = H
3
O
+
+ Cl
−
KWAS
ZASADA
ZASADA
KWAS
Analogiczne reakcje:
NH
4
+
+ H
2
O = H
3
O
+
+ NH
3
KWAS
ZASADA
ZASADA
KWAS
CN
−
+ H
2
O = HCN + OH
−
KWAS
ZASADA
ZASADA
KWAS
HS
−
+ H
2
O = H
3
O
+
+ S
2−
KWAS
ZASADA
ZASADA
KWAS
NH
3
+ H
2
O = NH
4
+
+ OH
−
KWAS
ZASADA
ZASADA
KWAS
[Al(H
2
O)
5
OH]
2+
+ H
2
O = [Al(H
2
O)
6
]
3+
+ OH
−
KWAS
ZASADA
ZASADA
KWAS
Według teorii Brønsteda i Lowry’ego, kwasami lub zasadami mogą być:
obojętne cząsteczki, kationy i aniony.

Wykład 2 – Teorie kwasów i zasad
Uogólnienie pojęcia kwasu i
zasady
III. Teoria Lewisa (1923 r.)
Gilbert Newton Lewis
(1875-1946)
H
+
+ :NH
3
= H:NH
3
+
= NH
4
+
Ag
+
+ 2 :NH
3
= [H
3
N:Ag:NH
3
]
+
= [Ag(NH
3
)
2
]
+
KWAS
ZASADA
KWAS
–
cząsteczka zdolna do przyjęcia pary elektronowej
(elektrofil)
ZASADA
–
cząsteczka zdolna do oddania pary elektronowej
(nukleofil)
Reakcja w wyniku której powstaje wiązanie koordynacyjne jest reakcją
kwasowo-zasadową.

Wykład 2 – Teorie kwasów i zasad
H
+
+ :Cl
–
= H:Cl
KWAS
ZASADA
Addukt
kwasowo-zasadowy
Dysocjacja HCl w H
2
O – wymiana zasady w addukcie (HCl)
HCl + H
2
O = H
3
O
+
+ Cl
−
ZASADA
ZASADA'
Addukt
Addukt'
ZASADA
Reakcja NH
3
z H
2
O – wymiana zasady w addukcie (H
2
O)
NH
3
+ H:OH = NH
4
+
+ OH
−
Addukt
ZASADA
ZASADA'
Addukt'
ZASADA

Wykład 2 – Teorie kwasów i zasad
IV. Teoria twardych i miękkich kwasów oraz zasad
HSAB (ang. – Hard and Soft Acids and Bases)
Ralph Pearson (1963)
Właściwości twardych kwasów (HA) i twardych zasad (HB):
- małe promienie atomowe lub jonowe
- wysokie stopnie utlenienia
- mała polaryzowalność
- duża elektroujemność
Właściwości miękkich kwasów (SA) i miękkich zasad (SB):
- duże promienie atomowe lub jonowe
- zerowy lub niskie stopnie utlenienia
- duża polaryzowalność
- niska elektroujemność
Wykład 2 – Teorie kwasów i zasad
Przykłady twardych i miękkich kwasów oraz zasad
Twarde kwasy (HA):
H+, Li
+
, Na
+
, K
+
, Mg
2+
, Ca
2+
, Ti
4+
, Cr
3+
, Fe
3+
Twarde zasady (HB):
OH
–
, F
–
, Cl
–
, CH
3
COO
–
, CO
3
2–
,
NO
3
–
, PO
4
3–
, SO
4
2–
, NH
3
, H
2
O
Miękkie kwasy (SA):
Ag
+
, Hg
2+
, Pt
4+
, Pd
2+
, Au
+
, Cd2+, Br
2
, metale
Miękkie zasady (SB):
H
–
, CN
–
, I
–
, CO.
Istnieją również kwasy i zasady o charakterze pośrednim
Przewidywanie kierunku reakcji twardych i miękkich kwasów oraz zasad
Połączenia (HA)(HB) oraz (SA)(SB) są trwalsze od (HA)(SB) oraz (SA)(HB)
Li I + Ag F = Li F
+ Ag I
HA
SB
SA
HB
HA HB
SA SB
Wykład 2 – Teorie kwasów i zasad
V. Kwasy i zasady w rozpuszczalnikach niewodnych.
Teoria „rozpuszczalnikowa”
Edward Franklin (1905)
KWAS
– powyższa stężenie
KATIONU
z autodysocjacji rozpuszczalnika
ZASADA
– powyższa stężenie
ANIONU
z autodysocjacji rozpuszczalnika
Autodysocjacja wody:
2H
2
O = H
3
O
+
+ OH
–
KATION
ANION
HCl + H
2
O = H
3
O
+
+ Cl
−
NH
3
+ H
2
O = NH
4
+
+ OH
−
KWAS
ZASADA
Autodysocjacja ciekłego amoniaku:
2NH
3
= NH
4
+
+ NH
2
–
KATION ANION
NH
4
Cl = NH
4
+
+ Cl
−
NaNH
2
= Na
+
+ NH
2
−
KWAS
ZASADA
NH
4
Cl
i
NaNH
2
w roztworze wodnym są solami !
NH
2
–
amidek
REGUŁA PRZEKORY W DYSOCJACJI SŁABYCH ELEKTROLITÓW
Zadanie: Jaki jest stopień dysocjacji HCN w 0,1 M roztworze?
Jak ten stopień dysocjacji można zmniejszyć? K
a
=10
−9
HCN H
+
+
CN
−
α=
Ka
c
a
Forma uproszczona
=
10
−9
0,1
0,01 %
=
Ka (1− α)
c
a
·
α
2
Forma dokładna
Czy skorzystanie ze
wzoru uproszczonego
(1− α)
=10
−4
10
−4
= 1–
1
= 0,9999
SŁUSZNE!
było słuszne?
Jak zmniejszyć stopień dysocjacji?
Przesunąć równowagę „w LEWO” –
HCN H
+
+
CN
−
– zwiększyć stężenie H
+
lub CN
–
– czyli dodać np:
HCl
lub
KCN
Wykład 2 – Teorie kwasów i zasad
[HCN]
[H
+
]
· [CN
−
]
K
=
a
Jaki jest stopień dysocjacji
0,1 M HCN w 0,2 M roztworze HCl
Jak zmniejszyć stopień dysocjacji?
Przesunąć równowagę „w LEWO” –
HCN H
+
+ CN
−
HCl – mocny kwas –
100 % dysocjacji
HCl H
+
+ Cl
−
0,2 M
0,2 M
0,2 M
Nie można stosować
PRAWA ROZCIEŃCZEŃ
– dodatek HCl !
=
α=
Ka
c
a
=
Ka (1− α)
c
a
·
α
2
c
a
– [CN
−
]
([H
+
]+[H
+
])
· [CN
−
]
HCl
HCN
<<<
>>>
=
0,2·[CN
−
]
0,1
K
a
=
2·[CN
−
]
=
10
−9
[CN
−
]
=
5·10
−10
=
[CN
−
]
c
a
α
=
5·10
−10
0,1
=
5·10
−9
=
0,0000005 %
[bez HCl
α = 0,01 %
]
Wykład 2 – Teorie kwasów i zasad
Słabszy
kwas
Silniejszy
kwas
Dysocjacja kwasów
wielozasadowych
Przykład: – kwas węglowy H
2
CO
3
H
2
CO
3
H
+
+ HCO
3
−
(1)
HCO
3
−
H
+
+ CO
3
2−
(2)
Stałe dysocjacji
[H
2
CO
3
]
[H
+
]
· [HCO
3
−
]
K
a1
=
= 9,1·10
−7
[HCO
3
−
]
[H
+
]
· [CO
3
2−
]
K
a2
=
= 2,7·10
−10
Obydwie równowagi
istnieją jednocześnie
Jony H
+
są wspólne
α
1
=
[HCO
3
−
]
c
a
α
2
=
[HCO
3
−
]
[CO
3
2−
]
α
2
>
α
1
Równowaga (2) przesunięta "w LEWO" przez jony H
+
pochodzące z reakcji (1).
Wykład 2 – Teorie kwasów i zasad
Wykład 2 – Teorie kwasów i zasad
AKTYWNOŚĆ ELEKTROLITÓW
W roztworach elektrolitów o stężeniach większych od ~0,01 M
jony zachowują się tak jakby ich stężenia były nieco inne od przygotowanych.
Aktywność
a
i
– skorygowane stężenie
Przykłady stosowania aktywności:
Przyczyna: - oddziaływanie elektrostatyczne pomiędzy jonami
a
i
= c
i
· f
i
aktywność
stężenie
molowe
współczynnik
aktywności
pH = –log a
H
3
O
+
NH
3
·H
2
O NH
4
+
+
OH
−
K
b
=
a
NH
4
+
OH
−
a
a
NH
3
·H
2
O
·
Wykład 2 – Teorie kwasów i zasad
AKTYWNOŚĆ ELEKTROLITÓW
stężenie
molowe
Współczynniki aktywności można wyliczyć z
równania:
ln f
i
=
A z
i
2
I
1 + a B I
√
√
A, a, B –
parametry zależne od
rozmiaru jonu i rozpuszczalnika
I –
siła jonowa roztworu
I = ½ ∑
c
i
· z
i
2
z
i
–
ładunek jonu
Siła jonowa uwzględnia obecność
wszystkich jonów obecnych w roztworze,
a nie tylko biorących udział w rozważanej
wielkości,
np. w równowadze chemicznej
K
b
=
a
NH
4
+
OH
−
a
a
NH
3
·H
2
O
·
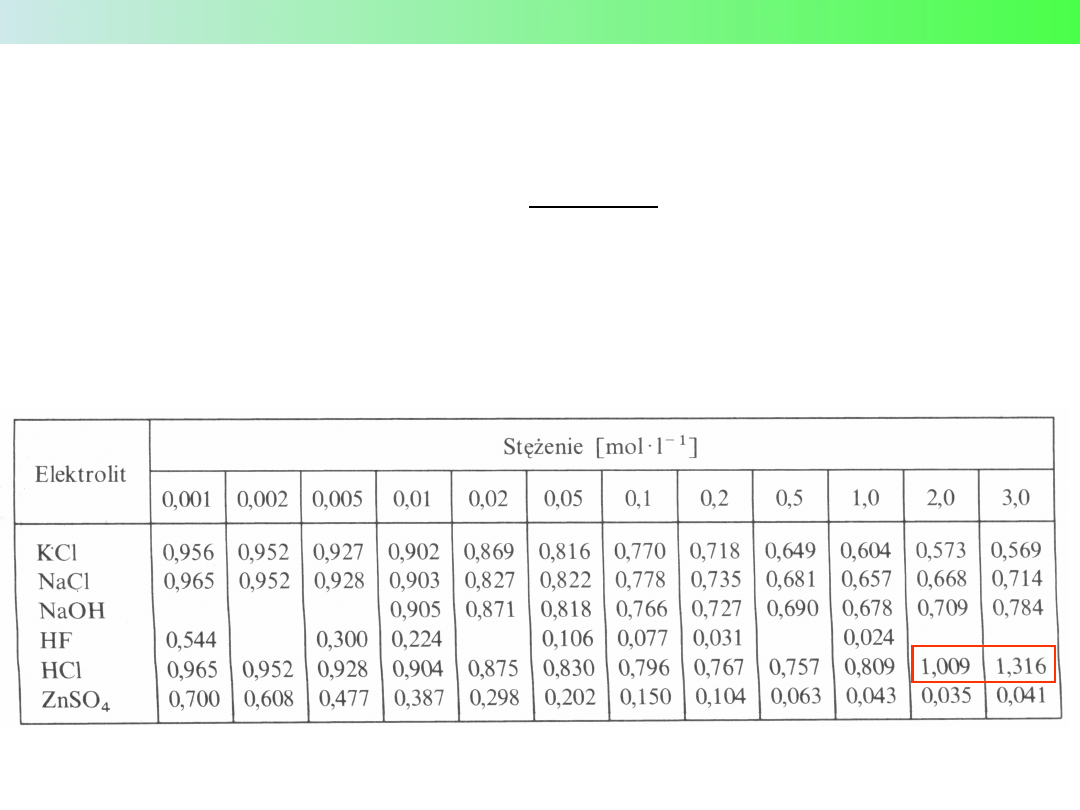
Wykład 2 – Teorie kwasów i zasad
AKTYWNOŚĆ ELEKTROLITÓW
Średnie współczynniki aktywności elektrolitu
A
+
B
−
f
±
=
√
f
+
·
f
−
Średnie współczynniki aktywności niektórych elektrolitów w roztworach wodnych
Wykład 2 – Teorie kwasów i zasad
SUPER KWASY
– ciecze niewodne w których stężenie
jonów H
+
jest wielokrotnie większe niż w
wodnych roztworach najsilniejszych
kwasów
W roztworach wodnych, najsilniejszym kwasem jest
H
3
O
+
- silniejsze kwasy przekazują protony
cząsteczkom wody
Przykłady:
SUPER KWASY
– kwasy silniejsze od 100% H
2
SO
4
KWAS
pH
Bezwodny H
2
SO
4
–12
Oleum H
2
SO
4
+ SO
3
–19
Kwas magiczny SbF
5
+ HSO
3
F
–15
CH
4
+ H
+
→ CH
5
+
→ CH
3
+
+ H
2
↑
Superkwasy mogą
protonować węglowodory
dając karbokationy
Kwas fluoroantymonowy SbF
5
+ HF –19,3
George Olah – Nobel 1994
SbF
5
+ HF = [SbF
6
]
–
+ H
+
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
Wyszukiwarka
Podobne podstrony:
02 MAKROEKONOMIA(2)id 3669 ppt
02 Notajca UMLid 3691 ppt
02 Zanieczyszczenie środowiskaid 3460 ppt
w13 09,03 gosp kwas zasad ES
Egzamin diagnozujący teorie kwasów i zasad
02 Powstanie filozofiiid 3435 ppt
02 geneza RBDid 3906 ppt
02 Reprezentacja danychid 3439 ppt
02 Stratygrafia sekwencyjnaid 3488 ppt
1 6 Teorie kwasów i zasad +Odpowiedzi
02 Grawimetria 2id 3908 ppt
Teorie kwasów i zasad
02 Inzynieria systemowid 3909 ppt
Gosp kwas zasad
więcej podobnych podstron