
1
Problemy do rozważenia...
• Jak tworzą się wiązania?
• Jakiego rodzaju wiązania?
• Jakie własności wynikają z rodzaju wiązań?
WIĄZANIA MIĘDZYATOMOWE
I WŁASNOŚCI MATERIAŁÓW
Ciekawy przykład - węgiel:
Dwie odmiany:
grafit
i
diament
grafit – miękki, "smarujący"
diament – najtwardszy znany materiał

2
Struktura Atomowa (Chemia)
• atom –
electrony
– 9.11 x 10
-31
kg
protony
neutrony
• Liczba atomowa Z
= liczba protonów w jądrze atomu
N
= liczba elektronów (atom obojętny)
liczba neutronów może być różna (
izotopy
)
• Masa atomowa
A
= masa 6.023 x 10
23
atomów
• Jednostka masy atomowej
= jma = u = 1/12 masy
12
C
(A = 12.0000)
A = Z + N
1 jma/atom = 1g/mol
C 12.011
H 1.008 etc.
}
1.67 x 10
-27
kg
3
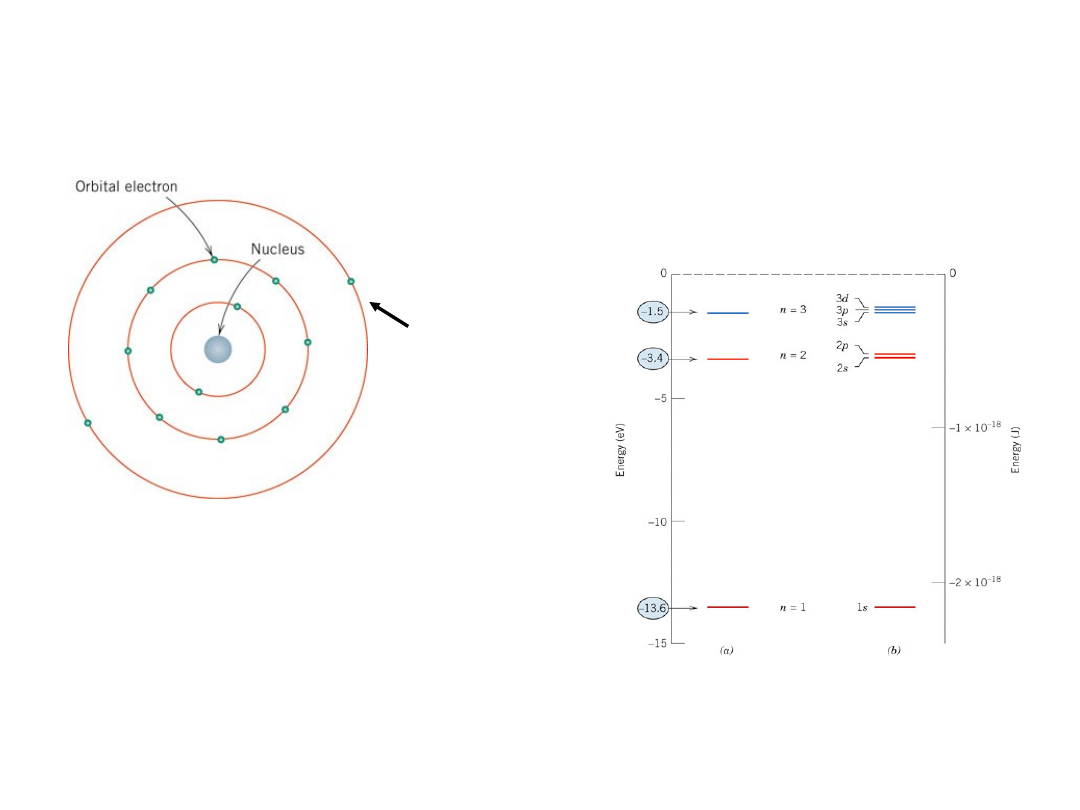
Model atomu wg Bohra
jądro – protony +
neutrony
Energie elektronów są skwantowane
Wartości energii (stany) – ściśle określone
wartości
Dozwolone stany
energetyczne dla
wodoru
Bardziej dokładny jest
model falowy – mechanika
kwantowa
Elektrony
walencyj
ne
4
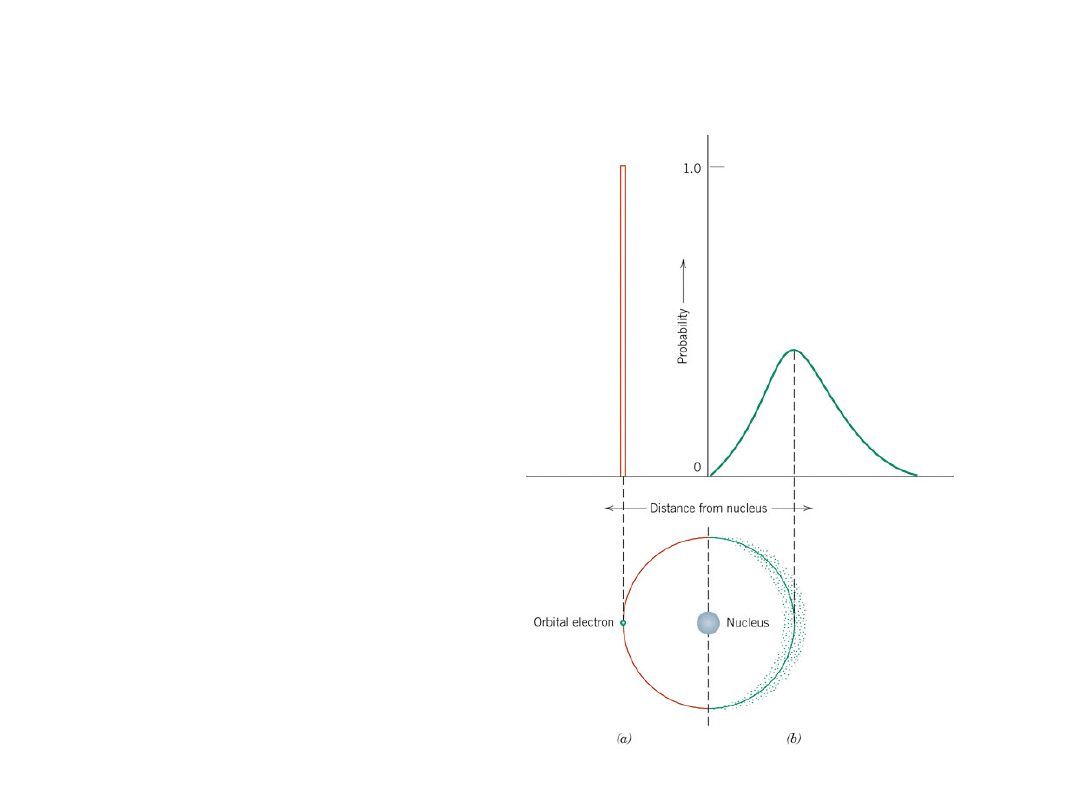
Model falowy
Elektrony wykazują
zarówno właściwości
falowe jak i
czasteczkowe
Położenie pojedynczego
elektronu jest
traktowane jako rozkład
prawdopodobieństwa
wokół jądra
Zasada Pauliego - w
atomie nie może być
więcej niż 2 elektronów
znajdujących się w tym
samym stanie

5
Struktura Elektronowa
• Elektrony mają właściwości falowe i
korpuskularne + zasada Pauli'ego:
– Elektrony zajmują ścisle określone stany
energetyczne zdefiniowane przez
prawdopodobieństwo
(orbitale)
.
– Każdy orbital ma dyskretny poziom energii
określony przez
liczby kwantowe
.
Liczby kwantowe Oznaczenie
n = główna (określa powłokę)
K, L, M, N, O (1, 2, 3, etc.)
l = poboczna (podpowłoka)
s, p, d, f (0, 1, 2, 3,…, n
-1)
m
l
= magnetyczna
1, 3, 5, 7 (-l to +l)
m
s
= spin ½, -½
6
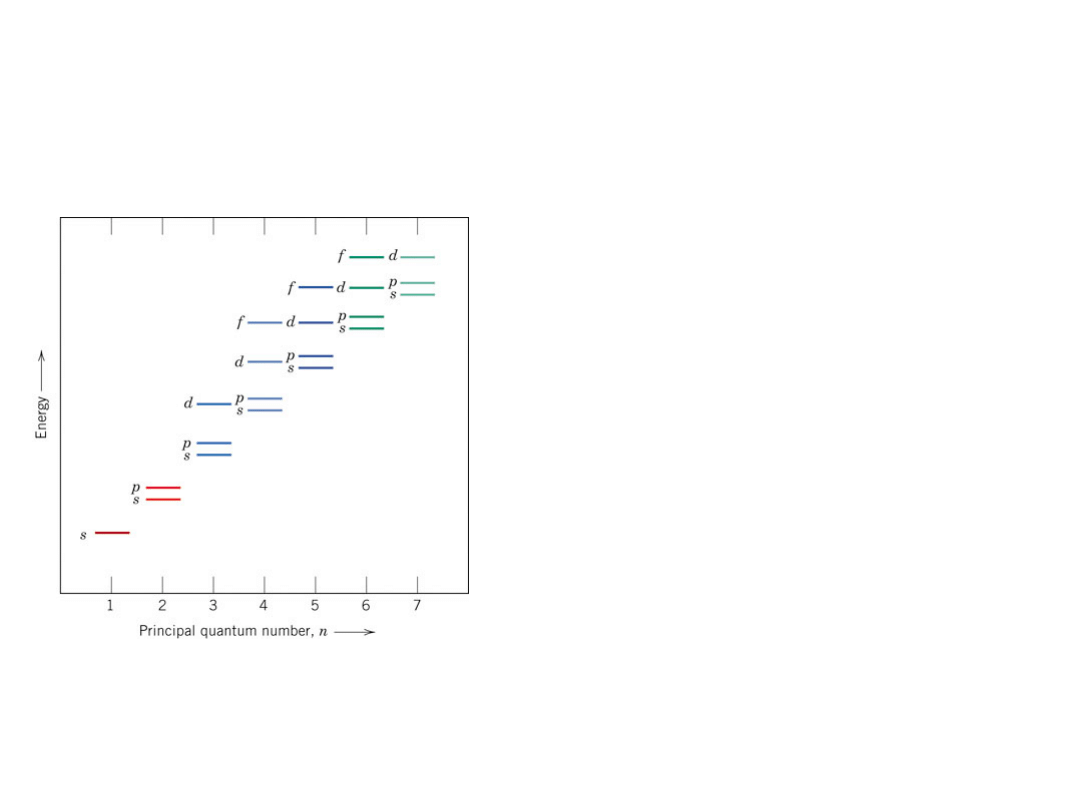
Stany Energetyczne
Elektronów
Elektrony zajmują kolejne orbitale na
kolejnych powłokach tak aby atom jako
całość posiadał jak najniższą energię.
Znając
danego pierwiastka
można łatwo samemu ustalić jego
konfigurację elektronową
Reguły:
1.
Najpierw zapełnieniu ulegają orbitale "s",
potem "p", potem "d" i na końcu "f".
2.
Orbitale z wyższych warstw są zapełniane
dopiero po całkowitym zapełnieniu warstw
niższych.
3.
Na orbitalach s mogą być tylko 2
elektrony, na p 6, na d 10 i na f 14
4.
W pierwszej powłoce jest tylko orbital s, w
drugiej są orbitale s i p, w trzeciej s, p i d i
w końcu w czwartej i piątej pojawiają się
jeszcze orbitale f.
7
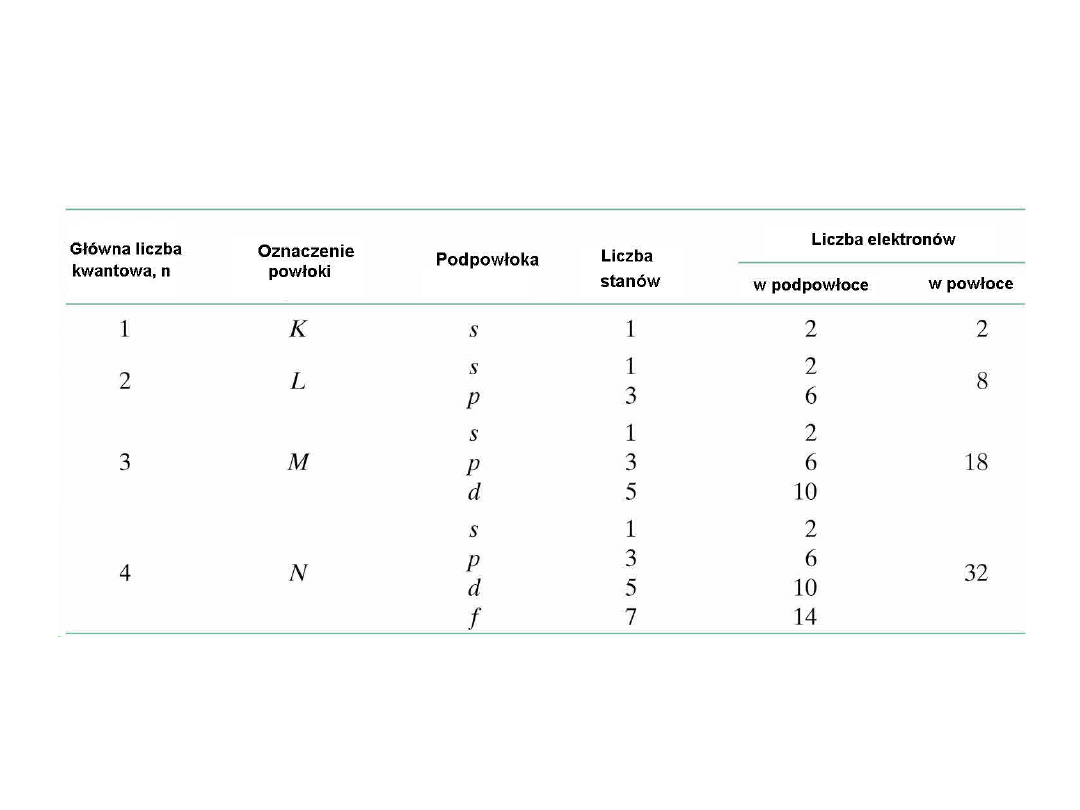
Liczba możliwych stanów elektronów w
poszczególnych powłokach i
podpowłokach
8
Większość pierwiastków ma konfigurację elektronową niestabilną
PRZEGLĄD PIERWIASTKÓW
Konfiguracja electronowa
(stabilna)
...
...
1s
2
2s
2
2p
6
3s
2
3p
6
(stabilna)
...
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
(stabilna)
Z
18
...
36
Pierwiastek
1s
1
1
Wodór
1s
2
2
Hel
1s
2
2s
1
3
Lit
1s
2
2s
2
4
Beryl
1s
2
2s
2
2p
1
5
Bor
1s
2
2s
2
2p
2
6
Węgiel
...
1s
2
2s
2
2p
6
(stabilna)
10
Neon
1s
2
2s
2
2p
6
3s
1
11
Sód
1s
2
2s
2
2p
6
3s
2
12
Magnez
1s
2
2s
2
2p
6
3s
2
3p
1
13
Aluminium
...
Argon
...
Krypton

9
Elektrony
• Elektrony walencyjne
–
elektrony w
najdalszej (zewnętrznej) powłoce, biorą udział
w tworzeniu wiązań międzyatomowych
• Elektrony walencyjne
wpływają
(poprzez wiązania) na nastepujące własności:
1)Chemiczne
2)Electryczne
3)Cieplne
4)Optyczne
Powłoka walencyjna
nie jest zwykle w
pełni obsadzona elektronami
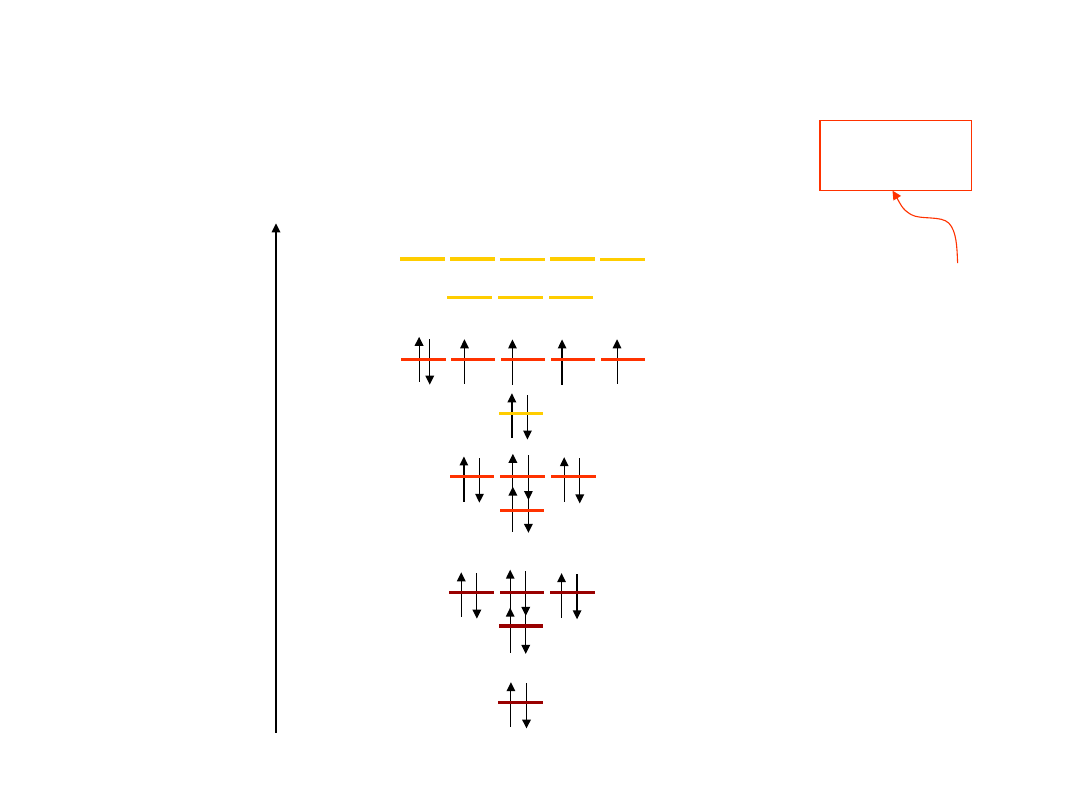
10
Konfiguracje Elektronowe
np: Fe, Z
=
26
Elektrony
walencyjne
1s
2s
2p
K n = 1
L n = 2
3s
3p
M n = 3
3d
4s
4p
4d
Energia
N n = 4
1s
2
2s
2
2p
6
3s
2
3p
6
3d
6
4s
2
11
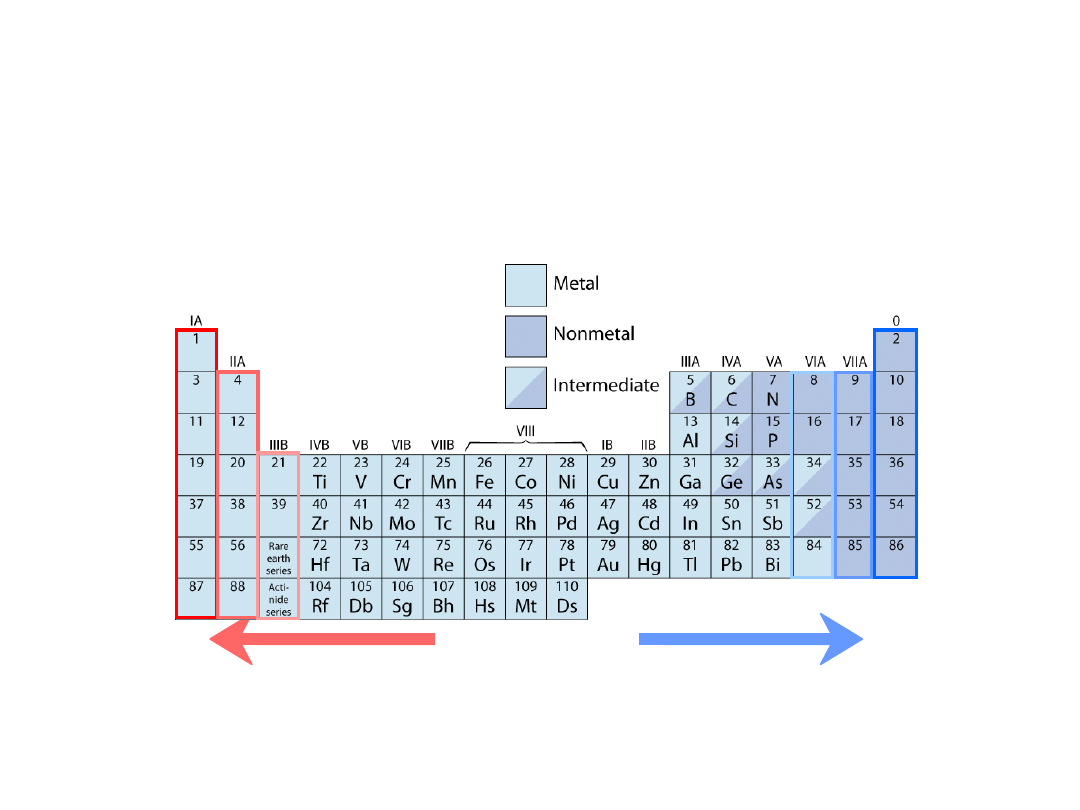
Układ okresowy pierwiastków
Kolumny:
Podobna struktura
walencyjna
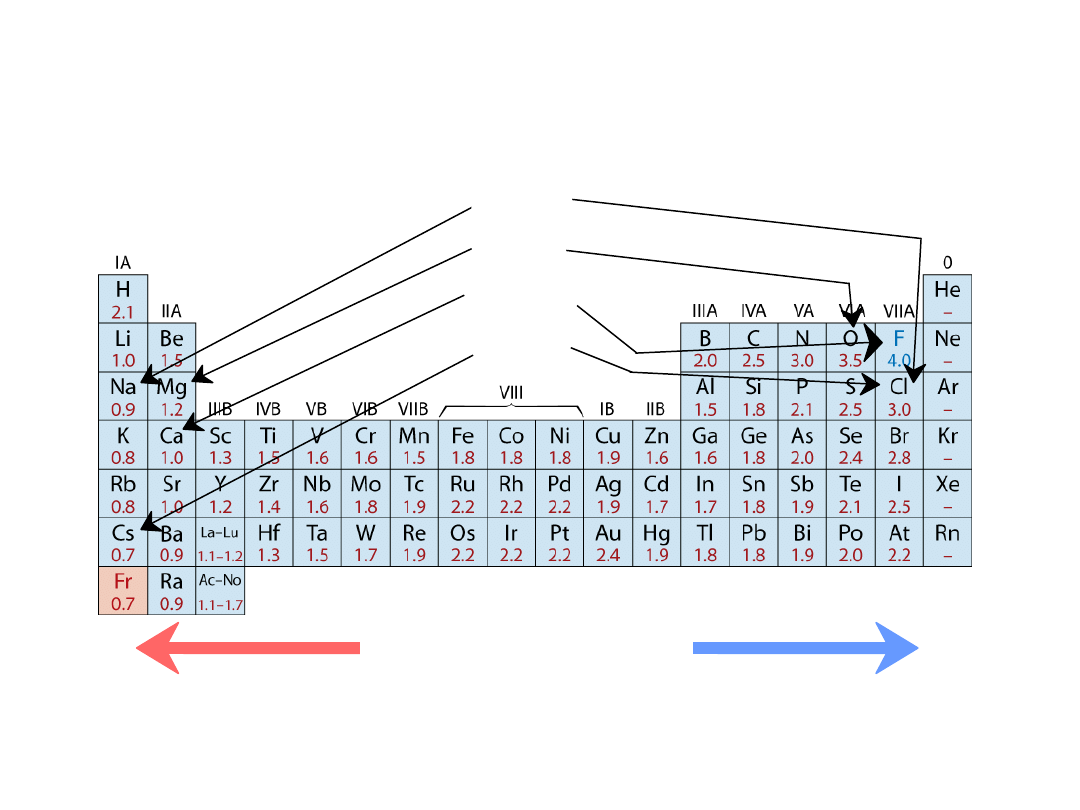
Pierwiastki electrododatnie:
chętnie oddają elektrony
i stają się jonami dodatnimi
Pierwiastki electroujemne:
chętnie pobierają elektrony i stają się
jonami ujemnymi
o
d
d
a
je
1
e
o
d
d
a
je
2
e
o
d
d
a
je
3
e
g
a
z
d
o
s
k
.
p
rz
y
jm
u
je
1
e
p
rz
y
jm
u
je
2
e
O
Se
Te
Po At
I
Br
He
Ne
Ar
Kr
Xe
Rn
F
Cl
S
Li
Be
H
Na
Mg
Ba
Cs
Ra
Fr
Ca
K
Sc
Sr
Rb
Y
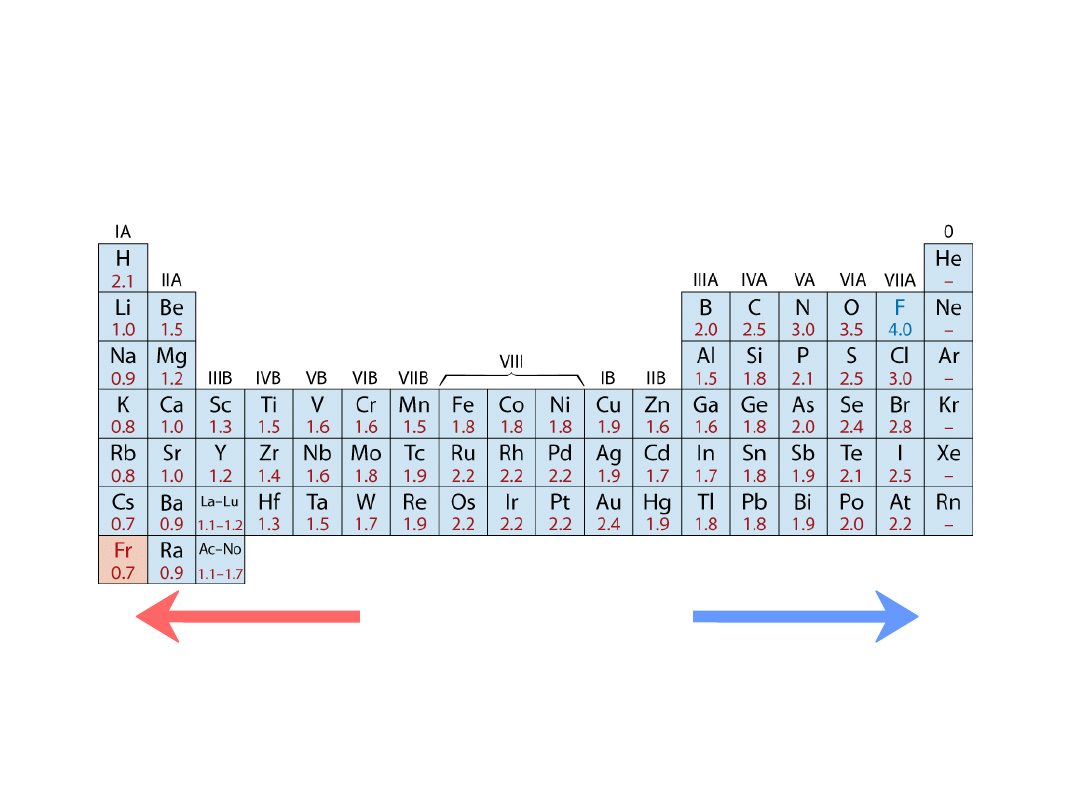
12
• Zakres od
0.7
do
4.0
,
Mniejsza elektroujemność
Większa elektroujemność
• Duże wartości: tendencja do przyjmowania electroów
Elektroujemność
13
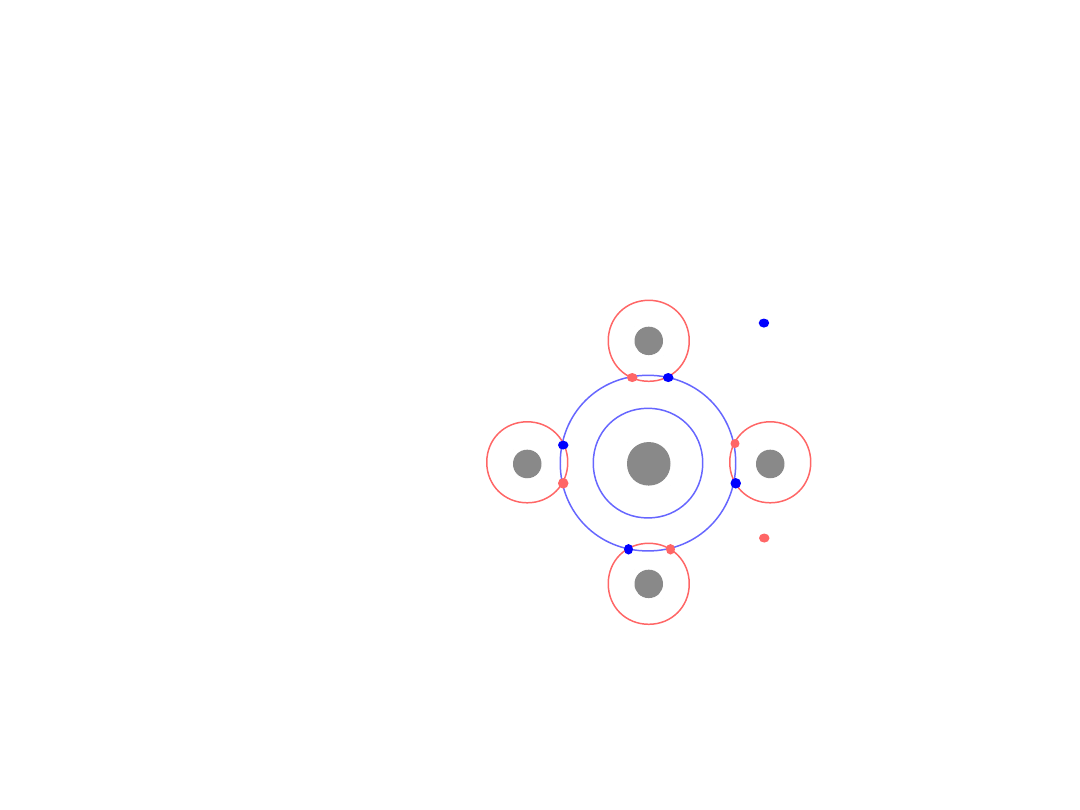
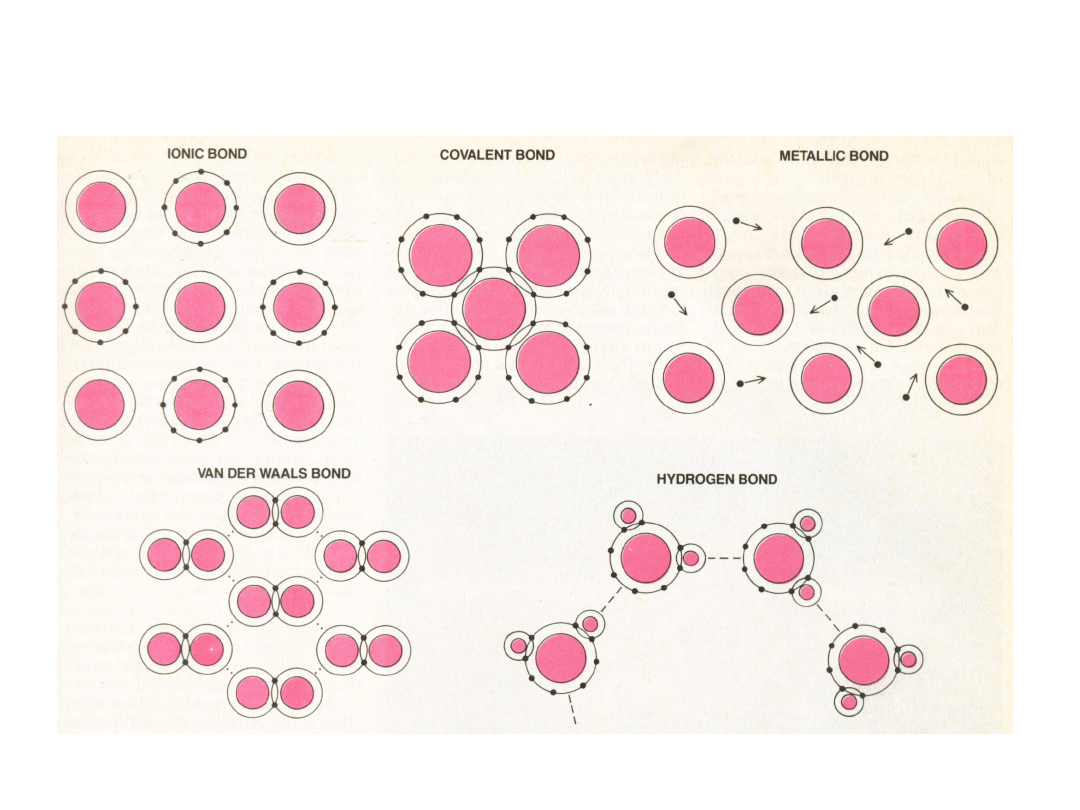
Wiązanie jonowe –
metal
+
nonmetal
dostarcza
przyjmuje
electrony
elektrony
Różne elektroujemności
Np.:
Mg
O
Mg
1s
2
2s
2
2p
6
3s
2
O
1s
2
2s
2
2p
4
[Ne] 3s
2
Mg
2+
1s
2
2s
2
2p
6
O
2-
1s
2
2s
2
2p
6
[Ne]
[Ne]
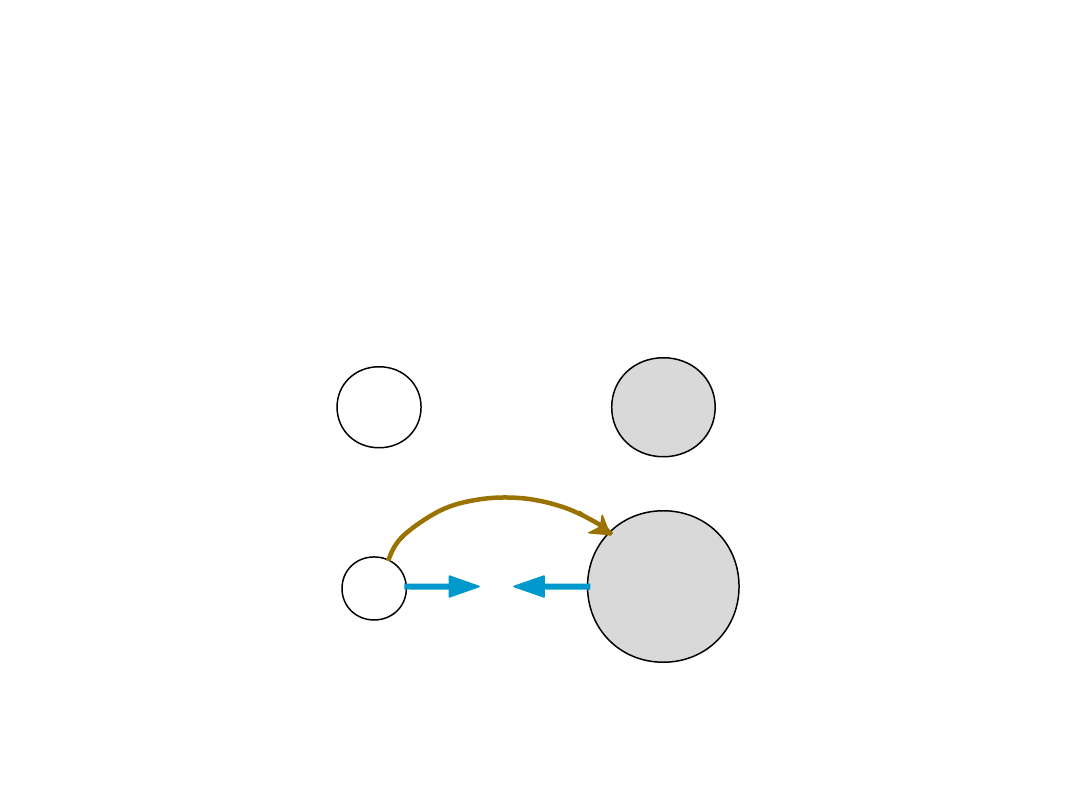
14
• Występuje pomiędzy
+
i
-
jonami
• Wymaga
transferu electronów
• Wymagana duża różnica w elektroujemności
• Przykład:
NaCl
Wiązanie jonowe
Na (metal)
niestabilny
Cl (niemetal)
niestabilny
electron
+
-
Przyciąganie
coulombowskie
Na (kation)
stabilny
Cl (anion)
stabilny
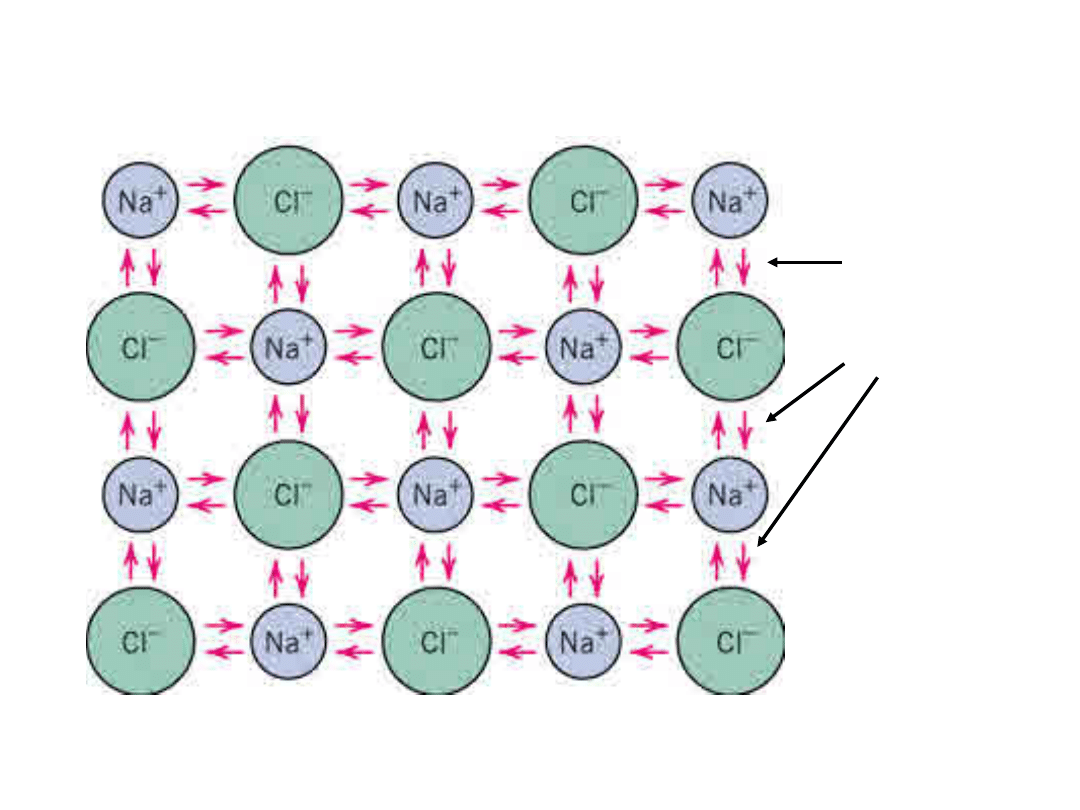
15
Wiązanie jonowe w NaCl
Siły
Coulomb
a
16
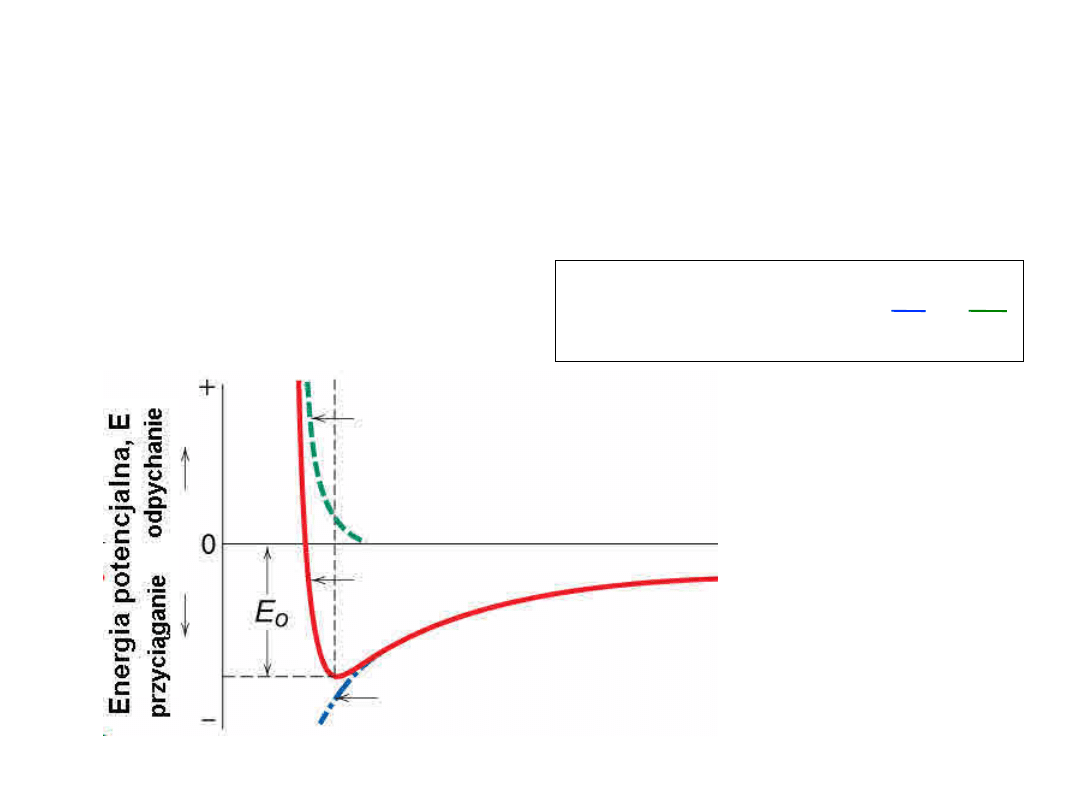
Wiązanie jonowe
Energia – minimum energii, najbardziaj stabilny
układ
– Równowaga pomiędzy
przyciąganiem
a
odpychaniem
r
A
n
r
B
E
N
=
E
A
+
E
R
=
Energia odpychania
E
R
Energia wypadkowa, E
N
Energia przyciągania, EA
Odległość międzyatomowa, r
17
Dominujące wiązanie w
Ceramikach
Przykłady wiązań jonowych
Oddają elektrony
Przyjmują elektrony
NaCl
MgO
CaF
2
CsCl
18
C: ma 4 el. walencyjne e
-
,
potrzebuje jeszcze 4
H: ma 1 el walencyjny e
-
,
potrzebuje jeszcze 1
Elektroujemności są
porównywalne
Wiązanie kowalencyjne
• podobna
elektroujemność
wspólne elektrony
• Wiązania tworzą elektrony z orbitali
s
&
p
• Przykład:
CH
4
Electrony od atomu
węgla
Elektrony od
atomów wodoru
H
H
H
H
C
CH4
Wiązanie kowalencyjne jest
kierunkowe
19
Wiązanie metaliczne
Wiązanie metaliczne
– chmura elektronów nie
związana z żadnym konkretnym jonem
Wiązanie
metaliczne nie ma
charakteru
kierunkowego
20
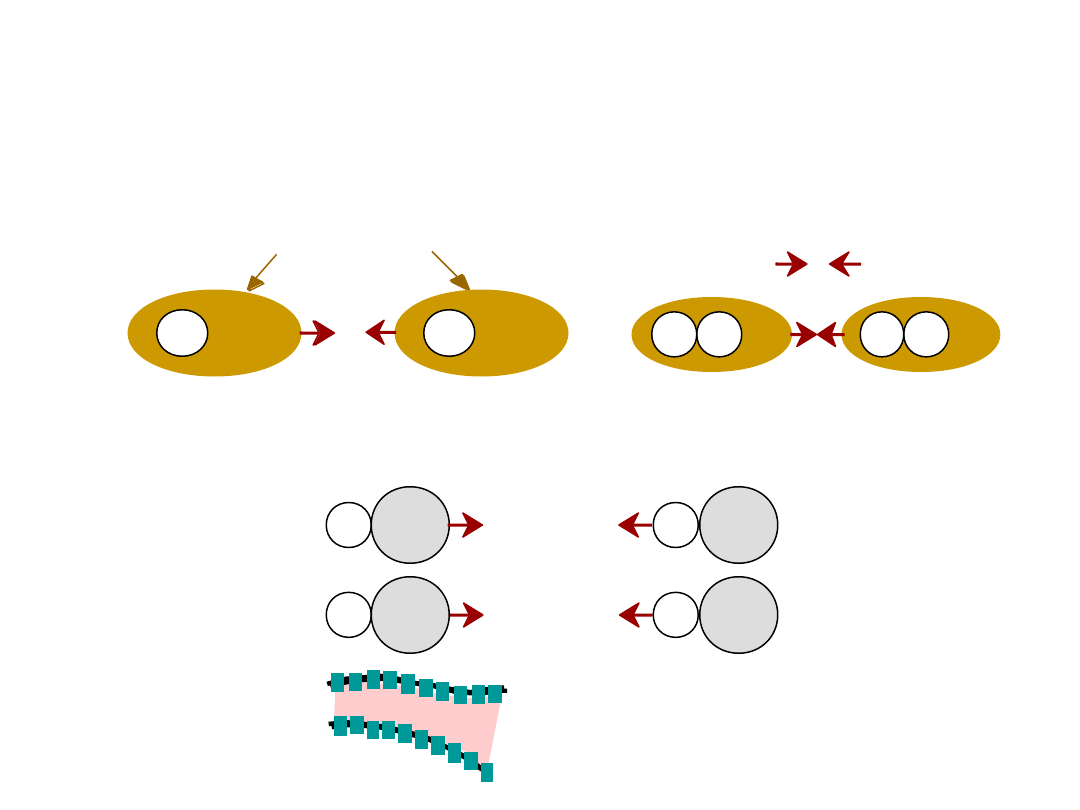
Wynika z oddziaływania pomiędzy
dipolami
•
Dipole trwałe
- cząsteczki
•
Dipole fluktuacyjne
przypadek ogólny:
ciekły HCl
polymer
WIĄZANIA WTÓRNE – Van der
Waalsa
asymetryczna chmura
elektronów
+
-
+
-
wiązanie
wtórne
H
H
H
H
H2
H2
wiązanie
wtórne
np: ciekły
H
2
H Cl
H Cl
wiązanie
wtórne
wiązanie
wtórne
+ -
+
-
Wiązanie w
tórne
21
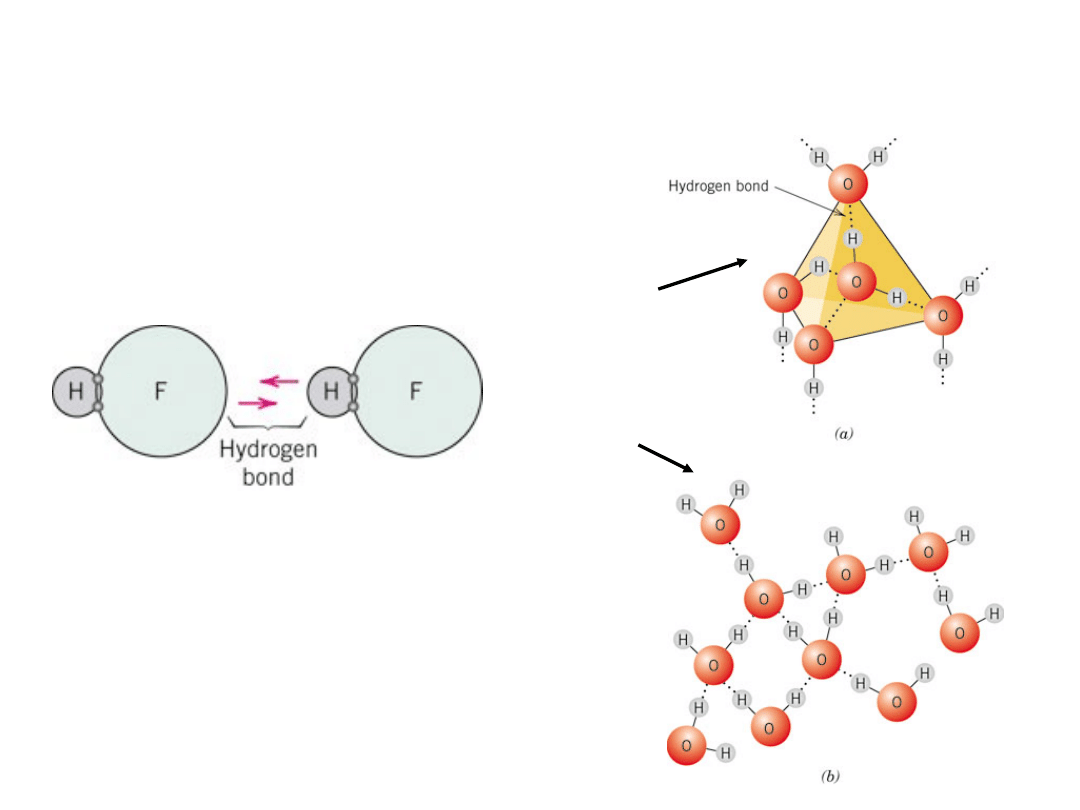
Wiązanie wodorowe
Wiązanie wodorowe w
HF
lód
woda
Szczególny przypadek wiązania
wtórnego, występuje pomiędzy
cząsteczkami zawierającymi
wodór
22
•
Długość wiązania
, r
•
Energia wiązania,
E
o
•
Temperatura topnienia
, T
m
T
m
jest większa, gdy E
o
jest większa
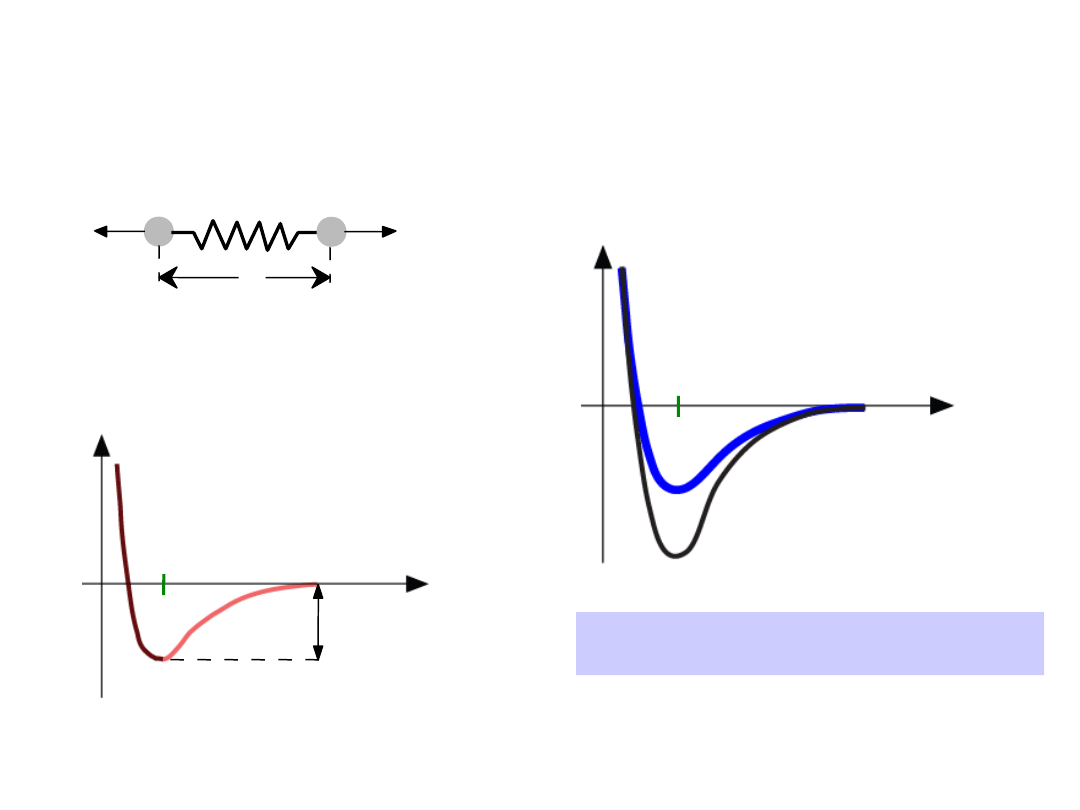
Własności zależne od typu
wiązania: T
m
r
o
r
Energia
r
większa T
m
mniejsza T
m
E
o
=
“energia wiązania”
Energia
r
o
r
Odległość
23
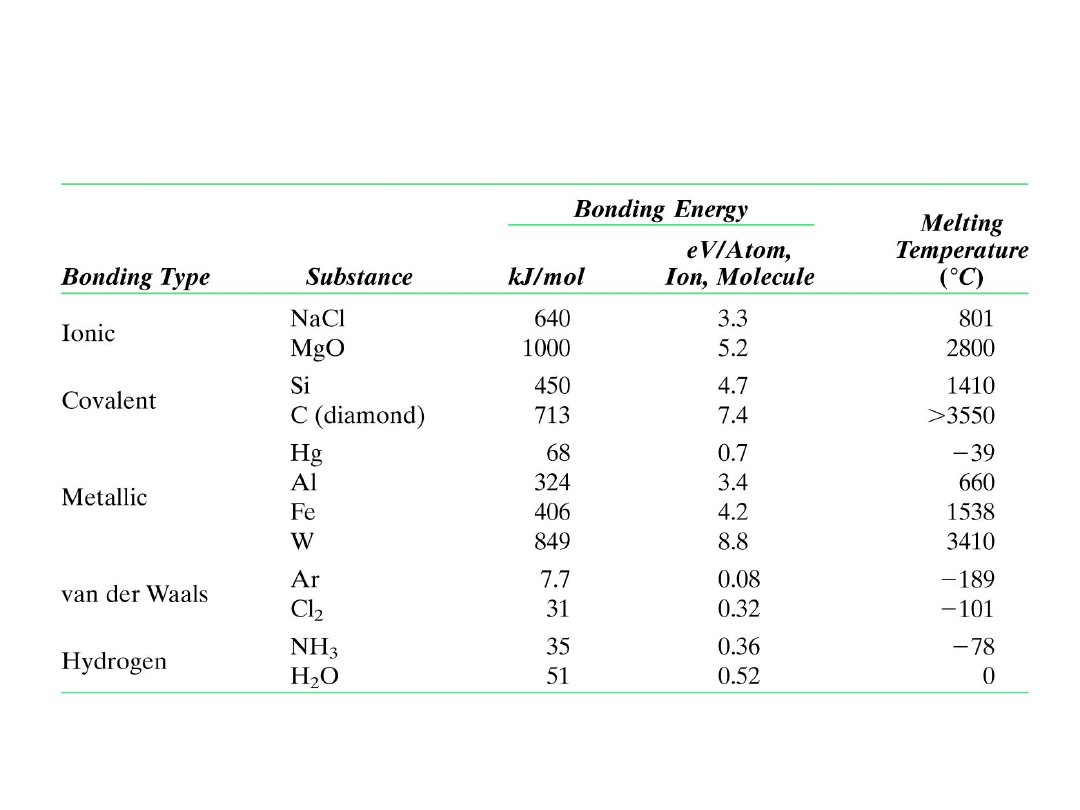
Energie wiązania i temperatury topnienia
dla niektórych substancji
24
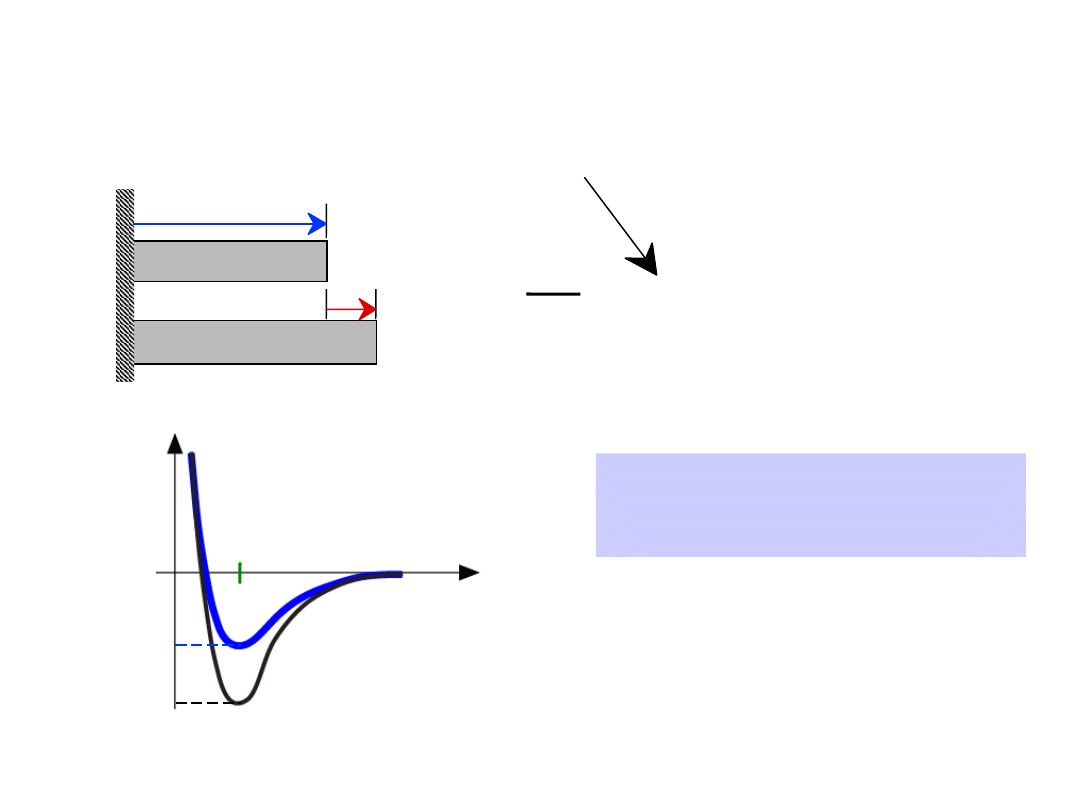
•
współczynnik rozszerzalności cieplnej
,
mniejsze, gdy E
o
jest
mniejsza
Własności zależne od typu
wiązania:
= (
2
T
)
L
T
-
1
L
o
L
długość,
Lo
Temp. T1
Temp. T2
r
o
r
większe
mniejsze
Energia
długość
E
o
E
o
25
Podsumowanie

26
Ceramiki
(jonowe & kowalencyjneg):
Metale
(metaliczne):
Polimery
(kowalencyjne i wtórne):
Duża energia wiązania
wysoka T
m
duża E
mały wsp.
Zmienna energia wiązania
średnia T
m
średnia E
średni
Własności kierunkowe
Wiązania wtórne dominują
niskal T
m
mała E
duży wsp.
Podsumowanie: Wiązania
pierwotne
Wiązanie w
tórne

27
Typ
Jonowe
Kowalencyjne
Metaliczne
Wtórne
Energia
Duża!
Zmienna
Duża-Diament
mała-Bismut
Zmienna
duża-Wolfram
mała-Rtęć
najmniejsza
Uwagi
Bezkierunkowe (
ceramiki
)
Kierunkowe
(półprzewodniki,
ceramiki
łańcuchy polimerowe
)
Bezkierunkowe (
metale
)
Kierunkowe
Między łańcuchami (
polymer
)
Pomiędzy cząsteczkami
Podsumowanie
Document Outline
- WIĄZANIA MIĘDZYATOMOWE I WŁASNOŚCI MATERIAŁÓW
- Struktura Atomowa (Chemia)
- f01_02_pg18
- Model falowy
- Struktura Elektronowa
- Stany Energetyczne Elektronów
- Liczba możliwych stanów elektronów w poszczególnych powłokach i podpowłokach
- PRZEGLĄD PIERWIASTKÓW
- Elektrony
- Konfiguracje Elektronowe
- Układ okresowy pierwiastków
- Elektroujemność
- Wiązanie jonowe – metal + nonmetal
- Wiązanie jonowe
- Wiązanie jonowe w NaCl
- Slide 16
- Przykłady wiązań jonowych
- Wiązanie kowalencyjne
- Wiązanie metaliczne
- WIĄZANIA WTÓRNE – Van der Waalsa
- Wiązanie wodorowe
- Własności zależne od typu wiązania: Tm
- Energie wiązania i temperatury topnienia dla niektórych substancji
- Własności zależne od typu wiązania: a
- Podsumowanie
- Podsumowanie: Wiązania pierwotne
- Slide 27
Wyszukiwarka
Podobne podstrony:
Wyklad 1 Wiazania
Wyklad 4 Wiazania chemiczne w cialach stalych
Wyklad 1 Wiazania
Wyklad wiazania
Wyklad 1 Wiazania
Wyklad 4 Wiazania chemiczne w cialach stalych
Wyklad 8 Wiazania chemiczne
Chemia wyklad I i II (konfiguracja wiÄ…zania Pauling hybrydyzacja wiazania pi i sigma)
Wykład 1, budowa atomu, wiązania chemiczne
18 wyklad Metale wiĄzania pierw przejc [F]7 12 04id 17855 ppt
notatek pl wiazanie peptydowe i jego cechy wyklad
3-Wiązania TECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
wiązania, Studja, Chemia Nieorganiczna, Wykłady, Wykłady pozostałe
4.Teoria wiązań, AGH różne, chemia wykłady
Chemia wyklad I i II (konfiguracja wiÄ…zania Pauling hybrydyzacja wiazania pi i sigma)
Wykład 1, budowa atomu, wiązania chemiczne
18 wyklad Metale wiĄzania pierw przejc [F]7 12 04id 17855 ppt
więcej podobnych podstron