
Materiały pochodzą z Platformy
Edukacyjnej Portalu
www.szkolnictwo.pl
Wszelkie treści i zasoby edukacyjne publikowane na łamach Portalu www.szkolnictwo.pl mogą być wykorzystywane przez jego
Użytkowników
wyłącznie
w zakresie własnego użytku osobistego oraz do użytku w szkołach podczas zajęć dydaktycznych. Kopiowanie, wprowadzanie zmian,
przesyłanie,
publiczne
odtwarzanie
i wszelkie wykorzystywanie tych treści do celów komercyjnych jest niedozwolone. Plik można dowolnie modernizować na potrzeby
własne
oraz
do
wykorzystania
w szkołach podczas zajęć dydaktycznych.

Myślenie bez intuicji jest puste,
intuicja bez myślenia jest
ślepa.
Albert Einstein
Układ okresowy
pierwiastków

Spis treści
•
Ważne pojęcia
•
Trochę historii
•
O ilu pierwiastkach wiemy
•
Wygląd współczesnego układu okresowego
•
Oznaczenia w układzie okresowym
•
Zmiany właściwości pierwiastków w
układzie okresowym
•
Charakterystyka poszczególnych grup
głównych
•
Przykłady
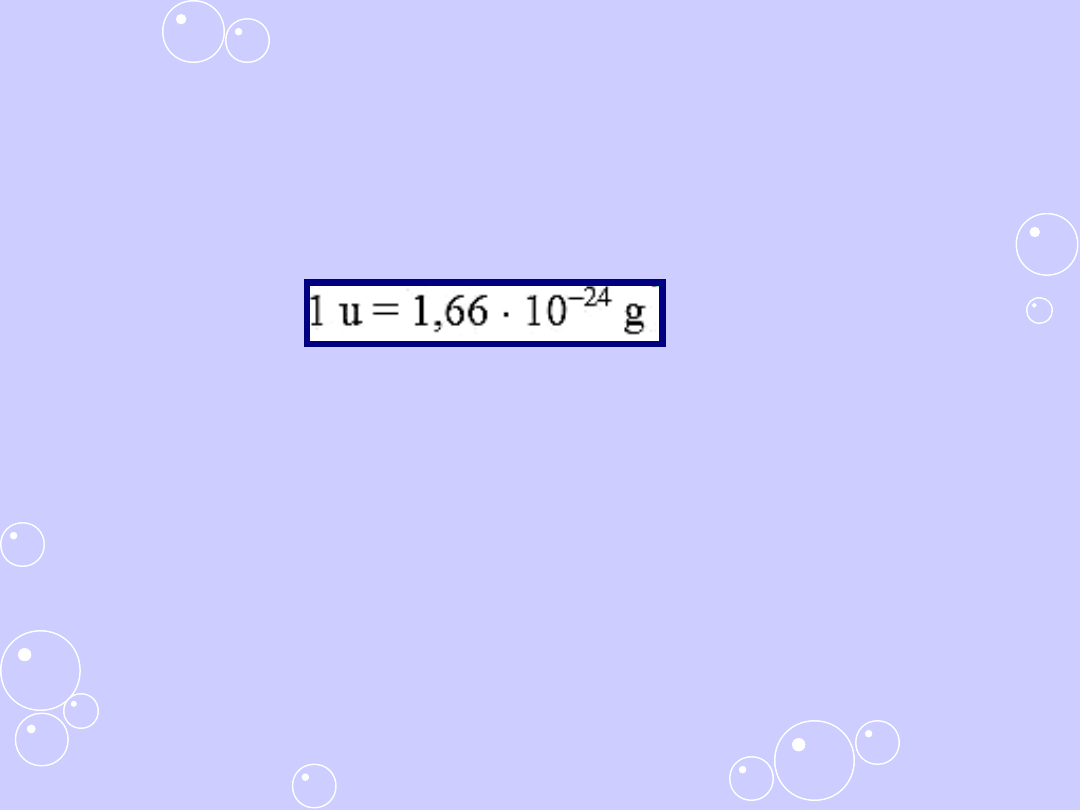
WAŻNE POJĘCIA
•
Atomowa jednostka masy [u]
Atomowa jednostka masy [u] to 1/12 masy atomu izotopu
węgla
12
C
•
Izotopy
Atomy posiadające
tę samą liczbę atomową (liczbę
protonów w jądrze), ale różną liczbę neutronów
•
Liczba atomowa ( Z )
(liczba
porządkowa)
Określa, ile protonów znajduje się w jądrze danego atomu.
Jest także równa liczbie elektronów niezjonizowanego
atomu.

•
Masa atomowa [M
A
]
Liczba określająca ile razy masa jednego reprezentatywnego
atomu danego pierwiastka chemicznego jest większa od 1/12
masy atomu izotopu
12
C, przy czym pod pojęciem
„reprezentatywnego atomu” rozumie się atom o średniej masie
wyliczonej proporcjonalnie ze wszystkich stabilnych izotopów
danego pierwiastka, ze względu na ich występowanie na Ziemi.
•
Powłoka walencyjna
Ostatnia, najdalej odsunięta od jądra powłoka elektronowa
atomu.
Elektrony na niej są najsłabiej związane z atomem i mogą
uczestniczyć w tworzeniu wiązań chemicznych.
W przypadku elektronów znajdujących się niżej zazwyczaj nie
jest to możliwe, choć są od tego liczne wyjątki
.

Liczba masowa (A)
to wartość opisująca liczbę nukleonów (czyli protonów i
neutronów)
w jądrze (w nuklidzie) danego izotopu atomu danego
pierwiastka.
Liczby masowej nie należy mylić z masą atomową
pierwiastka, która wyznaczana jest metodami chemicznymi,
ani też z masą pojedynczego
izotopu.
Nierówności te spowodowane są:
- istnieniem izotopów,
- defektem masy jądra,
- dodatkowym udziałem elektronów w masie
atomowej.
Atomy mające tę samą liczbę masową, ale różną liczbę
protonów, nazywa się izobarami. Oczywiście są to atomy
różnych pierwiastków

Przykłady:
wodór
1
H,
2
H,
3
H
uran
232
U,
233
U,
234
U,
235
U,
236
U,
238
U
Obliczanie ilości neutronów w jądrze
Izotop
64
Ni mający liczbę atomową 28. Chcąc
obliczyć liczbę neutronów, należy odjąć ilość
protonów w jądrze (liczbę atomową) od liczby
masowej (w tym przypadku 64). Liczba
neutronów w izotopie
64
Ni wynosi 36.

TROCHĘ HISTORII
Prawo triad pierwiastków chemicznych
(ok. 1817
r.)
Zostało sformułowane przez J. W. Doebereinera.
Zauważył on, że w kilku grupach zawierających po trzy
pierwiastki, np.: wapń, stront, bar lub chlor, brom, jod,
właściwości fizyczne i chemiczne są podobne i zmieniają się
regularnie ze wzrostem masy atomowej.
•
CIEKAWOSTKA
Przy wyznaczaniu mas atomowych pierwiastków
przyjmowano
w pierwszej połowie XIX wieku masę

Prawo oktaw
(1864r.)
Angielski chemik John A.Newlands, układał
szeregi pierwiastków według wzrastającej
masy atomowej i zauważył, że co ósmy
pierwiastek jest rodzajem powtórzenia tak, jak
co ósma nuta jest powtórzeniem oktawy w
muzyce. Tablica ułożona przez Newlandsa
wykazywała jednak niekonsekwencje,
wynikające po części z niekompletności listy
pierwiastków oraz z błędów w wyznaczaniu ich
mas atomowych.

Następnym uczonym zmagającym się z problemem
systematyzacji pierwiastków był francuski geolog
Alexandre E. Beguyer de
Chancourtois.
On również zestawił znane pierwiastki według ich mas
atomowych i przedstawił je na cylindrycznych wykresach.
Podobne pierwiastki ułożyły się w kolumnach pionowych.
Publikując swoją teorię nie podał on wykresów co
spowodowało, że doniesienie to nie zostało dostrzeżone
przez współczesnych badaczy.
W 1870 rosyjski uczony Dymitrij Mendelejew
opracował
prawo okresowości
, którego
wyrazem był układ okresowy (zwany Tablicą
Mendelejewa)

D.I. Mendelejew zastosował następujące założenia
opracowanej przez siebie klasyfikacji pierwiastków;
•
Pierwiastki uszeregowane zgodnie ze
wzrastającą masą atomową wykazują
powtarzalność (periodyczność) swoich
właściwości (prawo okresowości).
• W tabeli układu okresowego przewidziane były miejsca
dla prawdopodobnie istniejących, a nie odkrytych
jeszcze pierwiastków. Medelejew opisał ich właściwości.
• W kilku miejscach układu przestawiono kolejność
pierwiastków, uznając podobieństwo właściwości
pierwiastków w tej samej grupie za ważniejsze od ich
wzrastającej masy atomowej.
Puste miejsca pozostawione były dla
odkrytych później;
skandu (Sc), galu (Ga), germanu (Ge), itru
(Y), technetu (Tc), indu (In), ceru (Ce) i renu
(Re).

Pasjans Mendelejewa
Mendelejew dokonał swego odkrycia usiłując po raz kolejny
„ułożyć pasjansa" kartami, na których wypisał masy
atomowe i inne właściwości znanych wówczas 63
pierwiastków.
Zdobył się on przy tym na śmiały krok, ogłaszając, że
psujące schemat trzy nieregularności znikną, jeśli w
istniejącym układzie pierwiastków pozostawi się trzy wolne
miejsca w których powinny znaleźć się nie odkryte jeszcze
pierwiastki.
Tak więc, Mendelejew nie tylko dokonał systematyzacji
znanych w jego czasach pierwiastków chemicznych, ale
także przewidział odkrycie kolejnych - a co więcej,
przewidział ich właściwości fizyczne i chemiczne.

O ilu pierwiastkach wiemy teraz ?
Do 2008 r. udowodniono istnienie 117 pierwiastków
chemicznych
Pierwiastki o liczbach atomowych od 1 do 111 zostały
oficjalnie uznane przez Międzynarodową Unię Chemii
Czystej i Stosowanej (IUPAC) i nadano im oficjalne
nazwy oraz skróty.
Na temat istnienia pierwiastków o liczbach atomowych
112, 113,
114, 115, 116 i 118 istnieją spory naukowe i
dlatego jak dotąd nie mają one oficjalnych nazw i
skrótów.
Pierwiastek 117 jak dotąd nie został otrzymany.

Oprócz nazw pierwiastków uznanych oficjalnie przez IUPAC
w obiegu są też nazwy nieoficjalne. Dotyczy to głównie
pierwiastków otrzymanych sztucznie przy pomocy
technik rozwiniętych przez fizykę jądrową.
Naturalnie na Ziemi występują 92 pierwiastki.
Pozostałe zostały otrzymane sztucznie.
Pierwiastki o liczbie atomowej powyżej 82 są niestabilne.
Ulegają rozpadowi promieniotwórczemu w zauważalnym
eksperymentalnie tempie. Oprócz tego niestabilne są
także pierwiastki 43 (technet) i 61 (promet), które
zostały otrzymane sztucznie.
Wszystkie pierwiastki o liczbie atomowej powyżej 94 nie
występują naturalnie.

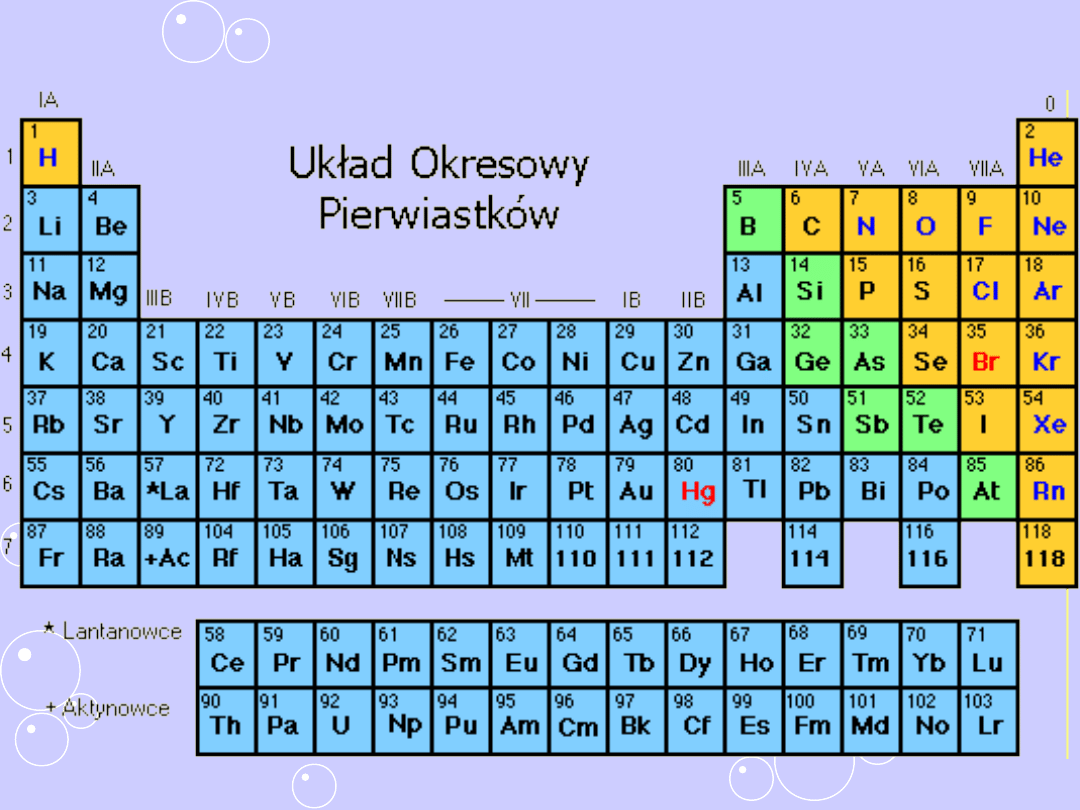
Współczesny układ okresowy
Współczesny układ okresowy zbudowany jest:
- z kolumn pionowych, zwanych grupami ( 18 grup)
( 8 głównych IA – VIII A ( 0) )
- szeregów poziomych, tzw. okresów ( 7 okresów)
Najnowsze zalecenia Komisji Nomenklatury IUPAC każą
numerować grupy kolejnymi liczbami arabskimi od 1 do
18.
Nazwę grupy tworzy się od nazwy pierwiastka, który
znajduje się na początku grupy (pierwsza grupa
przyjmuje swoją nazwę od litu, a nie od wodoru i zwana
jest litowcami, druga grupa to berylowce itd.).

Pierwiastki uszeregowane są według wzrastających liczb
atomowych (Z)
Każdy następny od poprzedniego różni się o jeden
proton w jądrze atomu
Pierwiastki danej grupy stanowią niejako wspólną
rodzinę, bowiem posiadają podobne właściwości
fizyczne i chemiczne
Numer okresu, w którym leży dany pierwiastek
odpowiada liczbie powłok elektronowych w jego atomie.
W atomach pierwiastków grup głównych liczba
elektronów na ostatniej powłoce jest równa liczbie
jedności w numerze grupy
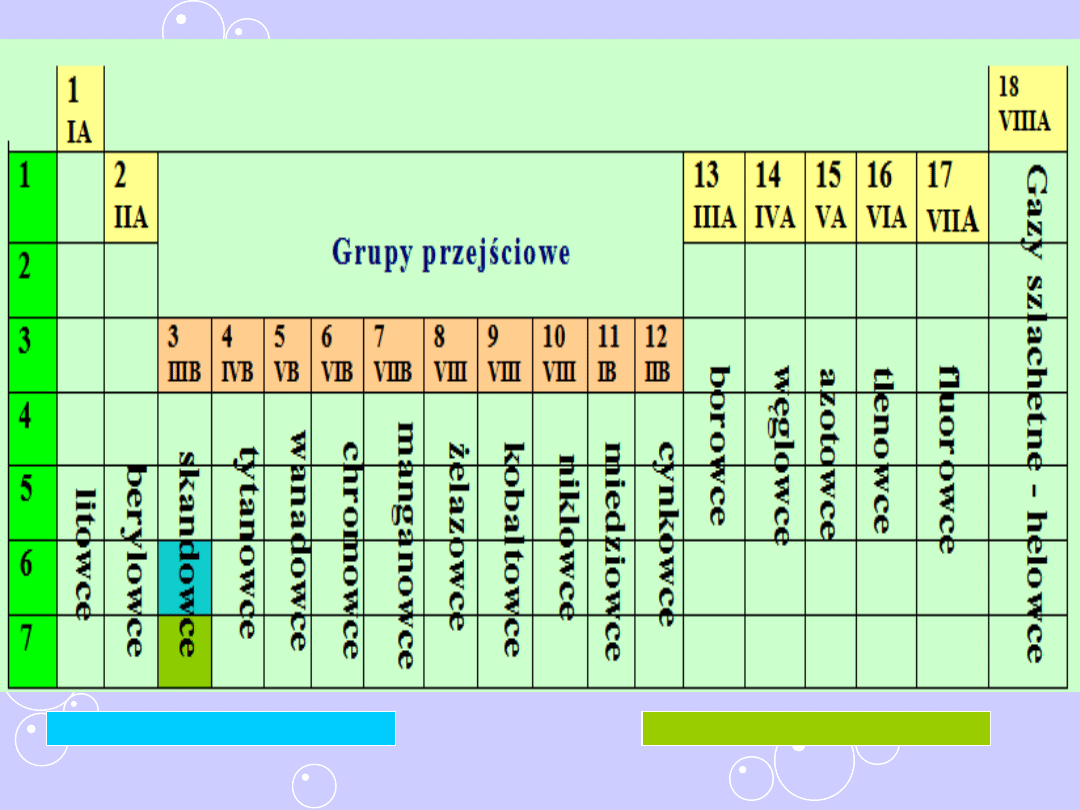
Atomy pierwiastków grup pobocznych, czyli od 3 do 12,
mają na ostatniej powłoce 1 lub 2 elektrony
Lantanowce
Aktynowce

Oznaczenia w układzie okresowym
Numery wierszy od 1 – 7 określają numer okresu
Numery kolumn od 1 – 18 określają numer grupy
Z
A
M
Symbol
pierwiast
ka
Liczba
atomowa
Masa
atomowa

Grupy główne
1
2
13
14
15
16
17
18
IA
IIA
IIIA
IVA
VA
VIA
VIIA
VIII A
Grupy poboczne
3
4
5
6
7
8
9
10
11
12
IIIB
IVB
VB
VIB
VIIB VIIIB VIIIB VIIIB
IB
IIB

Zmiany właściwości pierwiastków i ich
związków
w układzie okresowym
Wzrost właściwości kwasowych
Wzrost właściwości zasadowych

Charakterystyka poszczególnych grup
głównych
LITOWCE
Do pierwszej grupy układu okresowego, tzw. litowców,
zaliczane są następujące pierwiastki:
lit (Li), sód (Na), potas (K), rubid (Rb), cez (Cs) oraz
nietrwały promieniotwórczy frans (Fr).
Litowce występują w przyrodzie jedynie w stanie
związanym. Wszystkie litowce są metalami.
Sód i potas są dość powszechnymi składnikami litosfery,
ale ze względu na dużą reaktywność chemiczną
pierwiastki tej grupy nie występują w przyrodzie w
stanie wolnym lecz wyłącznie w postaci związków
najczęściej jako chlorki, siarczany, węglany, rzadziej
azotany i fosforany
W związkach wykazują zawsze wartościowość „1” równą
numerowi grupy IA

BERYLOWCE
Do metali drugiej grupy układu okresowego berylowców
należą: beryl (Be), magnez (Mg), wapń (Ca), stront (Sr),
bar (Ba) i promieniotwórczy rad (Ra).
Metale grupy IIA spotykane są w przyrodzie wyłącznie w
związkach, w których są dwuwartościowe
BOROWCE
Do grupy borowców zalicza się następujące pierwiastki:
glin (Al), gal (Ga), ind (In), tal (Tl).
Do grupy 13 należy również bor, który jest niemetalem,
a ściślej mówiąc półmetalem
W przyrodzie w stanie wolnym nie występują. Max
wartościowość wynosi 3

WĘGLOWCE
Do pierwiastków czternastej grupy układu okresowego
należą: węgiel (C), krzem (Si), german (Ge), cyna (Sn),
ołów (Pb).
Wszystkie węglowce mogą tworzyć wiązania
kowalencyjne. W grupie ze wzrostem masy atomowej
zmienia się charakter pierwiastków.
Węgiel jest typowym niemetalem, natomiast cyna i ołów
są typowymi metalami. W przyrodzie w stanie wolnym
występuje tylko węgiel.
Maksymalna wartościowość wynosi IV
AZOTOWCE
Do 15 grupy układu okresowego, tzw. azotowców należą:
azot (N), fosfor (P), arsen (As), antymon (Sb) i bizmut (Bi).
W przyrodzie występują w stanie wolnym (oprócz fosforu).
Azot i fosfor są typowymi niemetalami, gdyż tworzą tylko
tlenki kwasowe. Arsen i antymon są pierwiastkami
półmetalicznymi, natomiast bizmut jest typowym metalem
i tworzy tylko tlenki zasadowe.

TLENOWCE
Do 16 grupy układu okresowego tzw. grupy tlenowców
należą: tlen (O), siarka (S), selen (Se), tellur (Te) oraz
polon (Po).
Wszystkie występują w przyrodzie w stanie wolnym i w
związkach, w ilościach malejących wraz ze wzrostem
masy atomowej. Są dość silnymi utleniaczami,
najsilniejszym jest oczywiście tlen
FLUOROWCE
Wszystkie fluorowce są niemetalami. Fluor i chlor są w
zwykłych warunkach żółto zielonymi gazami o
charakterystycznej, ostrej woni; brom jest
ciemnobrunatną lotną cieczą, a jod ciałem stałym o
metalicznym połysku.
Żaden z fluorowców nie występuje w stanie wolnym
Astat nie występuje w przyrodzie; jest pierwiastkiem
promieniotwórczym o krótkim okresie półtrwania.

HELOWCE
Gazy szlachetne (helowce) leżą w 18 grupie układu
okresowego pierwiastków. Należą do niej: hel (He), neon
(Ne), argon (Ar), krypton (Kr), ksenon (Xe), oraz radon
(Ra)
Helowce są bezbarwnymi, bezwonnymi i biernymi
chemicznie gazami. W odróżnieniu od innych
pierwiastków gazowych występują w cząsteczkach
jednoatomowych (ich atomy nie łączą się w cząsteczki)
Numer grupy głównej informuje o maksymalnej
wartościowości pierwiastków wchodzących w różne
związki chemiczne. Pierwiastki tych grup najczęściej
przyjmują wartościowość równą nr A lub (8 – nr A)
Pierwiastki zapisane w grupach, oznaczone liczbą
parzystą, przyjmują w związkach wartościowość
parzystą, natomiast pierwiastki znajdujące się w grupach
o liczbach nieparzystych mają wartościowość
nieparzystą. Istnieje jednak kilka wyjątków od tej reguły

• Symbol Zn – nazwa polska cynk, nazwa łacińska zincum
• Liczba atomowa (porządkowa) - 30, więc jest 30
pierwiastkiem w UO
• Masa atomowa - 65,37( występują izotopy tego
pierwiastka)
• Znajdujemy w tablicy i odczytujemy:
• Grupa – IIB ( 12) pierwiastek należący do grupy
pobocznej (cynkowce), wartościowość II, metal
• Okres- 4
Zn
Zn
30
65,37

Korzystając z układu okresowego omów
pierwiastek o liczbie atomowej Z = 35
Z = 35, więc jest to 35 pierwiastek w UO. Atom tego
pierwiastka posiada 35 protonów w jądrze.
Odczytujmy z tablicy
Symbol: Br
Nazwa: brom (pl) bromum (łacińska)
Masa atomowa: 79,9 [u] ( istnieją izotopy – liczba ułamkowa)
Grupa: VIIA (17) , rodzina fluorowców, niemetal, ilość
elektronów na ostatniej powłoce 7,
wartościowość – 7, 8 – VII = 1
Okres: 4; ma więc 4 powłoki elektronowe
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
Wyszukiwarka
Podobne podstrony:
Układ okresowy pierwiastków(1), nauka, fizyka, FIZYKA-ZBIÓR MATERIAŁÓW
uklad okresowy pierwiastkow, Dokumenty Textowe, Nauka
UKŁAD OKRESOWY PIERWIASTKÓW
36 Atomy wieloelektronowe, układ okresowy pierwiastków
7 układ okresowy pierwiastków, wiązania chemiczne
Walkowiak, Chemia ogólna, Układ okresowy pierwiastków
Wyklad 6. Uklad okresowy pierwiastkow, pwr biotechnologia(I stopień), I semestr, Chemia ogólna
Powt. Dz. II, Powtórzenie wiadomości z działu II: Układ okresowy pierwiastków
UKŁAD OKRESOWY PIERWIASTKÓW (WERSJA SKRÓCONA) kolor, Dokumenty - chemia
Układ okresowy pierwiastków2, Chemia
Współczesny Układ Okresowy Pierwiastków, Chemia
uklad-okresowy-pierwiastkow
88 Uklad okresowy pierwiastkow 2
Uklad okresowy pierwiastkow a budowa atomu
Układ okresowy pierwiastków chemicznych, szkoła. hist -gosp
Chemia Wykład 6 Układ Okresowy Pierwiastków
więcej podobnych podstron