
. Ogniwa paliwowe - podstawy technologii .......................................................................2
Cykl energetyczny słoneczno- wodorowy .....................................................................2
1.2. Energia słoneczna..................................................................................................3
1.2. Elektrolizery PEM (z elektrolitem z membrany polimerowej) .................................6
1.4. Magazynowanie wodoru.........................................................................................7
1.5. Historia technologii ogniw paliwowych ...................................................................8
1.6. Typy ogniw paliwowych..........................................................................................8
1.7. Ogniwa paliwowe PEM.........................................................................................11
1.8. Bateria ogniw paliwowych ....................................................................................12
1.9. Bezpo
ś
rednie metanolowe ogniwo paliwowe ...................................................12
1.10. Zastosowania przeno
ś
ne................................................................................13
1.11. Zastosowania ruchome...................................................................................13
1.12. Zastosowania stacjonarne ..............................................................................14
2.1. Charakterystyka pr
ą
dowo-napi
ę
ciowa, krzywa mocy i sprawno
ść
modułu
słonecznego ....................................................................................................................16
2.2. Charakterystyka pr
ą
dowo-napi
ę
ciowa elektrolizera PEM.................................20
2.3. Sprawno
ść
energetyczna i sprawno
ść
Faradaya elektrolizera PEM ................23
2.4. Charakterystyka napi
ę
ciowo-pr
ą
dowa i krzywa mocy ogniwa paliwowego PEM
........................................................................................................................................27
2.5. Sprawno
ść
energetyczna i sprawno
ść
Faradaya ogniwa paliwowego PEM ....31
2.6. Charakterystyki pr
ą
dowo napi
ę
ciowe bezpo
ś
redniego ogniwa metanolowego
(DMFC) ...........................................................................................................................36
Arkusze
ć
wicze
ń
.............................................................................................................40
3.1 Informacje do pracy ...........................................................................................41
3.1.1. Cykl energetyczny słoneczno-wodorowy .......................................................41
3.1.2. Wodór ............................................................................................................42
3.1.3. Ogniwa paliwowe...........................................................................................44
3.1.4. Elektrolizer .....................................................................................................45
3.2. Rozwi
ą
zania arkuszy studenckich ....................................................................47
3.2.1. Cykl energetyczny słoneczno-wodorowy .......................................................47
3.2.2. Wodór ............................................................................................................48
3.2.3. Ogniwa paliwowe...........................................................................................49
3.2.4. Elektrolizery ...................................................................................................50
2
. Ogniwa paliwowe - podstawy
technologii
Cykl energetyczny słoneczno- wodorowy
Zmniejszaj
ą
ce si
ę
zasoby surowców energetycznych, rosn
ą
ce zanieczyszczenie
ś
rodowiska i zwi
ę
kszaj
ą
ce si
ę
zapotrzebowanie na energi
ę
zmuszaj
ą
do rozwa
ż
enia
struktury naszego systemu zaopatrzenia w energi
ę
.
2000
2050
2100
2150
2200
2250
uran
gaz
ziemny
ropa
naftowa
w
ę
giel
Nasze
globalne
zasoby
paliw kopalnych i j
ą
drowych
s
ą
ograniczone
Rys. 1. przewidywana dost
ę
pno
ść
paliw kopalnych i j
ą
drowych
(w oparciu o obecne zu
ż
ycie)
Niezb
ę
dne zmiany w naszym systemie zaopatrzenia w energi
ę
b
ę
d
ą
mo
ż
liwe je
ś
li
b
ę
dziemy mogli wykorzysta
ć
energi
ę
odnawialn
ą
jak na przykład słoneczn
ą
, wiatru lub wody
jako podstawow
ą
cz
ęść
rynku energii.
Problemem z którym si
ę
spotykamy przy wykorzystaniu ogniw słonecznych lub
elektrowni wiatrowych do produkcji energii elektrycznej polega na tym,
ż
e zapotrzebowanie
na energi
ę
elektryczn
ą
i mo
ż
liwo
ść
jej produkcji nie musz
ą
si
ę
pokrywa
ć
si
ę
w czasie. Na
przykład ogniwa słoneczne b
ę
d
ą
dostarczały energi
ę
w ci
ą
gu dnia a ta energia b
ę
dzie
potrzebna do o
ś
wietlenia w nocy. Podobnie elektrownia wiatrowa b
ę
dzie dostarcza
ć
energi
ę
w czasie gdy wieje wiatr. W takich przypadkach gdy mo
ż
liwo
ś
ci produkcji nie pokrywaj
ą
si
ę
z
zapotrzebowaniem w czasie lub w miejscu, konieczna jest mo
ż
liwo
ść
wygodnego
magazynowania i przesyłania energii. Tak
ą
mo
ż
liwo
ść
daje wodór. Kombinacja
wykorzystania energii słonecznej do produkcji energii elektrycznej i wykorzystania wodoru
jako no
ś
nika energii do jej magazynowania i przesyłania jest nazywana cyklem słoneczno-
wodorowym. W czasie gdy ogniwa słoneczne i elektrownie wiatrowe produkuj
ą
wi
ę
cej energii
elektrycznej ni
ż
wynosi zapotrzebowanie, zb
ę
dna energia jest wykorzystywana do produkcji

3
wodoru (Rys 2.). Proces ten zachodzi w elektrolizerach, w których woda jest rozdzielana na
wodór i tlen. Wodór (i potencjalnie tlen) mo
ż
e by
ć
magazynowany i transportowany. Energi
ę
elektryczn
ą
z wodoru produkuje si
ę
w ogniwach paliwowych. W czasie reakcji wodór ł
ą
czy
si
ę
z tlenem. Produktami s
ą
woda, energia elektryczna i cieplna. Wykorzystanie wodoru w
tym cyklu pozwala na produkcj
ę
energii elektrycznej w dogodnym miejscu i czasie.
1.2. Energia słoneczna
Energie odnawialne: co to jest i jak je wykorzystywa
ć
.
Energie odnawialne to
ź
ródła energii które s
ą
w sposób ci
ą
gły odnawiane w naturalnych
procesach zachodz
ą
cych w ludzkiej skali czasowej. W przeciwie
ń
stwie do tego , paliwa
kopalne (w
ę
giel, gaz ziemny, ropa naftowa) potrzebuj
ą
milionów lat procesów geologicznych
do powstania. Energie odnawialne z drugiej strony s
ą
rzeczywi
ś
cie niewyczerpywalne.
Do odnawialnych
ź
ródeł energii mo
ż
na zaliczy
ć
:
Energi
ę
słoneczn
ą
Energia słoneczna otacza nas w ró
ż
nych formach i mo
ż
e by
ć
wykorzystana w
ró
ż
norodny sposób:
•
promieniowanie słoneczne: urz
ą
dzenia fotovoltaiczne, ogrzewanie słoneczne,
•
ruch atmosfery: energia wiatru
•
parowanie, opady: energia hydroelektryczna
•
biomasa: np. biopaliwa, biogaz
Obecnie najcz
ęś
ciej wykorzystywanymi urz
ą
dzeniami korzystaj
ą
cymi z energii
odnawialnej s
ą
ogniwa słoneczne, elektrownie wiatrowe i elektrownie wodne.
Energia pływów (grawitacyjne przyci
ą
ganie Sło
ń
ca, Ziemi i Ksi
ęż
yca).
Elektrownie pływowe wykorzystuj
ą
energi
ę
pływów. Woda jest magazynowana w czasie
przypływu, i wykorzystywana do produkcji energii w turbinach w czasie odpływu.
Energia geotermalna (radioaktywno
ść
i ciepło wn
ę
trza Ziemi)
Elektrownie geotermalne wykorzystuj
ą
ciepło wn
ę
trza Ziemi. Ciepło mo
ż
e by
ć
wykorzystywane bezpo
ś
rednio, lub przetwarzane na energi
ę
elektryczn
ą
.
Systemy fotovoltaiczne przetwarzaj
ą
promieniowanie słoneczne bezpo
ś
rednio w
energi
ę
elektryczn
ą
.
Podstaw
ą
tej technologii s
ą
materiały półprzewodnikowe takie jak krzem.
Typowe ogniwo słoneczne składa si
ę
z dwóch ró
ż
nie domieszkowanych
półprzewodników. Domieszkowanie jest to kontrolowane wprowadzanie zanieczyszcze
ń
do
materiału bazowego. W przypadku czystego kryształu półprzewodnika (np. krzemu)
zast
ę
puje si
ę
niektóre atomy w siatce krystalicznej pierwiastkami maj
ą
cymi o jeden elektron
walencyjny wi
ę
cej lub o jeden elektron walencyjny mniej ni
ż
materiał podstawowy (elektrony

4
walencyjne okre
ś
laj
ą
zachowanie chemiczne materiału, s
ą
one umiejscowione na
zewn
ę
trznej powłoce elektronowej atomu). Pierwiastki półprzewodz
ą
ce maj
ą
cztery elektrony
walencyjne z których wszystkie s
ą
wykorzystane w wi
ą
zaniach w siatce krystalicznej. Je
ś
li
materiał domieszki ma pi
ęć
elektronów walencyjnych, jeden z nich b
ę
dzie dodatkowym,
słabo zwi
ą
zanym z atomem domieszkuj
ą
cym. „Wolne„ elektrony mog
ą
porusza
ć
si
ę
łatwo w
siatce i s
ą
odpowiedzialne za zwi
ę
kszenie przewodno
ś
ci. Poniewa
ż
maj
ą
one ładunek
ujemny, materiał domieszkowany w ten sposób jest nazywany półprzewodnikiem typu „n”.
Je
ś
li z kolei materiał domieszkuj
ą
cy ma tylko trzy elektrony walencyjne, siatka krystaliczna
b
ę
dzie miała niedomiar elektronów to znaczy b
ę
dzie miała jedn
ą
„dziur
ę
” (ładunek dodatni)
na atom domieszki. Podobnie do powy
ż
szych wolnych elektronów dziury mog
ą
si
ę
łatwo
przemieszcza
ć
w siatce zwi
ę
kszaj
ą
c ponownie przewodno
ść
. Poniewa
ż
w tym przypadku
wolne ładunki s
ą
dodatnie, ten rodzaj półprzewodnika jest nazywany półprzewodnikiem typu
„p”.
Je
ś
li półprzewodnik typu n zostanie poł
ą
czony z półprzewodnikiem typu p, powstaje
zł
ą
cze p-n. Ró
ż
nice koncentracji dziur i wolnych elektronów pomi
ę
dzy rejonami n i p,
powoduj
ą
powstanie dyfuzyjnego: elektrony przepływaj
ą
z obszaru n do obszaru p i
wypełniaj
ą
dziury. To tworzy region który jest prawie pozbawiony wolnych no
ś
ników ładunku
i dlatego jest nazywany warstw
ą
zubo
ż
on
ą
. W warstwie zubo
ż
onej po stronie n jest dodatni
ładunek netto, a po stronie p ujemny co powoduje powstanie pola elektrycznego
zapobiegaj
ą
cego dalszemu przepływowi elektronów. Im wi
ę
cej elektronów przepłynie ze
strony n na stron
ę
p tym silniejsze jest to pole. Prowadzi to do ustalenia si
ę
stanu
równowagi w którym przepływ elektronów ustaje. Ró
ż
nica potencjałów w polu
równowagowym jest nazywana napi
ę
ciem dyfuzji. To napi
ę
cie nie mo
ż
e by
ć
wykorzystane w
zewn
ę
trznym obwodzie. Jednak
ż
e gdy
ś
wiatło pada na ogniwo słoneczne, równowaga
zostaje zaburzona i tak zwany wewn
ę
trzny efekt fotowoltaiczny powoduje powstanie
dodatkowych no
ś
ników ładunku mog
ą
cych porusza
ć
si
ę
w polu elektrycznym warstwy
zubo
ż
onej.
Dziury poruszaj
ą
si
ę
w kierunku regionu p a elektrony w kierunku n, powoduj
ą
c
powstanie zewn
ę
trznego napi
ę
cia (biegu jałowego) ogniwa. Napi
ę
cie biegu jałowago ogniwa
słonecznego zale
ż
y od materiału a nie od jego powierzchni. Fotoogniwa krzemowe maj
ą
napi
ę
cie biegu jałowego około 0,5 V. Wi
ę
ksze napi
ę
cia mo
ż
na uzyska
ć
ł
ą
cz
ą
c ogniwa
szeregowo.
Pr
ą
d dostarczany przez fotoogniwo zale
ż
y od nat
ęż
enia
ś
wiatła padaj
ą
cego na nie.
Równoległe ł
ą
czenie ogniw pozwala na uzyskanie wi
ę
kszego pr
ą
du.
Moc ogniwa zale
ż
y nie tylko od samego ogniwa ale równie
ż
od przył
ą
czonego
obci
ąż
enia elektrycznego. Punkt mocy maksymalnej mo
ż
na okre
ś
li
ć
z charakterystyki
napi
ę
ciowo-pr
ą
dowej ogniwa (rozdział 2.1).

5
Sprawno
ść
fotoogniwa zale
ż
y od jego temperatury i maleje w miar
ę
jej wzrostu..
Najcz
ęś
ciej u
ż
ywanym do budowy fotoogniwa półprzewodnikiem jest krzem w ró
ż
nych
postaciach:
1. krzem monokrystaliczny (sprawno
ść
ogniwa ok. 14-17%)
2. krzem polikrystaliczny (sprawno
ść
ogniwa ok. 13-15%)
3. krzem amorficzny (sprawno
ść
ogniwa ok. 5-7%)
Energia wiatru
Energia wiatru jest u
ż
ywana od wieków. Wiatraki przekształcały energi
ę
wiatru w
energi
ę
mechaniczn
ą
wykorzystywan
ą
do celów takich jak mielenie zbo
ż
a.
Obecnie energia wiatru jest wykorzystywana do produkcji energii elektrycznej w
elektrowniach wiatrowych.
Podstawowymi składnikami elektrowni wiatrowej s
ą
:
Fundament
zapewnia posadowienie elektrowni w gruncie
Maszt
wykonywany typowo ze stali lub
ż
elbetonu, obecnie o wysoko
ś
ci od 10 do
120m, w przyszło
ś
ci planowane s
ą
wy
ż
sze maszty,
Gondola
konstrukcja mieszcz
ą
ca generator, przekładni
ę
i inne cz
ęś
ci elektrowni,
Wirnik
przekształca energi
ę
wiatru w mechaniczn
ą
energi
ę
obrotow
ą
. Wał wirnika
nap
ę
dza przekładni
ę
,
Przekładnia
zmienia wolne obroty wirnika na szybkie obroty wymagane przez
generator. Niektóre systemy wiatrowe nie wymagaj
ą
zwi
ę
kszenia pr
ę
dko
ś
ci
obrotowej dla generatora,
Generator
przetwarza energi
ę
mechaniczn
ą
w energi
ę
elektryczn
ą
.
Komercyjne elektrownie wiatrowe maj
ą
sprawno
ść
całkowit
ą
pomi
ę
dzy 35% a 43%.
Najwi
ę
ksze straty energii wyst
ę
puj
ą
przy zamianie energii wiatru na energi
ę
obrotow
ą
wirnika (straty aerodynamiczne), sprawno
ść
wynosi ok. 45-50%. Straty zwi
ą
zane z
przekładni
ą
wynosz
ą
2,5% a elektryczne ok. 5%.
Energia wody
Elektrownie wodne przetwarzaj
ą
energi
ę
kinetyczn
ą
wody w energi
ę
elektryczn
ą
.
Typowo elektrownia wodna jest budowana w poł
ą
czeniu z tam
ą
na rzece. Tama
podnosi poziom wody w powstałym zbiorniku.
Woda przepływaj
ą
c rurami ze zbiornika do elektrowni zamienia swoj
ą
energi
ę
potencjaln
ą
na kinetyczn
ą
, która jest z kolei wykorzystywana do nap
ę
dzania turbiny. Turbina
przekształca energi
ę
kinetyczn
ą
wody w energi
ę
mechaniczn
ą
. W ko
ń
cu generator
przekształca t
ę
energi
ę
w energi
ę
elektryczn
ą
.
Elektrownie wodne osi
ą
gaj
ą
sprawno
ś
ci 80 – 90%.
Moc systemu wyznacza wzór:

6
η
ρ
⋅
⋅
⋅
⋅
=
g
b
V
P
&
V&
= strumie
ń
wody (obj
ę
to
ść
/czas)
b = wysoko
ść
spadku
g = przyspieszenie ziemskie
r = g
ę
sto
ść
wody
h = całkowita sprawno
ść
systemu
Elektrownie wodne mo
ż
na podzieli
ć
na przepływowe i zbiornikowe>
Elektrownie przepływowe s
ą
budowane na rzece o małym spadku i du
ż
ym przepływie.
Pracuj
ą
one w sposób ci
ą
gły i dlatego s
ą
odpowiednie do pracy podstawowej. W elektrowni
zbiornikowej woda jest magazynowana w naturalnym lub sztucznym zbiorniku. To pozwala
na kontrol
ę
zmienno
ś
ci przepływu a tak
ż
e na dostosowanie mocy elektrowni do
zapotrzebowania systemu. Woda ze zbiornika mo
ż
e by
ć
wykorzystywana w szczycie
obci
ąż
enia. Dlatego elektrownie zbiornikowe s
ą
odpowiednie do pracy jako szczytowe.
Specjalnym przypadkiem elektrowni zbiornikowych s
ą
elektrownie pompowe.
1.2. Elektrolizery PEM (z elektrolitem z membrany polimerowej)
Wodór i tlen mog
ą
by
ć
produkowane w procesie elektrolizy wody. Elektroliza jest to
proces elektrochemiczny polegaj
ą
cy na rozkładzie elektrolitu przy pomocy pr
ą
du stałego
przepływaj
ą
cego przez elektrolit pomi
ę
dzy elektrodami. Je
ś
li proces elektrolizy ma
zachodzi
ć
, nat
ęż
enie pr
ą
du musi by
ć
równe lub wi
ę
ksze od pewnej warto
ś
ci progowej,
zale
ż
nej od materiału, znanej jako napi
ę
cie rozkładowe. Elektrolizery ró
ż
ni
ą
si
ę
typem
elektrolitu i rodzajem elektrod.
Elektrolizery PEM (Rys.7) maj
ą
szczególnie prost
ą
i kompaktow
ą
budow
ę
. Centralnym
składnikiem jest przewodz
ą
ca protony membrana polimerowa pokryta warstwami
katalizatora na obu stronach. Te warstwy s
ą
elektrodami.
Je
ś
li do elektrod jest przyło
ż
one napi
ę
cie wi
ę
ksze od napi
ę
cia rozkładowego wody,
elektrolizer PEM rozkłada czyst
ą
wod
ę
na wodór i tlen. Teoretyczne napi
ę
cie rozkładowe dla
wody wynosi 1,23 V, jednak w praktyce to napi
ę
cie musi by
ć
nieco wi
ę
ksze. (rozdział 2.2)
Elektrolizery o wi
ę
kszej mocy s
ą
budowane jako zestawy szeregowo poł
ą
czonych
pojedynczych elektrolizerów. Sprawno
ść
elektrolizerów PEM wynosi ok. 85%.
Jak pracuj
ą
elektrolizery PEM
Przypu
ść
my,
ż
e napi
ę
cie stałe jest przyło
ż
one do elektrod elektrolizera PEM (rys 7). Na
anodzie (prawa elektroda) woda jest utleniana zostawiaj
ą
c tlen, protony (jony H
+
) i wolne
elektrony. Podczas gdy tlen gazowy mo
ż
e by
ć
odbierany bezpo
ś
rednio z anody, protony
(
ż
ółte +) migruj
ą
przez membran
ę
przewodz
ą
c
ą
protony do katody, gdzie s
ą
redukopwane
do wodoru (konieczne do tego elektrony s
ą
dostarczane z zewn
ę
trznego obwodu).
Reakcja na anodzie:
2H
2
O
→
4H
+
+ 4e
-
+ O
2
Reakcje na katodzie:
4H
+
+ 4e
-
→
2H
2

7
Reakcje sumaryczne
2H
2
O
→
2H
2
+ 2O
2
Elekrolizery PEM s
ą
nazywane od ich materiału elektrolitu membrany polimerowej
przewodz
ą
cej protony. Akronim PEM odpowiada Proton Exchange Membrane lub Polimer
Electrolite Membrane. PEM składa si
ę
ze struktury teflonopodobnej z doł
ą
czonymi grupami
SO
3
H. Je
ś
li membrana staje si
ę
mokra, kwas siarkowy dysocjuje, membrana staje si
ę
kwa
ś
na i przewodzi protony. pozwala to na łatwy transport jonów H
+
podczas gdy aniony nie
mog
ą
przej
ść
przez membran
ę
.
1.4. Magazynowanie wodoru
Magazynowanie ci
ś
nieniowe
Najłatwiejsz
ą
i najbardziej ekonomiczn
ą
metod
ą
magazynowania wodoru jest spr
ęż
enie
go i przechowywanie w ci
ś
nieniowych zbiornikach o odpowiedniej wytrzymało
ś
ci (Rys8).
Je
ś
li problemem nie jest waga lub obj
ę
to
ść
, to ta metoda jest najlepsza. Zbiorniki s
ą
zaprojektowane na ci
ś
nienie 200 bar. S
ą
one u
ż
ywane w pomieszczeniach i na zewn
ą
trz.
Nowoczesne zbiorniki s
ą
wykonywane z kompozytów w
ę
glowych. S
ą
one nie tylko l
ż
ejsze od
konwencjonalnych al. maj
ą
mog
ą
równie
ż
wytrzymywa
ć
wi
ę
ksze ci
ś
nienia, obecnie do 350
bara w przyszło
ś
ci nawet 700.
Magazynowanie kriogeniczne (w postaci ciekłej)
W tej metodzie wodór jest składowany w postaci ciekłej w temperaturze poni
ż
ej -253ºC.
Główn
ą
zalet
ą
tej metody jest wysoka g
ę
sto
ść
składowania energii w jednostce obj
ę
to
ś
ci (i
masy). Jest to szczególnie wa
ż
ne przy małej ilo
ś
ci miejsca (np. w transporcie lub
tankowcach).
Wodór skrapla si
ę
w temperaturze -253ºC. W tak niskich temperaturach składowanie
jest mo
ż
liwe tylko w specjalnych zbiornikach kriogenicznych o odpowiedniej izolacji cieplnej.
Ale nawet w takich zbiornikach wodór mo
ż
na składowa
ć
bez strat tylko przez kilka dni. Po
tym czasie, pomimo izolacji, wyst
ą
pi
ą
straty parowania. Na skutek wzrostu temperatury mała
cz
ęść
wodoru odparowuje. Aby nie dopu
ś
ci
ć
do wzrostu ci
ś
nienia w zbiorniku, t
ę
ilo
ść
wodoru trzeba wypu
ś
ci
ć
. Takie straty gazu wynosz
ą
ok. 0,4%/dzie
ń
.
Inn
ą
istotn
ą
strat
ą
energii jest zwi
ą
zana ze skraplaniem wodoru: energia konieczna do
jego skroplenia si
ę
ga 1/3 zmagazynowanej energii.
Magazynowanie w wodorkach metali
Wodór mo
ż
e by
ć
magazynowany jako wodorki metali, w siatce krystalicznej niektórych
metali lub stopów. Pod ci
ś
nieniem nieco przekraczaj
ą
cym ci
ś
nienie otoczenia wodór jest
pompowany do
ś
rodka magazynuj
ą
cego w którym ł
ą
czy si
ę
z metalem tworz
ą
c wodorki
metalu w reakcji egzotermicznej. Reakcja jest odwracalna: dostarczenie ciepła powoduje
rozkład zwi
ą
zku i uwalnianie wodoru.

8
W porównaniu do metod przedstawionych wy
ż
ej, wodór magazynowany jako wodorki
metali jest bezpieczniejszy i łatwiejszy w u
ż
yciu. Ta metoda składowania ma wysok
ą
g
ę
sto
ść
obj
ę
to
ś
ciow
ą
energii. Jest ona odpowiednia do zastosowania w samochodach poniewa
ż
mała obj
ę
to
ść
zbiornika wystarczy do zapewnienia samochodowi koniecznego zasi
ę
gu.
Problemem w tym przypadku jest mała wagowo g
ę
sto
ść
magazynowania energii, co
powoduje du
ż
y ci
ęż
ar zbiornika. To ogranicza szerokie zastosowanie tej metody w
samochodach. (Rys. 10)
1.5. Historia technologii ogniw paliwowych
Ogniwo paliwowe zostało wynalezione ponad 150 lat temu; w 1839 r. Sir William
Grove (1811-1896) i Christian Friedrich Scoenbein (1799-1868) stwierdzili,
ż
e proces
elektrolizy mo
ż
e by
ć
odwrócony.
Na przykład, przy elektrolizie wody, elektryczno
ść
jest u
ż
ywana do produkcji wodoru i
tlenu. W ogniwie paliwowym zachodzi reakcja odwrotna: wodór i tlen reaguj
ą
daj
ą
c wod
ę
i
elektryczno
ść
.
Grove zbudował swoje pierwsze ogniwo paliwowe w 1839r. Schemat na rysunku obok
przedstawia model zbudowany w 1842r. składaj
ą
cy si
ę
z czterech elementów poł
ą
czonych
szeregowo. Ka
ż
dy z czterech pojemników jest wypełniony roztworem kwasu siarkowego i ma
dwie rurki szklane z elektrodami platynowymi wewn
ą
trz. Rurki s
ą
w górnej cz
ęś
ci zamkni
ę
te i
wypełnione: anoda – wodorem a katoda – tlenem. Generowana elektryczno
ść
mo
ż
e by
ć
wykorzystana w zewn
ę
trznym obwodzie. Na rysunku jest ona wykorzystana do
przeprowadzenia elektrolizy wody.
Trudno
ś
ci z materiałami, wynalezienie silników spalinowych i maszyn elektrycznych w
poł
ą
czeniu z niewyczerpalnymi (jak si
ę
wydawało) zasobami paliw to niektóre z przyczyn
tego,
ż
e technologia ogniw paliwowych pozostawała przez długi czas nieistotna. Dopiero w
1960 latach technologia ta została powtórnie odkryta jako przydatna do produkcji energii
elektrycznej w eksploracji kosmosu, gdzie była potrzebna pewna metoda nie wykorzystuj
ą
ca
spalania.
1.6. Typy ogniw paliwowych
Ogniwo paliwowe składa si
ę
zasadniczo z dwóch elektrod (katody i anody) oddzielonych
przez elektrolit. Zwykle typ elektrolitu jest u
ż
ywany do rozró
ż
nienia typów ogniw paliwowych.
Jednak
ż
e jest szereg dodatkowych charakterystyk takich jak temperatura pracy, sprawno
ść
i
zastosowanie, które mog
ą
si
ę
znacznie ró
ż
ni
ć
w ró
ż
nych typach ogniw.
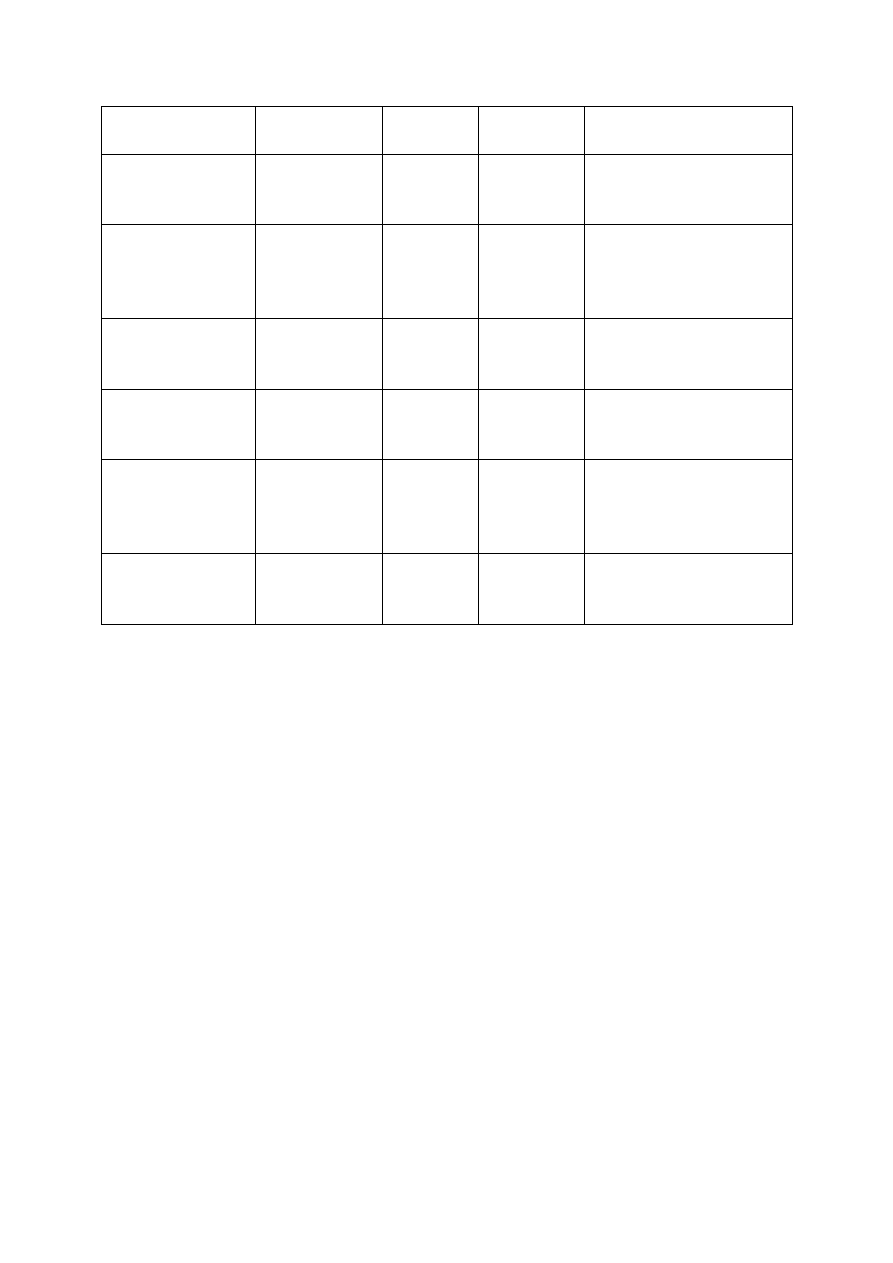
9
Ogniwo paliwowe
Elektrolit
Temperatura
pracy
Sprawno
ść
elektryczna
Paliwo
utleniacz
Alkaliczne ogniwo
paliwowe AFC
Roztwór
wodorotlenku
potasu (KOH)
pokojowa do
90ºC
60-70%
H
2
O
2
ogniwo paliwowe z
membran
ą
umo
ż
liwiaj
ą
c
ą
wymian
ę
protonów PEMFC
membran
ą
umo
ż
liwiaj
ą
c
ą
wymian
ę
protonów
pokojowa do
80ºC
40 –80 %
H
2
O
2
, powietrze
Bezpo
ś
rednie
metanolowe ogniwo
paliwowe DMFC
membran
ą
umo
ż
liwiaj
ą
c
ą
wymian
ę
protonów
pokojowa do
130ºC
20 –30%
CH
3
OH
O
2
, powietrze
Ogniwo paliwowe z
kwasem fosforowym
PAFC
kwas fosforowym
160 - 220ºC
55%
Gaz ziemny, biogaz, H
2
O
2
, powietrze
Ogniwo paliwowe ze
stopionymi w
ę
glanami
MCFC
Stopiona
mieszanina
w
ę
glanów metali
alkalicznych
620 - 680ºC
85%
Gaz ziemny, biogaz, gaz ze
zgazowania w
ę
gla, H
2
O
2
, powietrze
Ogniwa paliwowe z
zestalonym elektrolitem
tlenkowym
SOFC
Ceramika
przewodz
ą
ca jony
tlenu
800 - 1000ºC
80 –85%
Gaz ziemny, biogaz, gaz ze
zgazowania w
ę
gla, H
2
O
2
, powietrze
Alkaliczne ogniwo paliwowe (Alkaline Fuel Cel AFC)
Elektrolitem w alkalicznym ogniwie paliwowym jest roztwór wodorotlenku potasu (KOH).
Ogniwo pracuje w zakresie temperatur od pokojowej do 90ºC (ale temperatura mo
ż
e by
ć
wy
ż
sza w zale
ż
no
ś
ci od st
ęż
enia elektrolitu). Ogniwa AFC maj
ą
wysok
ą
sprawno
ść
i
wykorzystuj
ą
tani elektrolit. Głównym problemem przy tym ogniwie jest pochłanianie CO
2
przez elektrolit. CO
2
reaguje z KOH, w wyniku reakcji tworzy si
ę
nierozpuszczalny w
ę
glan.
To oznacza,
ż
e te ogniwa mog
ą
wykorzystywa
ć
bardzo czyste wodór i tlen, które nie
zawieraj
ą
CO
2
.
zastosowanie: wojskowe, eksploracja kosmosu
Reakcja na anodzie:
2H
2
O
→
4H
+
+ 4e
-
+ O
2
Reakcje na katodzie:
4H
+
+ 4e
-
→
2H
2
Reakcje sumaryczne
2H
2
O
→
2H
2
+ 2O
2
Ogniwo paliwowe PEM (PEMFC – ogniwo paliwowe z elektrolitem z membrany
polimerowej)
Elektrolitem w ogniwie paliwowym PEMFC jest membrana polimerowa przewodz
ą
c
ą
protony. Ogniwo PEMFC równie
ż
działa w niskich temperaturach (pokojowa do 80ºC).
Ogniwa te maj
ą
dobre wła
ś
ciwo
ś
ci zimnego startu i wysok
ą
sprawno
ść
. Ponadto,

10
Pojedyncze ogniwa mog
ą
by
ć
łatwo ł
ą
czone w zespoły co umo
ż
liwia uzyskanie wy
ż
szych
napi
ęć
. Katoda jest zasilana tlenem (np. z powietrza), anoda wodorem. Je
ś
li wodór pochodzi
z paliw zawieraj
ą
cych w
ę
giel musi by
ć
dokładnie oczyszczony z CO poniewa
ż
ten gaz
zniszczy katalizator PEMFC. Wad
ą
ogniw paliwowych PEM jest wysoki koszt materiału
katalizatora (platyna).
Zastosowania: silniki elektryczne np. w samochodach, eksploracji kosmosu, ruchome
ź
ródła zasilania, zamienniki akumulatorów, blokowe elektrownie cieplne (poł
ą
czenie ciepła i
elektryczno
ś
ci)
Reakcja na anodzie:
2H
2
→
4H
+
+ 4e
-
Reakcje na katodzie:
O2 + 4H
+
+ 4e
-
→
2H
2
O
Reakcje sumaryczne
2H
2
+ O
2
→
2H
2
O
Bezpo
ś
rednie ogniwo metanolowe (DMFC)
Bezpo
ś
rednie ogniwo metanolowe (DMFC) jest specjalnym przypadkiem PEMFC. Oba
ogniwa paliwowe maj
ą
podobn
ą
struktur
ę
jednak
ż
e DMFC wykorzystuje metanol (CH
3
OH)
jako paliwo a nie wodór. Metanol mo
ż
e by
ć
u
ż
ywany w stanie ciekłym, jego wadami s
ą
toksyczno
ść
i korozyjno
ść
, ponadto ogniwa DMFC maj
ą
nisk
ą
sprawno
ść
.
Zastosowania: silniki elektryczne, ruchome
ź
ródła zasilania, zamienniki akumulatorów
Reakcja na anodzie:
2CH
3
OH + 2H
2
O
→
2CO
2
+ 12H
+
+ 12e
-
Reakcje na katodzie:
3O2 + 12H
+
+ 12e
-
→
6H
2
O
Reakcje sumaryczne
2CH
3
OH + 3O
2
→
2CO
2
+ 4H
2
O
Ogniwa paliwowe z kwasem fosforowym (PAFC)
Elektrolitem w ogniwach PAFC jest kwas fosforowy. Ogniwa pracuj
ą
w zakresie
temperatur 160 - 220ºC. W porównaniu z innymi typami ogniw (poza DMFC) ogniwa te maj
ą
nisk
ą
sprawno
ść
.
Zastosowania: stacjonarne
ź
ródła zasilania, blokowe elektrownie cieplne (poł
ą
czenie
ciepła i elektryczno
ś
ci)
Reakcja na anodzie:
2H
2
→
4H
+
+ 4e
-
Reakcje na katodzie:
O2 + 4H
+
+ 4e
-
→
2H
2
O
Reakcje sumaryczne
2H
2
+ O
2
→
2H
2
O
Ogniwa paliwowe ze stopionymi w
ę
glanami (MCFC)
Elektrolitem w MCFC s
ą
stopione w
ę
glany metali alkalicznych utrzymywane w siatce
ceramicznej tlenków litu i glinu. Ogniwa te maj
ą
wysok
ą
temperatur
ę
pracy (600-700ºC) i
wysok
ą
sprawno
ść
. Mog
ą
one by
ć
zasilane nie tylko wodorom lecz równie
ż
gazem ziemnym
i biogazem.

11
Zastosowania: blokowe elektrownie cieplne (poł
ą
czenie ciepła i elektryczno
ś
ci),
elektrownie zawodowe.
Reakcja na anodzie:
2H
2
+2CO
3
2-
→
2H
2
O + 2CO
2
4e
-
Reakcje na katodzie:
O
2
+ 2CO
2
+ 4e
-
→
2CO
3
2-
Reakcje sumaryczne
2H
2
+ O
2
→
2H
2
O
Ogniwa paliwowe z zestalonym elektrolitem tlenkowym (SOFC)
Elektrolitem w tym ogniwie jest stały tlenek metalu, zwykle tlenek cyrkony stabilizowany
itrem (ZrO
2
). S
ą
to ogniwa wysokotemperaturowe. Mog
ą
one by
ć
zasilane wodorem, ale
równie
ż
innymi gazami wł
ą
czaj
ą
c gaz ziemny i biogaz.
Zastosowania: blokowe elektrownie cieplne (poł
ą
czenie ciepła i elektryczno
ś
ci),
elektrownie zawodowe, a tak
ż
e wytwarzanie energii elektrycznej w domu.
Reakcja na anodzie:
2H
2
+ 2O
2-
2H
2
O + 4e
-
Reakcje na katodzie:
O2 + 4e
-
2O
2-
Reakcje sumaryczne
2H
2
+ O
2
2H
2
O
1.7. Ogniwa paliwowe PEM
Ogniwa paliwowe PEM przekształcaj
ą
energi
ę
chemiczn
ą
w energi
ę
elektryczn
ą
z
wysok
ą
sprawno
ś
ci
ą
, przy nikim hałasie i bez emisji zanieczyszcze
ń
. Elektrolitem jest cienka
polimerowa membrana przewodz
ą
ca protony. Membrana jest obustronnie pokryta
katalizatorem. Katalizator tworzy elektrody ogniwa paliwowego – katod
ę
i anod
ę
. Pojedyncze
cele s
ą
poł
ą
czone w baterie, tak aby mogły spełnia
ć
wymagania co do pr
ą
du i napi
ę
cia
(rozdział 1.8). Wysoka sprawno
ść
, dobre parametry zimnego startu powoduj
ą
,
ż
e te ogniwa
s
ą
odpowiednie do szerokiego zakresu zastosowa
ń
takich jak nap
ę
dy elektryczne w
samochodach (rozdz.1.11), zast
ę
powanie baterii i akumulatorów (rozdz 1,10), i dostarczanie
energii w domu (rozdz1.12).
Jak pracuje ogniwo paliwowe PEM
W ogniwie paliwowy PEM dwie elektrody (typowo platynowe, niebieskie na rys 13) s
ą
oddzielone przez elektrolit (
ż
ółty) – membran
ę
polimerow
ą
przewodz
ą
c
ą
protony. Gazowy
wodór (czerwony, po lewej) jest dostarczany do jednej elektrody, a tlen (niebieski, po prawej)
do drugiej. Anoda jest katalizatorem dla dysocjacji wodoru na protony (jony H
+
) i elektrony.
Tak protony jak i elektrony przemieszczaj
ą
si
ę
na stron
ę
katodow
ą
, ale ró
ż
nymi drogami.
Jony H+ przechodz
ą
przez membran
ę
polimerow
ą
przewodz
ą
c
ą
protony, elektrony
przepływaj
ą
przez zewn
ę
trzny obwód tworz
ą
c pr
ą
d zewn
ę
trzny ogniwa. Na katodzie protony
i elektrony ostatecznie reaguj
ą
z tlenem daj
ą
c wod
ę
, jedyny produkt uboczny ogniwa
paliwowego.

12
Reakcja na anodzie:
2H
2
4H
+
+ 4e
-
Reakcje na katodzie:
O2 + 4H
+
+ 4e
-
2H
2
O
Reakcje sumaryczne
2H
2
+ O
2
2H
2
O
1.8. Bateria ogniw paliwowych
W celu otrzymania odpowiedniego napi
ę
cia nale
ż
y poł
ą
czy
ć
szereg ogniw
paliwowych w bateri
ę
.
Rysunek 14 przedstawia bateri
ę
składaj
ą
c
ą
si
ę
z trzech ogniw paliwowych. Przylegaj
ą
ce
ogniwa s
ą
oddzielone od siebie płytami separuj
ą
cymi (na rysunku szare z pionowymi i
poziomymi rowkami). Płyty separuj
ą
ce maj
ą
za zadanie: 1) zapewni
ć
poł
ą
czenie elektryczne
s
ą
siaduj
ą
cych ogniw, 2) umo
ż
liwi
ć
dostarczenie i odbiór gazu, 3) odprowadzi
ć
wydzielaj
ą
ce
si
ę
w ogniwie ciepło, 4) uszczelni
ć
przylegaj
ą
ce ogniwa i uniemo
ż
liwi
ć
ucieczk
ę
paliwa i
utleniacza. Na rysunku nie pokazano poł
ą
cze
ń
elektrycznych, kanały transportuj
ą
ce gaz s
ą
pokazano jako poziome (wodór) i pionowe (dostarczanie tlenu i odbiór wody) rowki.
Specjalne płyty ko
ń
cowe s
ą
umieszczone na ko
ń
cach baterii. Maj
ą
one ł
ą
czniki elektryczne
do zewn
ę
trznego obwodu a tak
ż
e kró
ć
ce do dostarczania gazu i ewentualnie chłodziwa. W
zale
ż
no
ś
ci od mocy baterii i zwi
ą
zanego z tym wydzielania ciepła chłodzenie mo
ż
e by
ć
powietrzne albo wodne.
Napi
ę
cie wyj
ś
ciowe baterii mo
ż
na regulowa
ć
dobieraj
ą
c odpowiedni
ą
ilo
ść
ogniw
poł
ą
czonych szeregowo.
1.9. Bezpo
ś
rednie metanolowe ogniwo paliwowe
Bezpo
ś
rednie metanolowe ogniwo paliwowe jest specjalnym przypadkiem ogniwa
PEM. DMFC i PEMFC maj
ą
podobn
ą
budow
ę
, dwie elektrody s
ą
odseparowane przez
elektrolit którym jest polimerowa membrana przewodz
ą
ca jony wodorowe,
nieprzenikliwa dla elektronów.
Ró
ż
nica pomi
ę
dzy DMFC i PEMFC polega na tym ,
ż
e w DMFC paliwem jest metanol
(CH3OH) a nie wodór. Przy ci
ś
nieniu otoczenia (101,3 kPa) metanol jest ciekły w
temperaturach od -97ºC do 64ºC. Dlatego główn
ą
zalet
ą
DMFC jest to,
ż
e paliwo mo
ż
e by
ć
składowane i transportowane podobnie jak inne paliwa ciekłe. Z drugiej strony metanol jest
truj
ą
cy i powoduje korozj
ę
a te ogniwa maj
ą
nisk
ą
sprawno
ść
w porównaniu z innymi
ogniwami paliwowymi. Zastosowanie: silniki elektryczne, przeno
ś
ne
ź
ródła zasilania
zmiennik akumulatorów.
Jak pracuje DMFC

13
Rysunek 15 przedstawia schemat DMFC. Elektrolit (PEM) ma kolor
ż
ółty, elektrody s
ą
niebieskie (anoda z lewej , katoda z prawej). Do anody jest doprowadzany jest wodny
roztwór metanolu. Dzi
ę
ki katalitycznemu działaniu elektrod wodór jest oddzielany od
roztworu i redukowany do jonów H
+
, uwalniaj
ą
c elektrony do anody. Jony wodoru i elektrody
przemieszczaj
ą
si
ę
do katody – jony wodoru przez membran
ę
przewodz
ą
c
ą
jony a elektrony
przez zewn
ę
trzny obwód elektryczny, tworz
ą
c u
ż
ytkowy pr
ą
d.
Na anodzie tlen i w
ę
giel z metanolu reaguj
ą
z tlenem z wody i tworz
ą
CO
2
.
Na katodzie jony wodoru które przeszły przez membran
ę
i elektrony z zewn
ę
trznego
obwodu reaguj
ą
z dostarczanym tlenem i tworz
ą
wod
ę
.
Reakcja na anodzie:
2CH
3
OH + H
2
O
2CO
2
+ 12H
+
+ 12e
-
Reakcje na katodzie:
3O2 + 12H
+
+ 12e
-
6H
2
O
Reakcje sumaryczne
2CH
3
OH + 3O
2
2CO
2
+ 4H
2
O
1.10. Zastosowania przeno
ś
ne
Ogniwa paliwowe do przeno
ś
nych zastosowa
ń
:
Do zastosowa
ń
przeno
ś
nych ogniwa paliwowe s
ą
zamiennikami typowych baterii. Ich
główn
ą
zalet
ą
jest to ,
ż
e w przeciwie
ń
stwie do zwykłych baterii one si
ę
nie rozładowuj
ą
.
Baterie s
ą
urz
ą
dzeniami do magazynowania energii elektrycznej, ilo
ść
energii które mog
ą
odda
ć
zale
ż
y od ilo
ś
ci reagentów zawartych w baterii. Po zu
ż
yciu reagentów bateria musi
by
ć
albo naładowana (akumulator) lub wyrzucona. Ogniwa paliwowe s
ą
urz
ą
dzeniami
przetwarzaj
ą
cymi energi
ę
dostarczanego z zewn
ą
trz paliwa. Wytwarzaj
ą
one energi
ę
elektryczn
ą
tak długo jak długo paliwo jest dostarczane.
Zakres mo
ż
liwych zastosowa
ń
jest bardzo szeroki. Obejmuje on dostarczanie energii
elektrycznej dla ró
ż
nych urz
ą
dze
ń
o małej mocy np.: laptopy, urz
ą
dzenia pomiarowe,
wyposa
ż
enie kempingowe.
Niskotemperaturowe ogniwa PEMFC i DMFC s
ą
najbardziej odpowiednie dla
przeno
ś
nych urz
ą
dze
ń
małej mocy poniewa
ż
pracuj
ą
one w niskich temperaturach, pracuj
ą
niezwłocznie po starcie (nie wymagaj
ą
rozgrzewania) i mog
ą
mie
ć
kompaktow
ą
budow
ę
.
Jedynym produkte, ubocznym PEMFC jest woda, podczas gdy DMFC produkuje
równie
ż
małe ilo
ś
ci CO
2
.
1.11. Zastosowania ruchome
Ogniwa paliwowe do ruchomych zastosowa
ń
:
Zastosowania ruchome s
ą
zdominowane przez ogniwa PEM. Ze wzgl
ę
du na nisk
ą
temperatur
ę
pracy ogniwa PEMFC mo
ż
e dostarcza
ć
energi
ę
elektryczn
ą
bezpo
ś
rednio po
starcie. Jest to szczególnie wa
ż
ne dla zastosowa
ń
w samochodach.
Zapotrzebowanie mocy w samochodach mie
ś
ci si
ę
w zakresie od kilku kW do setek kW.

14
Małe łodzie wymagaj
ą
kilku kW, wi
ę
ksze nawet setek KW do nap
ę
du i do zasilania
urz
ą
dze
ń
pokładowych a tak
ż
e w systemach zasilania awaryjnego.
Dzi
ę
ki budowie modułowej ogniwa paliwowe mog
ą
spełni
ć
najbardziej ró
ż
norodne
wymagania.
Samochód HydrGen3 zbudowany przez Opla ma bateri
ę
ogniw paliwowych zło
ż
on
ż
z
200 ogniw poł
ą
czonych szeregowo. Poniewa
ż
w ogniwach nie ma ruchomych cz
ęś
ci,
przetwarzanie energii odbywa si
ę
bez hałasu i zu
ż
ycia.
Istniej
ą
równie
ż
inne koncepcje wykorzystania wodoru do nap
ę
dzania samochodów.
Jedn
ą
z nich jest samochód BMW 745h, który wykorzystuje wodór jako paliwo w 135 kW
silniku spalinowym.
Samochód NECAR5 Daimler-Chrysler wykorzystuje w ogniwach paliwowych metanol
przetwarzany w samochodzie na wodór. W reformerze metanol jest przetwarzany na wodór,
CO2 i CO. W ten sposób wodór dla ogniw paliwowych jest wytwarzany bezpo
ś
redni w
samochodzie.
1.12. Zastosowania stacjonarne
Ogniwa paliwowe do zastosowa
ń
stacjonarnych
Zastosowania stacjonarne rozci
ą
gaj
ą
si
ę
od wytwarzania energii elektrycznej i ciepła dla
pojedynczych mieszka
ń
(moc od 2 kW) do zaopatrywania w energi
ę
ciepln
ą
i elektryczn
ą
całych obszarów (moc w zakresie MW).
Pierwszy pilota
ż
owy projekt domowego zaopatrzenia w energi
ę
ju
ż
został wdro
ż
ony ,
np. przy wykorzystaniu baterii ogniw paliwowych PEM firmy Vaillant i baterii Hexis SOFC
firmy Sulzer.
Kompletny system generacji energii składa si
ę
nie tylko z baterii ogniw paliwowych , lecz
równie
ż
z wielu innych składników:
•
Systemy kondycjonowania gazu: je
ś
li paliwo dla ogniw paliwowych ma
nieodpowiedni
ą
jako
ść
, musi by
ć
kondycjonowane. Ten proces mo
ż
e obejmowa
ć
reformowanie i czyszczenie CO, odsiarczanie i usuwanie nadmiernej ilo
ś
ci tlenu.
•
Wymienniki ciepła: słu
żą
do przekazywania wytwarzanego ciepła na zewn
ą
tr.
•
Inne składniki generuj
ą
ce energi
ę
: w zale
ż
no
ś
ci od potrzeb mog
ą
to by
ć
turbiny
rozpr
ęż
ne, turbiny gazowe albo kombinowane turbiny gazowe i parowe.
•
Ruroci
ą
gi, pompy i kondensatory wymagane do obsługi gazu i ciepła
•
Poł
ą
czenia elektryczne mi
ę
dzy składnikami systemu a tak
ż
e układy kontrolne i
pomiarowe
•
Przekształtniki i transformatory do przekształcania i transformacji napi
ę
cia stałego
baterii w napi
ę
cie przemienne.

15
Przykładowe eksperymenty
16
2.1. Charakterystyka pr
ą
dowo-napi
ę
ciowa, krzywa mocy i sprawno
ść
modułu słonecznego
Przed rozpocz
ę
ciem eksperymentu nale
ż
y przeczyta
ć
zasady bezpiecze
ń
stwa w
Instrukcji obsługi!
Podstawy:
Sprawno
ść
modułu słonecznego jest to stosunek produkowanej energii
elektrycznej do energii słonecznej padaj
ą
cej na ogniwo. Charakterystyki napi
ę
ciowo
pr
ą
dowe i krzywa mocy pozwalaj
ą
na wyznaczenie punktu mocy maksymalnej (MPP-
maximum power point).
in
out
P
P
=
η
Gdzie:
η
sprawno
ść
P
out
moc oddawana przez moduł
P
in
moc promieniowania padaj
ą
cego na moduł
Aparatura:
•
Moduł słoneczny
•
Ź
ródło
ś
wiatła do o
ś
wietlenia modułu
•
Woltomierz o zakresie 20 V
•
Amperomierz o zakresie 20 A ?
•
Opornik dekadowy
•
Miernik mocy promieniowania
ś
wietlnego
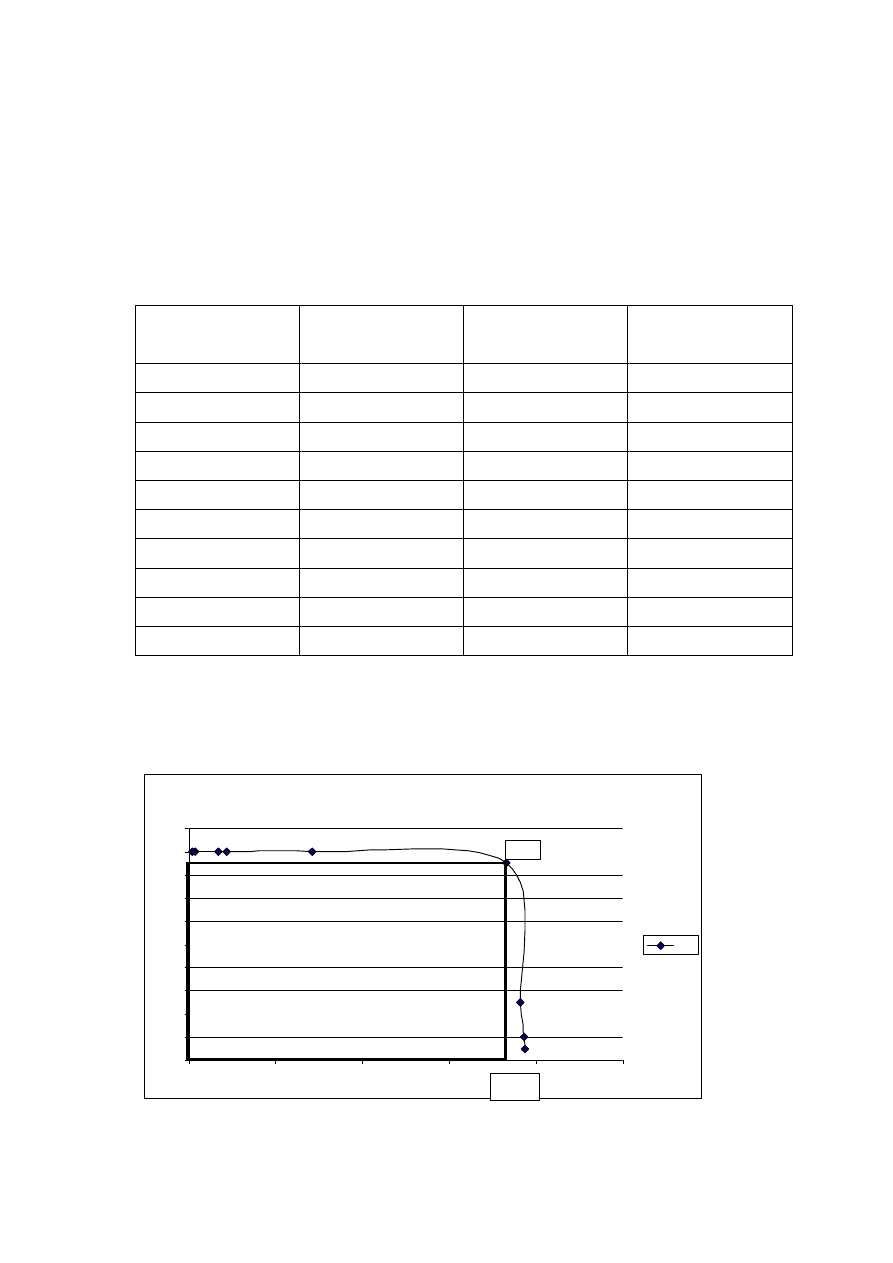
Schemat układu pomiarowego
Rys. 2.1. Schemat obwodu do wyznaczania charakterystyki modułu słonecznego.
V
Moduł
słoneczny
opornik
dekadowy
17
Wykonanie pomiaru
Poł
ą
cz obwód zgodnie ze schematem na rys 2.1. Skieruj
ś
wiatło na moduł słoneczny
pod k
ą
tem 90º do jego powierzchni. Odczekaj 1 min. aby unikn
ąć
bł
ę
dów
spowodowanych fluktuacjami temperatury. Rozpocznij pomiary od obwodu otwartego,
nast
ę
pnie wykonuj pomiary napi
ę
cia i pr
ą
du zmniejszaj
ą
c rezystancj
ę
opornika
dekadowego. Ka
ż
dorazowo po zmianie rezystancji odczekaj 20sekund.
Przykładowe wyniki pomiarów i oblicze
ń
:
R[
Ω
]
U [V]
I[A]
P [W]
P=U
x
I
∞
1,95
0,00
0,000
330
1,94
0,01
0,019
100
1,93
0,02
0,039
33
1,91
0,05
0,96
10
1,83
1,17
0,311
3,3
0,71
1,18
0,128
1
0,22
1,18
0,040
0,33
0,17
1,18
0,031
0,1
0,04
1,18
0,007
0
0,02
1,18
0,004
Tabela 2.1. Wyniki pomiarów Solar Module Junior i o
ś
wietlenia h-tec SWpotlight 75W w
odległo
ś
ci 50 cm od panelu.
Analiza
Wykonaj wykres zale
ż
no
ś
ci I (U)
I[A]
0
0,02
0,04
0,06
0,08
0,1
0,12
0,14
0,16
0,18
0,2
0
0,5
1
1,5
2
2,5
I[A]
P = V*I
MPP
Vmpp
Wyjres 2.1.a Charakterystyka pr
ą
dowo-napi
ę
ciowa modułu słonecznego
18
Wykonaj wykres P (U)
0
0,05
0,1
0,15
0,2
0,25
0,3
0,35
0
0,5
1
1,5
2
2,5
U [V]
P
[
W
]
P[W]
Wykres 2.1.b Krzywa mocy panelu słonecznego
Punkt maksymalnej mocy (MPP) jest maximum krzywej mocy.
MPP mo
ż
e by
ć
równie
ż
wyznaczony z charakterystyki pr
ą
dowo-napi
ę
ciowej jako
prostok
ą
t o maksymalnym polu powierzchni oparty na osiach współrz
ę
dnych i
wierzchołku nale
żą
cym do krzywej.
Sprawno
ść
modułów słonecznych
Aby wyznaczy
ć
sprawno
ść
modułu słonecznego musimy zna
ć
warto
ść
mocy
promieniowania słonecznego padaj
ą
cego na moduł P
in
i jego moc elektryczn
ą
(w tym
przykładzie 0,318 W)
A) wykorzystaj przyrz
ą
d opisany wy
ż
ej do zmierzenia mocy promieniowania
ś
wietlnego
padaj
ą
cego na jednostk
ę
powierzchni modułu. T
ę
warto
ść
nale
ż
y pomno
ż
y
ć
przez
efektywn
ą
powierzchni
ę
modułu aby wyznaczy
ć
moc Pin.
Sprawno
ść
mo
ż
na wyznaczy
ć
ze wzoru
in
out
P
P
=
η
B) Je
ś
li taki przyrz
ą
d nie jest dost
ę
pny, do pomiaru mocy promieniowania mo
ż
na
wykorzysta
ć
multimetr. Metoda ta opiera si
ę
na tym,
ż
e pr
ą
d zwarciowy modułu jest
proporcjonalny do ilo
ś
ci fotonów padaj
ą
cych na ogniwo, a wi
ę
c i do mocy
promieniowania
ś
wietlnego.
Napi
ę
cie biegu jałowego zale
ż
y od materiału fotoogniwa, a nie od jego o
ś
wietlenia,
wi
ę
c nie mo
ż
e by
ć
wykorzystane w tym pomiarze.
MPP
Pmax

19
Aby wyznaczy
ć
moc promieniowania nale
ż
y pomno
ż
y
ć
warto
ść
pr
ą
du zwarcia ogniwa
przez współczynnik F. Ten współczynnik jest zale
ż
ny od warto
ś
ci maksymalnej pr
ą
du
zwarcia ogniwa.
Warto
ść
maksymaln
ą
pr
ą
du zwarcia fotoogniwa podaje wytwórca dla mocy
promieniowania 1000 W/m
2
. Dla badanego ogniwa wynosi on 350 mA. St
ą
d:
mA
m
W
mA
m
W
F
2
2
86
,
2
350
1000
=
=
Dla wyznaczenia mocy promieniowania padaj
ą
cego na moduł, nale
ż
y pomno
ż
y
ć
pr
ą
d
przez współczynnik F i powierzchni
ę
modułu.
Przykład:
Powierzchnia ogniw paliwowych: A=5*10
-3
m
2
, cztery ogniwa (25mmx 50mm)
Pr
ą
d zwarcia: Is = 180 mA
W
mA
mA
m
W
A
I
F
P
s
in
57
,
2
10
5
180
86
,
2
3
2
=
⋅
⋅
⋅
=
⋅
⋅
=
−
Maksymalna moc elektryczna (MPP) modułu słonecznego wynosi 0,311W przy mocy
promieniowania padaj
ą
cego 2,57 W. St
ą
d mo
ż
na wyznaczy
ć
sprawno
ść
%
12
121
,
0
57
,
2
311
,
0
=
=
=
=
in
out
P
P
η
Dyskusja
Punkt mocy maksymalnej (MPP) mo
ż
na odczyta
ć
z wykresu mocy w prosty sposób. N
charakterystyce napi
ę
ciowo-pr
ą
dowej MPP wyznacza prostok
ą
t o maksymalnym polu
zawarty mi
ę
dzy osiami współrz
ę
dnych i krzyw
ą
. Rezystancj
ę
ogniwa R
MPP
w punkcie
MPP okre
ś
la wzór:
MPP
MPP
MPP
I
V
R
=
Sprawno
ś
ci polikrystalicznych fotoogniw mieszcz
ą
si
ę
pomi
ę
dzy 13 a 15%.
Wyznaczona warto
ść
12% jest nieco mniejsza. Jest to spowodowane bł
ę
dami
pomiarowymi i niedokładno
ś
ciami przy wyznaczaniu mocy promieniowania padaj
ą
cego.
Ponadto, sprawno
ść
modułu jest mniejsza ni
ż
sprawno
ś
ci poszczególnych fotoogniw.
Jest to spowodowane przez straty wywołane niejednakowymi charakterystykami
poszczególnych ogniw i zwi
ą
zanym z tym ich niedopasowaniem. Poszczególne ogniwa
modułu nie maj
ą
takich samych punktów mocy maksymalnej.
Gdzie powstaj
ą
straty w ogniwach paliwowych? Nie wszystkie fotony padaj
ą
ce na
ogniwo mog
ą
by
ć
przekształcone w ładunki elektryczne. Cz
ęść
z nich odbija si
ę
od
powierzchni ogniwa i od metalowych poł
ą
cze
ń
elektrycznych. Poniewa
ż
energia
fotonów nie odpowiada energii bariery, ponad połowa energii jest tracona. Ponadto
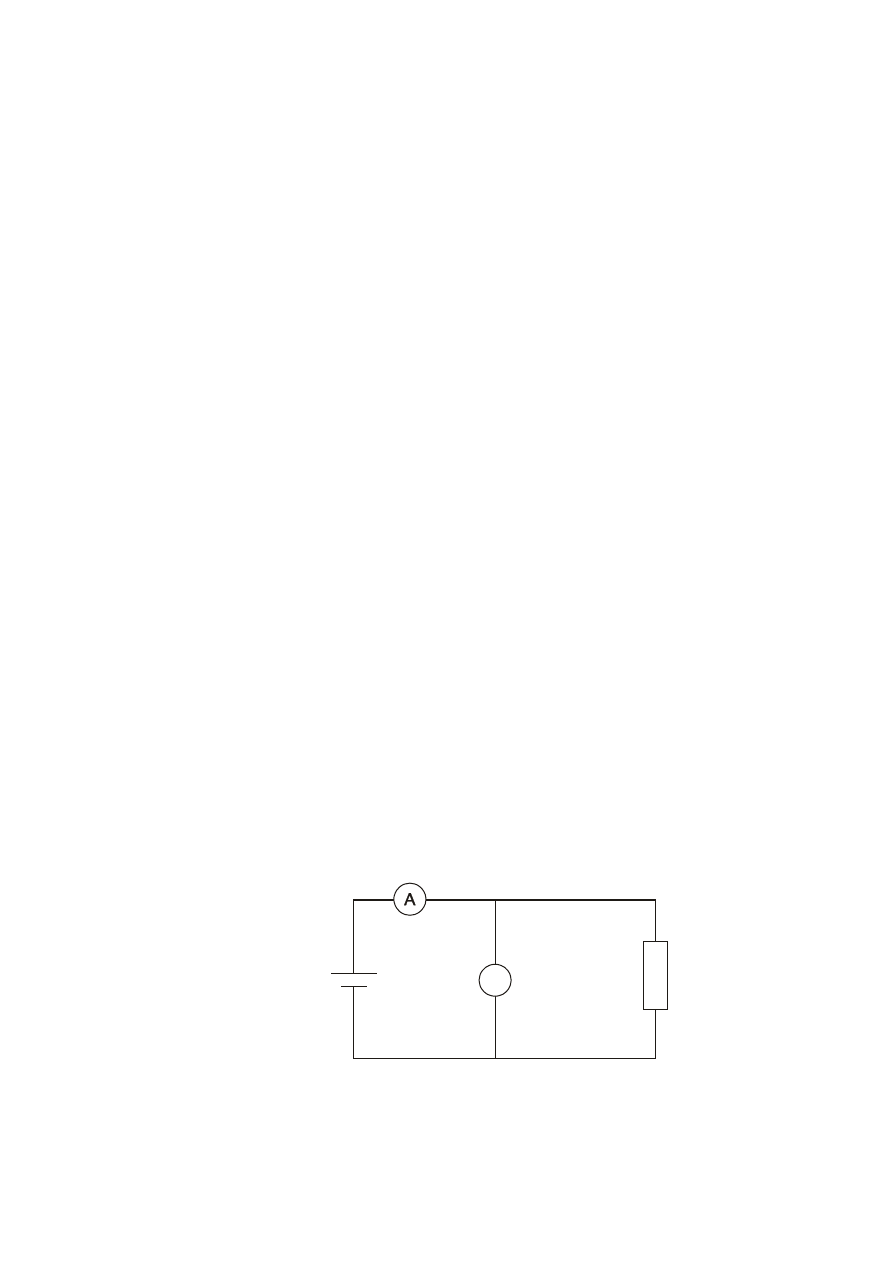
20
straty powstaj
ą
na skutek rekombinacji ładunków i jako straty elektryczne
spowodowane rezystancj
ą
materiałów ogniwa (półprzewodnika i styków elektrycznych).
2.2. Charakterystyka pr
ą
dowo-napi
ę
ciowa elektrolizera PEM
przed rozpocz
ę
ciem eksperymentów nale
ż
y zapozna
ć
si
ę
z zasadami bezpiecze
ń
stwa
zawartymi w instrukcji obsługi.
Podstawy:
Elektrolizer PEM rozdziela wod
ę
na wodór i tlen.
Napi
ę
cie zasilaj
ą
ce elektrolizer musi przekracza
ć
warto
ść
progow
ą
, napi
ę
cie
dekompozycji. Poni
ż
ej tego napi
ę
cia rozdzielanie wody nie zachodzi. Celem
poni
ż
szego eksperymentu jest wyznaczenie tej warto
ś
ci.
Aparatura
•
Elektrolizer PEM
•
2 mierniki (woltomierz i amperomierz
•
ź
ródło napi
ę
cia
a) regulowane
ź
ródło nai
ę
cia
b) Alternatywnie: nieregulowane
ź
ródło napi
ę
cia np. moduł słoneczny, w tym
przypadku niezb
ę
dne jest
ź
ródło
ś
wiatła i opornik dekadowy lub wyskalowany
potencjometr
Wykonanie
ć
wiczenia
a) Przył
ą
cz elektrolizer do regulowanego
ź
ródła napi
ę
cia zgodnie ze schematem
2.2a. Pocz
ą
tkowo napi
ę
ci musi by
ć
ustawione na 0V, nale
ż
y je stopniowo zwi
ę
ksza
ć
do 2 V dla pojedynczego elektrolizera. Dla szeregowej baterii elektrolizerów napi
ę
cie
ko
ń
cowe powinno by
ć
wielokrotno
ś
ci
ą
2V.
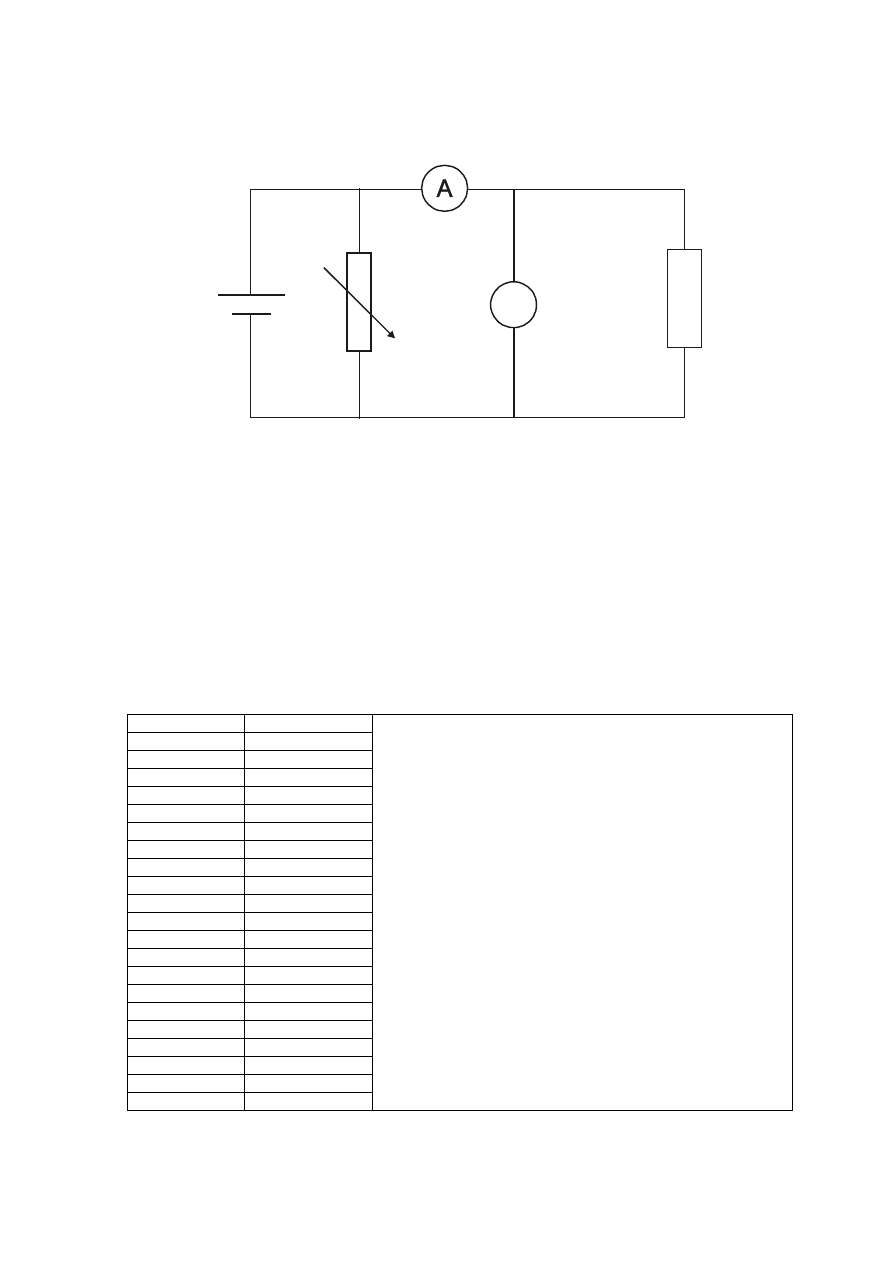
V
Regulowane
ź
ródło napi
ę
cia
elektrolizer
Schemat obwodu 2.2.a do wyznaczania charakterystyki pr
ą
dowo-napi
ę
ciowej
elektrolizera przy wykorzystaniu regulowanego
ź
ródła napi
ę
cia.
21
b) Poł
ą
cz urz
ą
dzenia według schematu 2.2.b
V
Nieregulowane
ź
ródło napi
ę
cia
opornik
dekadowy
elektrolizer
Schemat obwodu 2.2.b do wyznaczania charakterystyki pr
ą
dowo-napi
ę
ciowej
elektrolizera przy wykorzystaniu nieregulowanego
ź
ródła napi
ę
cia.
Procedury i dane
Uruchom aparatur
ę
zgodnie z instrukcj
ą
obsługi.
a) Zwi
ę
kszaj napi
ę
cie
ź
ródła ze skokiem 0,1V od 0 d0 2V DC, i zapisuj ka
ż
dorazowo
warto
ść
napi
ę
cia i odpowiadaj
ą
cego pr
ą
du w tablicy. Odczekaj 20 sekund pomi
ę
dzy
ka
ż
dym pomiarem aby uzyska
ć
reprezentatywne warto
ś
ci. Zwró
ć
uwag
ę
na
rozpocz
ę
cie produkcji gazu i zaznacz odpowiadaj
ą
ce warto
ś
ci pr
ą
du i napi
ę
cia.
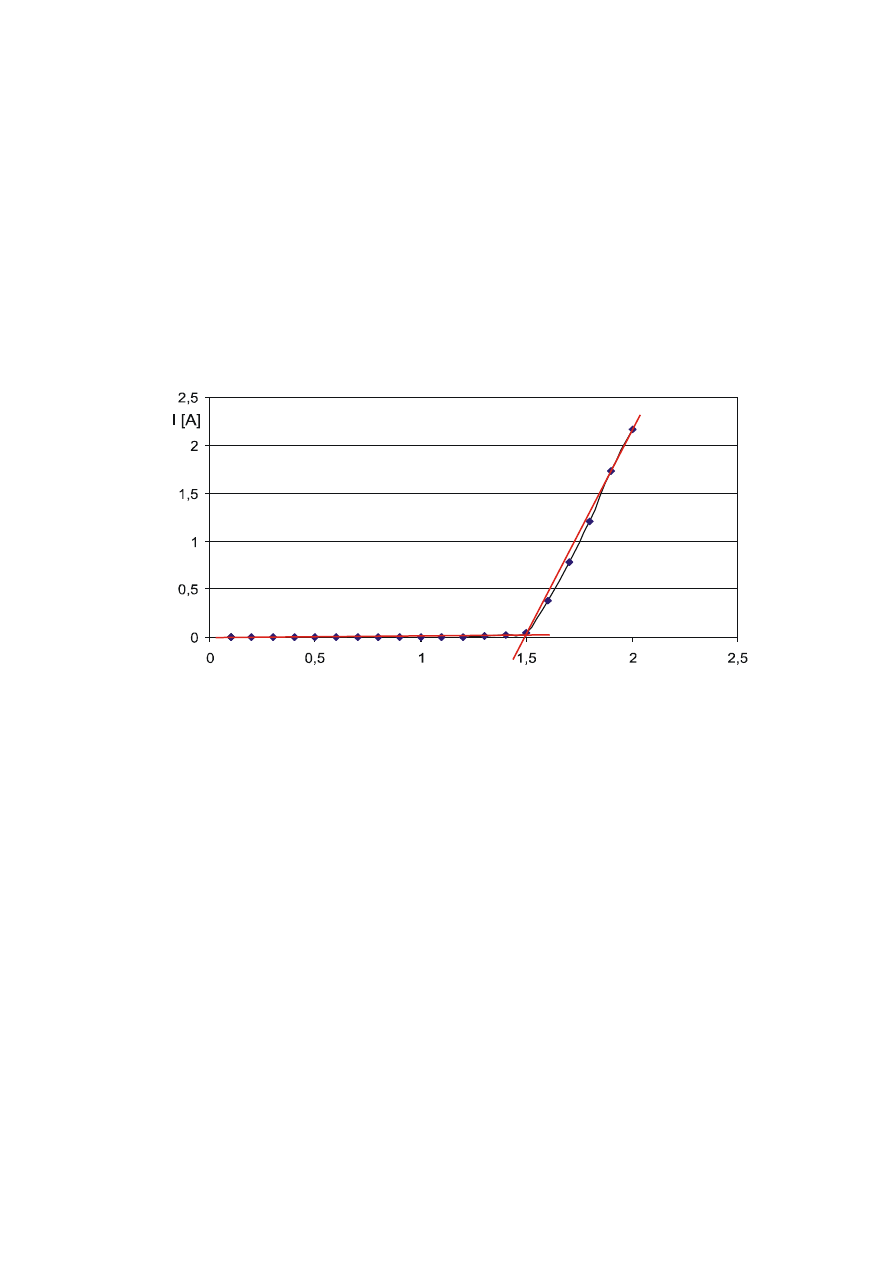
Przykład (dla elektrolizera h-tec Junior)
U [V]
I [A]
0,1
0,00
0,2
0,00
0,1
0,00
0,3
0,00
0,4
0,00
0,5
0,00
0,6
0,00
0,7
0,00
0,8
0,00
0,9
0,00
1,0
0,00
1,1
0,00
1,2
0,00
1,3
0,01
1,4
0,02
1,5
0,05
1,6
0,38
1,7
0,78
1,8
1,21
1.9
1,73
2,0
2,16
Tabela 2.2a Wyniki pomiarów
Elektrolizer PEM zaczyna wytwarza
ć
wodór i tlen po
przekroczeniu pewnej warto
ś
ci napi
ę
cia. Od tej warto
ś
ci
pr
ą
d ro
ś
nie wraz ze wzrostem napi
ę
cia.
22
b) W przypadku nieregulowanego
ź
ródła napi
ę
cia stopniowo zwi
ę
kszaj warto
ść
rezystancji opornika dekadowego zapisuj
ą
c za ka
ż
dym razem warto
ść
napi
ę
cia i pr
ą
du
w tablicy. (maksymalne napi
ę
cie 2 V DC! Dla baterii elektrolizerów napi
ę
cie
maksymalne jest iloczynem ilo
ś
ci celi i 2 V. Pomiary przeprowadzaj jak w punkcie a).
Analiza
Na podstawie przeprowadzonych pomiarów wykonaj wykres pr
ą
du w funkcji napi
ę
cia.
Uzyskana krzywa jest charakterystyk
ą
pr
ą
dowo-napi
ę
ciow
ą
elektrolizera, która mo
ż
e by
ć
aproksymowana przez dwie przecinaj
ą
ce si
ę
linie proste. Narysuj te linie i zaznacz punkt
ich przeci
ę
cia z osi
ą
napi
ę
cia. Ten punkt wyznacza praktycznie napi
ę
cie rozkładu wody
(schemat 2.2a)
U[V]
Wykres 2.2.a Charakterystyka pr
ą
dowo-napi
ę
ciowa elektrolizera
Dyskusja
Zale
ż
no
ść
mi
ę
dzy pr
ą
dem i napi
ę
ciem jest przedstawiona na wykresie 2.2.a.
Krzywa wykazuje,
ż
e pr
ą
d zaczyna płyn
ąć
przez elektrolizer od pewnej warto
ś
ci
przyło
ż
onego napi
ę
cia. Rozkład wody na wodór i tlen nast
ę
puje tylko wtedy gdy przez
elektrolizer płynie pr
ą
d. W naszym przykładzie ten proces zachodzi przy napi
ś
ciu
wi
ę
kszym ni
ż
1,5V (patrz tablica 2.2.a).
Napi
ę
cie rozkładu jest wyznaczone przez punkt przeci
ę
cia osi napi
ę
cia i prostej
przybli
ż
aj
ą
cej strom
ą
cz
ęść
charakterystyki.
Teoretyczne napi
ę
cie rozkładu wynosi 1,23V. Poni
ż
ej tej warto
ś
ci rozkład nie zachodzi.
Jednak
ż
e w praktyce to napi
ę
cie jest wy
ż
sze z powodu rezystancji przej
ś
ciowych.
Ró
ż
nica mi
ę
dzy warto
ś
ci
ą
teoretyczn
ą
i rzeczywist
ą
tego napi
ę
cia zale
ż
y od wielu
czynników, np. od typu i składu materiału elektrod, elektrolitu i temperatury.
V
d
=1,5V
23
2.3. Sprawno
ść
energetyczna i sprawno
ść
Faradaya elektrolizera PEM
Przed rozpocz
ę
ciem eksperymentu nale
ż
y zapozna
ć
si
ę
z zasadami bezpiecze
ń
stwa i
Instrukcj
ą
Obsługi
Aparatura
•
elektrolizer PEM
•
wyskalowany zbiornik wodoru do celów eksperymentalnych
•
woltomierz i amperomierz
•
stoper
•
ź
ródło napi
ę
cia
a) regulowane
b) alternatywnie: nieregulowane np.: moduł słoneczny ze
ź
ródłem
ś
wiatła
Wykonanie
ć
wiczenia
a) ze
ź
ródłem regulowanym: Podł
ą
cz elektrolizer do
ź
ródła napi
ę
cia jak na
schemacie 2.3.a. Napi
ę
cie musi by
ć
wi
ę
ksze od 1,5 VDC lecz mniejsze od 2V.
Dla baterii elektrolizerów to napi
ę
cie b
ę
dzie wielokrotno
ś
ci
ą
(równ
ą
ilo
ś
ci
pojedynczych elektrolizerów w tej baterii) tego napi
ę
cia .
V
Regulowane
ź
ródło napi
ę
cia
elektrolizer
Schemat obwodu 2.3.a: układ do wyznaczania sprawno
ś
ci energetycznej i sprawno
ś
ci
Faradaya elektrolizera z regulowanym
ź
ródłem napi
ę
cia
b) ze
ź
ródłem nieregulowanym: Podł
ą
cz elektrolizer do modułu słonecznego i o
ś
wietl
go. To da napi
ę
cie pomi
ę
dzy 1,5 V i 2V.
Procedury i dane
Uruchom aparatur
ę
tak jak to opisano w Instrukcji Obsługi.
Przed rozpocz
ę
ciem pomiarów elektrolizer powinien kilka minut pracowa
ć
. Wył
ą
cz
napi
ę
cie i otwórz zawory wylotowe gazów aby opró
ż
ni
ć
elektrolizer. Po usuni
ę
ciu gazów
napełnij elektrolizer wod
ą
destylowan
ą
. Poziom wody musi odpowiada
ć
kresce
oznaczonej 0 cm
3
na elektrolizerze, przy patrzeniu w poziomie. Zamknij teraz zawory
wylotowe gazów.

24
Rozpocznij pomiar czasu w momencie przył
ą
czenia elektrolizera do
ź
ródła napi
ę
cia.
Zapisuj napi
ę
cie przyło
ż
one do elekrtolizera i warto
ść
pr
ą
du. Zapisuj czas, pr
ą
d i napi
ę
cie
gdy poziom wody w zbiorniczku osi
ą
ga główne znaczniki. dokonaj równie
ż
pomiaru gdy
zbiornik gazu zostanie całkowicie napełniony (20 cm3 w naszym przypadku).
Przykład (dla elektrolizera h-tec Junior)
V
H2
[cm
3
]
t [s]
U [V]
I [A]
P [W]
0
0
1,9
1,73
3,29
5
23
1,9
1,73
3,29
10
47
1,9
1,73
3,29
15
68
1,9
1,73
3,29
20
92
1,9
1,73
3,29
Tablica 2.3.a
Elektrolizer PEM wytwarza wodór i tlen je
ś
li przyło
ż
one napi
ę
cie przekracza napi
ę
cie
rozkładu.
Sprawno
ść
energetyczna
Podstawy
Sprawno
ść
energetyczna
ηηηη
energy
jest stosunkiem energii u
ż
ytecznej E
uz
do energii
pobranej E
po
. Energia u
ż
yteczna jest to energia chemiczna zmagazynowana w
wytworzonym wodorze, energia pobrana jest to energia elektryczna dostarczona
elektrolizerowi.
a
elektryczn
wodoru
po
uz
energy
E
E
E
E
=
=
η
Analiza (cz
ęść
1)
Wykonaj wykres obj
ę
to
ś
ci wyprodukowanego gazu w funkcji czasu
25
0
5
10
15
20
25
0
10
20
30
40
50
60
70
80
90
100
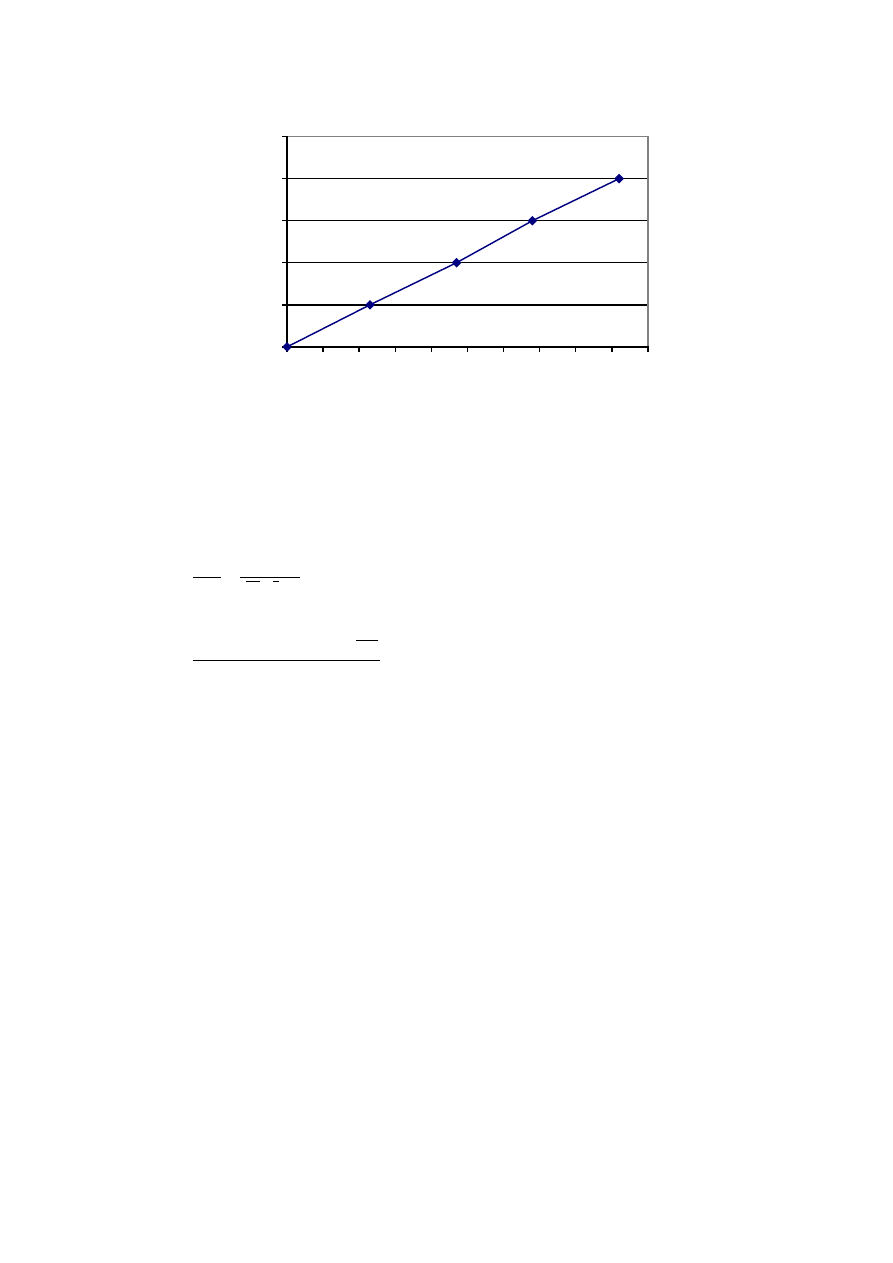
Wykres 2.3.a Zale
ż
no
ść
obj
ę
to
ś
ci wyprodukowanego gazu od czasu
Analiza (cz
ęść
2)
Obliczenie sprawno
ś
ci energetycznej elektrolizera.
Przykład (dla elektrolizera h-tec Junior)
t
I
U
H
V
E
E
h
H
po
uz
energy
⋅
⋅
⋅
=
=
2
η
%
84
843
,
0
92
73
,
1
9
,
1
10
745
,
12
10
2
3
6
3
5
≈
=
⋅
⋅
⋅
⋅
⋅
=
−
s
A
V
m
J
m
energy
η
gdzie
H
h
ciepło spalania
1)
wodoru = 12,745 x 10
6
J/m
3
V
H2
obj
ę
to
ść
wyprodukowanego wodoru w m
3
U
napi
ę
cie w V
I
pr
ą
d w A
t
czas w s
1)
Ciepło spalania (calorific value) jest definiowane jako energia wydzialona w czasie
spalania (utleniania) substancji. Uwzgl
ę
dnia ono energi
ę
zawart
ą
w parze wodnej jako
ciepło kondensacji. (Ta energie nie mo
ż
e by
ć
wykorzystana w konwencjonalnych
systemach spalania. Definiuje si
ę
równie
ż
wielko
ść
która tego ciepła nie zawiera, jest to
warto
ść
opałowa (heating value) która jest wykorzystywana do obliczania sprawno
ś
ci
systemów grzewczych, maszyn i ogniw paliwowych.)
Dyskusja
Tablica wyra
ź
nie wykazuje,
ż
e zu
ż
ycie energii przez elektrolizer jest stałe w czasie.
Równie
ż
wielko
ść
produkcji wodoru jest stała w czasie, poniewa
ż
jest to linowa funkcja
czasu.

26
Sprawno
ść
energetyczna elektrolizera w naszym przykładzie wynosi 84%. Oznacza to,
ż
e 84% energii elektrycznej zu
ż
ytej przez elektrolizer jest zmagazynowane w wodorze.
Straty wynikaj
ą
z ró
ż
nic pomi
ę
dzy teoretycznym i rzeczywistym napi
ę
ciem rozkładu dla
poszczególnych elektrod, z rezystancji wewn
ę
trznej urz
ą
dzenia i ze strat dyfuzji gazów w
celach.
Sprawno
ść
Faradaya elektrolizera PEM
Podstawy
Zale
ż
no
ść
mi
ę
dzy pr
ą
dem i teoretyczn
ą
obj
ę
to
ś
ci
ą
wytworzonego gazu mo
ż
na
wyznaczy
ć
przy u
ż
yciu drugiego prawa Faradaya i równania stanu gazu
doskonałego. Sprawno
ść
Faradaya ogniwa paliwowego wyznacza si
ę
jako
stosunek wyliczonej teoretycznej obj
ę
to
ś
ci gazu do obj
ę
to
ś
ci rzeczywistej.
Analiza
Drugie prawo Faradaya ma posta
ć
:
F
z
n
t
I
Q
⋅
⋅
=
⋅
=
Równanie stanu gazu idealnego ma posta
ć
:
T
R
n
V
p
⋅
⋅
=
⋅
Ł
ą
cz
ą
c te dwa równania otrzymujemy
z
p
F
t
T
I
R
V
⋅
⋅
⋅
⋅
⋅
=
gdzie:
V
Teoretyczna obj
ę
to
ść
wytworzonego gazu w m
3
R
uniwersalna stała gazowa 8,314 J/mol·K
p
ci
ś
nienie otoczenia w Pa (1Pa=1N/m
2
)
F
stała Faradaya 96485 C/mol (1C=1As)
T
temperatura otoczenia w K
I
pr
ą
d w A
t
czas w s
z
liczba elektronów koniecznych do uwolnienia cz
ą
steczki dla H
2
= 2, tzn 2 mole
elektronów s
ą
potrzebne do uwolnienia 1 mola H
2
, dla O
2
= 4
W przypadku szeregowej baterii elektrolizerów pr
ą
d płynie przez ka
ż
dy z nich,
wytworzony gaz jest sum
ą
gazów wytworzonych w poszczególnych elektrolizerach.
2
10
013
,
1
96485
92
298
73
,
1
314
,
8
5
⋅
⋅
⋅
⋅
⋅
⋅
⋅
=
⋅
⋅
⋅
⋅
⋅
=
Pa
mol
C
s
K
A
K
mol
j
z
p
F
t
T
I
R
V
oblicz
V
oblicz
=2,02·10
-5
m
3
=20,2cm
3

27
Sprawno
ść
Faradaya wyznaczamy z zale
ż
no
ś
ci
oblicz
H
wytworzony
H
Faradaya
V
V
2
2
=
η
Obj
ę
to
ść
gazu wytworzonego w do
ś
wiadczeniu wynosi;
V
H2wytworzony
=20 cm
3
St
ą
d sprawno
ść
Faradaya jest :
%
99
99
,
0
2
,
20
20
3
3
=
=
=
Faradaya
Faradaya
cm
cm
η
η
Dyskusja
Ró
ż
nica pomi
ę
dzy teori
ą
(
η
=100% ) i praktyk
ą
(
η
Faradaya
=99%) wynosi 1%. Wynika ona z
dyfuzji gazów w celach. Straty dyfuzji wynikaj
ą
z tego,
ż
e cz
ęść
gazów dyfunduje przez
membran
ę
elektrolizera, reaguje w kontakcie z katalizatorem i tworzy wod
ę
w
elektrolizerze.
Eksperymenty z ogniwami paliwowymi PEM
Do tych eksperymentów ogniwo paliwowe musi by
ć
dobrze nawil
ż
one (patrz instrukcja
obsługi). Jednak
ż
e je
ś
li wewn
ą
trz ogniwa jest zbyt wiele kropli, mo
ż
e to utrudni
ć
gazowi
przepływ i ogniwo nie b
ę
dzie mogło wła
ś
ciwie pracowa
ć
. Dlatego proponujemy
ż
eby:
•
Rozpoczynaj
ą
c prac
ę
ogniwa trzyma
ć
si
ę
ś
ci
ś
le Instrukcji Obsługi
•
Zatrzyma
ć
prac
ę
na chwil
ę
wył
ą
czaj
ą
c zasilanie elektrolizera i odł
ą
czaj
ą
c obci
ąż
enia
ogniwa paliwowego.
•
Odł
ą
czy
ć
w
ęż
e doprowadzaj
ą
ce gazy do ogniwa ze zbiorniczków, otworzy
ć
zaciski
wentylacyjne ogniwa paliwowego i krótko ale silnie przedmucha
ć
ogniwo (z obu
stron). To powinno usun
ąć
krople wody z ogniwa.
•
Zamkn
ąć
zaciski wentylacyjne i podł
ą
czy
ć
w
ęż
e do zbiorniczków.
2.4. Charakterystyka napi
ę
ciowo-pr
ą
dowa i krzywa mocy ogniwa
paliwowego PEM
Przed rozpocz
ę
ciem eksperymentu nale
ż
y zapozna
ć
si
ę
z zasadami bezpiecze
ń
stwa i
Instrukcj
ą
Obsługi
Podstawy
Ogniwo paliwowe przekształca energi
ę
chemiczn
ą
zmagazynowan
ą
w wodorze i
tlenie bezpo
ś
rednio w energi
ę
elektryczn
ą
. Wodór i tlen s
ą
doprowadzane do ogniwa
paliwowego gdzie reaguj
ą
ze sob
ą
tworz
ą
c wod
ę
i oddaj
ą
c energi
ę
elektryczn
ą
i
ciepło.
28
Moc oddawana przez ogniwo zale
ż
y od rezystancji obci
ąż
enia. Celem tego
eksperymentu jest wyznaczenie rezystancji i tym samym pr
ą
du dla optymalnej mocy.
Aparatura
•
elektrolizer PEM
•
woltomierz i amperomierz
•
opornik dekadowy, zmienny lub wyskalowany potencjometr
•
ź
ródło wodoru
a) elektrolizer, w tym przypadku b
ę
d
ą
równie
ż
potrzebne:
o
ź
ródło energii, takie jak moduł słoneczny lub zasilacz laboratoryjny
o
ź
ródło
ś
wiatła do o
ś
wietlenia modułu słonecznego
•
zbiornik wodoru, np. ci
ś
nieniowa butla z wodorem, zbiornik metalowo-wodorkowy.
Wykonanie
ć
wiczenia
Poł
ą
cz aparatur
ę
zgodnie ze schematem 2.4.a
Schemat 2.4.a Schemat obwodu do wyznaczania charakterystyki pr
ą
dowo-napi
ę
ciowej
ogniwa paliwowego
Procedury i dane
Uruchom przyrz
ą
dy zgodnie z Instrukcj
ą
Obsługi.
W przypadku ogniwa paliwowego wodorowo-powietrznego nie jest potrzebny tlen, to
znaczy,
ż
e poni
ż
sza instrukcja odnosi si
ę
tylko do wodoru.
a) Poł
ą
cz elektrolizer ze
ź
ródłem napi
ę
cia w celu wytworzenia wodoru i tlenu. Poł
ą
cz
wyj
ś
cia elektrolizera z wej
ś
ciami ogniwa paliwowego (najlepiej za po
ś
rednictwem
wyskalowanego zbiornika, jest to idealne do celów eksperymentalnych). Zamknij
wyj
ś
cia ogniwa paliwowego. Po wytworzeniu co najmniej 5 cm3 wodoru, otwórz
wyj
ś
cia ogniwa paliwowego, przedmuchaj je gazem i zamknij. Taka procedura
usuwa pozostało
ś
ci gazu i musi by
ć
wykonana aby unikn
ąć
bł
ę
dów pomiarowych.
V
Ogniwo
paliwowe
opornik
dekadowy
29
Ż
eby zapobiec zu
ż
ywaniu wodoru przez ogniwo paliwowe na tym etapie, obwód
zewn
ę
trzny ogniwa musi by
ć
otwarty (nie ma przepływu pr
ą
du).
Teraz rozpocznij produkcj
ę
wodoru. Rozpocznij zapisywanie danych do charakterystyki
pr
ą
dowo-napi
ę
ciowej od otwartego obwodu (R=
∞
), potem wł
ą
cz opornik dekadowy i
stopniowo zmniejszaj jego rezystancj
ę
. Dla ka
ż
dego obci
ąż
enia zapisuj warto
ś
ci pr
ą
du i
napi
ę
cia. Aby otrzyma
ć
warto
ś
ci reprezentatywne nale
ż
y po ka
ż
dej zmianie odczeka
ć
20s.
Przykład (dla eksperymentalnego systemu wodorowego h-tec JuniorBasic)
R[
Ω
]
U [V]
I[A]
P [W]
P=U
x
I
∞
0,99
0,00
0,000
330
0,97
0,01
0,001
100
0,94
0,01
0,001
33
0,90
0,03
0,027
10
0,84
0,08
0,067
3,3
0,76
0,22
0,167
1
0,62
0,56
0,347
0,33
0,47
1,05
0,494
0,1
0,32
1,43
0,458
0
0,24
1,61
0,386
Tablica 2.4.a Wyniki pomiarów napi
ę
cia i pr
ą
du dla ró
ż
nych rezystancji obci
ąż
enia
b) Zamknij wyj
ś
cia ogniwa paliwowego. Poł
ą
cz wyj
ś
cia
ź
ródła wodoru do wej
ść
ogniwa paliwowego (patrz Instrukcj
ę
Obsługi). Otwórz wyj
ś
cia ogniwa
paliwowego, przeczy
ść
ogniwo wodorem, potem zamknij wyj
ś
cia. To usuwa
pozostało
ś
ci gazu powoduj
ą
ce bł
ę
dy pomiarowe. Aby zapobiec zu
ż
ywaniu
wodoru przez ogniwo przed pomiarami, jego obwód zewn
ę
trzny musi by
ć
otwarty
(nie ma przepływu pr
ą
du).
Przy pomiarach charakterystyki pr
ą
dowo-napi
ę
ciowej ogniwa rozpocznij od pomiaru przy
otwartym obwodzie. Potem wł
ą
cz opornik dekadowy i wykonuj
ą
c pomiary zmniejszaj
stopniowo jego rezystancj
ę
. Po ka
ż
dej zmianie odczekaj 20 sekund aby uzyska
ć
reprezentatywny wynik.
Analiza
Wykonaj wykres charakterystyki pr
ą
dowo-napi
ę
ciowej.
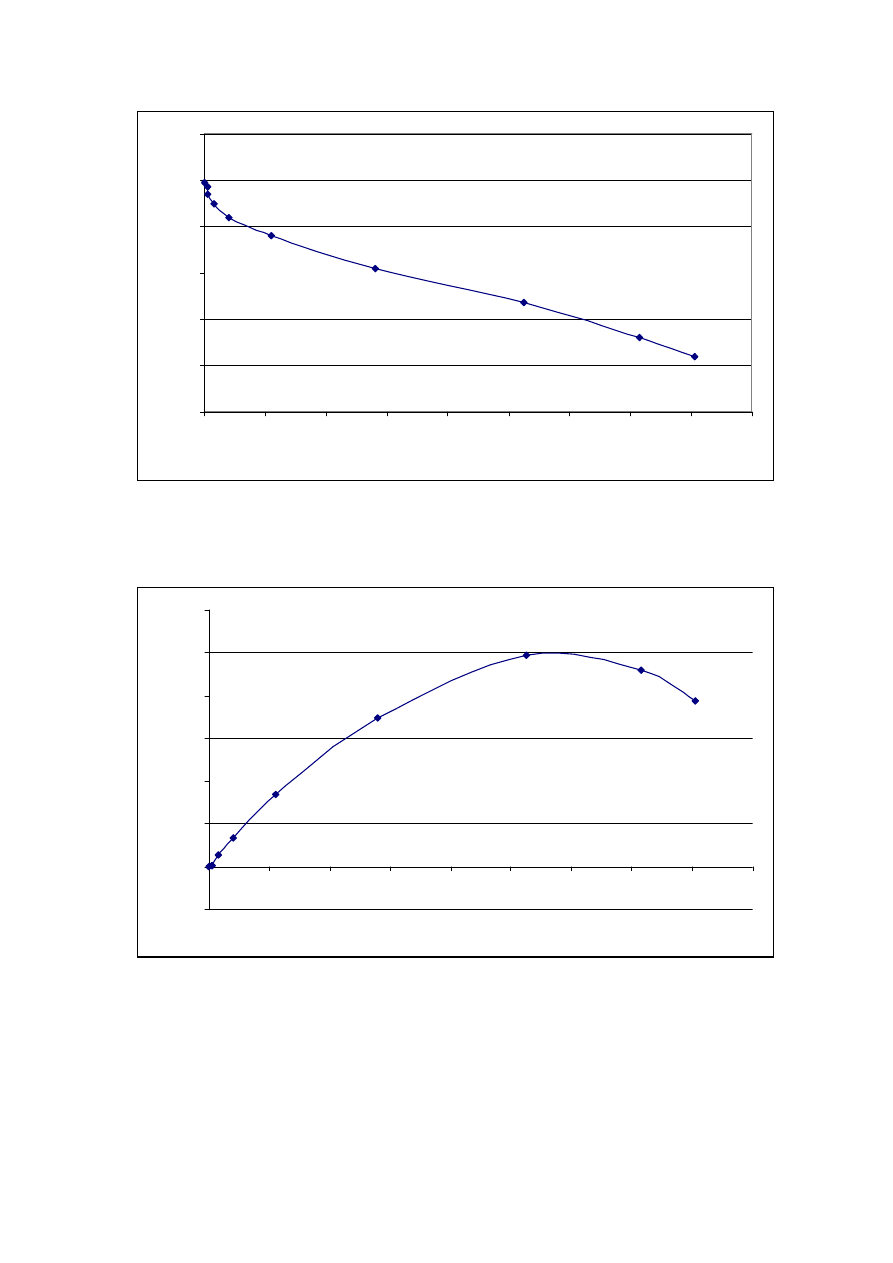
30
0
0,2
0,4
0,6
0,8
1
1,2
0
0,2
0,4
0,6
0,8
1
1,2
1,4
1,6
1,8
I[A]
U
[V
]
Wykres 2.4.a Charakterystyka pr
ą
dowo-napi
ę
ciowa ogniwa paliwowego
Wykonaj wykres mocy w funkcji pr
ą
du
-0,1
0
0,1
0,2
0,3
0,4
0,5
0,6
0
0,2
0,4
0,6
0,8
1
1,2
1,4
1,6
1,8
I [A]
P
[
W
]
Wykres 2.4.b Krzywa mocy ogniwa paliwowego
Dyskusja
Z powy
ż
szej krzywej mo
ż
na odczyta
ć
warto
ść
pr
ą
du dla której ogniwo paliwowe oddaje
najwi
ę
ksz
ą
moc. Ogniwo ma maksymaln
ą
moc dla pr
ą
du 1,05A co odpowiada
rezystancji obci
ąż
enia 0,33
Ω
(patrz tablica 2.4.a).
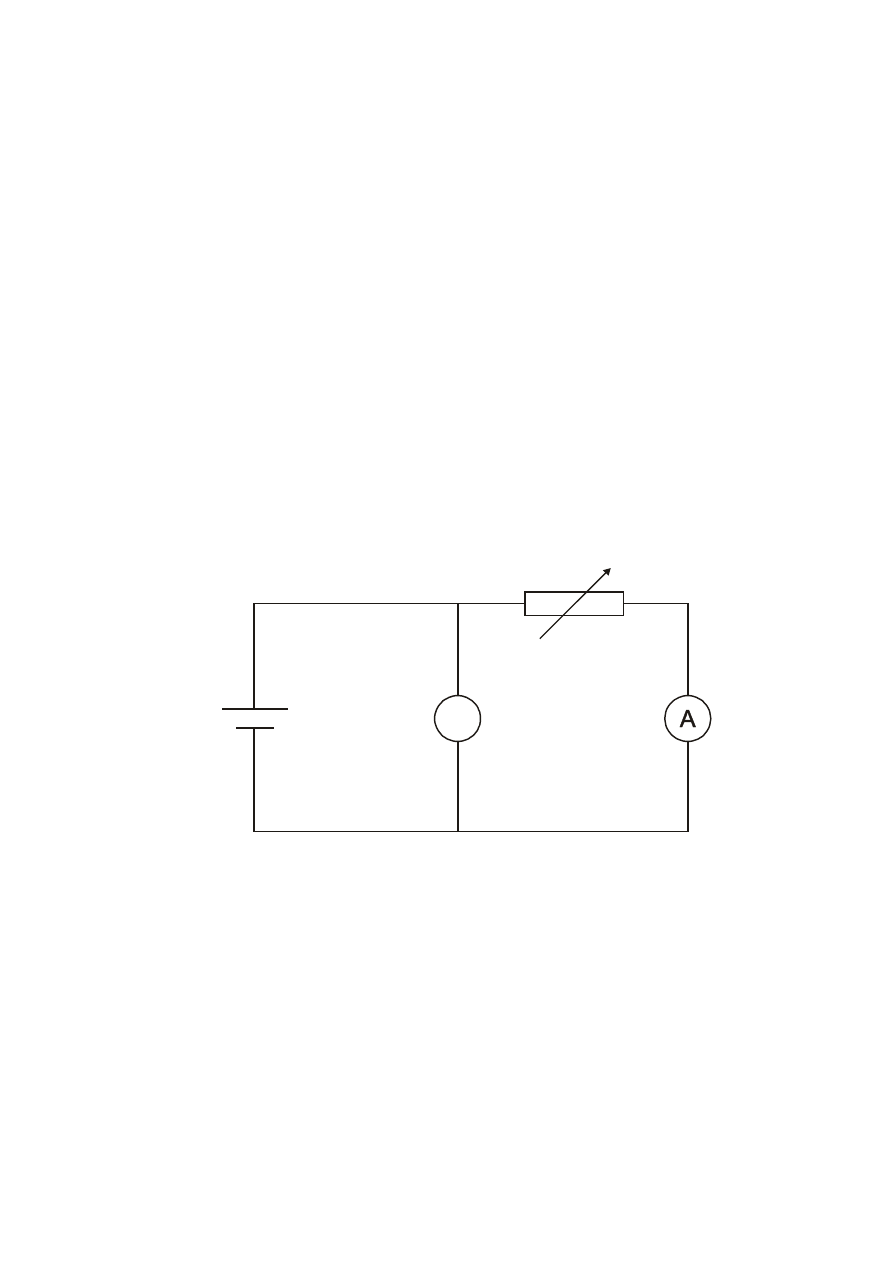
31
2.5. Sprawno
ść
energetyczna i sprawno
ść
Faradaya ogniwa paliwowego
PEM
Przed rozpocz
ę
ciem eksperymentu nale
ż
y zapozna
ć
si
ę
z zasadami bezpiecze
ń
stwa i
Instrukcj
ą
Obsługi
Aparatura
•
ogniwo paliwowe PEM
•
ź
ródło wodoru np. elektrolizer PEM, wyskalowany zbiornik wodoru
•
ź
ródło napi
ę
cie, je
ś
li jest wykorzystywany elektrolizer np. moduł słoneczny lub
zasilacz laboratoryjny
•
ź
ródło
ś
wiatła, je
ś
li jest wykorzystywany moduł słoneczny
•
woltomierz i amperomierz
•
opornik dekadowy, zmienny lub wyskalowany potencjometr
•
stoper
Wykonanie
ć
wiczenia
Poł
ą
cz aparatur
ą
zgodnie ze schematem 2.5.
V
Ogniwo
paliwowe
opornik
dekadowy
Schemat 2.5. Układ do wyznaczania sprawno
ś
ci energetycznej i Faradaya ogniwa paliwowe
Procedury i dane
Uruchom przyrz
ą
dy zgodnie z Instrukcj
ą
Obsługi.
Podł
ą
cz wyj
ś
cie zbiorniczka wodoru elektrolizera do wej
ś
cia ogniwa paliwowego.
Zamknij wyj
ś
cie ogniwa paliwowego. Wyprodukuj ok. 20 cm
3
wodoru, po czym na chwil
ę
otwórz wylot ogniwa paliwowego aby je przewentylowa
ć
. Wyprodukuj maksymaln
ą
, mo
ż
liw
ą
w tym układzie obj
ę
to
ść
wodoru (w tym przykładzie 20 cm
3
). Wył
ą
cz zasilanie elektrolizera.
Odł
ą
cz opornik dekadowy od ogniwa paliwowego i ustaw rezystancj
ę
przy której ma by
ć
wyznaczana sprawno
ść
. poł
ą
cz opornik dekadowy z ogniwem paliwowym i rozpocznij
wykonywa
ć
pomiary.

32
Zapisuj zmierzony czas, pr
ą
d i napi
ę
cie ogniwa dla ustalonych obj
ę
to
ś
ci wodoru. Nie
zmieniaj rezystancji. Upewnij si
ę
,
ż
e nie ma nadmiernych fluktuacji pr
ą
du. Ka
ż
de istotne
zmniejszenie warto
ś
ci pr
ą
du jest prawdopodobnie wywołane pozostało
ś
ciami gazu które
utrudniaj
ą
działanie ogniwa paliwowego. Najprawdopodobniej nie b
ę
dzie to istotnym
problemem poniewa
ż
mo
ż
e to wyst
ę
powa
ć
wtedy gdy w zbiorniczku pozostanie mała ilo
ść
wodoru (mniej ni
ż
5 cm
3
)
Przykład (dla eksperymentalnego systemu wodorowego h-tec JuniorBasic)
Zawarto
ść
zbiorniczka
V
H2
[cm
3
]
t [s]
U [V]
I [A]
P [W]
20
0
0,73
0,21
0,153
15
175
0,72
0,21
0,151
10
356
0,72
0,21
0,151
Warto
ś
ci
ś
rednie
0,72
0,21
0,152
Sprawno
ść
energetyczna ogniwa paliwowego PEM
Podstawy
Sprawno
ść
energetyczna
ηηηη
energy
jest stosunkiem energii u
ż
ytecznej E
uz
do energii
pobranej E
po
. Energia u
ż
yteczna jest to energia rozproszona w oporniku
dekadowym, podczas gdy energia pobrana jest to energia chemiczna
zmagazynowana w wytworzonym wodorze.
wodoru
a
elektryczn
po
uz
energy
E
E
E
E
=
=
η
Analiza (cz
ęść
1)
Wykonaj wykres zale
ż
no
ś
ci zu
ż
ytego wodoru od czasu.
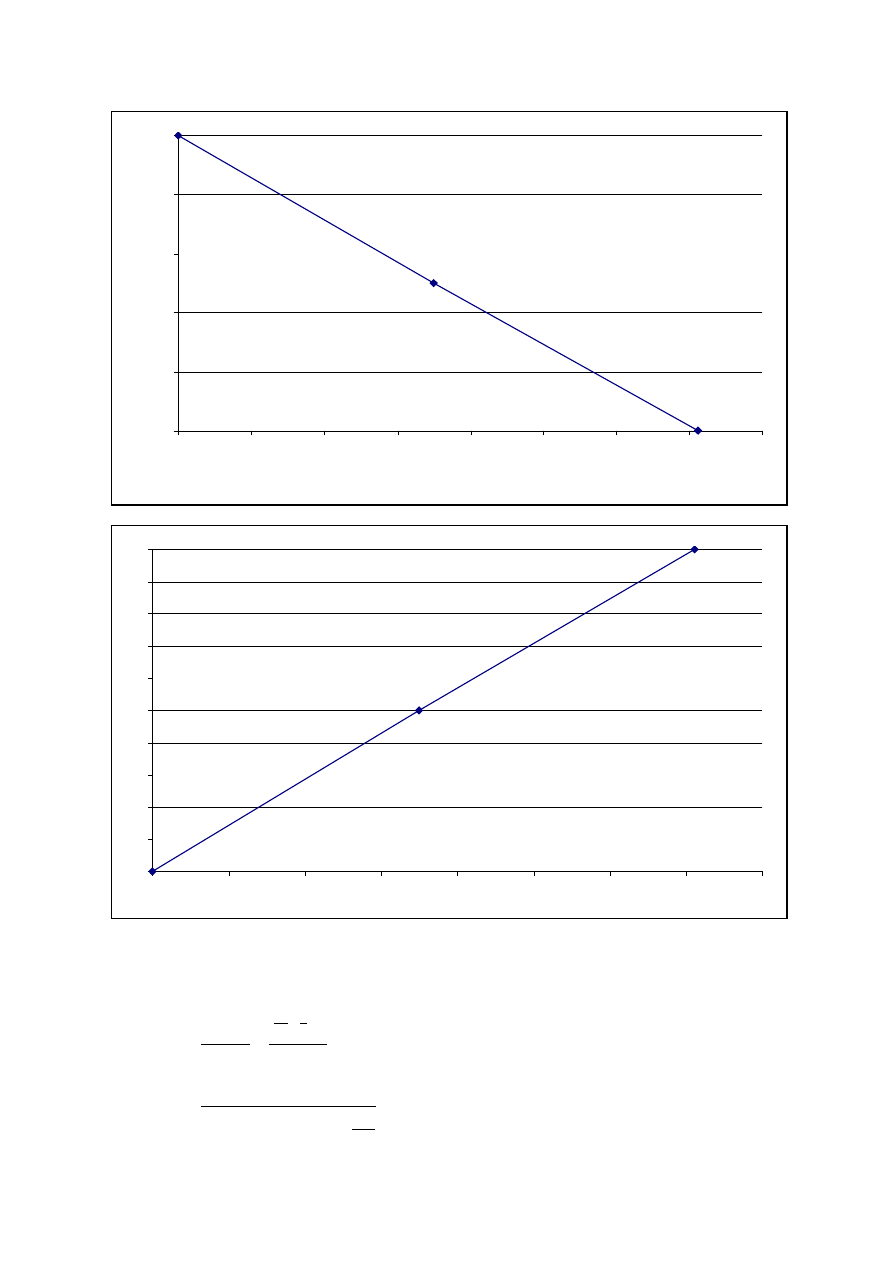
33
10
12
14
16
18
20
0
50
100
150
200
250
300
350
400
t [s]
V
[c
m
3
]
0
1
2
3
4
5
6
7
8
9
10
0
50
100
150
200
250
300
350
400
Wykres 2.5.a Zale
ż
no
ść
zawarto
ś
ci zbiorniczka wodoru od czasu
Analiza (cz
ęść
2)
Oblicz sprawno
ść
energetyczn
ą
ogniwa paliwowego.
l
H
wodoru
elektr
energy
H
V
t
I
U
E
E
⋅
⋅
⋅
=
=
2
η
%
50
498
,
0
10
8
,
10
10
10
356
21
,
0
72
,
0
3
6
3
6
≈
=
⋅
⋅
⋅
⋅
⋅
=
−
m
J
m
s
A
V
energy
η
34
gdzie:
H
l
warto
ść
opałowa
1)
wodoru = 10,8 x 10
6
J/m
3
V
H2
obj
ę
to
ść
zu
ż
ytego wodoru w m
3
U
napi
ę
cie w V
I
pr
ą
d w A
t
czas w s
1)
Ciepło spalania (calorific value) jest definiowane jako energia wydzielona w czasie
spalania (utleniania) substancji. Uwzgl
ę
dnia ono energi
ę
zawart
ą
w parze wodnej jako ciepło
kondensacji. (Ta energie nie mo
ż
e by
ć
wykorzystana w konwencjonalnych systemach
spalania. Definiuje si
ę
równie
ż
wielko
ść
która tego ciepła nie zawiera, jest to warto
ść
opałowa (heating value) która jest wykorzystywana do obliczania sprawno
ś
ci systemów
grzewczych, maszyn i ogniw paliwowych.)
Dyskusja
Z tablicy i z wykresu wyra
ź
nie wida
ć
,
ż
e moc elektryczna ogniwa paliwowego a tak
ż
e
zu
ż
ycie wodoru w czasie s
ą
w przybli
ż
eniu stałe.
Sprawno
ść
energetyczna ogniwa paliwowego w naszym przypadku wynosi 50% to
znaczy,
ż
e 50% energii zgromadzonej w wodorze zostało przetworzone na energi
ę
elektryczn
ą
. Ogniwo paliwowe wytwarza równie
ż
ciepło. Je
ś
li nie zostanie wykorzystane ono,
to nale
ż
y je uwa
ż
a
ć
za strat
ę
energii. Do oblicze
ń
idealnej sprawno
ś
ci
η
id
jest definiowane
jako stosunek wolnej entalpii reakcji
∆
G (praca uwolniona w czasie reakcji, np. jako energia
elektryczna) do entalpii reakcji
∆
H (energia uwolniona w czasie reakcji.
H
G
id
∆
∆
=
η
Uwolnione w czasie reakcji ciepło jest ró
ż
nic
ą
pomi
ę
dzy woln
ą
entalpi
ą
reakcji
∆
G i
entalpi
ą
reakcji
∆
H
S
T
Q
∆
⋅
=
S
T
G
H
∆
⋅
+
∆
=
∆
mol
J
Kmol
J
K
H
S
T
H
S
T
H
H
G
id
285840
985
,
162
298
1
1
−
−
⋅
−
=
∆
∆
⋅
−
=
∆
∆
⋅
−
∆
=
∆
∆
=
η
%
83
83
,
0
=
=
id
η
gdzie:
T temperatura =298K
∆
S.
entropia reakcji = -162,985 J/kmol
∆
H
entalpia reakcji = -285840 J/mol

35
Straty napi
ę
cia które równie
ż
przetwarzaj
ą
si
ę
na ciepło dodatkowo obni
ż
aj
ą
sprawno
ść
.
Te straty i straty spowodowane rezystancj
ą
wewn
ę
trzn
ą
ogniwa a tak
ż
e stratami dyfuzyjnymi
w ogniwie s
ą
przyczyn
ą
tego,
ż
e napi
ę
cie wyj
ś
ciowe ogniwa nie osi
ą
ga idealnej warto
ś
ci
1,23V.
Podobnie jak w elektrolizerze, sprawno
ść
ogniwa paliwowego silnie zale
ż
y od mocy.
Je
ś
li obci
ąż
enie ma du
żą
rezystancj
ę
elektryczn
ą
to chocia
ż
ogniwo paliwowe ma wysok
ą
sprawno
ść
to pracuje ono przy tylko cz
ęś
ciowym obci
ąż
eniu. Moc oddawana jest z tego
powodu mniejsza ni
ż
ogniwo mogłoby wytwarza
ć
.
W celu okre
ś
lenia rezystancji obci
ąż
enia przy której moc oddawana przez ogniwo jest
najwi
ę
ksza, ten eksperyment mo
ż
e by
ć
powtórzony przy ró
ż
nych rezystancjach (zalecane 10
do 0,1
Ω
).
Sprawno
ść
Faradaya ogniwa paliwowego Pem
Podstawy
Zale
ż
no
ść
mi
ę
dzy pr
ą
dem i teoretyczn
ą
obj
ę
to
ś
ci
ą
zu
ż
ytego gazu mo
ż
na
wyznaczy
ć
przy u
ż
yciu drugiego prawa Faradaya i równania stanu gazu
doskonałego. Sprawno
ść
Faradaya ogniwa paliwowego wyznacza si
ę
jako
stosunek wyliczonej teoretycznej obj
ę
to
ś
ci gazu do obj
ę
to
ś
ci rzeczywistej.
Analiza
Drugie prawo Faradaya ma posta
ć
:
F
z
n
t
I
Q
⋅
⋅
=
⋅
=
Równanie stanu gazu idealnego ma posta
ć
:
T
R
n
V
p
⋅
⋅
=
⋅
Ł
ą
cz
ą
c te dwa równania otrzymujemy
z
p
F
t
T
I
R
V
⋅
⋅
⋅
⋅
⋅
=
Gdzie:
V
Teoretyczna obj
ę
to
ść
wytworzonego gazu w m
3
R
uniwersalna stała gazowa 8,314 J/mol·K
p
ci
ś
nienie otoczenia w Pa (1Pa=1N/m
2
)
F
stała Faradaya 96485 C/mol (1C=1As)
T
temperatura otoczenia w K
I
pr
ą
d w A
t
czas w s
z
liczba elektronów koniecznych do uwolnienia cz
ą
steczki dla H
2
= 2, tzn 2 mole
elektronów s
ą
potrzebne do uwolnienia 1 mola H
2
, dla O
2
= 4
36
W przypadku szeregowej baterii elektrolizerów pr
ą
d płynie przez ka
ż
dy z nich,
wytworzony gaz jest sum
ą
gazów wytworzonych w poszczególnych elektrolizerach.
Sprawno
ść
Faradaya wyznaczamy z relacji
zużuży
H
obliczone
H
Faradaya
V
V
2
2
=
η
Przykład (dla eksperymentalnego systemu wodorowego h-tec JuniorBasic)
V
H2(zużyte)
=10cm
3
2
10
013
,
1
96485
356
298
21
,
0
314
,
8
5
2
⋅
⋅
⋅
⋅
⋅
⋅
⋅
=
⋅
⋅
⋅
⋅
⋅
=
Pa
mol
C
s
K
A
K
mol
j
z
p
F
t
T
I
R
V
oblicz
H
V
H2(oblicz)
=9,48*10
-6
m
3
=9,48 cm
3
%
95
948
,
0
10
48
,
9
3
3
≈
=
=
cm
cm
Faradaya
η
Dyskusja
Obj
ę
to
ść
gazu rzeczywi
ś
cie zu
ż
yta jest nieco wi
ę
ksza od obliczeniowej. Powodem tego
s
ą
straty dyfuzyjne podobne do tych jakie wyst
ę
powały w elektrolizerze.
Zgodnie z wynikami pomiarów sprawno
ść
Faradaya jest nieco ni
ż
sza od tej sprawno
ś
ci
w przypadku elektrolizera. Przyczyn
ą
tej ró
ż
nicy jest mniejszy pr
ą
d płyn
ą
cy przez ogniwo.
Według Faradaya, powodem jest to,
ż
e wi
ę
cej czasu potrzeba na utworzenie wody ni
ż
na jej
rozbicie. W dłu
ż
szym czasie wi
ę
cej wodoru dyfunduje przez membran
ę
i jest tracone
bezu
ż
ytecznie.
2.6. Charakterystyki pr
ą
dowo napi
ę
ciowe bezpo
ś
redniego ogniwa
metanolowego (DMFC)
Przed rozpocz
ę
ciem eksperymentu nale
ż
y zapozna
ć
si
ę
z zasadami bezpiecze
ń
stwa i
Instrukcj
ą
Obsługi
Ostrze
ż
enie: Metanol jest truj
ą
cy
Podstawy
Moc oddawana przez DMFC zale
ż
y od rezystancji obci
ąż
enia. Nale
ż
y wyznaczy
ć
rezystancj
ę
przy której moc jest maksymalna.
Aparatura
•
bezpo
ś
rednie metanolowe ogniwo paliwowe
•
roztwór metanolu (<3%)
•
woltomierz i amperomierz
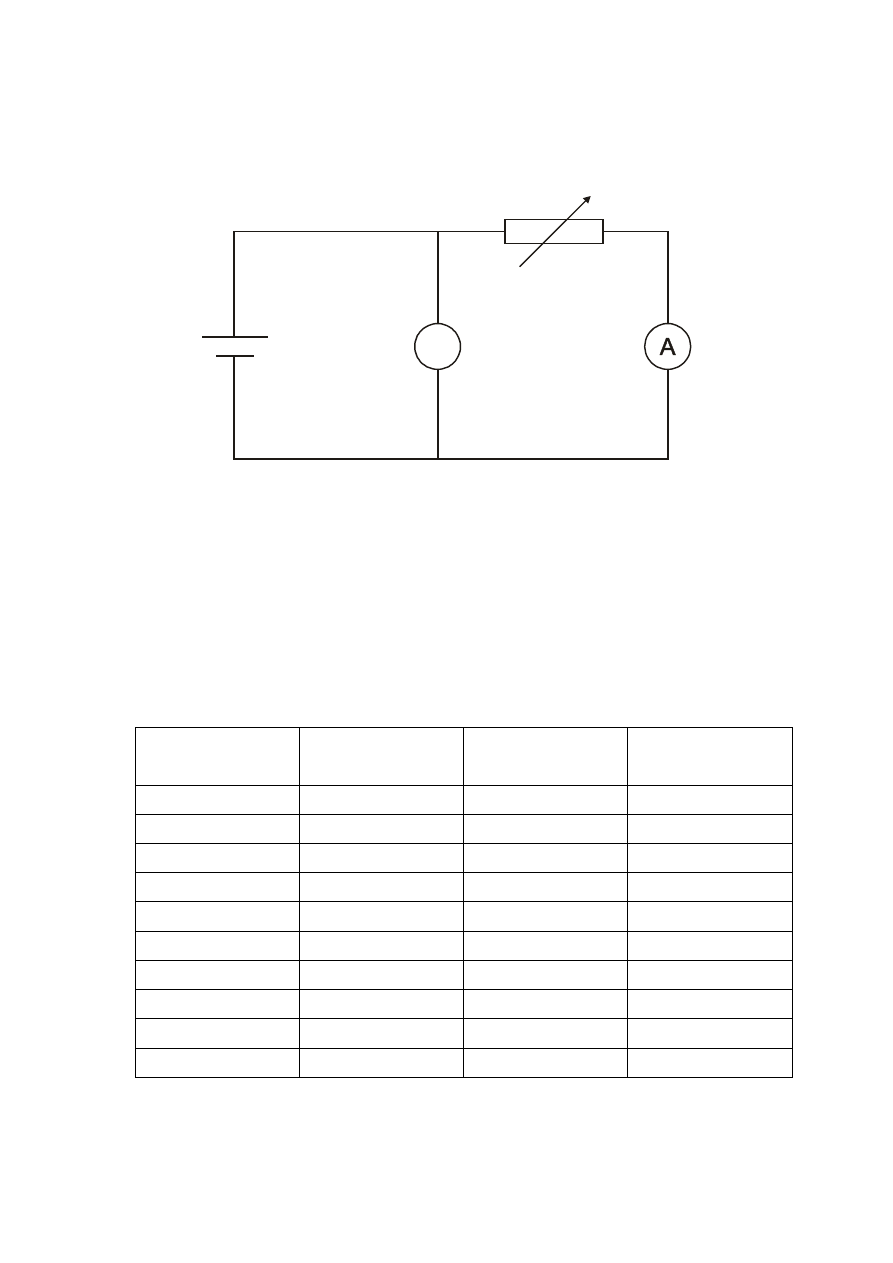
37
•
opornik dekadowy, zmienny lub wyskalowany potencjometr
Wykonanie
ć
wiczenia
Poł
ą
cz przyrz
ą
dy zgodnie ze schematem 2.6.
V
Bezpo
ś
rednie
metanolowe
ogniwo
paliwowe
opornik
dekadowy
Schemat 2.6. Obwód do wyznaczania charakterystyki pradowo-napi
ę
ciowej bezpo
ś
redniego
metanolowego ogniwa paliwowego DMFC
Procedury i dane
Przed rozpocz
ę
ciem pomiarów ogniwo DMFC musi odsta
ć
kilka minut z roztworem
metanolu aby osi
ą
gn
ę
ło stan ustalony i wyniki były reprezentatywne.
Wykonywanie pomiarów nale
ż
y rozpocz
ąć
od otwartego obwodu nast
ę
pnie nale
ż
y
stopniowo zmniejsza
ć
rezystancj
ę
opornika dekadowego. Po ka
ż
dej zmianie nale
ż
y
odczeka
ć
20 s przed wykonaniem pomiaru, aby wskazania si
ę
ustaliły.
Przykład (przy wykorzystaniu ogniwa Premium DMFC)
R[
Ω
]
U [V]
I[A]
P [mW]
P=U
x
I
∞
0,60
0,00
0,0
330
0,60
0,00
0,0
100
0,59
0,01
5,9
33
0,57
0,02
11,4
10
0,50
0,05
25,0
3,3
0,41
0,12
49,2
1
0,28
0,26
72,8
0,33
0,18
0,38
68,4
0,1
0,10
0,50
50,0
0
0,06
0,54
32,4
Tablica 2.6. Pomiary napi
ę
cia i pr
ą
du a zale
ż
no
ś
ci od rezystancji obci
ąż
enia.
Analiza
Wykorzystuj
ą
c wyniki pomiarów wykonaj wykres napi
ę
cia w funkcji pr
ą
du.
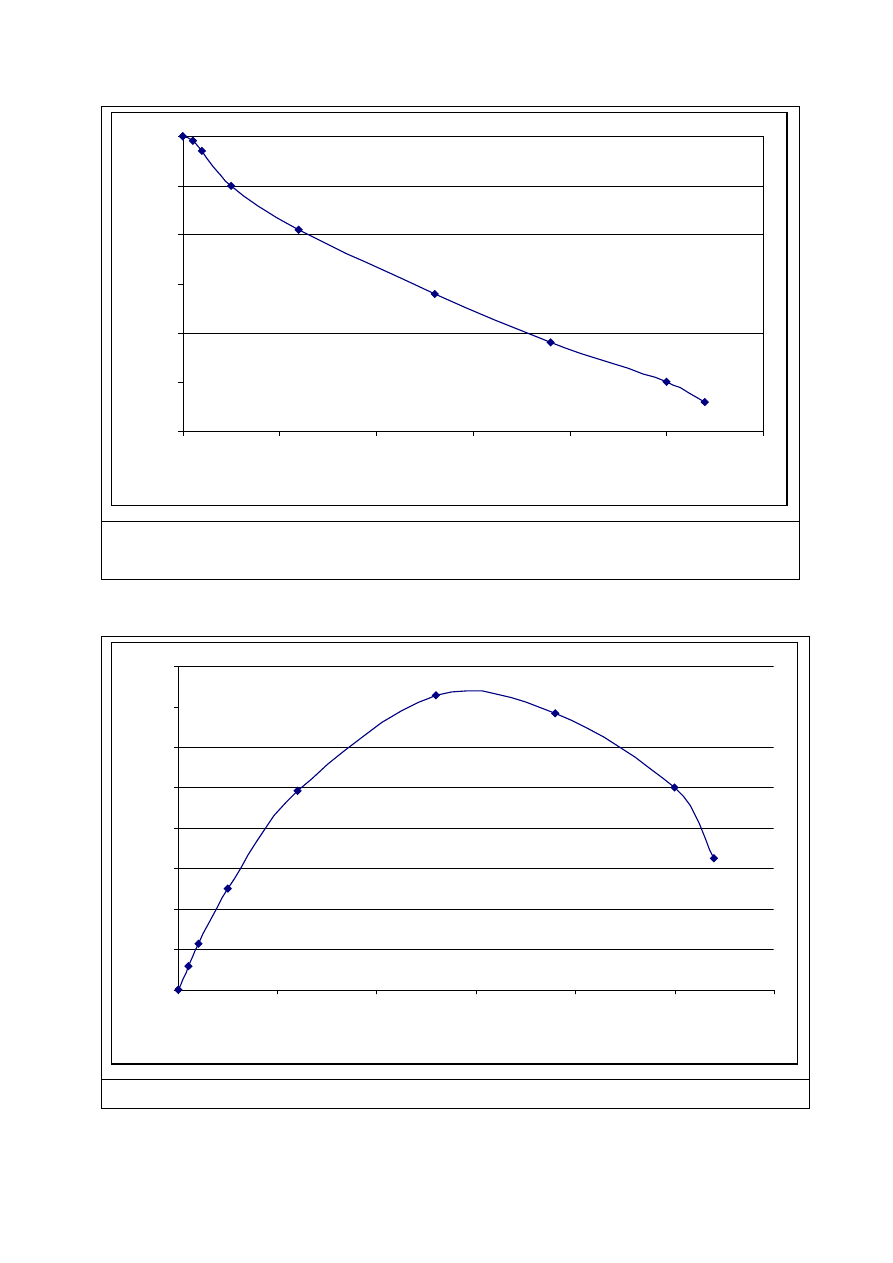
38
0
0,1
0,2
0,3
0,4
0,5
0,6
0
0,1
0,2
0,3
0,4
0,5
0,6
I [A]
U
[
V
]
Wykres 2.6.a. Charakterystyka pr
ą
dowo-napi
ę
ciowa bezpo
ś
redniego metanolowego ogniwa
paliwowego
Wykonaj wykres mocy ogniwa w funkcji pr
ą
du
0
10
20
30
40
50
60
70
80
0
0,1
0,2
0,3
0,4
0,5
0,6
I [A]
P
[
m
W
]
Wykres 2.6.b Krzywa mocy bezpo
ś
redniego ogniwa metanolowego
Dyskusja

39
Jak wida
ć
na wykresach 2.6.a i 2.6.b moc bezpo
ś
redniego ogniwa metanolowego zale
ż
y
od rezystancji obci
ąż
enia (napi
ę
cia ogniwa i pr
ą
du).
Warto
ść
pr
ą
du dla której ogniwo oddaje maksymaln
ą
moc elektryczn
ą
mo
ż
na odczyta
ć
z
wykresu. Wynosi ona 0,29A, co odpowiada rezystancji obci
ąż
enia około 1
Ω
.

40
Cz
ęść
3
Arkusze
ć
wicze
ń
Cz
ęść
3 zawiera przykłady arkuszy
ć
wicze
ń
(3.2) i (3.3) dla studentów a tak
ż
e arkusze
do zaawansowanych bada
ń
(3.4 i 3.5). Dodatkowe informacje potrzebne w tych pracach
mo
ż
na znale
źć
w sekcji 3.1.
41
3.1 Informacje do pracy
3.1.1. Cykl energetyczny słoneczno-wodorowy
Nasze całkowite zasoby paliw kopalnych s
ą
ograniczone.
2000
2050
2100
2150
2200
2250
Rok
Uran
Gaz
ziemny
Ropa
naftowa
W
ę
giel
Rys. 3.1.1 Przewidywana dost
ę
pno
ść
paliw kopalnych i j
ą
drowego (w oparciu o obecne
zu
ż
ycie)
Niezb
ę
dne zmiany w naszym systemie zaopatrzenia w energi
ę
b
ę
d
ą
mo
ż
liwe je
ś
li
b
ę
dziemy mogli wykorzysta
ć
energi
ę
odnawialn
ą
jak na przykład słoneczn
ą
, wiatru lub wody
jako podstawow
ą
cz
ęść
rynku energii.
Problemem z którym si
ę
spotykamy przy wykorzystaniu ogniw słonecznych lub
elektrowni wiatrowych do produkcji energii elektrycznej polega na tym,
ż
e zapotrzebowanie
na energi
ę
elektryczn
ą
i mo
ż
liwo
ść
jej produkcji nie musz
ą
si
ę
pokrywa
ć
si
ę
w czasie. Na
przykład ogniwa słoneczne b
ę
d
ą
dostarczały energi
ę
w ci
ą
gu dnia a ta energia b
ę
dzie
potrzebna do o
ś
wietlenia w nocy. Podobnie elektrownia wiatrowa b
ę
dzie dostarcza
ć
energi
ę
w czasie gdy wieje wiatr. W takich przypadkach gdy mo
ż
liwo
ś
ci produkcji nie pokrywaj
ą
si
ę
z
zapotrzebowaniem w czasie lub w miejscu, konieczna jest mo
ż
liwo
ść
wygodnego
magazynowania i przesyłania energii. Tak
ą
mo
ż
liwo
ść
daje wodór. Kombinacja
wykorzystania energii słonecznej do produkcji energii elektrycznej i wykorzystania wodoru
jako no
ś
nika energii do jej magazynowania i przesyłania jest nazywana cyklem słoneczno-

42
wodorowym. W czasie gdy ogniwa słoneczne i elektrownie wiatrowe produkuj
ą
wi
ę
cej energii
elektrycznej ni
ż
wynosi zapotrzebowanie, zb
ę
dna energia jest wykorzystywana do produkcji
wodoru. Proces ten zachodzi w elektrolizerach, w których woda jest rozdzielana na wodór i
tlen. Wodór (i potencjalnie tlen) mo
ż
e by
ć
magazynowany i transportowany. Energi
ę
elektryczn
ą
z wodoru produkuje si
ę
w ogniwach paliwowych. W czasie reakcji wodór ł
ą
czy
si
ę
z tlenem. Produktami s
ą
woda, energia elektryczna i cieplna. Wykorzystanie wodoru w
tym cyklu pozwala na produkcj
ę
energii elektrycznej w dogodnym miejscu i czasie.
Energie odnawialne: co to jest i jak je wykorzystywa
ć
.
Energie odnawialne to
ź
ródła energii które s
ą
w sposób ci
ą
gły odnawiane w naturalnych
procesach zachodz
ą
cych w ludzkiej skali czasowej. W przeciwie
ń
stwie do tego, paliwa
kopalne (w
ę
giel, gaz ziemny, ropa naftowa) potrzebuj
ą
milionów lat procesów geologicznych
do powstania. Energie odnawialne z drugiej strony s
ą
rzeczywi
ś
cie niewyczerpywalne.
Do odnawialnych
ź
ródeł energii mo
ż
na zaliczy
ć
:
Energi
ę
słoneczn
ą
Energia słoneczna otacza nas w ró
ż
nych formach i mo
ż
e by
ć
wykorzystana w
ró
ż
norodny sposób:
•
promieniowanie słoneczne: urz
ą
dzenia fotovoltaiczne, ogrzewanie słoneczne,
•
ruch atmosfery: energia wiatru
•
parowanie, opady: energia hydroelektryczna
•
biomasa: np. biopaliwa, biogaz
Obecnie najcz
ęś
ciej wykorzystywanymi urz
ą
dzeniami korzystaj
ą
cymi z energii
odnawialnej s
ą
ogniwa słoneczne, elektrownie wiatrowe i elektrownie wodne.
Energia pływów (grawitacyjne przyci
ą
ganie Sło
ń
ca, Ziemi i Ksi
ęż
yca).
Elektrownie pływowe wykorzystuj
ą
energi
ę
pływów. Woda jest magazynowana w czasie
przypływu, i wykorzystywana do produkcji energii w turbinach w czasie odpływu.
Energia geotermalna (radioaktywno
ść
i ciepło wn
ę
trza Ziemi)
Elektrownie geotermalne wykorzystuj
ą
ciepło wn
ę
trza Ziemi.
3.1.2. Wodór
Wła
ś
ciwo
ś
ci wodoru
Wodór jest bezbarwnym, bezwonnym i nietoksycznym gazem. Wodór jest pierwiastkiem
o najprostszej budowie atomu. Najcz
ęś
ciej wyst
ę
puj
ą
cy izotop ma w j
ą
drze tylko jeden
proton i nie ma neutronów, w powłoce elektronowej jest tylko jeden elektron. Rzadziej
wyst
ę
puj
ą
cymi izotopami wodoru s
ą
deuter i tryt. Deuter ma w j
ą
drze dodatkowo jeden
neutron, a tryt dwa. Wodór jest nie tylko najmniejszym i najl
ż
ejszym pierwiastkiem, ale i

43
najcz
ęś
ciej wyst
ę
puj
ą
cym we wszech
ś
wiecie. Na ziemi wyst
ę
puje tylko w zwi
ą
zkach
chemicznych.
Wła
ś
ciwo
ś
ci wodoru
G
ę
sto
ść
wodoru gazowego (0ºC, 101,3 kPa)
0,08988 kg/m
3
Temperatura topnienia (101,3 kPa)
-259ºC
Temperatura wrzenia (101,3 kPa)
-252,8ºC
H
h
ciepło spalania
12745 kJ/m
3
H
l
warto
ść
opałowa
10800 kJ/m
3
Warto
ś
ciowo
ść
1
Metody wytwarzania wodoru
W procesie elektrolizy, zwi
ą
zki chemiczne s
ą
rozkładane przy pomocy pr
ą
du
elektrycznego. Na przykład elektroliza mo
ż
e by
ć
wykorzystana do rozkładu wody na jej
składniki – wodór i tlen.
W procesie reformingu zło
ż
one zwi
ą
zki w
ę
glowodorowe s
ą
rozkładane.
W procesie krakingu – metody oczyszczania surowej ropy, gaz jest wytwarzany jako
produkt uboczny przy wysokim ci
ś
nieniu i wysokiej temperaturze.
Reakcja
ż
elaza z par
ą
wodn
ą
w wysokich temperaturach.
W procesie produkcji gazu wodnego koks i para wodna reaguj
ą
w wysokich
temperaturach, produktem jest gaz wodny.
Składowanie wodoru
Opracowanie sprawnych zbiorników na wodór jest jednym z istotnych wyzwa
ń
zwi
ą
zanych z stosowaniem wodoru. Czynnikami decyduj
ą
cymi s
ą
tu mo
ż
liwo
ś
ci składowania
wodoru, zachowanie przy magazynowaniu, nakłady przy produkcji i koszty produkcji. Do tej
pory pojawiły si
ę
trzy główne technologie które s
ą
konsekwentnie promowane.
Składowanie spr
ęż
onego gazu
Nakłady na wytwarzanie i koszty produkcji konwencjonalnych butli na spr
ęż
one gazy s
ą
niskie i z tego powodu jest to najlepsza metoda je
ś
li nie ma ogranicze
ń
co do zajmowanej
przestrzeni i wysoki ci
ęż
ar jest mo
ż
liwy do zaakceptowania. Poniewa
ż
butle na spr
ęż
one
gazy s
ą
projektowane na ci
ś
nienie 200 bar i wi
ę
c obj
ę
to
ść
składowanego w nich gazu jest
wielokrotno
ś
ci
ą
ich obj
ę
to
ś
ci (warunki normalne). Butle s
ą
zwykle stosowane w instalacjach
stacjonarnych.
Ostatnio do budowy zbiorników na spr
ęż
one gazy stosyje si
ę
w
ę
glowe materiały
kompozytowe. S
ą
one l
ż
ejsze ni
ż
konwencjonalne, a ponadto s
ą
projektowane na ci
ś
nienia
a
ż
do 350 bar (w przyszło
ś
ci mo
ż
liwe s
ą
ci
ś
nienia do 700 bar).
Składowanie wodoru w postaci ciekłej
Wodór skrapla si
ę
w temperaturze -253ºC. Skroplony wodór jest przechowywany w
zbiornikach kriogenicznych utrzymuj
ą
cych go we wła
ś
ciwej temperaturze (-253ºC) dzi
ę
ki
odpowiedniej izolacji termicznej. Przez kilka pierwszych dni po napełnieniu, wodór mo
ż
e by
ć
przechowywany bez strat. Po tym okresie, z powodu rosn
ą
cej temperatury w zbiorniku wodór
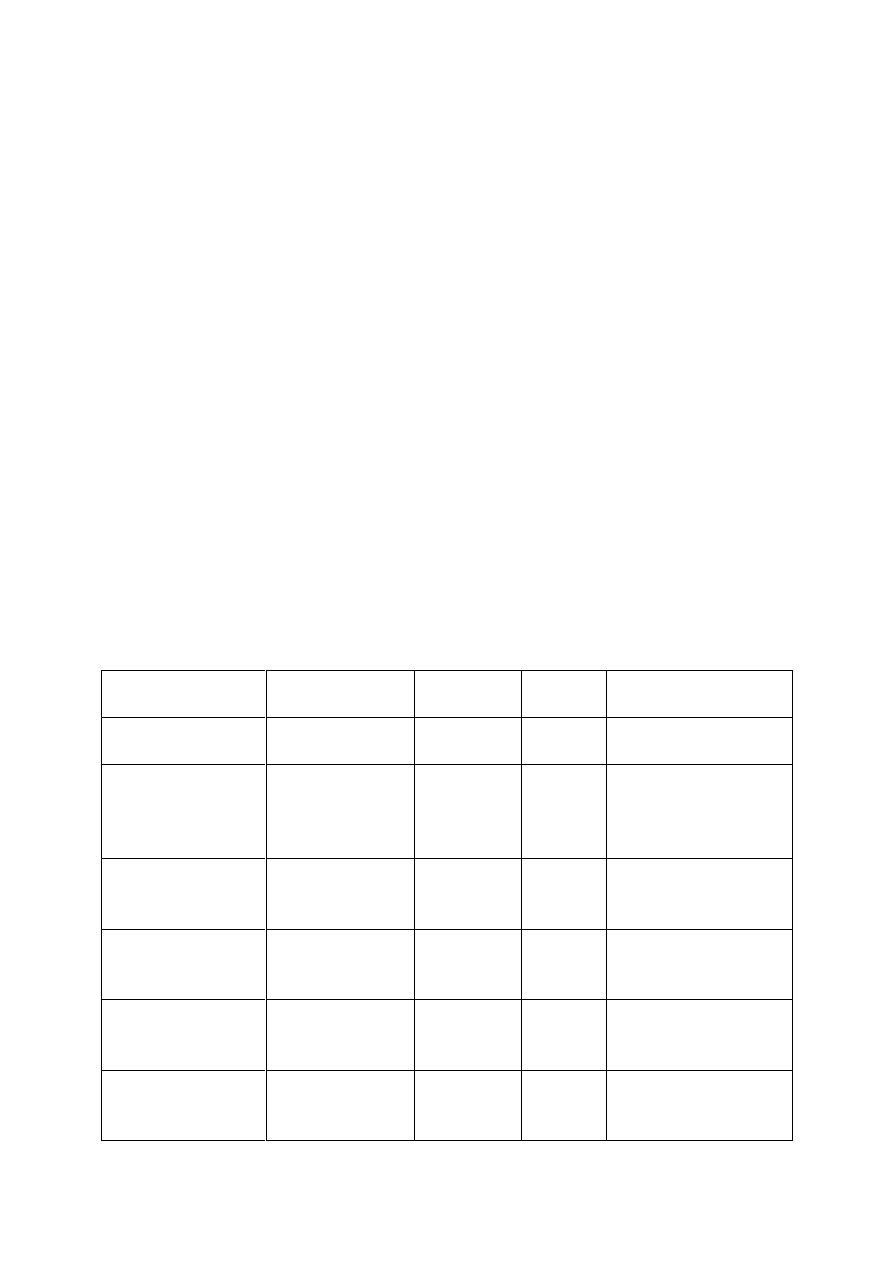
44
zaczyna parowa
ć
. Ze wzgl
ę
du na konieczno
ść
odprowadzania gazowego wodoru (aby nie
dopu
ś
ci
ć
do wzrostu ci
ś
nienie w zbiorniku) straty odparowania staj
ą
si
ę
znacz
ą
ce. Przy
dzisiejszej technologii te straty wynosz
ą
około 0,4% obj
ę
to
ś
ci zbiornika na dob
ę
. Do
skroplenia wodoru konieczna jest energia równa około 1/3 energii składowanego wodoru.
Składowanie wodoru w wodorkach metali
Zbiorniki do składowania t
ą
metod
ą
zawieraj
ą
specjalne stopy metali, które mog
ą
składowa
ć
wodór w swojej siatce krystalicznej. Ze wzgl
ę
du na konieczno
ść
uzyskania jak
najwi
ę
kszej powierzchni stopy s
ą
w postaci sproszkowanej. Wodór jest wprowadzany do
zbiornika pod niewielkim nadci
ś
nieniem i reaguje ze stopem metalu tworz
ą
c wodorki. Ten
proces jest egzotermiczny, wydzielone ciepło trzeba odprowadzi
ć
ze zbiornika. Aby uwolni
ć
wodór z wodorku nale
ż
y dostarczy
ć
ciepło do zbiornika.
Zbiorniki z wodorkami metali maj
ą
wysok
ą
obj
ę
to
ś
ciow
ą
g
ę
sto
ść
magazynowania
wodoru, jednak
ż
e wagowa g
ę
sto
ść
magazynowania jest niska. Obecnie s
ą
prowadzone
prace nad uzyskaniem l
ż
ejszych materiałów do magazynowania. Uzyskanie takich
materiałów pozwoli na poprawienie wagowej g
ę
sto
ś
ci magazynowania wodoru.
3.1.3. Ogniwa paliwowe
Zasada działania ogniwa paliwowego jest odwrotna do działania elektrolizera. Tak jak i
elektrolizer ogniwo składa si
ę
z elektrody dodatniej, ujemnej i elektrolitu.
Typy ogniw paliwowych
Ogniwo paliwowe
Elektrolit
Temperatura
pracy
Sprawno
ść
elektryczna
Paliwo
utleniacz
Alkaliczne ogniwo
paliwowe AFC
Roztwór wodorotlenku
potasu (KOH)
pokojowa do
90ºC
60-70%
H
2
O
2
ogniwo paliwowe z
membran
ą
umo
ż
liwiaj
ą
c
ą
wymian
ę
protonów
PEMFC
membrana
umo
ż
liwiaj
ą
c
ą
wymian
ę
protonów
pokojowa do
80ºC
40 –80 %
H
2
O
2
, powietrze
Bezpo
ś
rednie
metanolowe ogniwo
paliwowe DMFC
membrana
umo
ż
liwiaj
ą
c
ą
wymian
ę
protonów
pokojowa do
130ºC
20 –30%
CH
3
OH
O
2
, powietrze
Ogniwo paliwowe z
kwasem fosforowym
PAFC
kwas fosforowym
160 - 220ºC
55%
Gaz ziemny, biogaz, H
2
O
2
, powietrze
Ogniwo paliwowe ze
stopionymi w
ę
glanami
MCFC
Stopiona mieszanina
w
ę
glanów metali
alkalicznych
620 - 680ºC
85%
Gaz ziemny, biogaz, gaz ze
zgazowania w
ę
gla, H
2
O
2
, powietrze
Ogniwa paliwowe z
zestalonym elektrolitem
tlenkowym
SOFC
Ceramika
przewodz
ą
ca jony
tlenu
800 - 1000ºC
80 –85%
Gaz ziemny, biogaz, gaz ze
zgazowania w
ę
gla, H
2
O
2
, powietrze

45
Ogniwo paliwowe PEM przekształca z du
żą
sprawno
ś
ci
ą
energi
ę
chemiczn
ą
na energi
ę
elektryczn
ą
. Elektrolitem jest cienka polimerowa membrana przewodz
ą
ca jony wodoru.
Membrana jest z obu stron pokryta katalizatorem. Warstwy katalizatora tworz
ą
anod
ę
i
katod
ę
. Poł
ą
czone pojedyncze ogniwa tworz
ą
bateri
ę
o napi
ę
ciu które mo
ż
na dopasowa
ć
do
wymaga
ń
dobieraj
ą
c odpowiedni
ą
liczb
ę
ogniw. Mo
ż
liwo
ść
uzyskania wymaganego napi
ę
cia,
wysoka sprawno
ść
i dobre wła
ś
ciwo
ś
ci zimnego startu ogniw PEM czyni te ogniwa
wygodnymi w szerokim zakresie zastosowa
ń
.
Jak pracuje ogniwo paliwowe PEM
Gazowy wodór, dzi
ę
ki katalizatorowi (np. platynie), ulega jonizacji na anodzie. Jony H+
przechodz
ą
przez membran
ę
polimerow
ą
przewodz
ą
c
ą
protony do katody. Je
ś
li zewn
ę
trzny
obwód jest zamkni
ę
ty elektrony przepływaj
ą
przez niego do katody wykonuj
ą
c prac
ę
. Jony
wodoru, elektrony i atomy tlenu reaguj
ą
ze sob
ą
daj
ą
c wod
ę
.
Reakcja na anodzie:
2H
2
4H
+
+ 4e
-
Reakcje na katodzie:
O2 + 4H
+
+ 4e
-
2H
2
O
Reakcje sumaryczne
2H
2
+ O
2
2H
2
O
3.1.4. Elektrolizer
Elektroliza polega na rozkładzie zwi
ą
zków chemicznych przy pomocy pr
ą
du
elektrycznego. Na przykład, elektroliza mo
ż
e by
ć
wykorzystana do rozkładu wody na wodór i
tlen.
W zasadzie elektrolizer składa si
ę
z
•
ujemnie naładowanej katody, do której migruj
ą
jony dodatnie,
•
dodatnio naładowanej anody, do której migruj
ą
jony ujemne,
•
elektrolitu, materiału w którym jest mo
ż
liwe przewodnictwo jonowe.
Typy elektrolizerów ró
ż
ni
ą
si
ę
elektrodami i elektrolitem. Elektrolit mo
ż
e by
ć
ciekły lub
stały np. membrana polimerowa (Polymer Electrolyte Membrane – PEM).
Elektrolizery PEM wyró
ż
niaj
ą
si
ę
bardzo prost
ą
i zwart
ą
budow
ą
. Rdzeniem elektrolizera
PEM jest cienka polimerowa membrana przewodz
ą
ca jony, pokryta z obu stron materiałem
katalizatora. Te dwie warstwy tworz
ą
katod
ę
i anod
ę
ogniwa. Po doprowadzeniu stałego
napi
ę
cia elektrolizer rozkłada wod
ę
na tlen i wodór. Aby ten proces mógł zachodzi
ć
, napi
ę
cie
musi przekracza
ć
napi
ę
cie rozkładu, które dla wody wynosi 1,23V (teoretycznie). W praktyce
ten próg jest wi
ę
kszy z powodu rezystancji styków. Elektrolizery s
ą
budowane jako baterie
szeregowo poł
ą
czonych jednostek. Elsktrolizery PEM osi
ą
gaj
ą
sprawno
ść
do 85%.
Jak pracuje elektrolizer PEM

46
Je
ś
li pr
ą
d stały płynie przez ogniwo, na anodzie molekuły wody s
ą
utleniane daj
ą
c tlen,
jony wodoru i elektrony. Jony wodoru migruj
ą
przez membran
ę
przewodz
ą
c
ą
jony do katody,
gdzie z elektronami przepływaj
ą
cymi przez zewn
ę
trzny obwód tworz
ą
gazowy wodór.
Gazowy tlen gromadzi si
ę
na anodzie.
Reakcja na anodzie:
2H
2
O
4H
+
+ 4e
-
+ O
2
Reakcje na katodzie:
4H
+
+ 4e
-
2H
2
Reakcje sumaryczne
2H
2
O
2H
2
+ O
2
Nazwa elektrolizera pochodzi od Proton Elektrolite Membrane (równie
ż
Proton
Exchange Membrane). Membrana jest zbudowana z teflonu z grupami SO
3
H na ko
ń
cach
bocznych ła
ń
cuchów. Je
ś
li membrana jest mokra, uzyskuje charakter kwa
ś
ny i staje si
ę
przewodz
ą
ca dla jonów wodorowych. Aniony nie mog
ą
przechodzi
ć
przez membran
ę
.

47
3.2. Rozwi
ą
zania arkuszy studenckich
3.2.1. Cykl energetyczny słoneczno-wodorowy
Pytanie1: Na jak długo wystarcz
ą
jeszcze zasoby energetyczne?
Przewiduje si
ę
,
ż
e zasoby naturalnego uranu, gazu ziemnego i ropy naftowej b
ę
d
ą
jeszcze dost
ę
pne przez ponad 50 lat, w
ę
giel prawdopodobnie przez ponad 200 lat. Nale
ż
y
bra
ć
pod uwag
ę
to,
ż
e zasoby nie wyczerpi
ą
si
ę
nagle. Zasoby b
ę
d
ą
malały do gro
ź
nego
poziomu. Ponadto te zasoby s
ą
wykorzystywane nie tylko w energetyce, np. ropa naftowa
jest podstawowym surowcem wykorzystywanym do produkcji tworzyw sztucznych.
Pytanie2: Wymie
ń
składniki cyklu słoneczno-wodorowego
•
Ogniwa słoneczne, elektrownie wiatrowe itp.
•
Elektrolizer
•
Zbiornik wodoru,
•
Ogniwo paliwowe,
•
odbiorca energii elektrycznej
Pytanie3: Jak mo
ż
na opisa
ć
cykl słoneczni-wodorowy?
Ogniwa słoneczne, elektrownie wiatrowe etc. przetwarzaj
ą
energi
ę
słoneczn
ą
w energi
ę
elektryczn
ą
. Ta energia nie zawsze jest wytwarzana wtedy gdy jest na ni
ą
zapotrzebowanie. Niezb
ę
dne jest zastosowanie po
ś
redniego składnika systemu, który
mógłby magazynowa
ć
energi
ę
w czasie gdy jest jej nadmiar i oddawa
ć
gdy jej brak.
Takim elementem mo
ż
e w przyszło
ś
ci by
ć
cykl wodorowy. W czasie gdy energii jest
nadmiar elektrolizery wytwarzałyby wodór – energia elektryczna byłaby zamieniana na
chemiczn
ą
energi
ę
wodoru.
Wodór
byłby
magazynowany
do
czasu
gdy
zapotrzebowanie na energi
ę
przekroczy produkcj
ę
. Wtedy energia chemiczna wodoru
byłaby przetwarzana w ogniwach paliwowych w energi
ę
elektryczn
ą
.
Pytanie4: Wymie
ń
trzy pierwotne
ź
ródła energii
•
energia słoneczna (termoj
ą
drowa reakcja fuzji wodoru w hel)
•
energia pływów (oddziaływanie grawitacyjne Ziemi, Sło
ń
ca i Ksi
ęż
yca)
•
energia geotermalna (reakcje j
ą
drowe i ciepło j
ą
dra Ziemi)
Pytanie5: Jak s
ą
wykorzystywane trzy pierwotne
ź
ródła energii do produkcji
energii
Energia słoneczna
Energia słoneczna wyst
ę
puje pod ró
ż
nymi postaciami na skutek konwersji energii:
•
promieniowanie słoneczne (przetwarzanie fotowoltaiczne,, ogrzewanie słoneczne)
•
energia wiatru

48
•
energia wody z odparowania, opadów
•
biomasa z fotosyntezy.
Ostatecznie paliwa kopalne tylko przechowuj
ą
energi
ę
słoneczn
ą
. W przeciwie
ń
stwie do
paliw odnawialnych paliwa kopalne nie regeneruj
ą
siwe w ludzkiej skali czasowej s
wymagaj
ą
do tego milionów lat. Najcz
ęś
ciej wykorzystywanymi przetwornikami energii
słonecznej s
ą
obecnie ogniwa paliwowe, systemy wiatrowe i elektrownie wodne.
Energia pływów
Elektrownie pływowe wykorzystuj
ą
pr
ą
dy przypływów i odpływów spowodowane przez
podnoszenie si
ę
i opadanie poziomu wody.
Energia geotermiczna
Systemy geotermiczne wykorzystuj
ą
ciepło skorupy ziemskiej. Temperatura wzrasta w
miar
ę
zwi
ę
kszania gł
ę
boko
ś
ci. W systemach geotermicznych gor
ą
ca woda jest
wykorzystywana do celów grzewczych lub do produkcji energii elektrycznej.
3.2.2. Wodór
Pytani 1: wymie
ń
7 wła
ś
ciwo
ś
ci wodoru
1. gaz bezbarwny
2. bezwonny
3. nietoksyczny
4. temperatura topnienia pod normalnym ci
ś
nieniem -259ºC
5. temperatura wrzenia pod normalnym ci
ś
nieniem –252,8ºC
6. najprostsza budowa atomu – 1 proton w j
ą
drze i 1 elektron w powłoce
elektronowej
7. jest to najl
ż
ejszy i najmniejszy pierwiastek.
Pytanie 2: Jakie znasz izotopy wodoru?
1. atom podstawowego izotopu wodoru zawiera w j
ą
drze 1 proton, w powłoce
elektronowej 1 elektron. Jest to najcz
ęś
ciej wyst
ę
puj
ą
cy izotop wodoru
(>99,9%)
1
1
H
2. atom deuteru zawiera w j
ą
drze 1 proton i 1 neutron, w powłoce elektronowej 1
elektron
2
1
H
3. atom trytu zawiera w j
ą
drze 1 proton i 2 neutrony, w powłoce elektronowej 1
elektron
3
1
H
Pytanie 3: Wymie
ń
sposoby wytwarzania wodoru
•
elektroliza
•
reforming

49
•
kraking w
ę
glowodorów
•
reakcja
ż
elazo-woda
•
produkcja gazu wodnego
Pytanie 4: Wymie
ń
3 najpowszechniejsze metody magazynowania wodoru
1. gazowy w wysokoci
ś
nieniowych zbiornikach (200bar)
2. skroplony w zbiornikach kriogenicznych w temperaturze -253ºC
3. w siatce krystalicznej stopów metali – w wodorkach metali.
3.2.3. Ogniwa paliwowe
Pytanie 1: Wymie
ń
główne cz
ęś
ci ogniwa paliwowego
Elektrody (anoda i katoda), elektrolit
Pytanie 2: Jakie s
ą
podstawowe ró
ż
nice pomi
ę
dzy ogniwami paliwowymi
Rodzaj elektrolitu i temperatura pracy
Pytanie 3:Wymie
ń
typy ogniw paliwowych
AFC, PEMFC, DMFC, PAFC, MCFC, SOFC
Pytanie 4: Opisz zasad
ę
działania ogniwa paliwowego PEM
Gazowy wodór dostarczany do katody, dzi
ę
ki katalitycznemu działaniu elektrody jest
rozdzielany na elektrony i jony wodoru nawet w temperaturze pokojowej. Jony wodorowe
migruj
ą
przez membran
ę
przewodz
ą
c
ą
jony do katody a elektrony przepływaj
ą
do katody
przez zewn
ę
trzny obwód je
ś
li jest zamkni
ę
ty. Na katodzie jony wodorowe, elektrony i tlen z
powietrza reaguj
ą
tworz
ą
c wod
ę
.
Pytanie 5: Jaki materiał stosuje si
ę
na katalizator w ogniwie PEM
Platyn
ę
Pytanie 6: Przedstaw reakcje chemiczne zachodz
ą
ce w ogniwie PEM na anodzie,
katodzie i sumaryczne
Reakcja na anodzie:
2H
2
4H
+
+ 4e
-
Reakcje na katodzie:
O2 + 4H
+
+ 4e
-
2H
2
O
Reakcje sumaryczne
2H
2
+ O
2
2H
2
O
Pytanie 7: Jakie zalety ma ogniwo PEM w stosunku do
ś
rodowiska
Ma ono wysok
ą
sprawno
ść
a jego produktem jest czysta woda.
Pytanie 8: Jaka jest maksymalna sprawno
ść
ogniwa PEM
Sprawno
ść
elektryczna ogniwa PEM wynosi około 50%. Je
ś
li ciepło wytwarzane przez
ogniwo zostanie wykorzystane np. do celów grzewczych, sprawno
ść
całkowita mo
ż
e wynie
ść
85%.

50
Pytanie 9: Co to jest bateria
Jest to zestaw poł
ą
czonych ze sob
ą
ogniw w celu osi
ą
gni
ę
cia wy
ż
szego napi
ę
cia, pr
ą
du
lub mocy
Pytanie 10: W jakich dziedzinach stosuje si
ę
obecnie ogniwa paliwowe
W załogowych i bezzałogowych lotach kosmicznych, w pojazdach elektrycznych, w
elektrociepłowniach.
3.2.4. Elektrolizery
Pytanie 1: Co to jest elektroliza
Jest to zmiana wi
ą
za
ń
chemicznych w cieczach pod wpływem pr
ą
dy elektrycznego
Pytanie 2: Z czego składa si
ę
elektrolizer
Elektrolizer składa si
ę
z elektrod (ujemnej katody i dodatniej anody) i elektrolitu.
Pytanie 3: Jak mo
ż
e by
ć
otrzymywany wodór w przyszło
ś
ci na du
żą
skal
ę
Przy pomocy elektrolizy w elektrolizerach PEM
Pytanie 4: Wyja
ś
nij co oznacza skrót PEM
PEM pochodzi od angielskiej nazwy membrany elektrolitu - Polymer Electrolyte
Membrane lub od Proton Exchange Membrane
Pytanie 5: Jak
ą
sprawno
ść
maj
ą
elektrolizery PEM
Sprawno
ść
elektryczna elektrolizerów PEM si
ę
ga 85%
Pytanie 6: Jak pracuj
ą
elektrolizery PEM?
Je
ś
li napi
ę
cie stałe zostanie przyło
ż
one do anody, molekuły wody s
ą
utleniane tworz
ą
c
tlen, jony wodoru i elektrony. Jony wodoru migruj
ą
przez membran
ę
przewodz
ą
c
ą
jony do
katody gdzie z elektronami przepływaj
ą
cymi przez zewn
ę
trzny obwód tworz
ą
gazowy wodór.
Gazowy tlen gromadzi si
ę
na anodzie.
Pytanie 7: Przedstaw równania reakcji chemicznych wyst
ę
puj
ą
cych w
wodorowym elektrolizerze PEM a) na anodzie , b) na katodzie, c) reakcj
ę
sumaryczn
ą
a) reakcja na anodzie: 2H
2
O
4H
+
+ 4e
-
+ O
2
b) reakcje na katodzie: 4H
+
+ 4e
-
2H
2
c) reakcje sumaryczne 2H
2
O
2H
2
+ O
2
Pytanie 8: Jak
ą
warto
ść
ma napi
ę
cie dekompozycji wody
Napi
ę
cie dekompozycji wody wynosi 1,23V
Pytanie 9 : Wymie
ń
inne sposoby wytwarzania wodoru
Reforming, kraking, reakcja
ż
elazo-woda, proces produkcji gazu wodnego.
Wyszukiwarka
Podobne podstrony:
9) Powinowactwo elektronowe id Nieznany (2)
01 wstepny elektrycznyid 3080 Nieznany
93 Nw 10 Elektryczne wiertarki Nieznany
Instalacja elektryczna escort m Nieznany (2)
Elektryka i Elektronika Amper i Nieznany
15 elektrostatykaid 16020 Nieznany (2)
1 INSTALACJE ELEKTRYCZNEid 1031 Nieznany (2)
20031208!ELEKTRRid 25140 Nieznany (2)
Siła elektromotoryczna ogniwa galwanicznego, Studia, Politechnika
Instalacja elektryczna galaxy m Nieznany (2)
Obsluga elektromechanicznego ha Nieznany
Indukcja elektromagnetyczna id Nieznany
a15 pole elektryczne w dielektr Nieznany
Elektroenergetyka sprawozdanie Nieznany
1 11e ZGRZEWANIE ELEKTRYCZNE OP Nieznany
jakosc energii elektrycznej Mar Nieznany
więcej podobnych podstron