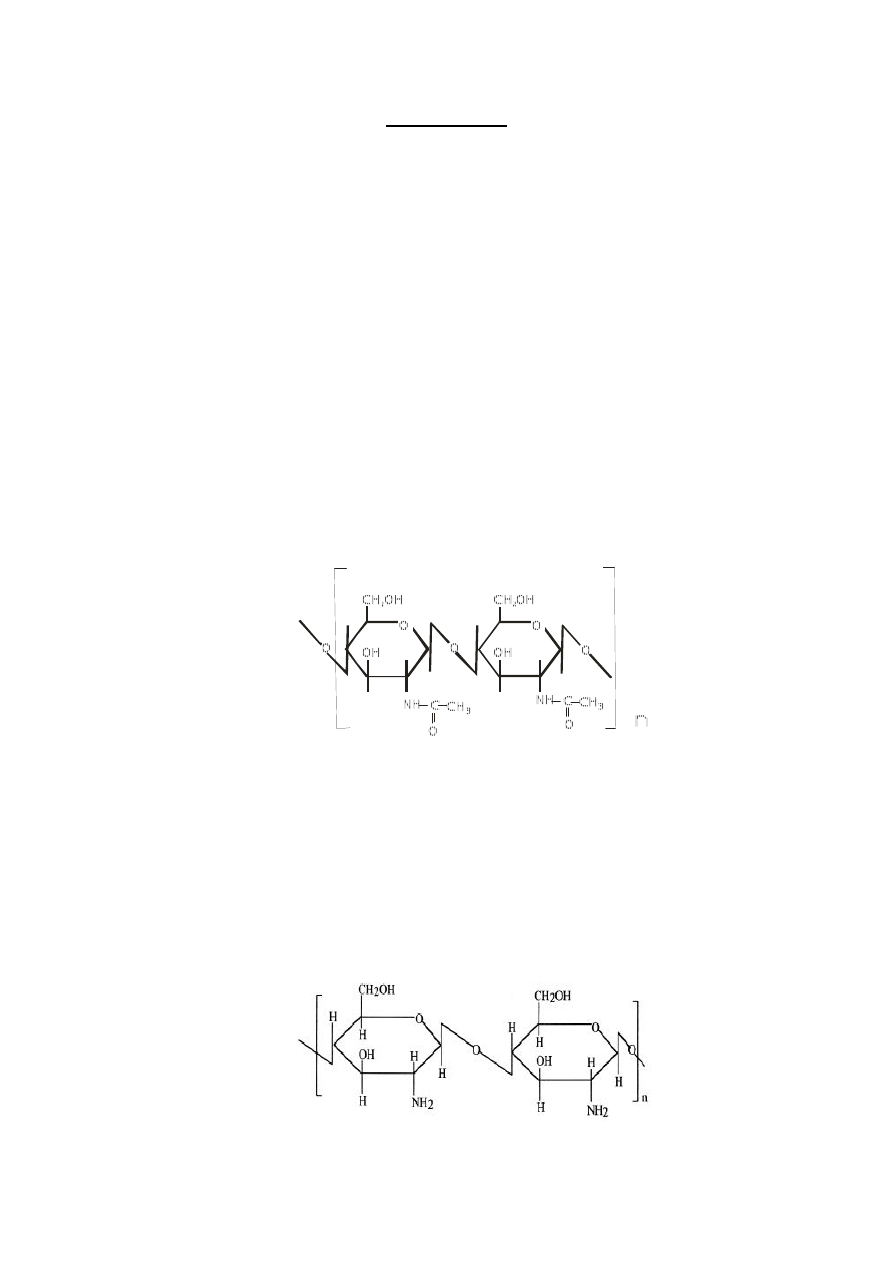
1
ĆWICZENIE 3
U
NIERUCHAMIANIE GLUKOZAMYLAZY NA CHITYNIE
Glukoamylaza (EC 3.2.1.3) jest egzoamylazą, która prowadzi rozkład wiązania
α-(1,4) – glikozydowego od nieredukującego końca łańcucha skrobi, odszczepiając cząsteczki
glukozy; a ponadto zdolna jest do hydrolizy wiązania α-(1,6) glikozydowego
w amylopektynie (reakcja przebiega jednak wielokrotnie wolniej). Z technologicznego punktu
widzenia należy do amylaz scukrzających, obok niektórych α-amylaz i β-amylaz.
Przemysłowa synteza glukoamylazy jest prowadzona przez pleśnie Aspergillus niger
NRRL 337, Aspergillus awamori i Aspergillus foetidus. Pierwsze technologie produkcji
glukoamylazy pojawiły się na początku lat 50. Roczna światowa produkcja wynosi kilka ton
w postaci proszku, najwięcej produkuje się jej jednak w postaci roztworu zawierającego kilka
procent enzymu. Przy użyciu glukoamylazy rocznie produkuje się kilkanaście milionów ton
hydrolizatów skrobiowych. Glukoamylaza jest często używana w mieszaninie z α-amylazą
i izomerazą glukozową, szczególnie przy produkcji syropów wysokofruktozowych ze skrobi.
Obecnie w Polsce jedynym producentem preparatów amylolitycznych są Zakłady Przemysłu
Owocowo-Warzywnego PEKTOWIN w Jaśle.
Chityna jest polisacharydem obojętnym z grupy homoglikanów, zbudowanym
z cząsteczek N-acetyloglukozaminy połączonych wiązaniami β-1,4-glikozydowymi w długie
i nierozgałęzione łańcuchy. Fragment łańcucha chityny przedstawiono na poniższym rysunku.
Łańcuchy chityny ułożone równolegle w pęczki i połączone wiązaniami wodorowymi tworzą
mikrofibryle, podobnie jak celuloza, co nadaje im znaczną wytrzymałość. W efekcie chityna
pełni rolę substancji podporowej w ścianach komórek niektórych grzybów i glonów. Jest
także głównym składnikiem strukturalnym pancerzyków stawonogów. Chityna jest bardzo
odporna na działanie czynników chemicznych; można przeprowadzić jej hydrolizę przy
pomocy stężonego HCl. Chityna może być degradowana do mono- i oligomerów
N-acetyloglukozaminy przez chitynazy. Enzymy te są szeroko rozpowszechnione wśród
bakterii, znaleziono je także u roślin, pierwotniaków, nicieni i stawonogów.
Przez depolimeryzację i częściową deacetylację łańcuchów chityny otrzymuje się
chitozan, będący poliaminą używaną jako nośnik w immobilizacji enzymów, bądź całych
komórek mikroorganizmów.

2
Chitozan jest często wykorzystywany jako nośnik do immobilizacji enzymów
stosowanych w przemyśle spożywczym. Jest on tani (chityna do produkcji chitozanu jest
uzyskiwana m.in. z pancerzy skorupiaków morskich takich jak krewetki, kraby, kryl
antarktyczny, stanowi więc odpad przemysłu spożywczego), łatwo dostępny, nietoksyczny i
wykazuje szereg pozytywnych cech takich jak hydrofilność, duże powinowactwo do białek,
porowatość, duża powierzchnia adhezji. Posiada liczne grupy funkcyjne –OH oraz –NH
2
,
które łatwo wiążą enzymy. Wykazuje także właściwości antybakteryjne i jest mało podatny
na degradację mikrobiologiczną. Chitozan jest nierozpuszczalny w wodzie, ale rozpuszcza się
w roztworach kwaśnych. W formie rozpuszczonej jest silnie naładowany dodatnio i może
tworzyć nierozpuszczalne w wodzie agregaty ze związkami polianionowymi. Ulega również
precypitacji w roztworach o wysokim pH. Dzięki tym cechom można go formować w różna
kształty: kulki, włókna, kapsułki, membrany i inne. Ograniczenia w przemysłowym
stosowaniu płatków lub kulek chitozanowych jako nośnika wynikają natomiast ze zbyt dużej
gęstości w stosunku do wody i delikatnej tekstury. Problem ten można rozwiązać poprzez
stosowanie chitozanu w połączeniach np. ze sproszkowaną gliną.
WYKONANIE ĆWICZENIA
Przygotowanie nośnika: 2,5 g handlowej chityny zalać 50 ml 25% HCl i pozostawić
w temperaturze pokojowej na 2 h. Po tym czasie przemywać wodą destylowaną do uzyskania
odczynu obojętnego. Następnie zalać chitynę 50 ml 25% NaOH i umieścić w temperaturze
90
0
C (suszarka) na 2h. Ponownie płukać wodą destylowaną do uzyskania odczynu obojętnego
i wysuszyć w suszarce z przewiewem w temp. 50
0
C. Tak przygotowaną chitynę można
przechowywać maksymalnie 24 godziny. Na tak przygotowanym nośniku glukoamylaza jest
adsorbowana przy pomocy słabych nieswoistych sił van der Waalsa i wiązań wodorowych.
Przygotowanie enzymu do immobilizacji:
2 ml handlowego preparatu glukoamylazy
NOVO II rozcieńczyć do 100 ml wodą destylowaną (1:50). Z tego, celem oznaczenia
aktywności wyjściowej, pobrać 1 ml do kolby miarowej na 100 ml, uzupełnić wodą
i wymieszać (1:5000). Po dodatkowym trzykrotnym rozcieńczeniu (1 ml + 2 ml wody→
1:15000) oznaczyć aktywność glukoamylazy.
Pozostałe 99 ml roztworu enzymu rozcieńczonego 1:50 mieszać w zlewce na 250 ml
(mieszadło magnetyczne) z chityną przez 2 godziny w temperaturze pokojowej.
Po tym czasie chitynę z immobilizowanym enzymem odsączyć na spieku G3, przemywając
wodą destylowaną (około 150 ml), potem 0,02 M buforem octanowym o pH 4,5 (100 ml
zimnego buforu i 100 ml ogrzanego buforu). Przesącz zbierać ilościowo do kolby miarowej
na 500 ml i oznaczyć w nim aktywność glukoamylazy niezwiązanej z nośnikiem. Przed
analizą na aktywność przesącz rozcieńczyć dodatkowo 10 razy.
Pakowanie kolumny: Przemyty osad chityny z immobilizowanym enzymem zebrać
ze spieku do zlewki na 250 ml, popłukując buforem octanowym o pH 4,5, ogrzanym do
temperatury około 37
o
C. Pakować kolumnę za pomocą pipety o pojemności 10 ml z obciętym
końcem
(Uwagi „techniczne”: złoże zawiesić w dość dużej ilości wody; przed pobraniem pipetą

3
mieszać bagietką złoże w zlewce; podczas pakowania mieszać górę złoża końcówką pipety; przy
pierwszym pipetowaniu końcówkę umieścić głęboko przy dnie kolumny)
. Stosować kolumnę z
płaszczem termostatowym K1, 6/20. Uważać by cząsteczki chityny nie uległy
frakcjonowaniu.
Praca kolumny: kolumnę równoważyć (przepłukiwać) dogrzanym do temperatury
37
o
C buforem octanowym o pH 4,5 przez 20 minut z szybkością naturalnego wypływu (około
2 ml/minutę). Po tym czasie przepuścić przez kolumnę w ten sam sposób 50 ml 2% roztworu
skrobi rozpuszczonej w 0,02 M buforze octanowym o pH 4,5. Na koniec podłączyć pompę
(wężyk przetłokowy 2 mm ) i pompować ciepły roztwór skrobi (37-38
0
C) na kolumnę z
szybkością od 40-100 ml/h (pierwsze 30 min szybkość pompowania 0,6 ml/min, następne
30 min szybkość 0,3 ml/min). Frakcje schodzące z kolumny, o objętości około 2 ml każda,
zbierać do probówek między 3 i 6min, 9 i 12; 15 i 18 min itd. Po zmianie szybkości odczekać
15 min i zebrać frakcje jak wyżej.
Zaraz po zebraniu frakcje zagotować (10 min) i ostudzić. Następnie rozcieńczyć 25 razy, tzn.
do 0,5 ml zagotowanej frakcji dodać 12 ml wody i wymieszać. Z tak rozcieńczonych frakcji
do analizy na obecność cukrów redukujących brać po 2 ml.
Jednocześnie, stosując tę samą metodą z DNS oznaczyć tło (kontrola) tj. zawartość cukrów
redukujących w roztworze skrobi pompowanej na kolumnę (przed wykonaniem analizy
metodą z DNS, roztwór skrobi zagotować (10 min.)).
Obliczenia:
1. Na podstawie
aktywności glukoamylazy oznaczonej (metodą z oksydazą glukozową
oraz metodą z DNS) w wyjściowym
preparacie i w
roztworze pozostałym po procesie
wiązania preparatu z nośnikiem, obliczyć procentowo ilość enzymu związanego.
2. Na podstawie oznaczeń zawartości cukrów redukujących w wyjściowym roztworze
skrobi i frakcjach zbieranych z kolumny, obliczyć procent konwersji skrobi do
glukozy dla dwóch różnych szybkości pompowania substratu na kolumnę.
Metody analityczne
A. Oznaczanie aktywności glukoamylazy (metoda z oksydazą glukozową)
Zasada:
β− D−glukoza + O
2
→ kwas glukonowy + H
2
O
2
(oksydaza glukozowa)
H
2
O
2
+ (ODA)
red
→ H
2
O + (ODA)
oksy
(peroksydaza)
(ODA)
oksy
+ H
2
SO
4
→ (ODA)
oksy
SO
4
Powstający kompleks (ODA)
oksy
SO
4
daje maximum absorpcji przy λ = 530 nm.
(ODA)
red
− ortodianizydyna zredukowana
(ODA)
oksy
− ortodianizydyna utleniona

4
Odczynniki:
1. Substrat - 2% roztwór skrobi o pH 4,5 (2,2 g skrobi rozpuścić w około 80 ml wrzącej
wody destylowanej, gotować 3 minuty. Po ostudzeniu dodać 10 ml 1 M buforu
octanowego o pH 4,5, uzupełnić do 100 ml, przesączyć).
2. Reagent GOX:
a) tris-bufor 0,5 M (61g trójhydroksymetyloaminometanu rozpuścić w wodzie dodać 5 ml
5 M HCl, uregulować pH na 7,1 i dopełnić do 1000 ml),
b) oksydaza glukozowa (12 mg/100 ml GOX),
c) roztwór peroksydazy (4 ml 20 mg% roztworu w tris-buforze lub 1 mg na 100 ml GOX),
d) roztwór o-dianizydyny (0,6 ml 1% roztworu w 96% etanolu nieskażonym). W tris-
buforze rozpuścić 12 mg oksydazy glukozowej, dodać 4 ml roztworu peroksydazy
i 0,6 ml o-dianizydyny, uzupełnić trisem do 100 ml.
3. 2,5 M H
2
SO
4
(138,8 ml stęż. H
2
SO
4
uzupełnić wodą do 1000 ml)
4. standardy glukozowe (z roztworu glukozy o stężeniu 10 mg%):
stężenie
glukoza
woda
0 mg% -
0,0 ml
1,0 ml
2 mg% -
0,2 ml
0,8 ml
4 mg% -
0,4 ml
0,6 ml
6 mg% -
0,6 ml
0,4 ml
8 mg% -
0,8 ml
0,2 ml
10 mg% -
1,0 ml
0,0 ml
Postępowanie:
1. Próby właściwe: 0,5 ml roztworu enzymu (odpowiednio rozcieńczonego) ogrzewać
w ultratermostacie w temperaturze 30
o
C przez 5 minut. Dodać 0,5 ml roztworu skrobi
(stoper!). Dokładnie po 30 minutach (od dodania skrobi) dodać 3 ml odczynnika GOX,
wymieszać i dokładnie po 60 minutach dodać 5 ml 2,5 M H
2
SO
4
, wymieszać, wyjąć
z ultratermostatu. Odczytać ekstynkcję przy 530 nm.
2. Próba kontrolna: do 0,5 ml enzymu dodać 3 ml GOX i 0,5 ml skrobi, inkubować
w temperaturze 30
o
C przez godzinę. Po tym czasie dodać 5 ml H
2
SO
4
i dalej postępować
jak z próbą właściwą.
3. Wzorce glukozowe: do 1 ml roztworu wzorcowego (0, 2, 4, 6, 8 i 10 mg%) dodać
3 ml GOX. Inkubować dokładnie 60 minut w temperaturze 30
o
C. Dodać 5 ml H
2
SO
4
,
wymieszać i odczytać ekstynkcję. Sporządzić krzywą wzorcową, z której odczytać
stężenie glukozy w próbach kontrolnych i właściwych (próba właściwa – kontrola = ∆)
Obliczenia:
Aktywność glukoamylazy (GA) wyrazić jako ilość mikromoli glukozy wytworzonej przez
1 ml enzymu w ciągu 1 godziny w temperaturze 30
o
C.
5
B. Oznaczanie cukrów redukujących z DNS
Zasada: oznaczania cukrów redukujących metodą z kwasem 3,5-dwunitrosalicylowym
polega na utlenieniu grup redukujących w produktach powstałych w wyniku enzymatycznej
degradacji skrobi i jednoczesnej redukcji cząsteczek kwasu 3,5 dwunitrosalicylowego do
kwasu 3,5 dwuaminosalicylowego. Procesowi temu towarzyszy zmiana barwy, której
natężenie oznacza się spektrofotometrycznie przy długości fali równej 530 nm.
C O O H
O H
N O
2
O N
2
+
C -H
O
R
4
C OO H
O H
N H
H N
2
2
+
4 C -OH
O
R
kwas 3,5 dwunitrosalicylowy
kwas 3,5 dwuaminosalicylowy
żółtopomarańczowy czerwonobrunatny
Odczynniki:
1. Odczynnik DNS (0,5 g DNS + 1,6 g NaOH lub 20 ml 2 M NaOH + 30 g winianu
Na-K). Winian, lekko ogrzewając, rozpuścić w wodzie. Dodać zawiesinę DNS
w możliwie dużej objętości wody, poczym dodać ług. Uzupełnić objętość do 100 ml.
Po 1-2 dniach odsączyć przez spiek.
2. Wzorzec glukozy 120 mg%
nr
stężenie [mg%]
glukoza [ml]
woda [ml]
1
0
0,000
2,000
2
10
0,170
1,830
3
20
0,330
1,670
4
40
0,670
1,330
5
60
1,000
1,000
6
80
1,330
0,670
7
100
1,670
0,330
8
120
2,000
0,000
Wykonanie:
Oznaczenie przeprowadzić w skalowanych probówkach.
Próby właściwe: 0,5 ml enzymu (odpowiednio rozcieńczonego) ogrzewać z 1 ml buforu w
ultratermostacie w temperaturze 30
o
C przez 5 minut. Dodać 0,5 ml roztworu skrobi (stoper).
Dokładnie po 30 min. dodać po 2 ml DNS.
Próby kontrolne: 0,5 ml enzymu + 1 ml buforu + 2 ml DNS (zamieszać). Dodać 0,5 ml
skrobi.
Próby właściwe, kontrolne i wzorce gotować 5 minut na wrzącej łaźni wodnej (stoper). Po
ostudzeniu dopełnić wodą destylowaną do 20 ml w probówkach skalowanych, wymieszać
i od razu czytać absorbancję przy 550 nm.
Literatura:
Cieśliński H., Filipkowski P., Kur J., Lass A., Wanarska M., 2007. Podstawy mikrobiologii przemysłowej.
Ćwiczenia laboratoryjne. wydawnictwo Politechniki Gdańskiej.
Wyszukiwarka
Podobne podstrony:
Ćwiczenia pytania na kolokwium 1 i 2
ĆWICZENIE 1 i 2 ODPOWIEDZI METROLOGIA LAB z MŁODYM Ćwiczenie 2 odpowiedzi na pytania
Przewodnik do ćwiczeń z hokeja na trawie
Ćwiczenie 1. immobilizacja, Mikrobiologia przemysłowa
Ból karku – ćwiczenia rozciągające na ból karku, Zdrowie
Architektura krajobrazu Ćwiczenie polegające na wykonaniu projektu ogrodu przed domem
Ćwiczenia Praca na kontach lokalnych stacji bezpieczne odłaczanie i
zzl ćwiczenia materiały na kolokwium
SPRAWOZDANIE ĆWICZENIE 6 elektronika na 8 05
ćwiczenie ch na sz
ćwiczenia 5-6 Składka na ubezpieczenie wypadkowe, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, ZARZĄDZANIE BE
rewalidacja, Wpływ ćwiczeń rewalidacyjnych na rozwój uczniów o obniżonej sprawności umysłowej
[040406] Tomasz Mroczka - Cwiczenia pomocnicze w na, Prywatne, Studia, Pływanie
[2009-01-20] MIKROEKONOMIA - Kolokwium 2 v2, mikro, Mikroekonomia, Ćwiczenia, Ściągi na kolokwia, [2
ćwiczenia - zagadnienia na egzamin
[2008-11-25] MIKROEKONOMIA - Kolokwium 1, mikro, Mikroekonomia, Ćwiczenia, Ściągi na kolokwia, [2008
więcej podobnych podstron