
BVD-MD
(Bovine Virus Diarrhoea - Mucosal Disease)
wirusowa biegunka bydła i choroba błon
śluzowych

Etiologia
Wirus BVD-MD należy do rodzaju Pestivirus, rodziny
Flaviviride. Do tego rodzaju należy również wirus powodujący
chorobę graniczną owiec i klasyczny pomór świń.
Wirus BVD-MD jest kształtu sferycznego, średnicy ok 40-50
nm.
Wirus jednoniciowy, RNA+

Wirus ten posiada otoczkę, lecz jest wrażliwy na działanie
łagodnych środków dezynfekcyjnych i substancji
powierzchniowo czynnych.
W niskich temperaturach i wysokiej wilgotności, może
zachować zdolność do zainfekowania nawet do kilku tygodni.

Wyróżniamy dwa biotypy wirusa:
●
cytopatyczny
(namnażający się w jelicie, nieprzechodzący
przez łożysko i nieprzenoszony przez nosicieli)
●
niecytopatyczny
(namnażający się OUN, kom. krwii,
węzłach chłonnych i układzie oddechowym, powodujący
wiremię i przechodzący przez łożysko)
Wirus występuje w licznych wariantach antygenowych, co
manifestuje się ciągłymi zmianami antygenowymi. Dzięki
temu może się „bronić” przed układem immunologicznym
gospodarza.

Występowanie
Po raz pierwszy wirus ten pojawił się w roku 1946 w USA.
Obecnie rozpowszechniony na całym świecie.
W Austrii i krajach skandynawskich ze względu na
prowadzone tam działania zwalczające wydaje się
występować znacznie rzadziej.

Wrota zakażenia
droga pokarmowa
oddechowa
poprzez krycie
Ryzyko przeniesienia wirusa podczas sztucznej inseminacji
lub przez transfer zarodków jest niewielkie, ze względu na
ścisłe kontrole.

Źródła zakażenia
Wektorem wirusa mogą być owady, zwierzęta dzikie (sarny,
muflony) oraz kozy i owce. Zakażenie może nastąpić drogą
jatrogenną, podczas transportu, przez kontakt na pastwisku.
Dołączenie do stada
ciężarnej krowy - nie
będącej nosicielką – też jest
ryzykiem, gdyż płód może
być trwale zakażony –
mówimy o tzw. „krowie
trojańskiej”. Infekuje
środowisko przy porodzie
wydalając wirusa z wodami
płodowymi.

Wirus namnaża się w miejscu wniknięcia, dochodzi do
wiremii i jego uogólnionego namnażania.
W przypadku wirusa BVD-MD mamy możliwość zakażenia
postnatalnego
i
prenatalnego
.

Zakażenie postnatalne
Występują postaci choroby:
●
Ostra przebiegająca z niecharakterystycznymi objawami
choroby (apatia, osowienie, nieznacznie podwyższenie
temperatury, leukopenia)
●
Ostra z charakterystycznymi objawami choroby
(temperatura 41 stopni C, wypływy z oczu i nosa, biegunka,
spadek laktacji)
●
Podostra przebiegająca z objawami
duszności i kaszlu, wypływem
surowiczym z oczu i nosa – śmiertelność
nawet 25%

●
Postać krwotoczna (biegunka z krwią, krwawienia w
miejscach iniekcji, skręty szyi, niezborność ruchów,
trombocyto- i leukopenię, wybroczyny pod twardówką,
wybroczyny punktowe na błonach śluzowych). Wysoka
śmiertelność.
●
Ostre zaburzenia ze strony układu oddechowego. Często
powikłania drobnoustrojami warunkowo chorobotwórczymi.
●
Stan ostrej immunosupresji (będącej wynikiem upośledzenia
funkcji leukocytów i spadku aktywności limfocytów
cytotoksycznych CD4+ i limfocytów pomocniczych CD8+, a
także makrofagów i neutrofili)
Podtwardówkowe wybroczyny ►

Zakażenie prenatalne
U zwierząt ciężarnych następstwo zakażenia wirusem BVD-
MD zależy od okresu ciąży. Objawy chorobowe związane są
także z serotypem wirusa obecnego w stadzie.
Jeśli do infekcji niecytopatycznymi szczepami dojdzie:
●
do 40 dnia po zapłodnieniu - dochodzi do obumarcia płodu
●
między 40 a 125 dniem – rodzą się cielęta trwale zakażone
(PI, persistent infected) – przypominają zdrowe zwierzęta,
mają słabsze przyrosty, nie wytwarzają przeciwciał przeciwko
BVD, zdolne do siewstwa przez całe życie

●
pomiędzy 100 a 150 dniem ciąży cielęta rodzą się z
wrodzonymi wadami, jak: niedorozwój mózgu i móżdżku,
małoocze, niedorozwój pokrywy włosowej.
●
infekcja w późnym okresie ciąży (128 - 285 dzień) pobudza
ukł. odpornościowy płodu do odpowiedzi, rodzą się cielęta z
czynnymi przeciwciałami przeciw BVDV (przeciwciała
przedsiarowe) lub klinicznymi objawami choroby – dochodzi
do spowolnienia lub zatrzymania rozwoju osobniczego.
Ataksja spowodowana niedorozwojem ►
móżdżku

Osobniki trwale zakażone po zetknięciu z antygenowo
identycznym lecz cytopatycznym wirusem BVD chorują na
śmiertelna w skutkach chorobę błon śluzowych.
Przy infekcji szczepem heterogennym wytwarzane są
normalne przeciwciała.
Krowy trwale zakażone ZAWSZE będą rodziły zwierzęta
trwale zakażone – szczepienie nie eliminuje tego zjawiska.

Zmiany AP
Jama ustna:
nieżytowe zapalenie, ogniska
martwicowe
Jama nosowa i przełyk:
nadżerki
Żwacz i księgi:
nieżytowe zapalenie oraz nadżerki
Trawieniec:
przekrwienie i obrzęk
Przy postaci biegunkowej kał jest płynny
brunatnozielonkawy z domieszką krwi i włóknika.

Stadium końcowe BVD-MD wyraża się biegunką,
czasem można zauważyć skrzepy krwi i pokłady
włóknika w odbytnicy,
zapalne/nadżerkowe/wrzodziejące zmiany w
błonie śluzowej jamy ustnej lub narządów
płciowych, także zamiany zapalne w ujściu
nozdrzy i na śluzawicy. Znaczenie diagnostyczne
mają nadżerkowo-martwicowe zmiany szpary
międzyracicznej, leukocytoza, pancreatitis.
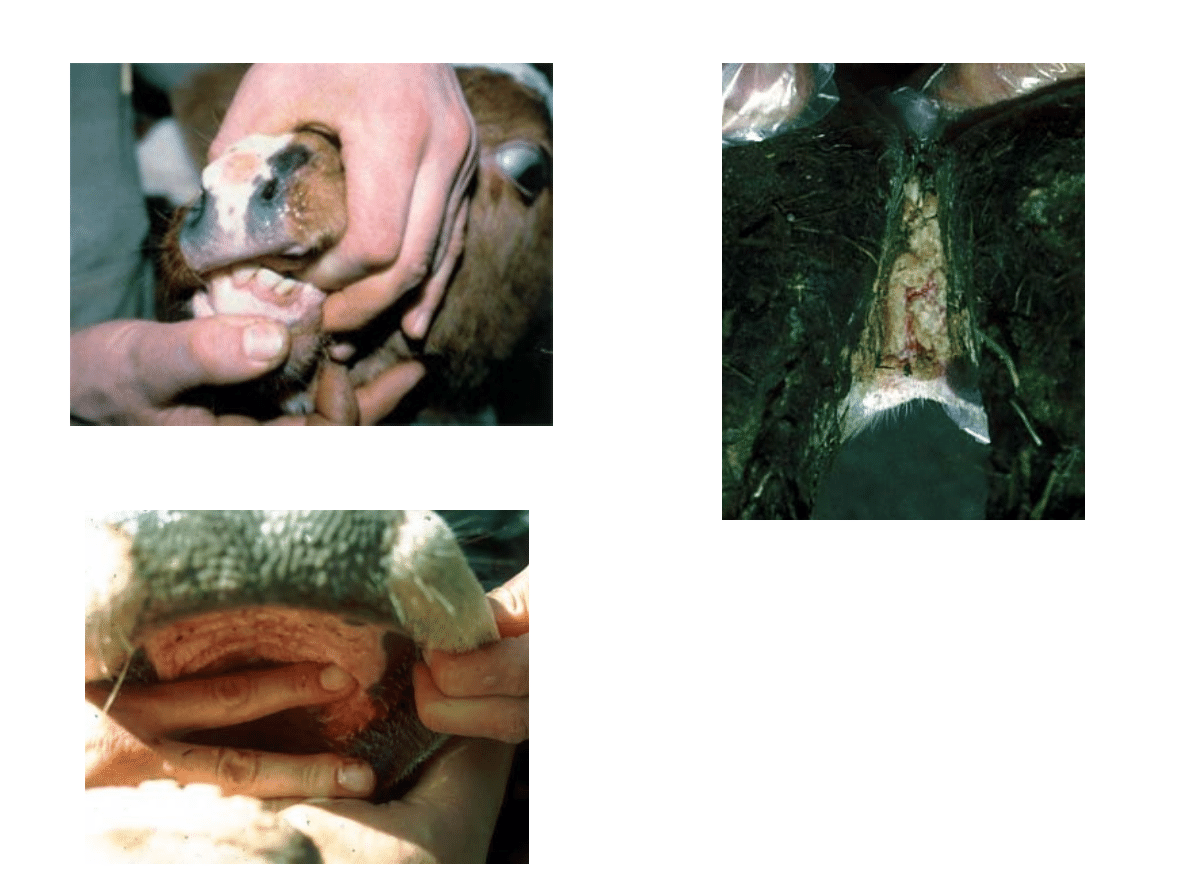
▲Owrzodzenia śluzawicy i dziąseł
▲Martwica szpary
międzyracicowej: wtórne
zasiedlenia bakteriami
chorobotwórczymi
spowodowane pierwotnymi
zmianami w naskórku
◄ Nadżerki na błonie śluzowej jamy ustnej
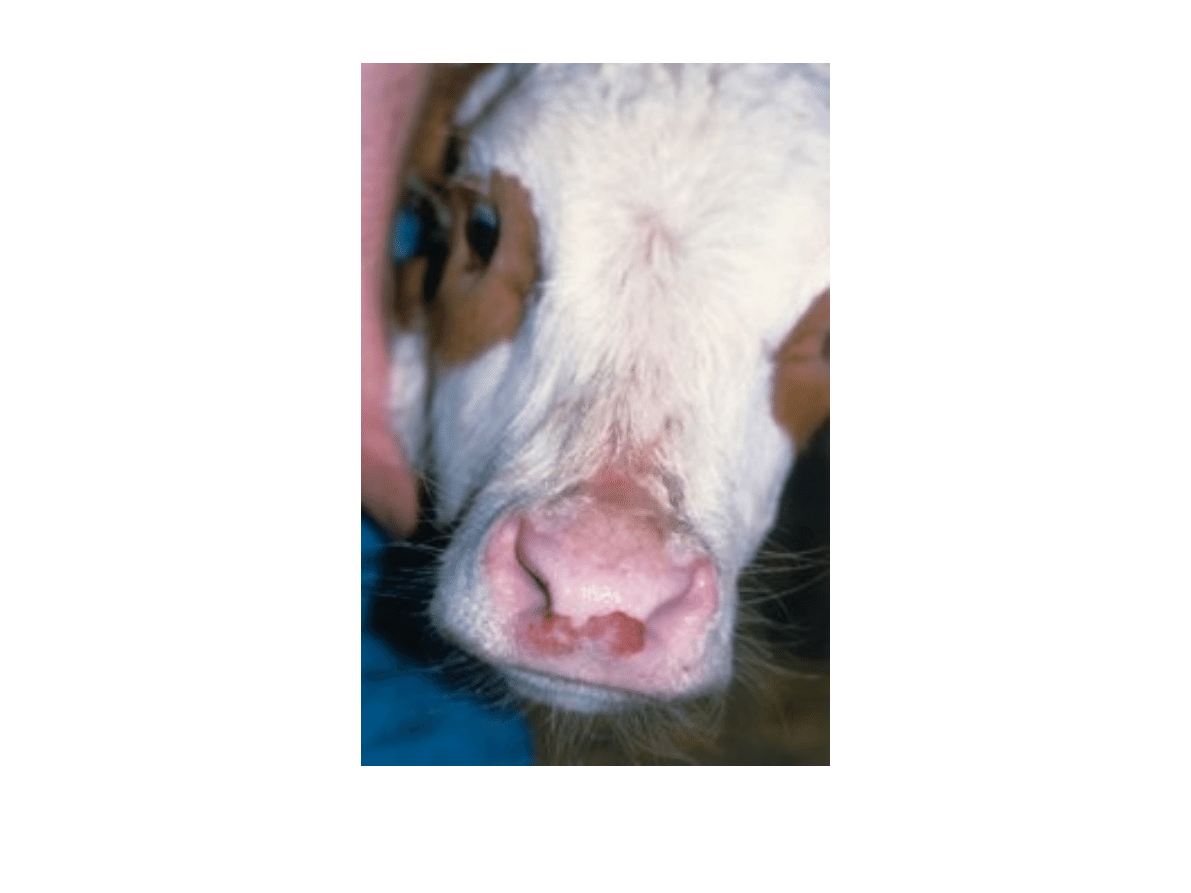
▲ Nadżerki na śluzawicy

Diagnostyka różnicowa
●
Zaburzenia rozwojowe wynikające z wewnątrzmacicznych
zakażeń mogą być konsekwencją zaburzeń genetycznych
np.. demielogenezą rdzenia lub syndromu Arnolda – Chiari
●
Choroba niebieskiego języka
●
Choroba Akabane
●
Zakażenie wirusem Zachodniego Nilu (w krajach
południowych)
●
Zaburzenia wzrostu mogą wynikać z niedoborów
żywieniowych i inwazjii pasożytniczych

●
Jeżeli chodzi o biegunkę należy brać pod uwagę
salmonellozę, kokcydiozę, pasożytnicze gastroenteritis i
dyzenterię zimową (nie występują zmiany w błonach
śluzowych i szparze)
●
Pierwotne choroby okolicy racic (dermatitis) są ograniczone
wyłącznie do obszaru miejscowego.
●
Skaza krwotoczna będąca konsekwencją trombocytopenii
może pojawiać się również przy zatruciem orlicą pospolitą i
rodentycydami.

Diagnostyka
Materiał do badań:
pełna krew, surowica, wymazy ze spojówek i nosa oraz
narządy padłych zwierząt (zwłaszcza nerka, śledziona, kępki
Peyera, grasica)
Trwale zakażone zwierzęta można rozpoznać relatywnie
łatwo na podstawie obecności antygenów wirusowych.
Osobniki takie po badaniu powtórzonym w odstępie trzech
tygodni pozostają pozytywne antygenowo.
Stosuje się metody „antigen-capture-ELISA”, cytofluorymetrię
i cytometrię przepływowa.
Można także wykrywać metodą PCR w mleku.

Szczepionki
Ze względu na brak w Polsce programów zwalczania BVD-
MD decyzja o szczepieniach zależy głównie od właścicieli
zwierząt. Czynniki, które powinny skłonić właściciela do
szczepień, są konsekwencje ekonomiczne (ronienia, spadek
mleczności, nieefektywność inseminacji, upadki cieląt)

Przykładem sposobu zwalczania choroby jest model
niemiecki wprowadzony w Dolnej Saksonii.
Polega na brakowaniu z hodowli osobników trwale
zakażonych i szczepieniu jałówek powyżej 6 miesiąca życia,
co najmniej 10 tygodni przed kryciem, celem szczepień jest
również uniknięcie śródmacicznej infekcji płodu i rodzenia
siewców wirusa.

Dostępne szczepionki
Żywe – zawierają szczepy wirusa poddane atenuacji, po ich
zastosowaniu indukowana jest odpowiedź limfocytów T i B,
jednak te szczepionki posiadają możliwość przepasażowania
szczepu wirusa w postać zjadliwą.
Inaktywowane – powodują wytworzenie odporności
humoralnej, zdecydowanie bezpieczniejsze w użyciu,
znajdują zastosowanie w każdym okresie cielności.
Dostępne są także szczepionki poliwalentne, jednak nie
posiadają one udowodnionej zdolności ochrony płodu

Frey i Eicken opracowali procedurę dwuetapowego
szczepienia przy użyciu preparatów inaktywowanych oraz
zmodyfikowanych żywych. Jako pierwsze stosowane są
szczepionki inaktywowane, po 4 tyg. atenuowane.
Przeciwciała nawet do 3 lat po przeprowadzeniu szczepień.

Szczepienie całego całego stada:
(zwierzęta powyżej 8 miesiąca życia) - dwukrotne iniekcje w
odstępach 4 tyg. Szczepienie przypominające zalecane co
pół roku.
Płód zostaje zabezpieczony tylko wówczas gdy ostatnia
dawka zostanie podana na 4 tygodnie przed rozpoczęciem
ciąży (ochrona przed zakażeniem śródmacicznym)
Zabezpieczanie cieląt:
Szczepienie na 2 i 6 tygodni przed porodem – daje wysoki
poziom przeciwciał w siarze (ochrona cielaka do 4 miesiąca)
Kolejne użycie szczepionki po ukończeniu 4 mies. życia.
U cieląt pozbawionych ochrony przeciwciał matczynych –
szczepienie w 15 dniu (dwie iniekcje co 3-4 tyg. szczepienia
przypominające co 9-12 mies.)

KONIEC
Document Outline
- Slajd 1
- Slajd 2
- Slajd 3
- Slajd 4
- Slajd 5
- Slajd 6
- Slajd 7
- Slajd 8
- Slajd 9
- Slajd 10
- Slajd 11
- Slajd 12
- Slajd 13
- Slajd 14
- Slajd 15
- Slajd 16
- Slajd 17
- Slajd 18
- Slajd 19
- Slajd 20
- Slajd 21
- Slajd 22
- Slajd 23
- Slajd 24
- Slajd 25
- Slajd 26
Wyszukiwarka
Podobne podstrony:
BVD-MD BVD-MD 3, Weterynaria, bydła + konie + trzoda chlerwna
BVD-MD 2, Weterynaria, bydła + konie + trzoda chlerwna
Infekcje BVD MD w stadach bydła mogą się okazać przyczyną poważnych strat ekonomicznych tjx
BVD MD konsp 11
Wirus BVD MD bydła
Szczepienia przeciw BVD MD
BVD MD PASTERELOZA cw bydlo
BVD MD
Zakażenia wirusem BVD MD
08 md wykl8
MD 3
MD cw 1 id 290131 Nieznany
md elementy teorii liczb
MD cw 05
MD wykl 06 id 290158 Nieznany
Einfacher MD Vorverstaerker
więcej podobnych podstron