
MATURA PRÓBNA 2003
O K R Ę G O W A
K O M I S J A
EGZAMINACYJNA
w K R A K O W I E
CHEMIA
MATERIAŁY DLA ZESPOŁÓW OCENIAJĄCYCH
Zasady oceniania rozwiązań
1.
Punkty przyznawane są za całkowicie poprawne rozwiązanie. W wypadku poprawnej, ale
niepełnej odpowiedzi należy przyznać odpowiednią część punktów, np. za podanie nazw
zwyczajowych zamiast systematycznych.
2.
W przypadku podania do jednego polecenia kilku odpowiedzi – poprawnej i błędnych – nie
przydziela się punktów.
3.
Ocenianiu podlegają tylko te fragmenty pracy, które dotyczą polecenia. Komentarze, nawet
poprawne, wykraczające poza zakres polecenia nie podlegają ocenianiu, przy czym odpowiedzi
zdających mogą odbiegać od modelowych, podanych w kryteriach oceniania.
4.
Jeżeli polecenie brzmiało „zapisz równanie reakcji” – nie przydziela się punktów za zapisanie
schematu procesu.
5.
Inne niż modelowe rozwiązania należy oceniać uwzględniając zaproponowaną punktację.
Zasady przeliczania punktacji na oceny szkolne:
ocena
liczba punktów
warunek
niedostateczny
0 – 36
dopuszczający
37 – 45
Za jedno zadanie min. 18 punktów.
dostateczny
46 – 66
Za jedno zadanie min. 21 punktów.
dobry
67 – 76
Za dwa zadania min. po 21 punktów.
bardzo dobry
77 – 83
Za dwa zadania min. po 24 punkty.
celujący
84 – 90
CHEMIA – MATERIAŁY DLA ZESPOŁÓW OCENIAJĄCYCH
Strona 2 z 8
Okręgowa Komisja Egzaminacyjna w Krakowie-Matura próbna – marzec 2003
Zadanie 1
Zadanie sprawdza wiadomości i umiejętności:
•
identyfikacji związków nieorganicznych (soli) i organicznych (węglowodorów alifatycznych
nasyconych i nienasyconych) na podstawie opisu wyników doświadczeń,
•
pisania równań reakcji na podstawie słownych informacji oraz dobierania współczynników
stechiometrycznych w oparciu o bilans materiałowy lub elektronowy,
•
wykonywania obliczeń stężeń roztworów oraz ilości substancji na podstawie równań reakcji,
obliczania pH roztworów,
•
poprawnego stosowania nomenklatury chemicznej,
•
rozwiązywania zadań w oparciu o podane informacje (nie znane wcześniej uczniom) liczba
kwasowa i kwasota mleka.
Model odpowiedzi
Kryterium
Punktacja
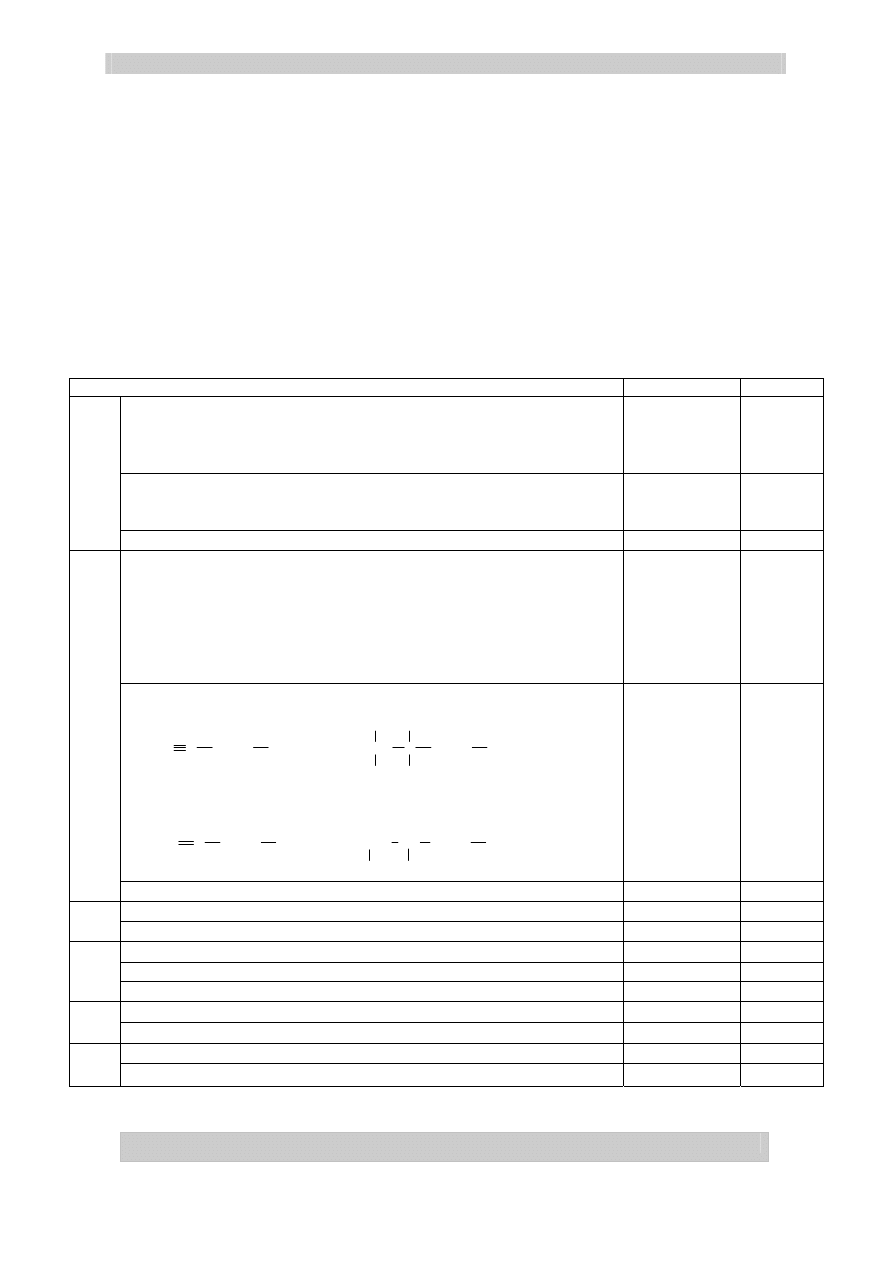
Opis toku postępowania i obserwacji dla każdej reakcji:
- dodanie roztworu Na
2
CO
3
– np. obfite pienienie – roztwór HCl
- dodanie roztworu Na
2
CO
3
– np. brak objawów reakcji – roztwór NaCl
- dodanie roztworu Na
2
CO
3
– np. wytrącanie osadu – roztwór CaCl
2
Za tok
postępowania i
obserwacje
3x1 pkt
3 pkt
Zapis równań reakcji w formie cząsteczkowej lub jonowej:
Na
2
CO
3
+ 2 HCl = 2 NaCl + H
2
O + CO
2
lub CO
3
2-
+ 2 H
+
= H
2
O + CO
2
Na
2
CO
3
+ CaCl
2
= 2 NaCl + CaCO
3
lub CO
3
2-
+ Ca
2+
= CaCO
3
Za równania
2x1 pkt
2 pkt
A
Na
2
CO
3
+ NaCl ––––– brak reakcji
Za stwierdzenie
1 pkt
Zapis obserwacji i wniosków:
- probówka 1 – odbarwienie – węglowodór nienasycony – 1-oktyn
- probówka 2 – brak odbarwienie – węglowodór nasycony n-oktan
- probówka 3 – odbarwienie – węglowodór nienasycony – 1-okten
Na podstawie pomiarów ilościowych można ustalić, że węglowodór
z probówki nr 1 charakteryzuje się większym stopniem nienasycenia,
niż węglowodór z probówki nr 3
Za wnioski oraz
identyfikację
3x1 pkt
3 pkt
Zapis równań reakcji:
Za równania
2x1 pkt
2 pkt
B
Podanie dwóch nazw: 1,1,2,2-tetrabromooktan i 1,2,-dibromooktan
Za nazwy
1 pkt
Zapis równania reakcji: BaCl
2
+ H
2
SO
4
= BaSO
4
+ 2 HCl
Za równanie
1 pkt
C
Obliczenie stężenia molowego - 0,2 mol/dm
3
.
Za obliczenie
2 pkt
Zapis równania reakcji: H
+
+ OH
–
= H
2
O
Za równanie
1 pkt
Obliczenie stężenia molowego: 2,5 ٠ 10
-4
mol/dm
3
Za obliczenie
3 pkt
D*
Obliczenie liczby jonów: 1,505 ٠ 10
20
jonów H
+
Za obliczenie
2 pkt
Zapis równania reakcji: H
+
+ OH
–
= H
2
O
Za równanie
1 pkt
D** Obliczenie pH: pH = 4,0
Za obliczenie
4 pkt
Obliczenie liczby kwasowej - 6,72 mg KOH
Za obliczenie
3 pkt
E*
Obliczenie kwasoty mleka – kwasota -52
0
Za obliczenie
2 pkt
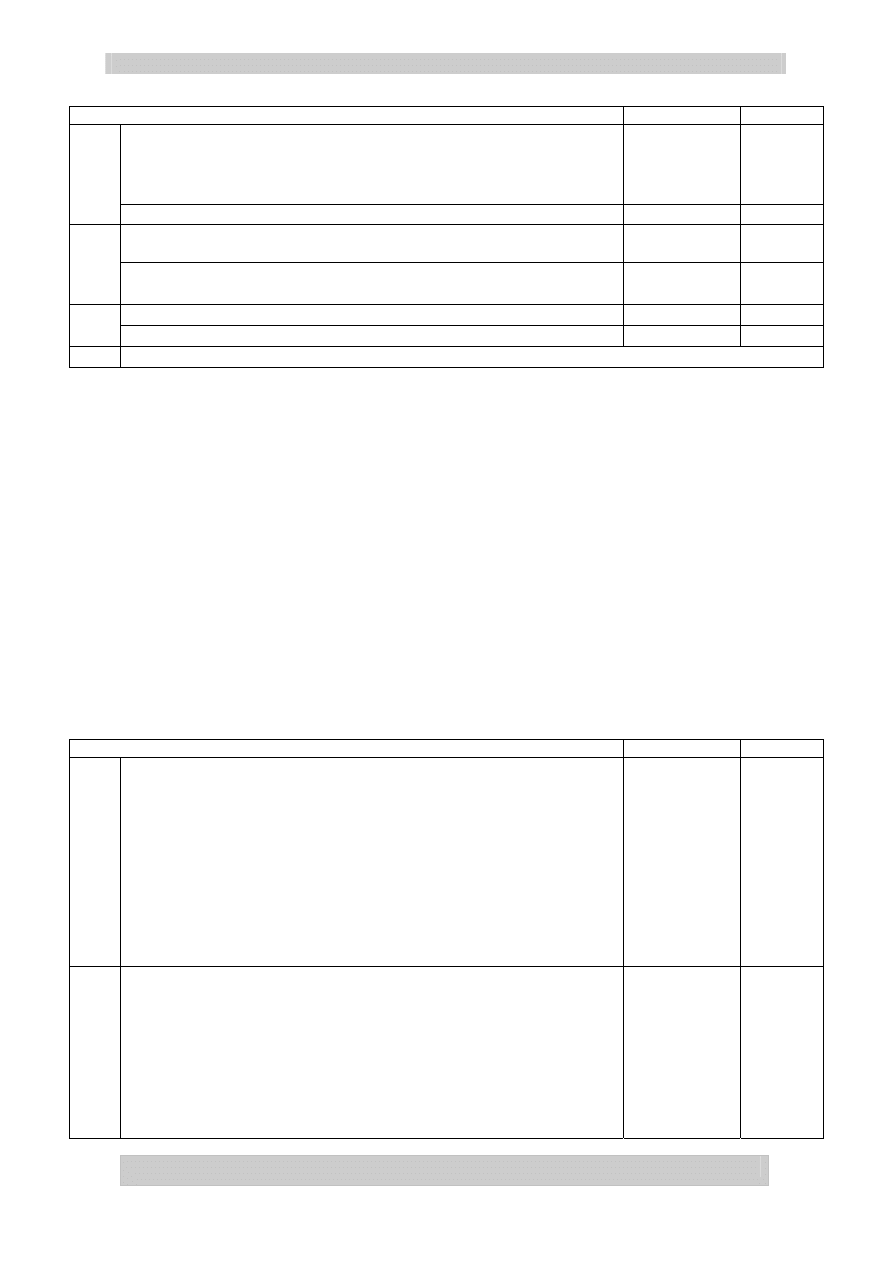
CH C
(CH
2
)
5
CH
3
+ 2 Br
2
=
C
(CH
2
)
5
CH
3
CH
Br
Br
Br
Br
+ Br
2
=
CH (CH
2
)
5
CH
3
CH
2
Br
Br
C
(CH
2
)
5
CH
3
CH
2
Strona 3 z 8 CHEMIA – MATERIAŁY DLA ZESPOŁÓW OCENIAJĄCYCH
Okręgowa Komisja Egzaminacyjna w Krakowie-Matura próbna – marzec 2003
Model odpowiedzi
Kryterium
Punktacja
Zapis równań reakcji:
1. Ca
2+
+ (COO)
2
2–
+ 2 NH
4
+
= 2 NH
4
+
+ (COO)
2
Ca
2. (COO)
2
Ca + H
2
SO
4
= CaSO
4
+ (COOH)
2
3. 5(COOH)
2
+2KMnO
4
+3H
2
SO
4
= 10CO
2
+ 2MnSO
4
+K
2
SO
4
+ 8H
2
O
Za równanie
1. i 2. - 2x1 pkt
za równanie 3.
– 2 pkt
4 pkt
E**
Obliczenie zawartości jonów Ca
2+
- 50 mg Ca
2+
.
Za obliczenie
4 pkt
Zapis równania reakcji CaCO
3
+ 2 HCl = CaCl
2
+ H
2
O + CO
2
i stwierdzenie: CaCl
2
+ HCl –––– reakcja nie zachodzi
Za zapis
1 pkt
F*
Obliczenie: zawartość % CaCO
3
- 89,28 %
≈ 89,3 %
zawartość % CaCl
2
- 10,72 %
≈ 10,7 %
Za obliczenie
2x1,5 pkt
3 pkt
Zapis równania: H
2
N–CH
2
–COOH
→
CH
3
NH
2
+ CO
2
Za równanie
1 pkt
F**
Obliczenie stężenia glicyny – 0,5 mol/dm
3
Za obliczenie
1 pkt
• RAZEM: A, B, C, D*, E*, F* - 30 pkt RAZEM: A, B, C, D**, E**, F** - 30 pkt
Zadanie 2
Zadanie sprawdza następujące wiadomości i umiejętności:
•
właściwości chemiczne pierwiastków drugiej grupy,
•
znajomość nomenklatury związków nieorganicznych i organicznych,
•
pisania równań reakcji w oparciu o podany schemat (chemograf),
•
uzgadniania równań reakcji w oparciu o bilans materiałowy i elektronowy,
•
rozwiązywania zadań w oparciu o równania chemiczne (stechiometria),
•
proponowania różnych metod otrzymywania soli i ilustrowania ich odpowiednimi równaniami
reakcji,
•
przewidywania odczynu wodnych roztworów soli nieorganicznych i organicznych oraz
ilustrowanie odpowiednimi równaniami reakcji,
•
ilustrowania równaniami reakcji elektrodowych procesów zachodzących podczas elektrolizy
wodnych roztworów soli nieorganicznych (poziom rozszerzony),
•
obliczania pH roztworów (poziom rozszerzony).
Model odpowiedzi
Kryterium
Punktacja
A
Zapis równań reakcji:
2 Sr + O
2
= 2 SrO
SrO + H
2
O = Sr(OH)
2
Sr(OH)
2
+ CO
2
= SrCO
3
+ H
2
O
SrO + CO
2
= SrCO
3
SrCO
3
= SrO + CO
2
SrCO
3
+ 2 HCl = SrCl
2
+ H
2
O + CO
2
SrCl
2
+ 2 C
15
H
31
COONa = 2 NaCl + (C
15
H
31
COO)
2
Sr
SrO + 2 HBr = SrBr
2
+ H
2
O
SrO + N
2
O
5
= Sr(NO
3
)
2
SrO + 2 CH
3
COOH = (CH
3
COO)
2
Sr + H
2
O
Za równania
10x1 pkt
10 pkt
B
Podanie nazw związków zawierających stront:
A – SrO tlenek strontu;
B - Sr(OH)
2
wodorotlenek strontu lub diwodorotlenek strontu;
D - SrCO
3
węglan strontu;
E - SrCl
2
chlorek strontu;
F - (C
15
H
31
COO)
2
Sr palmitynian (heksadekanian) strontu;
X - SrBr
2
bromek strontu;
Y - Sr(NO
3
)
2
azotan(V) strontu;
Z - (CH
3
COO)
2
Sr octan (etanian) strontu.
Za nazwy:
8x0,5 pkt
4 pkt

CHEMIA – MATERIAŁY DLA ZESPOŁÓW OCENIAJĄCYCH
Strona 4 z 8
Okręgowa Komisja Egzaminacyjna w Krakowie-Matura próbna – marzec 2003
Model odpowiedzi
Kryterium
Punktacja
Wskazanie procesu utleniania i redukcji - równanie nr 1
Za wskazanie
1 pkt
Zapis równań połówkowych:
2
0
Sr
– 4 e
→ 2
II
Sr
0
2
O
+ 4 e
→ 2
–II
O
Za równania
2x1 pkt
2 pkt
Wskazanie: utleniacz
0
2
O
; reduktor
0
Sr
Za wskazanie
2x0,5 pkt
1 pkt
Wskazanie reakcji strąceniowych – reakcje nr 3 i nr 7
Za wskazanie
2x1 pkt
2 pkt
C
Zapis jonowych równań reakcji
Sr
2+
+ 2 OH
–
+ CO
2
= SrCO
3
+ H
2
O
Sr
2+
+ 2 Cl
–
+ 2 Na
+
+ 2 C
15
H
31
COO
–
= (C
15
H
31
COO)
2
Sr + 2 Na
+
+ 2 Cl
–
lub Sr
2+
+ 2 C
15
H
31
COO
–
= (C
15
H
31
COO)
2
Sr
Za równania
2x1 pkt
2 pkt
Zapis równania reakcji: Sr + 2 H
2
O = Sr(OH)
2
+ H
2
Za równanie
1 pkt
D*
Obliczenie objętości - V = 0,224 dm
3
Za obliczenie
1 pkt
Zapis równania reakcji: Sr + 2 H
2
O = Sr(OH)
2
+ H
2
Za równanie
1 pkt
D** Obliczenie objętości - V = 0,240 dm
3
Za obliczenie
2 pkt
E*
Zapis równań reakcji otrzymywania soli, np.:
SrO + 2 HCl = SrCl
2
+ H
2
O
Sr(OH)
2
+ 2 HCl = SrCl
2
+ 2 H
2
O
Sr + 2 HCl = SrCl
2
+ H
2
Za równania
3x1 pkt
3 pkt
E**
Zapis równań reakcji elektrodowych:
K(–) 4H
2
O + 4e
→
2H
2
+ 4 OH
–
lub K(–) 2 H
2
O + 2e
→
H
2
+ 2 OH
–
A(+) 2 H
2
O – 4 e
→
O
2
+ 4 H
+
Za równania
2x1,5 pkt
3 pkt
Wskazanie soli o odczynie zasadowym - (CH
3
COO)
2
Sr
Za wskazanie
1 pkt
F*
Zapis równań reakcji hydrolizy
(CH
3
COO)
2
Sr + 2 H
2
O = 2 CH
3
COOH + 2 Sr(OH)
2
2 CH
3
COO
–
+ Sr
2+
+ 2 H
2
O = 2 CH
3
COOH + Sr
2+
+ 2 OH
–
lub CH
3
COO
–
+ H
2
O = CH
3
COOH + OH
–
Za równania
2x1 pkt
2 pkt
F**
Obliczenie pH roztworu: pH = 9,0
Za obliczenie
2 pkt
• RAZEM: A, B, C, D*, E*, F* - 30 pkt RAZEM: A, B, C, D**, E**, F** - 30 pkt
Zadanie 3
Zadanie sprawdza następujące wiadomości i umiejętności:
•
ustalania wzorów elementarnych i rzeczywistych związków chemicznych na podstawie
ich składu wagowego i masy molowej,
•
rysowania wzorów półstrukturalnych związków organicznych,
•
rozumienia istoty zjawiska izomerii,
•
stosowania poprawnej nomenklatury związków organicznych,
•
pisania równań reakcji w oparciu o opis słowny i uzgadniania ich w oparciu o bilans
materiałowy lub elektronowy,
•
właściwości alkoholi, aldehydów, ketonów, kwasów karboksylowych i estrów,
•
przewidywania kierunku przesunięcia równowagi reakcji w wypadku zmiany stężenia
substratów lub produktów,
•
rozwiązywania zadań rachunkowych w oparciu o równania reakcji (stechiometria).

Strona 5 z 8 CHEMIA – MATERIAŁY DLA ZESPOŁÓW OCENIAJĄCYCH
Okręgowa Komisja Egzaminacyjna w Krakowie-Matura próbna – marzec 2003
Model odpowiedzi
Kryterium
Punktacja
A
Wzór rzeczywisty – C
3
H
8
O
Za ustalenie
2,5 pkt
CH
3
CH
2
CH
2
OH
CH
3
CH CH
3
OH
Za wzory
2x1 pkt
2 pkt
1-propanol (propan-1-ol) 2-propanol (propan-2-ol)
Za nazwy
1 pkt
B
izomeria położeniowa
Za określenie
0,5 pkt
Zapis równań reakcji
C
3
H
7
OH + CuO
→ C
2
H
5
CHO + Cu + H
2
O
C
2
H
5
CHO + 2 CuO
→ C
2
H
5
COOH + Cu
2
O
Za równania
2x1 pkt
2 pkt
C
Podanie nazw systematycznych: propanal, kwas propanowy
Za nazwy
1 pkt
D
Obliczenie: 1,45 g propanalu
Za obliczenie
2,5 pkt
Zapis równań reakcji:
2 C
2
H
5
COOH + Ca
→ (C
2
H
5
COO)
2
Ca + H
2
2 C
2
H
5
COOH + CuO
→ (C
2
H
5
COO)
2
Cu + H
2
O
C
2
H
5
COOH + KOH
→ C
2
H
5
COOK + H
2
O
C
2
H
5
COOH + C
2
H
5
OH
→ C
2
H
5
COOC
2
H
5
+ H
2
O
Za równania
4x1 pkt
4 pkt
Podanie nazw systematycznych:
(C
2
H
5
COO)
2
Ca - propanian wapnia
(C
2
H
5
COO)
2
Cu - propanian miedzi(II)
C
2
H
5
COOK – propanian potasu
C
2
H
5
COOC
2
H
5
– propanian etylu
Za nazwy
4x0,5 pkt
2 pkt
Określenie odczynu (C
2
H
5
COO)
2
Ca - odczyn zasadowy
Za określenie
0,5 pkt
E
Zapis równań:
(C
2
H
5
COO)
2
Ca + 2 H
2
O
→ 2 C
2
H
5
COOH + Ca(OH)
2
2 C
2
H
5
COO
–
+ 2 H
2
O
→ 2 C
2
H
5
COOH + 2 OH
–
Za równania
1,5 pkt
F
Obliczenie stężenia: c
mol
= 0,144 mol/dm
3
Za obliczenie
3 pkt
Zapis równania: C
2
H
5
COOH + CH
3
OH
⇄ C
2
H
5
COOCH
3
+ H
2
O
Za równanie
1 pkt
Zapis wzorów: np. CH
3
COOC
2
H
5
, HCOOC
3
H
7
Za wzory
1 pkt
G*
Podanie nazw: propanian metylu,
oraz odpowiednio: octan etylu, mrówczan propylu
Za nazwy
3x0,5 pkt
1,5 pkt
Zapis równania: C
2
H
5
COOH + CH
3
OH
⇄
C
2
H
5
COOCH
3
+ H
2
O
Za równanie
1 pkt
Określenie kierunku przesunięcia stanu równowagi:
- usunięcie wody – w prawo
- dodanie alkoholu – w prawo
-
usunięcie estru – w prawo
Za określenie
3x0,5 pkt
1,5 pkt
G**
Wyjaśnienie kierunku przesunięcia stanu równowagi
Za wyjaśnienie
1 pkt
Zapis równania: C
3
H
8
+ 1,5 O
2
→ C
2
H
5
COOH + H
2
O
Za równanie
1 pkt
H*
Obliczenie: V = 67,2 dm
3
Za obliczenie
3 pkt
Za ustalenie jaki związek jest utleniany (propanon)
Za ustalenie
1 pkt
Zapis równania:
5 CH
3
–CO–CH
3
+ 6 KMnO
4
+ 9 H
2
SO
4
→
→
5 CH
3
COOH + 5 HCOOH +3 K
2
SO
4
+ 6 MnSO
4
+ 9 H
2
O
Za substraty
i produkty,
współczynniki
1 pkt
1 pkt
H**
Bilans elektronowy;
II
C
– 1 e
→
III
C
–III
C
– 5 e
→
II
C
6e x 5
VII
Mn
+ 5 e
→
II
Mn
5e x 6
Za bilans
1 pkt
• RAZEM: A, B, C, D, E, F, G*, H* - 30 pkt RAZEM: A, B, C, D, E, F, G**,H** - 30 pkt
CHEMIA – MATERIAŁY DLA ZESPOŁÓW OCENIAJĄCYCH
Strona 6 z 8
Okręgowa Komisja Egzaminacyjna w Krakowie-Matura próbna – marzec 2003
Zadanie 4
Zadanie to sprawdza następujące wiadomości i umiejętności:
•
znajomość właściwości chemicznych związków azotu na różnych stopniach utlenienia,
•
umiejętność pisania równań reakcji na podstawie słownych informacji,
•
uzgadnianie równań reakcji w oparciu o bilans materiałowy i elektronowy,
•
rozwiązywanie zadań w oparciu o stechiometrię,
•
obliczanie stężeń roztworów w oparciu o wyniki doświadczeń,
•
uzasadniania, za pomocą odpowiednich równań reakcji, odczynu wodnych roztworów
amoniaku, amin i soli amonowych,
•
zapisywania równań reakcji kondensacji aminokwasów,
•
znajomość nomenklatury peptydów,
•
przewidywania kierunku zmian równowagi reakcji przy zmianie ciśnienia i temperatury oraz
uzasadnienie za pomocą reguły przekory (zakres rozszerzony).
Model odpowiedzi
Kryterium
Punktacja
A
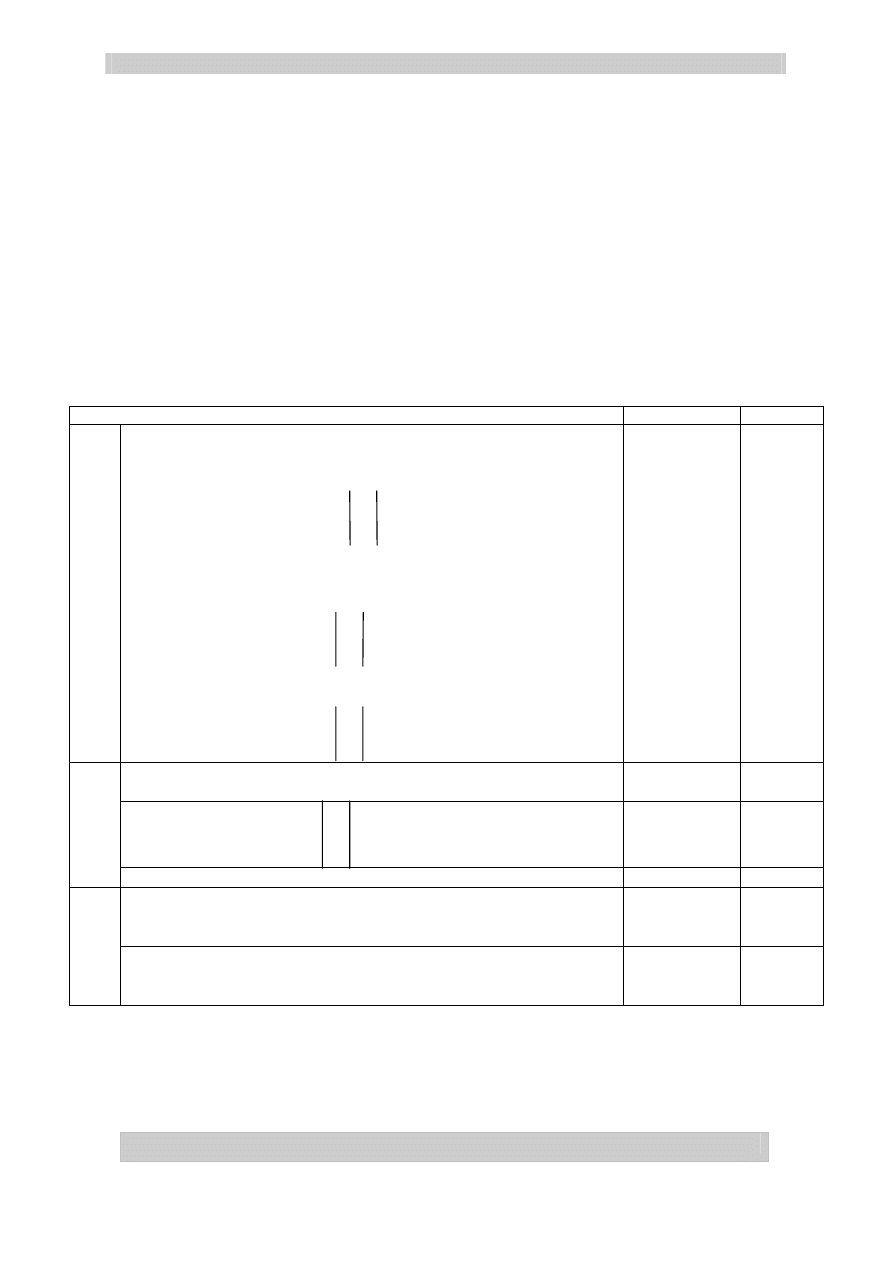
Zapis równań reakcji:
1. N
2
+ 3 H
2
= 2 NH
3
2. 4 NH
3
+ 5 O
2
= 4 NO + 6 H
2
O
-III
N
– 5 e
→
II
N
5e x 4
0
2
O
+ 2•2 e
→ 2
–II
O
4e x 5
3. 2 NO + O
2
= 2 NO
2
i 2 NO
2
= N
2
O
4
lub 2NO + O
2
= N
2
O
4
4. N
2
O
4
+ H
2
O = HNO
2
+ HNO
3
5. 3 HNO
2
= HNO
3
+ 2 NO + H
2
O
III
N
– 2 e
→
V
N
2e x 1
III
N
+ 1 e
→
II
N
1e x 2
6. 4 HNO
3
= 4 NO
2
+ O
2
+ 2 H
2
O
2
–II
O
– 2
⋅2 e →
0
2
O
4e x 1
V
N
+ 1 e
→
IV
N
1e x 4
Za równania:
1. – 1 pkt
2. – 2 pkt
3. – 2x0,5 pkt
4. – 1 pkt
5. – 3 pkt
6. – 2 pkt
10 pkt
Zapis równania reakcji:
3 Cu + 8 HNO
3
= 2 NO +4 H
2
O + 3 Cu(NO
3
)
2
Za równanie
współczynniki
2 pkt
0
Cu
– 2 e
→
II
Cu
2e x 3
V
N
+ 3 e
→
II
N
3e x 2
Za bilans
1 pkt
B
Obliczenie: 0,7 dm
3
NO
Za obliczenie
3 pkt
Zapis równań reakcji dla amoniaku:
NH
3
+ H
2
O = NH
4
+
+ OH
–
NH
3
+ HCl = NH
4
Cl
Za równania
2x1 pkt
2 pkt
C
Zapis równań reakcji dla metyloaminy:
CH
3
NH
2
+ H
2
O = [CH
3
NH
3
]
+
+ OH
–
CH
3
NH
2
+ HCl = [CH
3
NH
3
]Cl
Za równania
2x1,5 pkt
3 pkt
Strona 7 z 8 CHEMIA – MATERIAŁY DLA ZESPOŁÓW OCENIAJĄCYCH
Okręgowa Komisja Egzaminacyjna w Krakowie-Matura próbna – marzec 2003
Model odpowiedzi
Kryterium
Punktacja
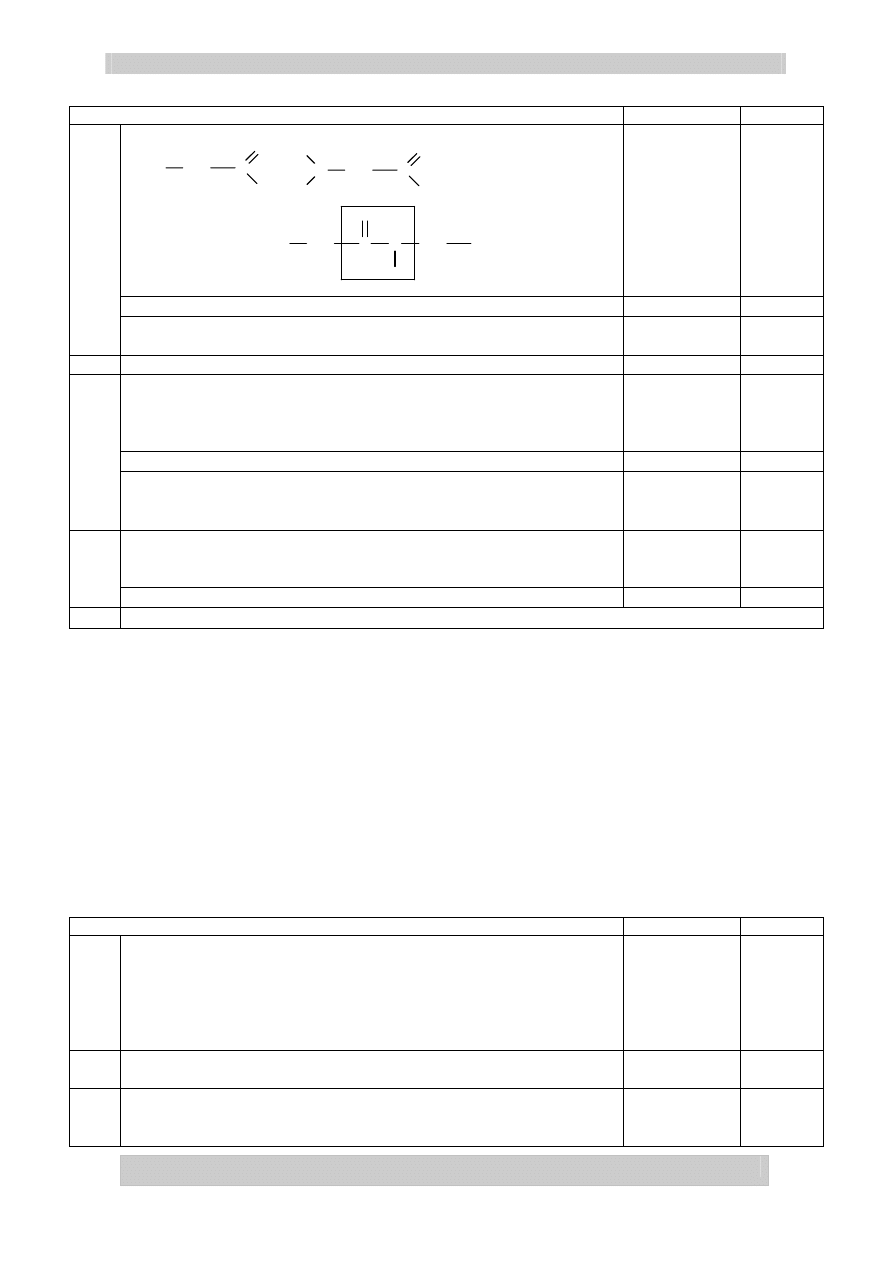
H
2
O
+
H
2
N
CH
2
C
O
N
H
CH
2
COOH
=
N
CH
2
C
O
OH
H
H
+
H
2
N
CH
2
C
O
OH
=
Za równanie
2 pkt
Podanie nazwy: glicyloglicyna lub glicynoglicyna
Za nazwę
1 pkt
D*
Zaznaczenie wiązania i podanie nazwy: wiązanie peptydowe (amidowe)
Za zaznaczenie
i nazwę
1 pkt
D** Obliczenie: 46,24 % czystego KCl
Za obliczenie
6 pkt
Zapis równań:
2 NH
3
+ H
2
SO
4
= (NH
4
)
2
SO
4
NH
3
+ HNO
3
= NH
4
NO
3
(NH
4
)
2
SO
4
+ 2 NaOH = 2 NH
3
+ Na
2
SO
4
+ 2 H
2
O
Za równania
3x1 pkt
3 pkt
Określenie odczynu NH
4
NO
3
: odczyn kwaśny
Za określenie
0,5 pkt
E*
Uzasadnienie:
NH
4
NO
3
+ H
2
O = NH
3
•H
2
O + HNO
3
NH
4
+
+ H
2
O = NH
3
•H
2
O + H
+
Za równania
1,5 pkt
Określenie kierunku przesunięcia stanu równowagi:
-zwiększenie temperatury – w lewo
- zwiększenie ciśnienia – w prawo
Za określenie
1 pkt
E**
Uzasadnienie w oparciu o regułę przekory
Uzasadnienie
2 pkt
• RAZEM: A, B, C, D*, E* - 30 pkt RAZEM: A, B, C, D**, E** - 30 pkt
Zadanie 5
Zadanie to sprawdza następujące wiadomości i umiejętności:
•
pisania równań reakcji w oparciu o podany schemat (chemograf),
•
uzgadniania równań reakcji w oparciu o bilans materiałowy lub elektronowy,
•
systematycznej nomenklatury związków organicznych,
•
właściwości chemicznych alkoholi,
•
identyfikacji alkoholi jedno i wielowodorotlenowych,
•
typów reakcji charakterystycznych dla chemii organicznej,
•
obliczania stężeń roztworów.
Model odpowiedzi
Kryterium
Punktacja
A
Zapis równań:
CH
2
=CH
2
+ H
2
O = CH
3
CH
2
OH
np. CH
3
CH
2
Cl + NaOH = CH
3
CH
2
OH + NaCl
CH
3
CH
2
OH + CuO = CH
3
CHO + Cu + H
2
O
CH
3
CH
2
OH + C
2
H
5
COOH = C
2
H
5
COOCH
2
CH
3
+ H
2
O
2CH
3
CH
2
OH + 2Na = 2CH
3
CH
2
ONa + H
2
Za równania
5x 1 pkt
5 pkt
B
Za określenie typów reakcji:
1. addycja; 2. substytucja; 3. utlenianie - redukcja
Za określenie
3x 0,5 pkt
1,5 pkt
C
Podanie nazw systematycznych:
A – eten , B – np. chloroetan, D – etanal, E – propanian etylu,
F – etanolan sodu
Za nazwy
5x0,5 pkt
2,5 pkt

CHEMIA – MATERIAŁY DLA ZESPOŁÓW OCENIAJĄCYCH
Strona 8 z 8
Okręgowa Komisja Egzaminacyjna w Krakowie-Matura próbna – marzec 2003
Określenie odczynu etanolanu sodu: odczyn zasadowy
Za określenie
0,5 pkt
Zapis równań uzasadniających odczyn:
CH
3
CH
2
ONa + H
2
O = CH
3
CH
2
OH + NaOH
CH
3
CH
2
O
–
+ Na
+
+ H
2
O = CH
3
CH
2
OH + Na
+
+ OH
–
CH
3
CH
2
O
–
+ H
2
O = CH
3
CH
2
OH + OH
–
Za równania
2,5 pkt
D
Użycie wskaźnika, np. fenoloftaleiny
Za wskazanie
1 pkt
Zapis równania: C
2
H
5
OH + 3O
2
= 2CO
2
+ 3H
2
O
Za równanie
1 pkt
E
Obliczenie: V = 840 dm
3
Za obliczenie
2 pkt
Zapis wzorów półstrukturalnych izomerów:
np. 1-butanol (alkohol butylowy, butan-1-ol) pierwszorzędowy
2-butanol ( butan-2-ol) drugorzędowy
2-metylo-2-propanol (2-metylo-propan-2-ol) trzeciorzędowy
Za wzory
3x0,5 pkt
Za nazwy
i rzędowość
3x1 pkt
1,5 pkt
3 pkt
CH
3
CH
2
CH CH
3
OH
+ CuO = CH
3
CH
2
C CH
3
O
+ Cu + H
2
O
Za równanie
1 pkt
F
Określenie: keton
Za określenie
0,5 pkt
G*
Opis doświadczenia:
odczynnik: Cu(OH)
2
lub wodorotlenek miedzi(II)
rysunek lub opis czynności
obserwacje: w jednej probówce następuje rozpuszczenie osadu (powstaje
niebieski roztwór)
wniosek: rozpuszczenie osadu nastąpiło w probówce z etanodiolem
Odczynnik –
0,5 pkt
opis – 0,5 pkt
obserwacje –
0,5 pkt
wniosek – 1 pkt
2,5 pkt
G** Opis czynności lub rysunek.
Obserwacje: np. podczas ogrzewania w jednej probówce wytrąca się
ceglastoczerwony osad.
Wniosek: w probówce, w której powstał osad był roztwór glukozy.
Opis – 0,5 pkt
obserwacje –
0,5 pkt
wniosek – 1 pkt
2 pkt
H*
Obliczenie: c = 94 %
Za obliczenie
3 pkt
H** Obliczenie: V = 404,8 cm
3
Za obliczenie
3 pkt
Wzór izomeru: np. CH
3
CH
2
CH
2
COOCH
3
nazwa; butanian (maślan) metylu
Za wzór
i nazwę
1 pkt
I*
Zapis równania hydrolizy:
CH
3
CH
2
CH
2
COOCH
3
+ H
2
O = CH
3
CH
2
CH
2
COOH + CH
3
OH
Za równanie
1,5 pkt
Zapis równania:
3 CH
3
CH
2
OH + K
2
Cr
2
O
7
+ 4 H
2
SO
4
=
= 3 CH
3
CHO + Cr
2
(SO
4
)
3
+ K
2
SO
4
+ 7 H
2
O
Za równanie
2 pkt
I**
Bilans elektronowy:
-I
C
– 2 e
→
I
C
2e x 3
2
VI
Cr
+ 2
⋅
3 e
→
2
III
Cr
6e x 1
Za bilans
1 pkt
• RAZEM: A, B, C, D, E, F, G*, H*, I* - 30 pkt RAZEM: A, B, C, D, E, F, G**, H**, I** - 30 pkt
Wyszukiwarka
Podobne podstrony:
2003 probna matura styczen 2003 Chemia podstawowa arkusz1 id 60 (2)
2003 probna matura styczen 2003 Chemia rozszerzona arkusz2 id 6 (2)
2003 próbna matura styczeń 2003, Chemia podstawowa arkusz1-odpowiedzi
2003, próbna matura styczeń 2003 Chemia rozszerzona arkusz2 odpowiedzi
2003, próbna matura styczeń 2003 Chemia podstawowa arkusz1 odpowiedzi
chemia 2003 styczen probna rozszerzona
chemia 2003 styczeń rozsz
chemia 2003 styczeń rozsz
2003 próbna Arkusz III
Zadania egzaminacyjne 2003, Nieorganiczna, chemia2, Arkusze powtórzeniowe, Pobieranie1, studia 1.2,
chemia organiczna 2003 cała PDF(1)
2003 arkusz pp próbna
chemia matura styczen 2003 arkusz 1 7NL7HMDRBPQUD5O26HUGWX
Biotechnologia 2003-sem2, studia, CHEMIA
PROBNA MATURA GRU2007 Chemia PP odp
więcej podobnych podstron