
28
BIOLOGICZNE MECHANIZMY OCZYSZCZANIA SKA¯EÑ
ORGANICZNYCH W GLEBIE
Henryk Ko³oczek, Pawe³ Kaszycki
W dobie burzliwego rozwoju ró¿nych ga³êzi przemys³u, w tym
samochodowego i chemicznego oraz rozwoju miast i infrastruktury, dochodzi
czêsto do wzrostu zanieczyszczenia rodowiska naturalnego ró¿norakimi
szkodliwymi substancjami. Takie obce substancje, niespotykane naturalnie
i zanieczyszczaj¹ce przyrodê nazywamy ksenobiotykami. Istnieje pilna
koniecznoæ eliminacji ska¿eñ rodowiskowych, poniewa¿ stanowi¹ ogromne
zagro¿enie dla rolin, zwierz¹t i ludzi, wywo³uj¹c niejednokrotnie niebezpieczne
choroby i zak³ócenie równowagi biologicznej. W ostatnich latach du¿e znaczenie
w usuwaniu ksenobiotyków ze rodowiska naturalnego uzyskuj¹ metody
biologiczne, które likwiduj¹ zagro¿enia w sposób ostateczny, a jednoczenie nie
wymagaj¹ du¿ych nak³adów finansowych. Rozwój nauki i g³êbsze poznanie
biologicznych mechanizmów zwi¹zanych z unieszkodliwianiem organicznych
odpadów przemys³owych przez ró¿ne drobnoustroje umo¿liwi³y zastosowanie
wyspecjalizowanych bakterii, grzybów i rolin do walki z odpadami. Procesy
eliminacji lub zmniejszenia toksycznoci odpadów za pomoc¹ mikroorganizmów
nazywamy bioremediacj¹. Oprócz tej metody, w walce z odpadami znajduj¹
zastosowanie roliny (fitoremediacja).
Szerokie wykorzystanie metod biologicznych w walce z zanieczyszczeniami
w rodowisku naturalnym (w wodach, glebach i powietrzu) wi¹¿e siê z wieloma
korzystnymi czynnikami, z których najistotniejsze s¹:
bezporednia degradacja zanieczyszczenia ksenobiotyku, a nie jego trans-
fer pomiêdzy ró¿nymi mediami, jak to czêsto siê dzieje w przypadku metod
fizykochemicznych;
wykorzystanie szlaków i cykli metabolicznych mikroorganizmów
prowadz¹cych do koñcowych produktów przemian ksenobiotyku, tj. do H
2
O
i CO
2
;
ród³em energii potrzebnej do unieszkodliwienia zanieczyszczeñ s¹ w³anie
zanieczyszczenia;
zastosowanie metody bioremediacji zanieczyszczeñ in situ nie prowadzi do
dewastacji krajobrazu;
ni¿szy koszt oczyszczania w porównaniu do innych metod.
Z tych w³anie przyczyn metody biologiczne, a szczególnie bioremediacja,
ciesz¹ siê du¿¹ popularnoci¹. Dowodem jest ogromny wzrost nak³adów
poniesionych przez amerykañsk¹ Agencjê Ochrony rodowiska (EPA) na badania

29
i wdro¿enie metod bioremediacji na terenie USA. Od po³owy lat osiemdziesi¹tych
ubieg³ego wieku do roku 2000 liczba projektów zwi¹zanych z usuwaniem
zanieczyszczeñ organicznych wzros³a od kilku do kilkuset [http://cfpub.epa.gov].
W ostatnich latach, dziêki zastosowaniu nowoczesnych metod genomiki
i proteomiki, nast¹pi³ dalszy postêp w zrozumieniu mechanizmów biochemicznych
i mikrobiologicznych, prowadz¹cych do degradacji zanieczyszczeñ, i jest to
powodem gwa³townego wzrostu liczby i jakoci projektów zwi¹zanych
z oczyszczaniem rodowiska metod¹ bioremediacji. Opublikowany w koñcu lat
dziewiêædziesi¹tych raport EPA przewiduje, ¿e wydatki w USA na oczyszczanie
gleby zawieraj¹cej same tylko chlorowcopochodne zwi¹zków aromatycznych
i alifatycznych (m.in. zanieczyszczenia przemys³u rafineryjnego i chemicznego)
poch³on¹ ok. 45 mld dolarów w nastêpnej dekadzie. Kwota ta ilustruje znaczenie
technologii wykorzystuj¹cych procesy bioremediacji i wyznacza nowe kierunki
prac badawczych i technologicznych w ochronie rodowiska naturalnego na
nastêpne lata w USA, a poprzez ogromny potencja³ naukowy tego kraju równie¿
na wiecie. Nale¿y podkreliæ, ¿e tak¿e w pañstwach Unii Europejskiej nastêpuje
wzrost nak³adów na badania w zakresie bioremediacji ska¿eñ organicznych.
Zastosowanie biologicznych metod oczyszczania gruntów i wód ska¿onych
produktami naftowymi i innymi toksycznymi zwi¹zkami organicznymi,
praktykowane jest z dobrym skutkiem od kilkunastu lat w Polsce. Jednym
z pionierów oczyszczania gruntów zanieczyszczonych odpadami organicznymi
(w tym wyciekami oleju napêdowego) w Polsce jest prof. J. Siuta z Instytutu
Ochrony rodowiska w Warszawie, którego grupa zastosowa³a metody
biotechnologiczne likwidacji zanieczyszczeñ ropopochodnych w P³ocku w latach
80. i 90. ubieg³ego wieku [1]. W pierwszej po³owie lat 90. wiele innych orodków
naukowych i firm komercyjnych rozwinê³o metody biologiczne likwidacji ska¿eñ
rafineryjnych w glebie i wodach powierzchniowych [1-4].
W naszym kraju najwiêksze zagro¿enie dla rodowiska naturalnego stanowi¹
ró¿norodne, przewa¿nie ma³e, ale powszechnie wystêpuj¹ce ród³a emisji
zwi¹zków ropopochodnych do ziemi, wód powierzchniowych i kanalizacji.
Górnicza eksploatacja, a tak¿e transport, przerób i dystrybucja ropy i jej
pochodnych, eksploatacja maszyn, mechanizacja rolnictwa i lenictwa stanowi¹
g³ówne ród³a punktowego i obszarowego zaolejenia ziemi i wód podziemnych [1].

30
1. Wp³yw zanieczyszczeñ przemys³u rafineryjnego na w³aciwoci gleby
Ropa naftowa i jej pochodne zmieniaj¹ fizyczne, chemiczne i biologiczne
w³aciwoci gleby. Wyró¿nia siê kilka istotnych zaburzeñ, maj¹cych wp³yw na
charakterystykê gleby:
drastyczna zmiana w iloci i sk³adzie chemicznym substancji organicznych
gleby,
obni¿enie pojemnoci wodnej gleby i utrudnienie wymiany powietrznej na
skutek zape³nienia porów glebowych przy jednoczesnym wzrocie
zapotrzebowania na tlen,
zaburzenie stosunku zawartoci wêgla organicznego do zawartoci azotu
i fosforu, uniemo¿liwiaj¹cy prawid³owy rozwój ¿ycia biologicznego,
zaburzenie w³aciwoci koloidów glebowych, w tym wymiany jonowej i pH
(g³ównie zakwaszenie gleby).
W g³êbszych warstwach gleby naturalna zawartoæ zwi¹zków organicznych
jest niska, dlatego nawet niewielkie ³adunki zanieczyszczeñ ropopochodnych
znacz¹co podwy¿szaj¹ stê¿enie substancji organicznej w tych warstwach,
wydatnie pogarszaj¹c warunki wodne i tlenowe. Zaburzona struktura i w³aciwoci
gleby prowadz¹ do zahamowania ¿ycia biologicznego, a naturalna rekultywacja
gruntu, w skrajnych przypadkach, mo¿e trwaæ od kilku do kilkuset lat.
Zastosowanie nowoczesnych metod biotechnologicznych, opartych na
wyselekcjonowanych biocenozach, pozwala skróciæ czas rekultywacji do kilku
miesiêcy (por. kolejny artyku³ autorów w niniejszej monografii).
2. Biologiczne mechanizmy remediacji zanieczyszczeñ ropopochodnych
Zwi¹zki wêglowodorowe wystêpuj¹ce w ropie naftowej mo¿na podzieliæ na
cztery grupy: wêglowodory nasycone, aromatyczne, asfalteny (fenole, kwasy
t³uszczowe, ketony, estry i porfiryny) oraz ¿ywice (pirydyny, chinoliny, karbazole,
sulfotlenki, amidy) [5].
Mikroorganizmy wystêpuj¹ce w rodowisku przyrodniczym posiadaj¹
zdolnoæ degradacji prawie wszystkich naturalnie wystêpuj¹cych substancji,
aczkolwiek zwi¹zki wêglowodorowe charakteryzuj¹ siê ró¿n¹ podatnoci¹ na
atak katalityczny drobnoustrojów. Zdolnoæ do biodegradacji wêglowodorów
mo¿na uporz¹dkowaæ w nastêpuj¹cy malej¹cy sposób: n-alkany > alkany
rozga³êzione > zwi¹zki aromatyczne o niskiej masie cz¹steczkowej > zwi¹zki
aromatyczne wielopiercieniowe (WWA) [6]. W efekcie, kinetyka biodegradacji
jest najszybsza dla nasyconych alkanów, a najwolniejsza dla WWA. Ekstremalnie

31
woln¹ degradacjê stwierdzono dla polarnych wielopiercieniowych
chlorowcopochodnych [7]. Jednoczenie w ostatnich latach zauwa¿ono, ¿e
nastêpuje szybszy proces degradacji niektórych zwi¹zków organicznych
w obecnoci innych zanieczyszczeñ. Jest to tzw. efekt ko-metabolizmu, gdzie
mikroorganizmy wykorzystuj¹ jedno zanieczyszczenie jako donor elektronów
w procesie redukcji drugiego [8]. Przyk³ad ten ilustruje ogromn¹ plastycznoæ
biochemiczn¹ drobnoustrojów w procesach wykorzystania zanieczyszczeñ jako
ród³a wêgla i energii.
Sprawny proces rozk³adu zanieczyszczeñ organicznych zachodzi tylko
w przypadku, gdy istniej¹ sprzyjaj¹ce warunki rodowiskowe (odpowiednia
wilgotnoæ, temperatura, pH, obecnoæ dodatkowych substancji troficznych,
obecnoæ tlenu w przemianach aerobowych lub odpowiednich donorów
i akceptorów elektronów w warunkach beztlenowych). Proces biodegradacji
czêsto koñczy siê niepowodzeniem, w przypadku gdy stê¿enie odpadów
organicznych jest zbyt du¿e i powoduje toksyfikacjê mikroorganizmów, lub te¿
w przypadku braku odpowiedniego aparatu enzymatycznego, rozk³adaj¹cego
przejciowe produkty (intermediaty) degradacji. Bardzo czêsto produkty
pierwszych etapów biodegradacji wykazuj¹ o wiele silniejszy efekt toksycznoci
ni¿ zanieczyszczenie wyjciowe [9]. Stwarza to koniecznoæ monitoringu i kontroli
biologicznej dekompozycji zanieczyszczeñ, z mo¿liwoci¹ mikrobiologicznej
i biochemicznej interwencji, w celu wprowadzenia dodatkowych szczepów
mikroorganizmów o po¿¹danej aktywnoci biologicznej.
Powy¿sze fakty dowodz¹, ¿e biologiczny rozk³ad substancji organicznych
jest procesem skomplikowanym i wieloetapowym. W zanieczyszczonej glebie
rozk³ad mo¿e zachodziæ w warunkach tlenowych, jak równie¿ beztlenowych,
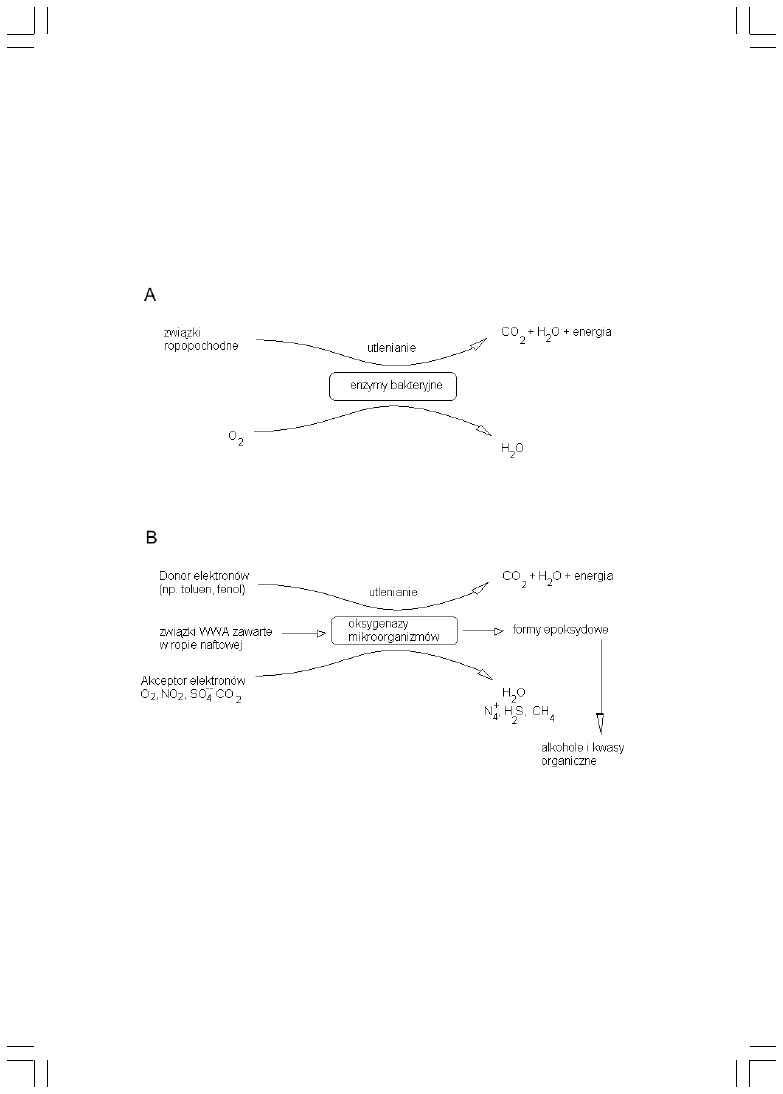
pod warunkiem obecnoci akceptorów i donorów elektronów (rys.1 A i B).
Drogi i strategia biochemicznej transformacji zwi¹zków ropopochodnych
zale¿¹ od charakteru chemicznego rozk³adanego ksenobiotyku, od dostêpnoci
akceptora elektronów i oczywicie od szczepów drobnoustrojów bior¹cych
udzia³ w remediacji [10, 11]. W warunkach tlenowych, gdy akceptorem
elektronów jest tlen, stosunkowo szybkiej degradacji podlegaj¹ zawarte w ropie
naftowej n-alkany. Produktami przemian s¹ alkohole i kwasy t³uszczowe, w³¹czane
nastêpnie w szlaki metaboliczne mikroorganizmów (np. cykl Krebsa,
(ß-oksydacja), a koñcowym produktem jest dwutlenek wêgla i woda [9, 18].
W warunkach utrudnionego dostêpu tlenu efektywnoæ procesu biodegradacji
zale¿y od mo¿liwoci wykorzystania innych akceptorów elektronów. Energiê
uzyskan¹ przez mikroorganizmy utleniaj¹ce zwi¹zki organiczne, w zale¿noci od
dostêpnego akceptora elektronów, przedstawia schemat na rys.2. Najwiêkszy
zysk energetyczny mikroorganizmy uzyskuj¹ w wyniku utleniania substancji
32
organicznej, gdy akceptorem jest tlen (ok. 120 kJ mol
-1
elektronów), a najni¿szy
w warunkach beztlenowych, gdy akceptorem jest dwutlenek wêgla [11].
Rys.1. Schemat biodegradacji olejowych zanieczyszczeñ w warunkach tlenowych (A) i
beztlenowych (B).
Ze schematu p³ynie wniosek, ¿e brak tlenu powoduje, i¿ proces degradacji
podejmuj¹ bakterie beztlenowe korzystaj¹ce z dostêpnego akceptora elektronów
daj¹cego najwy¿szy zysk energetyczny, a po jego wyczerpaniu nastêpna grupa
mikroorganizmów prowadzi degradacjê z udzia³em kolejnego dostêpnego
akceptora [10, 11, 12].

33
Rys. 2. Energia dostêpna dla mikroorganizmów wykorzystuj¹cych ró¿ne akceptory elektronów
w procesie degradacji zwi¹zków organicznych.
Porównanie efektywnoci i czasu rozk³adu zwi¹zków ropopochodnych
w gruncie, w warunkach tlenowych i beztlenowych przedstawia tabela 1, z której
wynika, ¿e obecnoæ tlenu skraca czas oczyszczania zaolejonego gruntu.
W przypadku obecnych w zanieczyszczeniach rafineryjnych
wielopiercieniowych wêglowodorów aromatycznych (WWA), proces
bioremediacji jest wieloetapowy i zachodzi na drodze tzw. ko-metabolizmu
realizowanego przez konsorcja mikroorganizmów. Przyk³adem mo¿e byæ proces
degradacji chlorowcopochodnych jedno- i wielopiercieniowych zwi¹zków
aromatycznych (rys. 3.) [9, 10, 14, 15, 16].
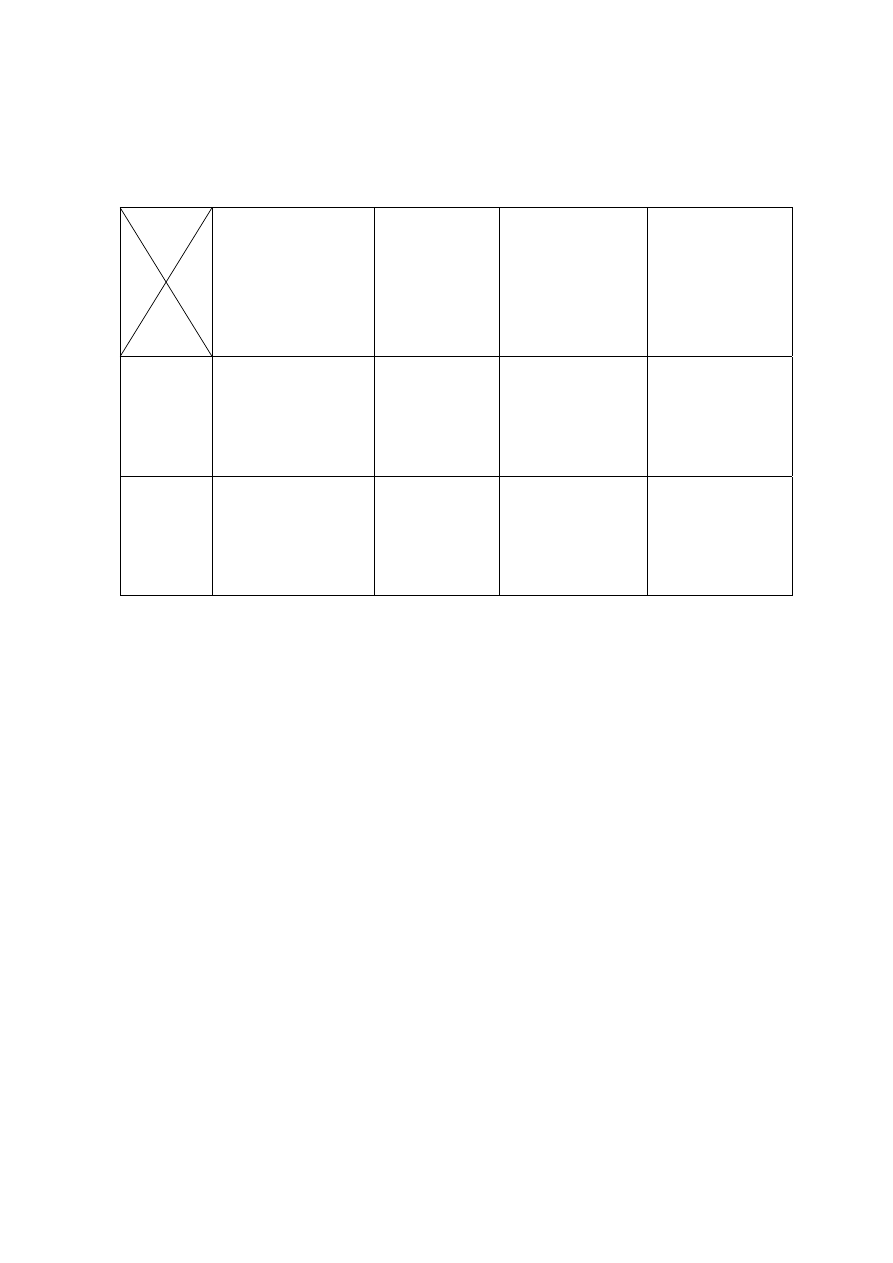
Tab.1. Porównanie efektywności bioremediacji gruntu zanieczyszczonego olejem
mineralnym, mierzonej w warunkach laboratoryjnych w obecności i nieobecności
tlenu (kompilacja wyników pracy Salminena i wsp. (2004), [13])
Początkowe stężenie
oleju mineralnego
[mg kg
-1
s.m.]
Czas trwania
procesu
[w miesiącach]
% usunięcia oleju
mineralnego po
zakończeniu
inkubacji
Czas potrzebny
do usunięcia 1000
mg kg
-1
s.m. oleju
mineralnego
[w miesiącach]
Warunki
beztlenowe
2400
5000
16400
12
12
12
42
64
34
11.9
3.75
2.15
Warunki
tlenowe
1300
5100
14900
3
3
3
58
22
31
3.9
2.1
0.6
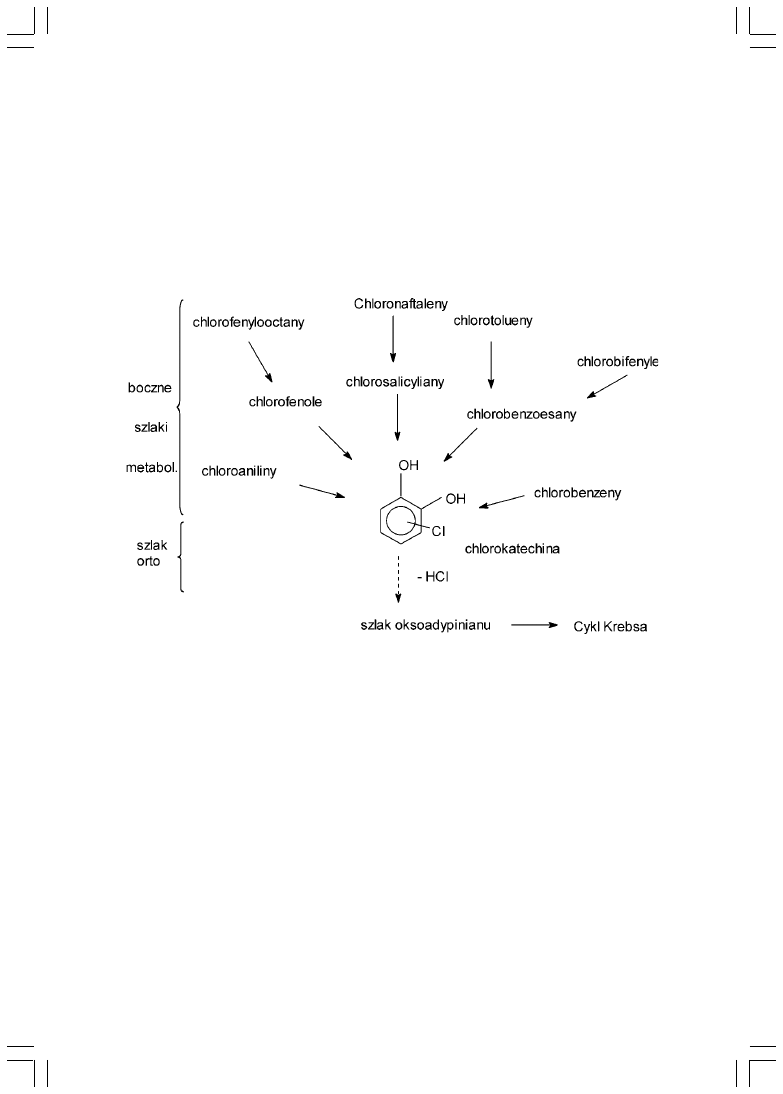
34
Rys.3. Uproszczony schemat biochemicznych szlaków degradacji chlorowcopochodnych
zwi¹zków aromatycznych.
W procesie takiej degradacji uczestniczy wiele mikroorganizmów, najczêciej
z rodzaju Pseudomonas, Sphingomonas, Acinetobacter, Flavobacterium,
Mycobacterium, Rhodococcus i wiele innych [17, 18].

35
W pierwszej fazie przemian metabolicznych pochodnych WWA nastêpuje
przekszta³cenie podstawników, ³añcuchów bocznych lub ca³ych piercieni
aromatycznych do pochodnych chlorokatechiny. W drugiej fazie, zwanej
zmodyfikowanym szlakiem orto, nastêpuje sekwencja skomplikowanych reakcji
biochemicznych prowadz¹cych do degradacji pochodnych chlorokatechiny [17].
Dla przyk³adu, w fazie I zwi¹zki mono- i bi-aromatyczne pozbawione grup
hydroksylowych s¹ aktywowane przez wielopodjednostkowe dioksygenazy, np.
dioksygenazê benzenow¹ czy 2,3-dioksygenazê bifenylow¹ w obecnoci tlenu
cz¹steczkowego. Powsta³e pochodne cis-hydrodiolowe podlegaj¹ dzia³aniu
dehydrogenazy i zostaj¹ przekszta³cone do pochodnych 1,2-difenolowych, które
s¹ substratem w kolejnej reakcji enzymatycznego rozszczepiania, prowadz¹cej
do rozbicia piercienia aromatycznego. Reakcje te wymagaj¹ obecnoci tlenu.
Nale¿y podkreliæ, ¿e biodegradacja niektórych grup WWA wykazuje pewn¹
specyfikê biochemiczn¹, np. w przypadku pochodnych aniliny powstawanie
difenolu zachodzi w reakcji dioksygenazy aniliny z jednoczesnym uwolnieniem
amoniaku [17, 19].
Faza I prowadzi do powstania katechiny i jej analogów, które stanowi¹ substrat
w II fazie przemian. W fazie tej pochodne katechiny s¹ degradowane przez
szereg enzymów (dioksygenazy, cykloizomerazy, hydrolazy i reduktazy)
w sekwencyjnych reakcjach biochemicznych, prowadz¹cych do powstania
intermediatów w³¹czanych do cyklu Krebsa, glukoneogenezy czy (ß-oksydacji
[9, 18]. Obszerny przegl¹d poznanych dot¹d mechanizmów enzymatycznej
degradacji WWA i ich chlorowcopochodnych jest opisany w kilku publikacjach
wraz z subtelnymi osobliwociami, wynikaj¹cymi z heterogenicznoci tej klasy
zwi¹zków [9, 16, 18].
Warto zaznaczyæ, ¿e zupe³nie nie jest znana rola szeregu enzymów
uczestnicz¹cych w dekompozycji WWA, takich jak np. transferazy bursztynylo-
CoA, tiolazy 3-oksoadypilo-CoA i innych, w koñcowych etapach szlaku
degradacji.
Enzymy mikroorganizmów uczestnicz¹ce w przemianach fazy I i II
charakteryzuj¹ siê ró¿n¹ specyficznoci¹ i nie wszystkie, konieczne do pe³nej
degradacji ksenobiotyków, s¹ obecne w jednym szczepie. Przyk³adem jest analiza
aktywnoci dioksygenazy chlorobenzoesanu wystêpuj¹cej w Ralstonia eutropha
szczepie degraduj¹cym benzoesan, oraz Pseudomonas sp. B13 degraduj¹cym
3-chlorobenzoesan (3-CB). Szczepy te posiadaj¹ podobn¹ aktywnoæ 1,2
dioksygenazy o du¿ej specyficznoci [19] w stosunku do 3-CB, ale nie s¹, lub
s¹ degradowane z niewielk¹ szybkoci¹, inne pochodne tego kwasu. Z kolei
enzym 1,2 dioksygenaza metylobenzoesowa, obecny w Pseudomonas putida
PaW1, degraduje wszystkie pochodne benzoesanu, ze szczególn¹ preferencj¹

36
4-CB, natomiast degradacji nie podlega analog 2-CB. Odpowiedni enzym
rozk³adaj¹cy ten analog obecny jest w Burkholderia cepacia. Wykorzystuj¹c
w³aciwoci biochemiczne tych szczepów mo¿na skonstruowaæ konsorcjum
efektywnie degraduj¹ce wszystkie pochodne benzoesanu.
Oprócz specyficznoci katalizy enzymatycznej pojawia siê nastêpny prob-
lem. Zwi¹zki WWA s¹ w ograniczonym stopniu dostêpne dla mikroorganizmów
ze wzglêdu na ich hydrofobowy charakter. Bioremediacja tych zwi¹zków
nastêpuje na granicy faz utworzonej przez emulgatory produkowane przez
bakterie i wodê. Efektywnym mikroorganizmem produkuj¹cym polisacharydy
egzogenne jest Halomonas eurihalina [20, 21]. Obecnoæ bakterii
produkuj¹cych bioemulgatory w sposób znacz¹cy wp³ywa na szybkoæ
biodegradacji omawianych zwi¹zków. Istnieje jednak niebezpieczeñstwo zwi¹zane
z nadmiarem substancji emulguj¹cych, czy to produkowanych przez konsorcjum,
czy to dodawanych do mediów podlegaj¹cych dekontaminacji, np.
degradowalnych detergentów. Dodawanie detergentów syntetycznych lub
naturalnych niesie niebezpieczeñstwo powstania toksycznych intermediatów,
zanieczyszczaj¹cych wody gruntowe i glebê w jeszcze wiêkszym stopniu ni¿
substancje pierwotne [21]. Z kolei dodanie surfaktantów pochodzenia rolinnego
(saponiny lecytyny) mo¿e spowodowaæ solubilizacjê WWA i pochodnych
w nadmiernym stopniu, tak ¿e bakterie prowadz¹ce proces oczyszczania ulegn¹
toksyfikacji [20]. Dlatego zewnêtrzne dodawanie substancji wp³ywaj¹cych na
solubilizacjê hydrofobowych zanieczyszczeñ musi podlegaæ kontroli.
Kolejnym zagadnieniem w procesie biodegradacji zwi¹zków ropopochodnych
jest problem zwi¹zany z dostêpnoci¹ efektywnego akceptora elektronów.
Procesy utleniania WWA i pochodnych przebiegaj¹ najczêciej w warunkach
aerobowych, gdzie akceptorem elektronów jest tlen. Jednak czasami dostêpnoæ
tlenu do wód gruntowych czy g³êbszych warstw gleby jest utrudniona. Dlatego
wykorzystanie innych akceptorów elektronów, takich jak azotany, siarczany czy
Fe
3+
staje siê konieczne w warunkach rodowiskowych [22]. Analiza konsumpcji
akceptorów elektronów wykaza³a, ¿e biodegradacja toluenu i naftalenu by³a
faworyzowana w obecnoci od 1.5 do 2.0 mg tlenu/l, oraz ¿e tlen i azotan by³y
wykorzystywane jako akceptory elektronów w taki sposób, i¿ spadek stê¿enia
tlenu powodowa³ wiêksze wykorzystanie azotanu w badanym przedziale stê¿eñ
tlenu. Jednoczenie dowiadczalnie wykazano, ¿e w przypadku mniejszych stê¿eñ
tlenu (0.5 do 1.0 mg O
2
/l), biodegradacja toluenu i etylobenzenu przebiega³a
efektywniej. Nie s¹ znane mechanizmy tych reakcji przy ró¿nych stê¿eniach tlenu,
a tylko sugeruje siê ich odrêbnoæ [14]. W³aciwoæ ta mo¿ne zostaæ
wykorzystana w warunkach rodowiskowych w przypadku degradacji
zanieczyszczonych gleb i wód zwi¹zkami BTEX (benzen, toluen, etylobenzen,
ksylen).

37
Wyniki prezentowanych powy¿ej prac [11, 12, 14, 23] otwieraj¹ ogromne
mo¿liwoci w procesie sterowania bioremediacj¹ w zale¿noci od stopnia ska¿enia
medium toluenem i naftalenem, jak równie¿ toluenem i etylobenzenem. Bardzo
czêsto stwierdza siê obecnoæ tych zwi¹zków w ska¿onych gruntach, dlatego
znajomoæ kinetyki degradacji i jej zale¿noci od warunków tlenowych oraz
dostêpnoci innych akceptorów elektronów mo¿e byæ wykorzystana
w optymalizacji procesu oczyszczania.
Dzia³anie enzymów rozk³adaj¹cych WWA oraz regulacja ich ekspresji zosta³y
najlepiej poznane w przypadku szczepów Pseudomonas i Sphingomonas [24,
25]. Inne szczepy z rodzaju Mycobacterium, Rhodococcus, Nocardioides,
równie¿ posiadaj¹ce enzymy katabolizuj¹ce WWA, s¹ poznane w niewielkim
stopniu pod k¹tem ich aktywnoci enzymatycznej [26]. W procesach
oczyszczania gruntów i wód najbardziej po¿¹dane s¹ aktywnoci mono-
i dioksygenaz enzymów rozbijaj¹cych piercienie aromatyczne. Bia³ka te s¹
najczêciej kodowane w sekwencjach plazmidowego DNA. Oko³o 70% znanych
szczepów degraduj¹cych WWA i ich pochodne to szczepy Pseudomonas,
w tym oko³o 50% to izolanty P. putida. W literaturze opisano plazmidy koduj¹ce
enzymy I i II fazy oraz ich w³aciwoci i drogi genetycznego transferu [27, 28].
W niektórych przypadkach interesuj¹ce sekwencje genetyczne zlokalizowane
s¹ w chromosomie bakteryjnym. Przyk³adem s¹ geny koduj¹ce bia³ka
odpowiedzialne za degradacjê toluenu/benzenu w szczepie P. putida F1, czy
geny koduj¹ce degradacjê bifenyli w przypadku szczepu P. pseudoalcaligenes
KF707 [28]. Istnieje zatem mo¿liwoæ transferu po¿¹danej aktywnoci
katabolicznej do szczepu, który wykazuje upoledzon¹ aktywnoæ intermediatu
stanowi¹cego tzw. w¹skie gard³o szlaku (bottle-neck). Wiadomo równie¿, ¿e
ekspresja klasteru genów zwi¹zanych z degradacj¹ bifenyli nastêpuje w postaci
jednego transkryptu [28]. Oznacza to, ¿e kilka enzymów i ich podjednostek jest
kodowanych w jednej cz¹steczce mRNA, w której mo¿na stosunkowo ³atwo
oznaczyæ i zidentyfikowaæ sekwencje nukleotydowe kilku wa¿nych oksygenaz.
Stwarza to pewn¹ ³atwoæ identyfikacji szczepów bakteryjnych o najwiêkszej
aktywnoci degradacji WWA i ewentualnej konstrukcji (doboru) kilku lub
kilkunastu szczepów, szybko i efektywnie rozk³adaj¹cych uci¹¿liwe
zanieczyszczenia rodowiskowe. Nale¿y zaznaczyæ, ¿e zdolnoæ katabolizmu
wêglowodorów aromatycznych posiadaj¹ równie¿ dro¿d¿e z rodzaju Candida,
Cryptococcus, Pichia, Rhodotorula czy Yarrowia [4, 29].
W kolekcji drobnoustrojów pro- i eukariotycznych Zak³adu Biochemii AR
w Krakowie zgromadzono dotychczas wiele szczepów bakteryjnych
i dro¿d¿owych, które s¹ wykorzystywane do konstrukcji mieszanych biocenoz,
rozk³adaj¹cych uci¹¿liwe zanieczyszczenia ropopochodne w gruncie. Miêdzy

38
innymi zastosowano rodowiskowe izolanty dro¿d¿owe do biodegradacji ska¿eñ
wystêpuj¹cych w zaolejonej ziemi, zawieraj¹cej WWA [30]. Bank
mikroorganizmów Zak³adu Biochemii zosta³ utworzony ze szczepów
wyizolowanych z wielu ró¿nych róde³ zanieczyszczonych wód i gleb,
wystêpuj¹cych na terenie ca³ej Polski. Bank ten jest obecnie podstaw¹ do
dalszych badañ zwi¹zanych z opracowaniem sk³adu specyficznych biocenoz,
przeznaczonych do degradacji uci¹¿liwych ksenobiotyków, ze szczególnym
uwzglêdnieniem zwi¹zków z grupy WWA oraz ich chlorowcopochodnych (jak
np. polichlorowane bifenyle, PCB) [30, 31], nale¿¹cych do zwi¹zków najtrudniej
podlegaj¹cych bioremediacji, o najwiêkszej geno- i cytotoksycznoci dla
organizmów ¿ywych. Konstruowane konsorcja drobnoustrojów wykazuj¹
równie¿ wysok¹ efektywnoæ pod wzglêdem biodegradacji szeregu innych
toksycznych substancji, takich jak: detergentów, metanolu, formaldehydu i jego
po³¹czeñ chemicznych, ¿ywic, klejów oraz wielu innych.
Z powodzeniem powy¿sze techniki konstrukcji konsorcjów mikroorganizmów
wykorzystano do oczyszczania gleby w wielu rodowiskowych projektach
rekultywacji. Prace te opisano w nastêpnym artykule.
Pimiennictwo
[1] Siuta J., 1997. Podstawy biodegradacji ropopochodnych sk³adników
w glebach i w odpadach. Technologie odolejania gruntów, odpadów,
cieków. Wyd. Ekoin¿ynieria, 119-130.
[2] £ebkowska M., Muszyñski A., Sztompka E., Karwowska E., Miakiewicz
E., 1997. Mikrobiologiczne oczyszczanie gruntów ze sk³adników
ropopochodnych. Technologie odolejania gruntów, odpadów, cieków.
Wyd. Ekoin¿ynieria, 115-118.
[3] Siuta J., £¹cka-Pilaszek B., Królikowski K., Turowski P., 1997. Wapnohum
produktem utylizacji osadów Petrochemii P³ock S.A. Technologie odolejania
gruntów, odpadów, cieków. Wyd. Ekoin¿ynieria, 150-161.
[4] Kaszycki P., Solecki T., Krawczyk A., Ko³oczek H., 2000. Optymalizacja metod
biologicznego oczyszczania zaolejonych gruntów. In¿ynieria Ekologiczna, 2: 40-47.
[5] Leahy J.G., Colwell R.R., 1990. Microbial Degradation of hydrocarbons in
the environment. Microbiol. Rev., 54: 305-315.
[6] Hamme van J.D., Singh A., Ward O.P., 2003. Recent advances in petroleum
microbiology. Microbiol. Mol. Biol. Rev., 67: 503-549.
[7] Bregnard T.P., Hohener P., Haner A., Zeyer J., 1996. Degradation of weath-
ered diesel fuel by microorganisms from a contaminated aquifer in aerobic
and anaerobic microcosms. Environ. Toxicol. Chem., 15: 299-307.

39
[8] Cooney J.J., Silver S.A., Beck E.A., 1985. Factors influencing hydrocarbon
degradation in three freshwater lakes. Microbial Ecol., 11: 127-137.
[9] Reineke W., 1998. Development of hybrid strains for the mineralization of
chloroaromatics by patchwork assembly. Annu. Rev. Microbiol., 52: 287-331.
[10] Bayly R.C., Wigmore G.J., 1973. Metabolism of phenol and cresols by
mutants of Pseudomonas putida. J. Bacteriol., 113: 1112-20.
[11] Ottow J.C.G., Fabig W., 1985. Influence of oxygen aeration on denitrifica-
tion and redox level in different batch cultures. W: Caldwell D.E., Brierly
J.A., eds. Planetary Ecology, New York, Van Nostrad Reinhold, pp. 427-40.
[12] Phelps C.D., Young L.Y., 2001. Biodegradation of BTEX under anaerobic
conditions: a review. Adv. Agron., 70: 329-357.
[13] Salminen J.M., Tuomi P.M., Suortti A-M., Jorgensen K.S., 2004. Potential
for aerobic and anaerobic biodegradation of petroleum hydrocarbons in bo-
real subsurface. Biodegradation, 15: 29-39.
[14] Kuhn E.P., Zeyer J., Eichner P., Schwarzenbach R.P., 1988. Anaerobic
degradation of alkylated benzenesin denitrificating laboratory columns. Appl.
Environ Microbiol., 54: 490-496.
[15] Wittich R.M., Wilkes H., Sinnwell V., Francke W., Fortnagel P., 1991.
Metabolism of dibenzo-p-dioxin by Sphingomonas sp., strain RW1. Appl.
Environ. Microbiol., 58: 1005-10.
[16] Worssey M.J., Williams P.A., 1975. Metabolism of toluene and xylenes by
Pseudomonas putida (arvilla) mt-2: evidence for a new function of the TOL
plasmid. J. Bacteriol., 124: 7-13.
[17] Bachofer R., Lingens F., 1975. Conversion of aniline into pyrocatechol by
a Nocardia sp., incorporation of oxygen 18. FEBS Lett., 50: 288-90.
[18] Gibson J., Harwood C.S., 2002. Metabolism diversity in aromatic
compound utilization by anaerobic microbes. Annu. Rev. Microbiol., 56: 345-69.
[19] Engelberts K., Schmidt E., Reineke W., 1989. Degradation of o-toluate by
Pseudomonas sp., strain WR401. FEMS Microbiol. Lett., 59: 35-38.
[20] Vinas M., Grifoll M., Sabate J., Solanas A.M., 2002. Biodegradation of
a crude oil by three microbial consortia of different origins and metabolic
capabilities. J. Indust. Microbiol. Biotechnol., 28: 252-60.
[21] Calvo C., Martinez-Checa F., Toledo F.L., Porcel J., 2002. Characteris-
tics of bioemulsifiers synthesized in crude oil media by Halomonas eurihalina
and their effectiveness in the isolation of bacteria able to grow in the presence
of hydrocarbons. Appl. Microbiol. Biotechnol., 60: 347-351.
[22] Deziel E., Paquette G., Villemur R., Lepine F., Bisaillon J.G., 1996.
Biosurfactant production by a soil Pseudomonas strain growing on polycy-
clic aromatic hydrocarbons. Appl. Environ. Microbiol., 62: 1908-12.

40
[23] Su J., Kafkewitz D., 1994. Utilization of toluen and xylenes by a nitrate
reducing strain of Pseudomonas maltophilia under low oxygen and anoxic
conditions. FEMS Microbiol. Ecol., 15: 249-58.
[24] Meyer S., Moser R., Neff A., Stahl U., Kampfer P., 1999. Differential
detection of key enzymes of polyaromatic hydrocarbon- degrading bacte-
ria using PCR and gene probes. Microbiology, 145: 1731-41.
[25] Resnick S. M., Lee K., Gibson D.T., 1996. Diverse reactions catalyzed by
naphthalene dioxygenase from Pseudomonas sp. Strain NCIB 9816. J. Ind.
Microbiol., 17: 438-57.
[26] Khan A.A., Wang R-F., Cao W-W., Doerge D., Wennerstorm D., Cerniglia
C.E., 2001. Molecular cloning, nucleotide sequence and expression of genes
encoding a polycyclic aromatic ring dioxygenase from Mycobacterium sp.
Strain PYR-1. Appl. Environ. Microbiol., 67: 3577-85.
[27] Springael D., Van Thor J., Goorissen H., Ryngaert A., de Baere R., 1996.
RP4:Mu3A mediated in vivo cloning and transfer of a chlorobiphenyl cata-
bolic pathway. Microbiology, 142: 3283-93.
[28] Taira K., Hirose J., Hayashida S., Furukawa K., 1992. Analysis of bph
operon from the polychlorinated biphenyl-degrading strain of Pseudomonas
pseudoalcalgenes KF707. J. Biol. Chem., 267: 4844-53.
[29] Romero M.C., Hammer E., Cazau M.C., Arambarri A., 2001. Selection of
autochthonous yeast strain able to degrade biphenyl. W. J. Microbiol.
Biotechnol. ,17: 591-594.
[30] Koloczek H., Czechowska K., Petryszak P., Kaszycki P., 2004. Biode-
gradation of oil derivatives with methylotrophic yeast isolates. Possible enzy-
matic links between the methylotrophic and hydrocarbon-degrading path-
ways. Bioremediation of soils contaminated with aromatic compounds: Ef-
fects of rhizosphere, bioavailability, gene regulation and stress adaptation.
NATO Advanced Research Workshop, 1-3 July 2004, Tartu, Estonia.
[31] Ko³oczek H., Kaszycki P., Jaglarz A., Solecki T., 2003. Opracowanie
procesu biodegradacji zanieczyszczeñ organicznych zawieraj¹cych
polichlorowane bifenyle (PCB) w warunkach zagro¿enia wód. Technologie
odolejania gruntów, odpadów, cieków. In¿ynieria Ekologiczna., 8: 59-70.
dr hab. Henryk Ko³oczek prof. AR
dr Pawe³ Kaszycki
Zak³ad Biochemii
Wydzia³ Ogrodniczy AR w Krakowie
Al. 29 Listopada 54, 31-425 Kraków
e-mail: koloczek@ogr.ar.krakow.pl
Wyszukiwarka
Podobne podstrony:
przebieg, PSYCHOLOGIA, I ROK, semestr II, biologiczne mechanizmy zachowania II.mózgowe mechanizmy fu
2 - mechaniczne oczyszczanie, IŚ Tokarzewski 27.06.2016, V semestr ISiW, Technologie oczyszczania śc
BIOLOGICZNE MECHANIZMY ZACHOWANIA I
Biologia ściągi, ściąga bio, Biologiczne metody oczyszczania ścieków:
Biologiczne metody oczyszczania gleby
Psychologia ogólna - Biologiczne Mechanizmy Człowieka - Móżg, Mózg (mózgowie) - największe skupienie
14 Behe, Biologiczne mechanizmy molekularne Eksperymentalne poparcie dla wniosku o projekcie
Biologiczne mechanizmy zachowania
Pytania na egzamin z BMZ, Studia UG, Psychologia, Semestr 1, Biologiczne mechanizmy zachowania się l
Biologiczny Mechanizm na stres
,pytania na obronę inż,MECHANICZNE OCZYSZCZANIE ŚCIEKÓW
Biologiczne mechanizmy zachowania - notatki na kolokwium 16.04.2010, KN, rok I, Biologiczne mechaniz
Rozdziały z podręcznika obowiązujące do egzaminu, psychologia, biologiczne mechanizmy zachowania II.
BIOLOGICZNE MECHANIZMY ZACHOWANIA I, Psychologia materiały do obrony UJ
Prezentacja - Metody mechaniczne oczyszczania ścieków, sanbud, budownictwo,inżynieria i ochrona śro
więcej podobnych podstron