
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
MINISTERSTWO EDUKACJI
NARODOWEJ
Kazimierz Olszewski
Wytwarzanie podstawowych półproduktów i produktów
nieorganicznych 815[01].Z2.02
Poradnik dla nauczyciela
Wydawca
Instytut Technologii Eksploatacji
–
Państwowy Instytut Badawczy
Radom 2007

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
1
Recenzenci:
dr inż. Paweł Religa
mgr Zbigniew Piotr Rawluk
Opracowanie redakcyjne:
mgr inż. Kazimierz Olszewski
Konsultacja:
mgr inż. Halina Bielecka
Poradnik stanowi obudowę dydaktyczną programu jednostki modułowej 815[01].Z2.02
„Wytwarzanie podstawowych półproduktów i produktów nieorganicznych”, zawartego
w modułowym programie nauczania dla zawodu operator urządzeń przemysłu chemicznego.
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy, Radom 2007

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
2
SPIS TREŚCI
1.
Wprowadzenie
3
2.
Wymagania wstępne
5
3.
Cele kształcenia
6
4.
Przykładowe scenariusze zajęć
7
5.
Ćwiczenia
11
5.1.
Technologia wody
11
5.1.1.
Ć
wiczenia
11
5.2.
Produkcja kwasu siarkowego(VI)
15
5.2.1.
Ć
wiczenia
15
5.3.
Technologia związków azotu
17
5.3.1.
Ć
wiczenia
17
5.4.
Technologia związków fosforu
20
5.4.1.
Ć
wiczenia
20
5.5.
Procesy elektrochemiczne
23
5.5.1.
Ć
wiczenia
23
6.
Ewaluacja osiągnięć ucznia
25
7.
Literatura
39

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
3
1. WPROWADZENIE
Przekazujemy Państwu Poradnik dla nauczyciela, który będzie pomocny w prowadzeniu
zajęć dydaktycznych w szkole kształcącej w zawodzie operator urządzeń przemysłu
chemicznego w jednostce modułowej „Wytwarzanie podstawowych półproduktów
i produktów nieorganicznych”.
W poradniku zamieszczono:
−
wymagania wstępne,
−
wykaz umiejętności, jakie uczeń opanuje podczas zajęć,
−
przykładowe scenariusze zajęć,
−
propozycje ćwiczeń, które mają na celu ukształtowanie umiejętności praktycznych
uczniów,
−
wykaz literatury, z jakiej uczniowie mogą korzystać podczas nauki.
Wskazane jest, aby zajęcia dydaktyczne były prowadzone różnymi metodami ze
szczególnym uwzględnieniem:
−
tekstu przewodniego,
−
metody projektów,
−
ć
wiczeń praktycznych.
Z powodu obszernego materiału nauczania objętego programem jednostki modułowej
815[01].Z2.02 w poradnikach zawarto tylko wybrane ćwiczenia zawarte w programie
jednostki jako najbardziej reprezentatywne dla specyfiki nauczania przedstawionych
w Materiale nauczania jednostki zagadnień.
Formy organizacyjne pracy uczniów mogą być zróżnicowane, począwszy od
samodzielnej pracy uczniów do pracy zespołowej.
W celu przeprowadzenia sprawdzianu wiadomości i umiejętności ucznia, nauczyciel
może posłużyć się zamieszczonym w rozdziale 6 zestawem zadań testowych i sprawdzianem
praktycznym. W rozdziale 6 podano również:
−
plan testu,
−
punktację zadań,
−
propozycje norm wymagań,
−
instrukcję dla nauczyciela,
−
instrukcję dla ucznia,
−
kartę odpowiedzi,
−
zestaw zadań testowych.
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
4
Schemat układu jednostek modułowych
815[01].Z2
Technologie wytwarzania półproduktów
i produktów przemysłu chemicznego
815[01].Z2.02
Wytwarzanie podstawowych
półproduktów i produktów
nieorganicznych
815[01].Z2.03
Wytwarzanie podstawowych
półproduktów i produktów
organicznych
815[01].Z2.01
Stosowanie zasad prowadzenia
procesów produkcyjnych

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
5
2. WYMAGANIA WSTĘPNE
Przystępując do realizacji programu jednostki modułowej uczeń powinien umieć:
–
korzystać z różnych źródeł informacji,
–
wykonywać podstawowe czynności laboratoryjne,
–
posługiwać się podstawowy pojęciami i wzorami z zakresu chemii nieorganicznej,
–
wykonywać podstawowe obliczenia chemiczne,
–
rozróżniać symbole graficzne aparatów, maszyn i urządzeń przemysłu chemicznego,
–
charakteryzować wymagania dotyczące bezpieczeństwa pracy przy obsłudze aparatów,
maszyn i urządzeń przemysłu chemicznego,
–
charakteryzować budowę i zasadę działania podstawowych aparatów maszyn i urządzeń
przemysłu chemicznego,
–
posługiwać się podstawowymi pojęciami technologicznymi,
–
rozróżniać zastosowane zasady technologiczne,
–
posługiwać się normami, ustawami, rozporządzeniami,
–
obsługiwać komputer,
–
współpracować w grupie.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
6
3. CELE KSZTAŁCENIA
W wyniku realizacji jednostki modułowej, uczeń powinien umieć:
−
scharakteryzować podstawowe wymagania jakości wody (zasilającej kotły, używanej do
celów chłodniczych, technologicznej) stosowanej w typowych procesach produkcji
chemicznej,
–
określić skład ścieków pochodzących z typowych procesów produkcji chemicznej,
–
rozróżnić metody oczyszczania ścieków przemysłu chemicznego,
–
scharakteryzować zanieczyszczenia wód, metody ich oczyszczania i uzdatniania,
–
wskazać najważniejsze surowce, z których wytwarza się półprodukty i produkty
nieorganiczne,
–
określić metody wydobycia i oczyszczania surowców przemysłu nieorganicznego,
–
określić wpływ zmiany parametrów procesowych na przebieg procesów wytwarzania
produktów
przemysłu
siarkowego,
azotowego,
fosforowego,
sodowego
oraz
elektrochemicznego i nawozów sztucznych,
–
rozróżnić symbole aparatury, punktów pomiaru parametrów, urządzeń regulacji i
sterowania stosowanych w procesach wytwarzania półproduktów i produktów
nieorganicznych,
–
scharakteryzować budowę i zasady działania aparatów i urządzeń stosowanych w
procesie wytwarzania podstawowych produktów przemysłu nieorganicznego,
–
posłużyć się uproszczonymi schematami technologicznymi procesów wytwarzania
produktów
przemysłu
siarkowego,
azotowego,
fosforowego,
sodowego
oraz
elektrochemicznego i nawozów sztucznych,
–
wskazać wpływ instalacji wytwarzania produktów nieorganicznych na stan środowiska
naturalnego,
–
ocenić stopień zagrożenia środowiska pracy podczas eksploatacji aparatów i urządzeń
stosowanych w procesach wytwarzania produktów przemysłu siarkowego, azotowego,
fosforowego, sodowego oraz elektrochemicznego i nawozów sztucznych,
–
ocenić toksyczność substancji stosowanych w procesach wytwarzania produktów
nieorganicznych na podstawie analizy karty charakterystyki substancji niebezpiecznych,
–
scharakteryzować skład i warunki pracy katalizatorów stosowanych w procesach
wytwarzania produktów nieorganicznych,
–
wyjaśnić, w oparciu o schemat ideowy, chemiczną koncepcję procesu wytwarzania
produktu nieorganicznego,
–
sporządzić schematy ideowe procesów wytwarzania produktów przemysłu siarkowego,
azotowego, fosforowego, sodowego oraz elektrochemicznego i nawozów sztucznych,
–
wskazać stosowanie zasad technologicznych w procesach wytwarzania produktów
nieorganicznych,
–
wyjaśnić istotę, przebieg oraz wskaźniki przebiegu procesów elektrochemicznych,
–
zapisać i zinterpretować reakcje elektrodowe zachodzące w procesach elektrolizy,
–
wskazać najważniejsze powiązania nieorganicznych procesów technologicznych z
procesami przemysłu syntez organicznych,
–
zastosować zasady bezpieczeństwa i higieny pracy, ochrony przeciwpożarowej i ochrony
ś
rodowiska obowiązujące na stanowiskach pracy.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
7
4. PRZYKŁADOWE SCENARIUSZE ZAJĘĆ
Scenariusz zajęć 1
Osoba prowadząca
……………………………………….……………………
Modułowy program nauczania:
Operator urządzeń przemysłu chemicznego 815[01]
Moduł:
Technologie wytwarzania podstawowych półproduktów
i produktów przemysłu chemicznego 815[01].Z2
Jednostka modułowa:
Wytwarzanie podstawowych półproduktów i produktów
nieorganicznych 815[01].Z2.02
Temat: Wpływ produkcji kwasu siarkowego na środowisko naturalne.
Cel ogólny: Kształtowanie umiejętności określania wpływu instalacji produkcyjnej na
ś
rodowisko naturalne.
Po zakończeniu zajęć edukacyjnych uczeń potrafi:
−
oceniać toksyczność substancji stosowanych w procesie produkcji kwasu siarkowego,
−
korzystać z kart charakterystyki substancji niebezpiecznych,
−
wskazać wpływ instalacji produkcji kwasu siarkowego na stan środowiska naturalnego.
Metody nauczania–uczenia się:
−
ć
wiczenia praktyczne.
Formy organizacyjne pracy uczniów:
−
grupowa jednolita.
Czas trwania zajęć: 1 godzina dydaktyczna.
Środki dydaktyczne:
−
karty charakterystyki substancji niebezpiecznych,
−
uproszczony schemat technologiczny produkcji kwasu siarkowego,
−
literatura z rozdziału 7 poradnika dla nauczyciela.
Zadanie dla ucznia
Określ co najmniej 5 możliwych sposobów skażenia środowiska naturalnego przez instalację
produkcji kwasu siarkowego powstałych na wskutek awarii tej instalacji. Ponadto określ
rodzaj powstałego skażenia.
W tym celu:
−
określ wpływ substancji występujących w procesie produkcji kwasu siarkowego na
ś
rodowisko naturalne,
−
wypisz wpływ substancji występujących w procesie produkcji kwasu siarkowego na
ś
rodowisko naturalne,
−
określ co najmniej 5 możliwych sposobów skażenia środowiska naturalnego przez
instalację produkcji kwasu siarkowego,
−
określ rodzaj skażenia.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
8
Przebieg zajęć:
1.
Sprawy organizacyjne.
2.
Nawiązanie do tematu, omówienie celów zajęć.
3.
Zorganizowanie stanowiska pracy do wykonania ćwiczenia.
4.
Realizacja zajęć:
–
zapoznanie się z kartami charakterystyki substancji niebezpiecznych,
–
zapoznanie się z uproszczonym schematem produkcji kwasu siarkowego,
–
określenie wpływu substancji występujących w procesie produkcji kwasu siarkowego
na środowisko naturalne,
–
wypisanie wpływu substancji występujących w procesie produkcji kwasu siarkowego
na środowisko naturalne,
–
określenie możliwych sposobów skażenia środowiska naturalnego przez instalację
produkcji kwasu siarkowego,
–
wypisanie możliwych sposobów skażenia środowiska naturalnego przez instalację
produkcji kwasu siarkowego.
5.
Po wykonaniu ćwiczenia uczeń określa, jakie zagrożenia stanowi produkcja kwasu
siarkowego.
6.
Nauczyciel analizuje prace uczniów.
7.
Grupa wspólnie z nauczycielem dokonuje oceny prac.
Zakończenie zajęć
Praca domowa
Odszukaj w literaturze informacji dotyczących zasadności stosowania metody podwójnej
absorpcji.
Sposób uzyskania informacji zwrotnej od ucznia po zakończonych zajęciach:
−
anonimowe ankiety ewaluacyjne dotyczące sposobu prowadzenia zajęć i zdobytych
umiejętności.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
9
Scenariusz zajęć 2
Osoba prowadząca
……………………………………….…………………
Modułowy program nauczania:
Operator urządzeń przemysłu chemicznego 815[01]
Moduł:
Technologie wytwarzania podstawowych półproduktów
i produktów przemysłu chemicznego 815[01].Z2
Jednostka modułowa:
Wytwarzanie podstawowych półproduktów i produktów
nieorganicznych 815[01].Z2.02
Temat: Odżelazienie wody przez napowietrzanie i filtrację.
Cel ogólny: Kształtowanie umiejętności odżelazienia wody w warunkach laboratoryjnych.
Po zakończeniu zajęć edukacyjnych uczeń potrafi:
−
przeprowadzić proces napowietrzania wody,
−
przeprowadzić proces filtracji wody na złożach filtracyjnych żwirowych,
−
określić zawartość jonów żelaza(III) w wodzie metodą kolorymetryczną.
Metody nauczania–uczenia się:
−
ć
wiczenia praktyczne.
Formy organizacyjne pracy uczniów:
−
grupowa jednolita.
Czas trwania zajęć: 2 godziny dydaktyczne.
Środki dydaktyczne:
−
stanowisko do napowietrzania i filtracji wody,
–
kolba miarowa 50 cm
3
,
–
pipety,
–
roztwór NH
4
CNS o stężeniu 20%,
–
roztwór HCl o stężeniu 2 mol/dm
3
,
–
roztwór H
2
O
2
o stężeniu 3%,
–
kolorymetr,
–
krzywa wzorcowa,
−
instrukcja oznaczania zawartości jonów żelaza(III) metodą kolorymetryczną,
−
ś
rodki ochrony indywidualnej.
Zadanie dla ucznia
Określ skuteczność odżelazienia wody metodą jonitową.
W tym celu:
−
sporządź wykaz niezbędnego sprzętu laboratoryjnego i odczynników,
−
zaplanuj konieczne czynności laboratoryjne,
−
określ warunki bhp niezbędne do bezpiecznego wykonywania czynności laboratoryjnych,
−
pobierz od nauczyciela niezbędny sprzęt i odczynniki,
−
przeprowadź zaplanowane czynności laboratoryjne,
−
zapisz obserwacje w dzienniku laboratoryjnym,

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
10
Przebieg zajęć:
1.
Czynności porządkowe.
2.
Omówienie celów lekcji oraz przepisów bhp.
3.
Omówienie szczegółowych zasad sporządzania sprawozdania.
4.
Ć
wiczenia praktyczne:
–
zgromadzenie niezbędnego sprzętu i odczynników,
–
oznaczenie zawartości jonów żelaza(III) w badanej wodzie metodą kolorymetryczną,
–
wykonanie procesu napowietrzania badanej wody,
–
oznaczenie zawartości jonów żelaza(III) w wodzie przed napowietrzeniem i po jej
napowietrzaniu metodą kolorymetryczną.
5.
Przygotowanie tabeli wyników.
6.
Uporządkowanie stanowiska pracy.
Zakończenie zajęć
Praca domowa
Przygotuj sprawozdanie z dzisiejszego ćwiczenia. Pamiętaj o podaniu wniosków.
Sposób uzyskania informacji zwrotnej od ucznia po zakończonych zajęciach:
−
anonimowe ankiety ewaluacyjne dotyczące sposobu prowadzenia zajęć, trudności
podczas realizowania zadania i zdobytych umiejętności.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
11
5.
ĆWICZENIA
5.1. Technologia wody
5.1.1. Ćwiczenia
Ćwiczenie 1
Sklasyfikuj wodę mineralną na podstawie danych zaczerpniętych z etykiety na butelce.
Kationy:
wapniowy Ca
2+
96,19 mg/l
magnezowy Mg
2+
12,76 mg/l
sodowy Na
+
3,75 mg/l
potasowy K
+
1,17 mg/l
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia uczniowie powinni przeczytać fragment
rozdziału „Materiał nauczania” dotyczący twardości wody. Nauczyciel powinien omówić
zakres ćwiczenia oraz sposób wykonania. Ćwiczenie może być wykonywane indywidualnie
lub w grupach 2–4-osobowych.
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
określić, które jony wymienione na etykiecie tworzą twardość wody,
2)
wyznaczyć twardość wody w mg CaO/dm
3
,
3)
wyznaczyć twardość wody w stopniach niemieckich [
0
n],
4)
określić na podstawie tabeli załączonej poniżej jaka klasa wody znajduje się w butelce.
Tabela do ćwiczenia 1
Klasyfikacja wody pod względem twardości
twardość wody [
o
n]
rodzaj wody
0–4
bardzo miękka
4–8
miękka
8–20
twarda
ponad 20
bardzo twarda
Zalecane metody nauczania–uczenia się:
−
ć
wiczenie.
Ś
rodki dydaktyczne:
−
papier formatu A4, kalkulator,
−
Poradnik dla ucznia,
−
literatura zgodna z punktem 7 poradnika dla nauczyciela.
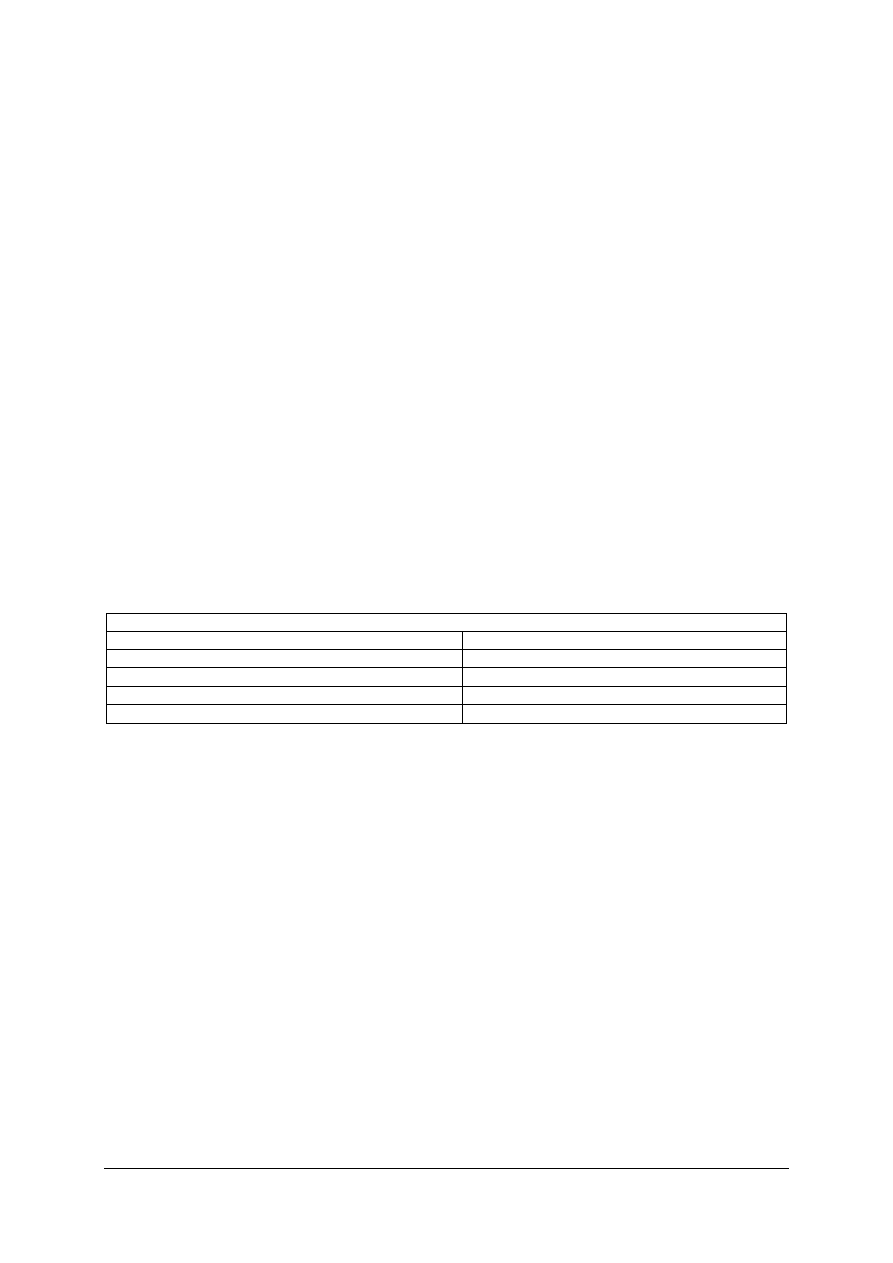
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
12
Ćwiczenie 2
Oznacz twardość ogólną (całkowitą) wody wodociągowej zmiękczonej metodą
termiczną.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia uczniowie powinni przeczytać fragment
rozdziału „Materiał nauczania” dotyczący metod usuwania twardości wody. Nauczyciel
powinien omówić zakres ćwiczenia, sposób wykonania oraz warunki zachowania
bezpieczeństwa pracy. Ćwiczenie może być wykonywane indywidualnie lub w grupach
2–4-osobowych.
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
wnikliwie przeczytać instrukcję wykonania ćwiczenia,
2)
dobrać sprzęt, przyrządy pomiarowe i urządzenie,
3)
dobrać niezbędne do zapewnienia bezpiecznej pracy środki ochrony indywidualnej,
4)
wykonać czynności laboratoryjne opisane w instrukcji wykonania ćwiczenia,
5)
wyznaczyć twardość wody w mmol CaO/dm
3
,
6)
wyznaczyć twardość wody w stopniach niemieckich [
0
n],
7)
uzupełnić tabelę,
8)
określić klasę wody na podstawie tabeli załączonej poniżej.
Tabela do ćwiczenia 2.
Klasyfikacja wody pod względem twardości
twardość wody [
o
n]
rodzaj wody
0–4
bardzo miękka
4–8
miękka
8–20
twarda
ponad 20
bardzo twarda
Zalecane metody nauczania–uczenia się:
−
metoda tekstu przewodniego.
Ś
rodki dydaktyczne:
−
zlewka o pojemności 400 cm
3
,
−
trójnóg,
−
palnik,
−
płytka metalowa,
−
biureta,
−
pipeta jednomiarowa o pojemności 100 cm
3
,
−
3 kolby stożkowe o pojemności 250 cm
3
,
−
roztwór wersenianu dwusodowego (EDTA) o stężeniu 0,02 mol/dm
3
,
−
bufor amonowy (pH = 10),
−
nasycony roztwór czerni eriochromowej T w etanolu,
−
ś
rodki ochrony indywidualnej,
−
instrukcja wykonania ćwiczenia.
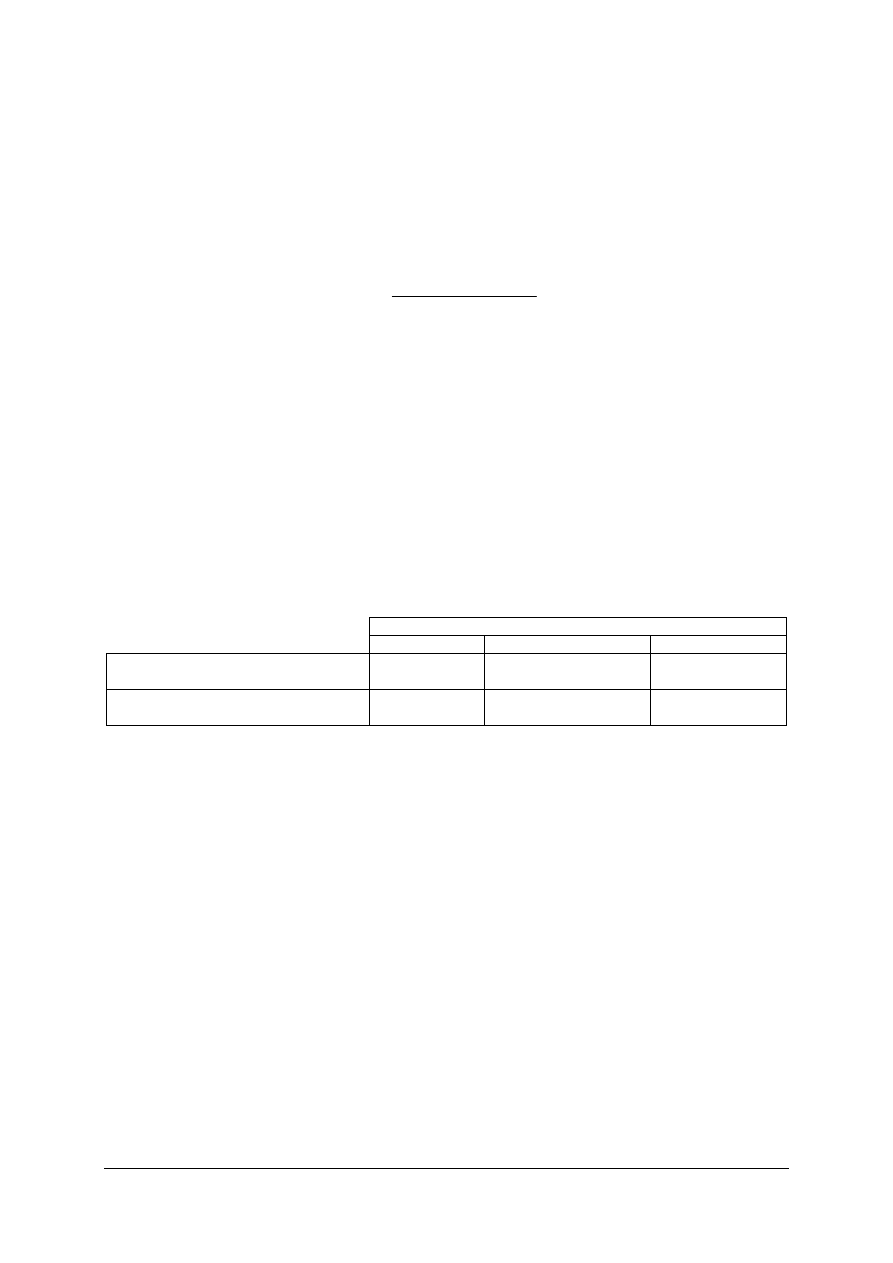
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
13
Stosowane oznaczenia w instrukcji wykonania ćwiczenia
T
c
– twardość ogólna (całkowita) [mmol CaO/dm
3
],
EDTA – wersenian dwusodowy,
V
próbki
– objętość próbki wody wzięta do oznaczenia [cm
3
],
V
EDTA
– objętość wersenianu dwusodowego zużyta na zmiareczkowanie próbki wody [cm
3
],
c
EDTA
– stężenie użytego roztworu EDTA [mol/dm
3
].
Użyteczne wzory
próbki
EDTA
EDTA
c
V
c
V
T
1000
⋅
⋅
=
Instrukcja wykonania ćwiczenia
1.
Do kolby stożkowej odmierz pipetą 100 cm
3
wody wodociągowej, dodaj 10 cm
3
buforu
amonowego oraz 5 kropli czerni eriochromowej T. Zmiareczkować tak przygotowaną
wodę roztworem EDTA o stężeniu 0,02 mol/dm
3
, aż
do momentu zmiany zabarwienia
z czerwonego na niebieskie. Odczytaj z biurety objętość zużytego roztworu wersenianu.
Wykonaj trzy powtarzalne miareczkowania.
2.
Doprowadź do wrzenia około 350 cm
3
wody wodociągowej w zlewce na płytce
umieszczonej na trójnogu nad palnikiem, utrzymuj wodę w stanie wrzenia przez około
5 minut. Następnie zakończ ogrzewanie i po ostudzeniu wody do temp. pokojowej
pobierz trzy próbki ostudzonej wody po 100 cm
3
. Miareczkuj próbki tak jak w punkcie 1.
Wyniki pomiarów
Tabela do ćwiczenia 2. Wyniki oznaczenia twardości wody
Wyniki miareczkowania [cm
3
]
1
2
3
woda wodociągowa
woda zmiękczona termicznie
Ćwiczenie 3
Narysuj schemat ideowy procesu mechanicznego oczyszczania wody na podstawie tabeli 1
zawartej w Poradniku dla ucznia opisującej metody uzdatniania wody do celów spożywczo-
gospodarczych.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia uczniowie powinni przeczytać fragment
rozdziału „Materiał nauczania” dotyczący oczyszczania wody do celów gospodarczych
i przemysłowych. Nauczyciel powinien omówić zakres ćwiczenia oraz sposób jego
wykonania. Ćwiczenie może być wykonywane indywidualnie lub w grupach 2–4-osobowych.
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
odszukać w Poradniku dla ucznia informacje dotyczące metod oczyszczania wody do
celów gospodarczych i przemysłowych,
2)
odszukać w materiałach dydaktycznych dowolny schemat ideowy w celu przypomnienia
sobie jego struktury,
3)
narysować schemat ideowy procesu mechanicznego oczyszczania wody.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
14
Zalecane metody nauczania–uczenia się:
−
pokaz z objaśnieniem,
−
metoda projektu.
Ś
rodki dydaktyczne:
−
papier formatu A4, flamastry,
−
Poradnik dla ucznia,
−
literatura zgodna z punktem 7 poradnika dla nauczyciela.
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
15
5.2. Produkcja kwasu siarkowego(VI)
5.2.1. Ćwiczenia
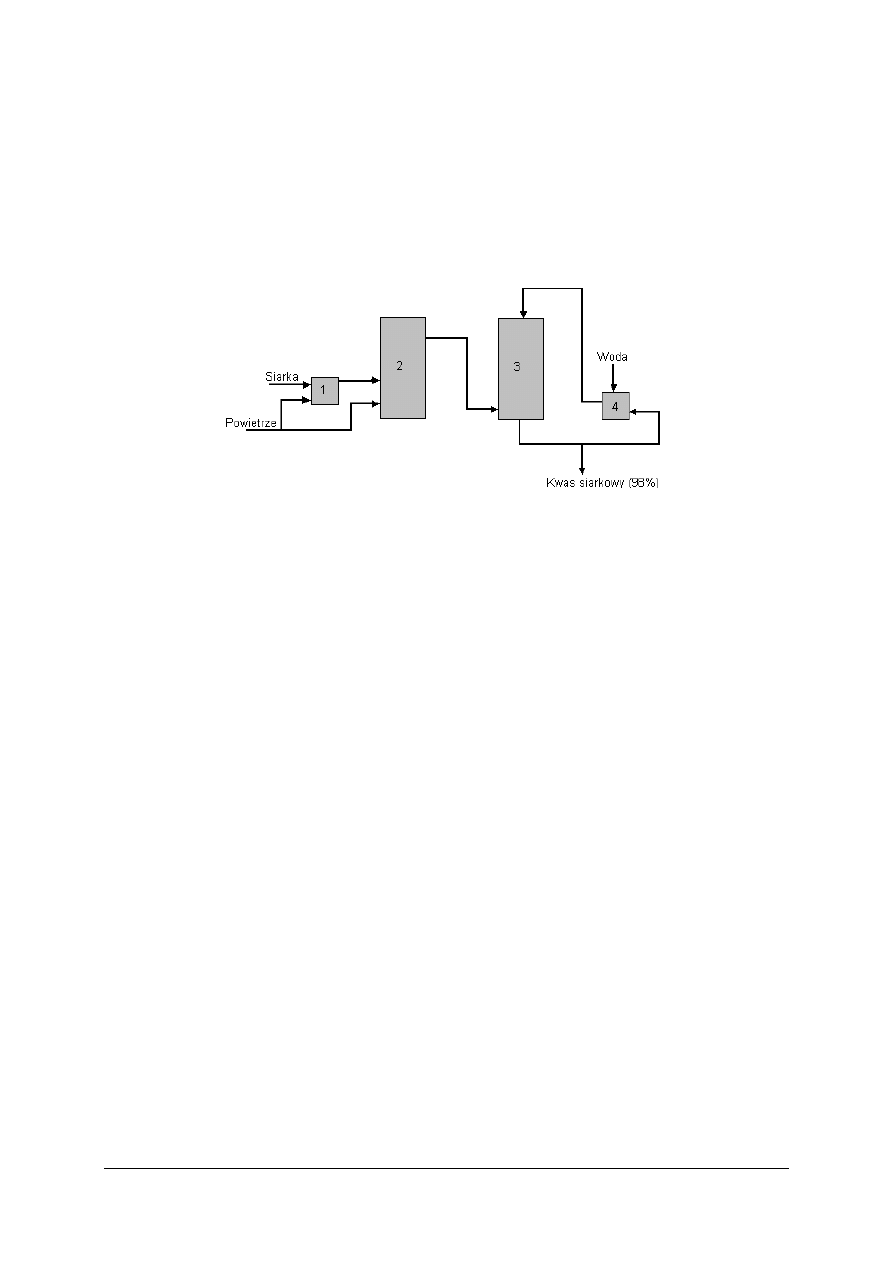
Ćwiczenie 1
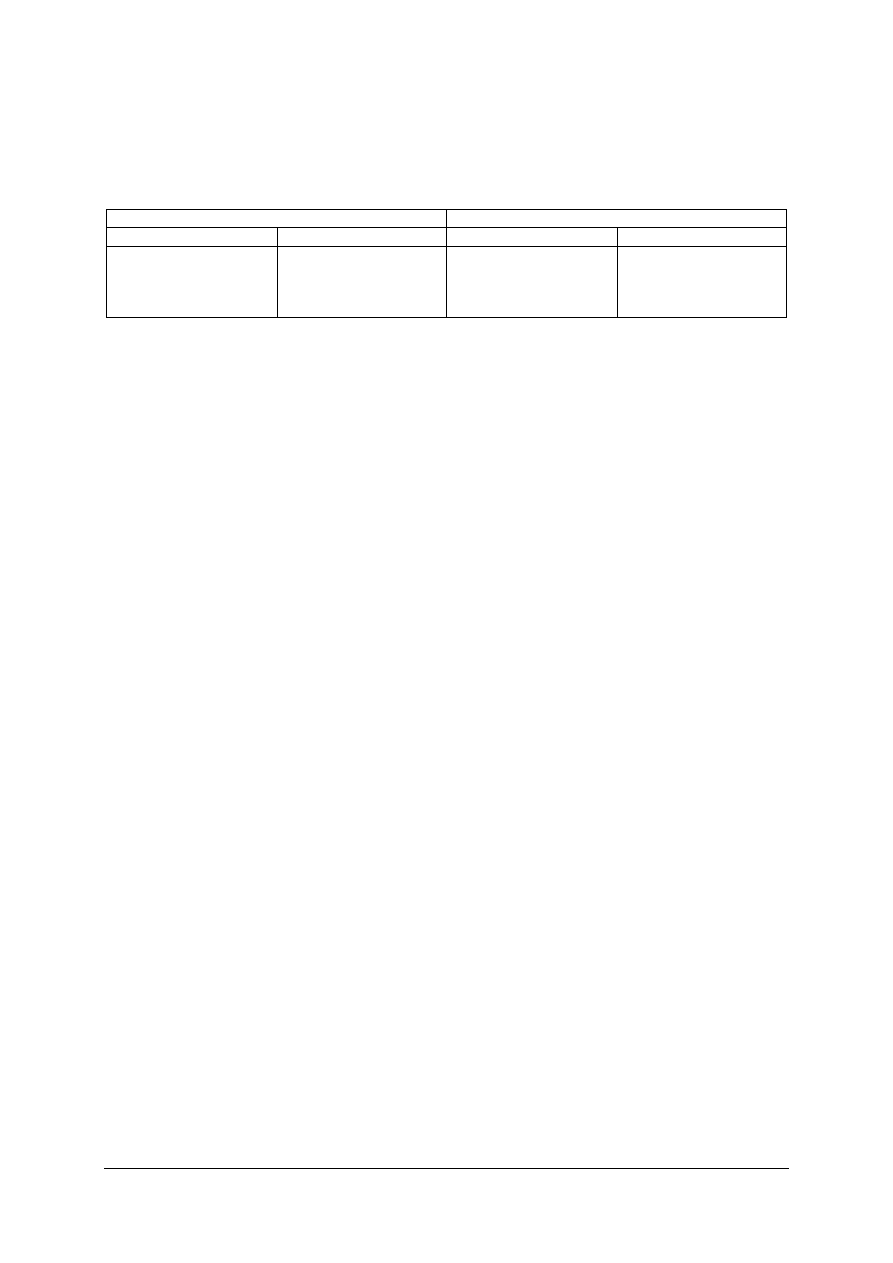
Określ, jakie procesy zachodzą w elementach oznaczonych cyframi na uproszczonym
schemacie produkcji kwasu siarkowego przedstawionym na rysunku.
Rysunek do ćwiczenia 1
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia uczniowie powinni przeczytać fragment
rozdziału „Materiał nauczania” dotyczący produkcji kwasu siarkowego. Nauczyciel powinien
omówić zakres ćwiczenia oraz sposób wykonania. Ćwiczenie może być wykonywane
indywidualnie lub w grupach 2–4-osobowych.
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
odszukać w materiałach dydaktycznych informacje dotyczące produkcji kwasu
siarkowego,
2)
dokonać analizy schematu ideowego produkcji kwasu siarkowego,
3)
rozpoznać na załączonym do ćwiczenia rysunku elementy instalacji produkcji kwasu
siarkowego.
Zalecane metody nauczania–uczenia się:
−
pokaz z objaśnieniem,
−
tekstu przewodniego.
Ś
rodki dydaktyczne:
−
papier formatu A4, flamastry,
−
Poradnik dla ucznia,
−
literatura zgodna z punktem 7 poradnika dla nauczyciela.
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
16
Ćwiczenie 2
Naszkicuj wykres Sankeya dla węzła kontaktowego instalacji produkcji kwasu
siarkowego korzystając z danych zawartych w tabeli.
Tabela do ćwiczenia 2
Przychód
Rozchód
składnik
masa [kg]
składnik
masa [kg]
dwutlenek siarki
tlen
azot
657
246
1890
trójtlenek siarki
dwutlenek siarki
tlen
azot
818
3
82
1890
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia uczniowie powinni przeczytać fragment
rozdziału „Materiał nauczania” dotyczący produkcji kwasu siarkowego(VI). Nauczyciel
powinien omówić zakres ćwiczenia oraz sposób jego wykonania. Ćwiczenie może być
wykonywane indywidualnie lub w grupach 2–4-osobowych.
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
zapisać równanie reakcji utleniania dwutlenku siarki,
2)
dowiedzieć się, co opisuje wykres Sankeya,
3)
dowiedzieć się, jaka jest konstrukcja wykresu Sankeya,
4)
naszkicować obraz graficzny przychodu,
5)
naszkicować obraz graficzny rozchodu.
Zalecane metody nauczania–uczenia się:
−
ć
wiczenie.
Ś
rodki dydaktyczne:
−
papier formatu A4,
−
Poradnik dla ucznia,
−
literatura zgodna z punktem 7 poradnika dla nauczyciela.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
17
5.3. Technologia związków azotu
5.3.1. Ćwiczenia
Ćwiczenie 1
Oblicz zawartość azotu, w przeliczeniu na N
2
, w azotanie amonu oraz w moczniku. Do
obliczeń możesz wykorzystać uproszczone równania:
NH
4
NO
3
N
2
NH
2
CONH
2
N
2
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia uczniowie powinni przeczytać fragment
rozdziału „Materiał nauczania” dotyczący nawozów azotowych. Nauczyciel powinien omówić
zakres ćwiczenia oraz sposób jego wykonania. Ćwiczenie może być wykonywane
indywidualnie lub w grupach 2–4-osobowych.
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
wyszukać w materiałach dydaktycznych informacje dotyczące produkcji saletry
amonowej,
2)
zapisać wzory opisujące zawartość procentową azotu, w przeliczeniu na N
2
, w azotanie
amonu i moczniku,
3)
wyznaczyć masę cząsteczkową (molową) azotanu amonu i mocznika,
4)
obliczyć zawartość azotu, w przeliczeniu na N
2
, w azotanie amonu oraz w moczniku.
Zalecane metody nauczania–uczenia się:
−
pokaz z objaśnieniem,
−
ć
wiczenie.
Ś
rodki dydaktyczne:
−
kalkulator,
−
papier formatu A4,
−
Poradnik dla ucznia,
−
literatura zgodna z punktem 7 poradnika dla nauczyciela.
Ćwiczenie 2
Produkcja saletry amonowej polega na zobojętnianiu roztworu kwasu azotowego
amoniakiem. Oblicz objętość amoniaku niezbędną do zobojętnienia 1 tony roztworu kwasu
azotowego o stężeniu 63%.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia uczniowie powinni przeczytać fragment
rozdziału „Materiał nauczania” dotyczący nawozów azotowych. Nauczyciel powinien omówić
zakres ćwiczenia oraz sposób jego wykonania. Wskazane jest, aby nauczyciel przypomniał
uczniom także obliczenia stechiometryczne w zakresie ujętym w ćwiczeniu. Ćwiczenie może
być wykonywane indywidualnie lub w grupach 2–4-osobowych.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
18
Sposób wykonania ćwiczenia
Uczeń powinien:
1) zapisać równanie reakcji neutralizacji kwasu azotowego amoniakiem,
2)
obliczyć masę czystego kwasu azotowego zawartą w 1 tonie roztworu kwasu azotowego
o stężeniu 63%,
3)
obliczyć objętość amoniaku wykorzystując zależność stechiometryczną pomiędzy
kwasem azotowym a amoniakiem.
Zalecane metody nauczania–uczenia się:
−
pokaz z objaśnieniem,
−
ć
wiczenie.
Ś
rodki dydaktyczne:
–
kalkulator,
–
papier formatu A4,
–
Poradnik dla ucznia,
–
literatura zgodna z punktem 7 poradnika dla nuczyciela.
Ćwiczenie 3
Wyznacz procentową zawartość gazu syntezowego otrzymanego w wyniku katalitycznej
konwersji metanu z przegrzaną parą wodną. Do wykonania obliczeń przyjmij, że zareaguje
tylko połowa początkowej ilości metanu. Uzupełnij tabelę.
Tabela do ćwiczenia 3
Gazy poddawane konwersji
Gazy po konwersji
Substancje
Objętość [m
3
]
Substancje
Objętość [m
3
]
Zawartość procentowa
CH
4
H
2
O
CO
H
2
1
1
0
0
CH
4
H
2
O
CO
H
2
Razem:
2
Razem
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia uczniowie powinni przeczytać fragment
rozdziału „Materiał nauczania” dotyczący produkcji gazu syntezowego. Nauczyciel powinien
omówić zakres ćwiczenia oraz sposób jego wykonania. Ćwiczenie może być wykonywane
indywidualnie lub w grupach 2–4-osobowych.
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
wyszukać w materiałach dydaktycznych informacje dotyczące produkcji gazu
syntezowego,
2)
zapisać równanie reakcji konwersji metanu z przegrzaną parą wodną,
3)
obliczyć objętość gazu po konwersji korzystając z prawa Avogadro,
4)
obliczyć zawartość procentową składników gazu po konwersji.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
19
Zalecane metody nauczania–uczenia się:
−
pokaz z objaśnieniem,
−
ć
wiczenie.
Ś
rodki dydaktyczne:
−
kalkulator,
−
papier formatu A4,
−
Poradnik dla ucznia,
−
literatura zgodna z punktem 7 poradnika dla nauczyciela.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
20
5.4. Technologia związków fosforu
5.4.1. Ćwiczenia
Ćwiczenie 1
Oblicz zawartość fosforu, w przeliczeniu na P
2
O
5
, w diwodorofosforanie wapnia,
głównym składniku superfosfatu potrójnego. Do obliczeń możesz wykorzystać uproszczone
równania:
Ca(H
2
PO
4
)
2
P
2
O
5
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia uczniowie powinni przeczytać fragment
rozdziału „Materiał nauczania” dotyczący nawozów fosforowych skoncentrowanych.
Nauczyciel powinien omówić zakres ćwiczenia oraz sposób jego wykonania. Ćwiczenie może
być wykonywane indywidualnie lub w grupach 2–4-osobowych.
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
wyszukać w materiałach dydaktycznych informacje dotyczące produkcji nawozów
fosforowych,
2)
zapisać wzory opisujące zawartość procentową fosforu, w przeliczeniu na P
2
O
5
,
w diwodorofosforanie wapnia,
3)
wyznaczyć masę cząsteczkową (molową) diwodorofosforanu wapnia,
4)
obliczyć zawartość fosforu, w przeliczeniu na P
2
O
5
, w diwodorofosforanie wapnia.
Zalecane metody nauczania–uczenia się:
−
pokaz z objaśnieniem,
−
ć
wiczenie.
Ś
rodki dydaktyczne:
−
kalkulator,
−
papier formatu A4,
−
Poradnik dla ucznia,
−
literatura zgodna z punktem 7 poradnika dla nauczyciela.
Ćwiczenie 2
Narysuj schemat ideowy procesu otrzymywania superfosfatu potrójnego. W czasie
opracowywania schematu ideowego tego procesu skorzystaj z następujących wskazówek:
−
produkcja superfosfatu prostego wymaga stosowania kwasu siarkowego, zaś produkcja
superfosfatu potrójnego wymaga stosowania kwasu fosforowego,
−
w produkcji superfosfatu prostego nie powstaje fosfogips, zaś w produkcji superfosfatu
potrójnego fosfogips powstaje,
−
procesy tężenia i dojrzewania występują zarówno w produkcji superfosfatu prostego, jak
i superfosfatu potrójnego.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
21
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia uczniowie powinni przeczytać fragment
rozdziału „Materiał nauczania” dotyczący nawozów fosforowych skoncentrowanych.
Nauczyciel powinien omówić zakres ćwiczenia oraz sposób jego wykonania. Ćwiczenie może
być wykonywane indywidualnie lub w grupach 2–4-osobowych.
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
wyszukać w Poradniku dla ucznia informacje dotyczące produkcji nawozów fosforowych
oraz schemat ideowy produkcji superfosfatu prostego,
2)
dokonać analizy schematu ideowego produkcji superfosfatu prostego,
3)
narysować schemat ideowy produkcji superfosfatu potrójnego.
Zalecane metody nauczania–uczenia się:
−
pokaz z objaśnieniem,
−
metoda projektu.
Ś
rodki dydaktyczne:
−
papier formatu A4, flamastry,
−
Poradnik dla ucznia,
−
literatura zgodna z punktem 7 poradnika dla nauczyciela.
Ćwiczenie 3
Sprawdź doświadczalnie, dlaczego składnikiem nawozów fosforowych nie powinien być
fosforan wapnia.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia uczniowie powinni przeczytać fragment
rozdziału „Materiał nauczania” dotyczący nawozów fosforowych skoncentrowanych.
Nauczyciel powinien omówić zakres ćwiczenia, sposób wykonania oraz warunki zachowania
bezpieczeństwa pracy. Ćwiczenie może być wykonywane indywidualnie lub w grupach
2–4-osobowych.
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
wyszukać w materiałach dydaktycznych informacje dotyczące produkcji nawozów
fosforowych,
2)
wykonać doświadczenie zgodnie z zamieszczoną instrukcją wykonania doświadczenia,
3)
zapisać równanie zachodzących reakcji,
4)
wyciągnąć wnioski z wyników doświadczenia.
Zalecane metody nauczania–uczenia się:
−
pokaz z objaśnieniem,
−
ć
wiczenie laboratoryjne.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
22
Ś
rodki dydaktyczne:
−
3 zlewki o pojemności 200 cm
3
,
−
bagietka,
−
roztwór Na
3
PO
4
o stężeniu 0,1 mol/dm
3
,
−
roztwór NaH
2
PO
4
o stężeniu 0,1 mol/dm
3
,
−
roztwór CaSO
4
o stężeniu 0,1 mol/dm
3
,
−
ś
rodki ochrony indywidualnej,
−
dziennik laboratoryjny,
−
Poradnik dla ucznia,
−
literatura zgodna z punktem 7 poradnika dla nauczyciela.
Instrukcja wykonania doświadczenia
W celu wykonania doświadczenia:
−
przygotuj trzy zlewki o pojemności 200 cm
3
,
−
w pierwszej zlewce przygotuj 50 cm
3
wodnego roztworu Na
3
PO
4
o stężeniu 0,1 mol/dm
3
,
−
w drugiej zlewce przygotuj 50 cm
3
wodnego roztworu NaH
2
PO
4
o stężeniu 0,1 mol/dm
3
,
−
w trzeciej zlewce przygotuj 100 cm
3
wodnego roztworu CaSO
4
o stężeniu 0,1 mol/dm
3
,
−
dodaj do zlewki pierwszej i drugiej po 50 cm
3
wodnego roztworu CaSO
4
o stężeniu
0,1 mol/dm
3
, a następnie zamieszaj roztwory.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
23
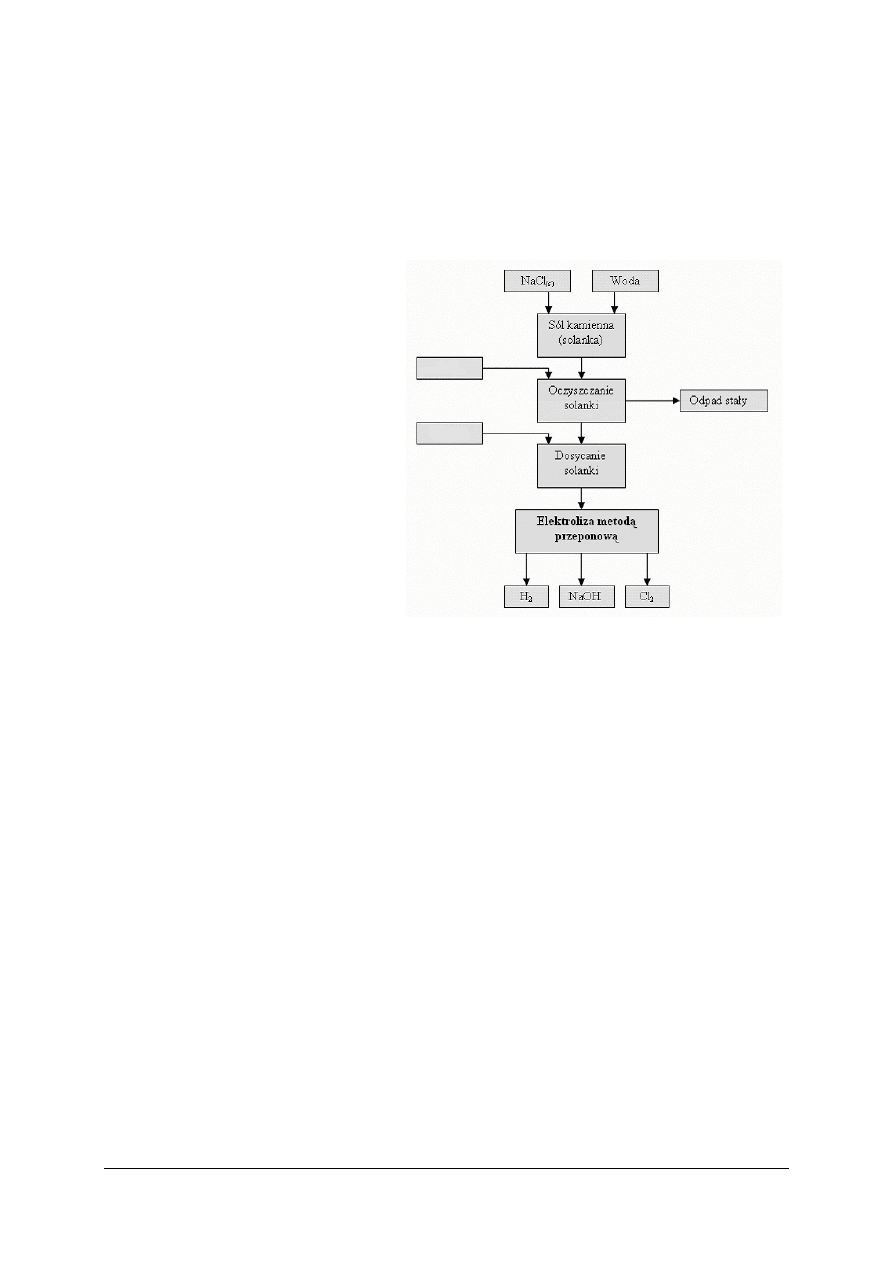
5.5. Procesy elektrochemiczne
5.5.1. Ćwiczenia
Ćwiczenie 1
Korzystając z kart charakterystyki substancji niebezpiecznych określ podstawowe dane
dotyczące chloru, a mianowicie:
−
jego wpływ na środowisko naturalne,
−
postępowanie w przypadku uwolnienia się chloru do środowiska,
−
obchodzenie się z chlorem i jego magazynowanie,
−
ś
rodki ochrony indywidualnej zapewniające bezpieczną pracę.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia uczniowie powinni przeczytać fragment
rozdziału „Materiał” nauczania dotyczący elektrolizy wodnego roztworu soli kamiennej.
Nauczyciel powinien omówić zakres ćwiczenia oraz sposób jego wykonania. Ćwiczenie może
być wykonywane indywidualnie lub w grupach 2–4-osobowych.
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
wyszukać w kartach charakterystyki substancji niebezpiecznych dane dotyczące chloru,
2)
wyszukać w tekście niezbędne informacje,
3)
zapisać krótką charakterystykę dotyczącą chloru.
Zalecane metody nauczania–uczenia się:
−
pokaz z objaśnieniem,
−
ć
wiczenie praktyczne.
Ś
rodki dydaktyczne:
−
papier formatu A4, flamastry,
−
Poradnik dla ucznia,
−
karty charakterystyki substancji niebezpiecznych.
Ćwiczenie 2
Korzystając ze schematu ideowego produkcji chloru, wodoru i wodorotlenku sodu,
określ, w jakim celu dodawany jest dwutlenek węgla.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia uczniowie powinni przeczytać fragment
rozdziału „Materiał nauczania” dotyczący elektrolizy wodnego roztworu soli kamiennej.
Nauczyciel powinien omówić zakres ćwiczenia oraz sposób jego wykonania. Ćwiczenie może
być wykonywane indywidualnie lub w grupach 2–4-osobowych.
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
wyszukać w Poradniku dla ucznia schemat ideowy produkcji chloru, wodoru
i wodorotlenku sodu,

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
24
2)
wyszukać w literaturze podanej w poradniku lub w Internecie informacje dotyczące
elektrolizy przeponowej wodnego roztworu soli kamiennej,
3)
zapisać krótką informację dotyczącą zasadności stosowania dwutlenku węgla w procesie
oczyszczania solanki.
Zalecane metody nauczania–uczenia się:
−
pokaz z objaśnieniem,
−
metoda tekstu przewodniego.
Ś
rodki dydaktyczne:
−
papier formatu A4, flamastry,
−
Poradnik dla ucznia,
−
literatura zgodna z punktem 7 poradnika dla nauczyciela.
Ćwiczenie 3
Oblicz maksymalną objętość chloru, jaką można uzyskać w czasie elektrolizy wodnego
roztworu soli kamiennej metodą przeponową, jeżeli elektrolizę prowadzono przez trzy
godziny prądem o natężeniu 1000 A.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia uczniowie powinni przeczytać fragment
rozdziału Materiał nauczania dotyczący elektrolizy przemysłowej. Nauczyciel powinien
omówić zakres ćwiczenia oraz sposób jego wykonania. Wskazane jest, aby nauczyciel
przypomniał uczniom podstawowe obliczenia chemiczne ujęte zakresem ćwiczenia.
Ć
wiczenie może być wykonywane indywidualnie lub w grupach 2–4-osobowych.
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
wyszukać w Poradniku dla ucznia informacji dotyczących elektrolizy przemysłowej.
2)
wyszukać wzór opisujący masę wydzielonej substancji,
3)
wyznaczyć masę molową cząsteczki chloru,
4)
obliczyć masę wydzielonego chloru,
5)
przeliczyć masę chloru na objętość gazowego chloru, wykorzystując objętość molową
gazu.
Zalecane metody nauczania–uczenia się:
−
pogadanka,
−
ć
wiczenie praktyczne.
Ś
rodki dydaktyczne:
−
kalkulator,
−
papier formatu A4, flamastry,
−
Poradnik dla ucznia,
−
literatura zgodna z punktem 7 poradnika dla nauczyciela.
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
25
6. EWALUACJA OSIĄGNIĘĆ UCZNIA
Przykłady narzędzi pomiaru dydaktycznego
TEST 1
Test dwustopniowy do jednostki modułowej
„Wytwarzanie podstawowych
półproduktów i produktów nieorganicznych”
Test składa się z 30 zadań wielokrotnego wyboru, z których:
−
zadania 1, 2, 5, 7, 8, 9, 11, 14, 17, 18, 19, 21, 22, 25, 26, 27, 28, 29, 30 są z poziomu
podstawowego,
−
zadania 3, 4, 6, 10, 12, 13, 15, 16, 20, 23, 24 są z poziomu ponadpodstawowego.
Punktacja zadań: 0 lub 1 punkt
Za każdą prawidłową odpowiedź uczeń otrzymuje 1 punkt. Za złą odpowiedź lub jej brak
uczeń otrzymuje 0 punktów.
Proponuje się następujące normy wymagań – uczeń otrzyma następujące
oceny szkolne:
−
dopuszczający – za rozwiązanie co najmniej 10 zadań z poziomu podstawowego,
−
dostateczny – za rozwiązanie co najmniej 15 zadań z poziomu podstawowego,
−
dobry – za rozwiązanie 22 zadań, w tym co najmniej 5 z poziomu ponadpodstawowego,
−
bardzo dobry – za rozwiązanie 27 zadań, w tym co najmniej 8 z poziomu
ponadpodstawowego.
Klucz odpowiedzi: 1. b, 2. c, 3. c, 4. b, 5. d, 6. a, 7. d, 8. d, 9. c, 10. c, 11. c,
12. d, 13. b, 14. b, 15. b, 16. b, 17. c, 18. a, 19. c, 20. c, 21. c,
22. c, 23. c, 24. b, 25. b, 26. d, 27. a, 28. d, 29. d, 30. c.
Plan testu
Nr
zad.
Cel operacyjny
(mierzone osiągnięcia ucznia)
Kategoria
celu
Poziom
wymagań
Poprawna
odpowiedź
1. Rozpoznać jony tworzące twardość wody
A
P
b
2. Rozróżnić metody usuwania twardości wody
B
P
c
3. Wyznaczyć podstawowy parametr wody
C
PP
c
4. Rozróżnić metody uzdatniania wody
C
PP
b
5. Określić parametry procesu
B
P
d
6. Określić zapotrzebowanie surowców
C
PP
a
7. Scharakteryzować elementy procesu
B
P
d
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
26
8. Zdefiniować produkty procesu
A
P
d
9. Zidentyfikować surowiec podstawowy
A
P
c
10. Ocenić zagrożenie środowiska naturalnego
D
PP
c
11.
Rozpoznać elementy uproszczonego schematu
procesu
A
P
c
12. Uzasadnić stosowanie zasad technologicznych
D
PP
d
13. Określić skład produktu
C
PP
b
14. Wskazać zastosowanie produktów ubocznych
B
P
b
15.
Wyjaśnić wpływ zmiany parametrów na przebieg
procesu
C
PP
b
16. Wyjaśnić koncepcję chemiczną procesu
C
PP
b
17. Wskazać metody pozyskiwania surowców
B
P
c
18. Scharakteryzować produkty procesu
B
P
a
19. Rozpoznać znak ostrzegawczy
B
P
c
20. Wyznaczyć ilość produktu
C
PP
c
21. Scharakteryzować koncepcję chemiczną procesu
B
P
c
22. Rozróżnić produkty procesu
B
P
c
23.
Posłużyć się uproszczonym schematem ideowym
procesu
B
PP
c
24. Wyznaczyć ilość surowca
C
PP
b
25. Określić przebieg procesu elektrochemicznego
B
P
b
26. Scharakteryzować metody uzdatniania wody
B
P
d
27.
Określić materiały stosowane do budowy
urządzeń
B
P
a
28.
Określić materiały stosowane do budowy
urządzeń
B
P
d
29. Ocenić stopień zagrożenia środowiska pracy
B
P
d
30. Scharakteryzować metody oczyszczania wody
B
P
c

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
27
Przebieg testowania
Instrukcja dla nauczyciela
1.
Ustal z uczniami termin przeprowadzenia sprawdzianu z wyprzedzeniem co najmniej
jednotygodniowym.
1.
Omów cel stosowania pomiaru dydaktycznego.
2.
Zapoznaj uczniów z rodzajem zadań podanych w zestawie oraz z zasadami punktowania.
3.
Omów z uczniami sposób udzielania odpowiedzi (karta odpowiedzi).
4.
Zapewnij uczniom możliwość samodzielnej pracy.
5.
Rozdaj uczniom zestawy zadań testowych i karty odpowiedzi, podaj czas przeznaczony
na udzielanie odpowiedzi.
6.
Postaraj się stworzyć odpowiednią atmosferę podczas przeprowadzania pomiaru
dydaktycznego (rozładuj niepokój, zachęć do sprawdzenia swoich możliwości).
7.
Kilka minut przed zakończeniem sprawdzianu przypomnij uczniom o zbliżającym się
czasie zakończenia udzielania odpowiedzi.
8.
Zbierz karty odpowiedzi oraz zestawy zadań testowych.
9.
Sprawdź wyniki i wpisz do arkusza zbiorczego.
10.
Przeprowadź analizę uzyskanych wyników sprawdzianu i wybierz te zadania, które
sprawiły uczniom największe trudności.
11.
Ustal przyczyny trudności uczniów w opanowaniu wiadomości i umiejętności.
12.
Opracuj wnioski do dalszego postępowania, mającego na celu uniknięcie niepowodzeń
dydaktycznych – niskie wyniki przeprowadzonego sprawdzianu.
Instrukcja dla ucznia
1.
Przeczytaj uważnie instrukcję.
2.
Podpisz imieniem i nazwiskiem kartę odpowiedzi.
3.
Zapoznaj się z zestawem zadań testowych.
4.
Test zawiera 30 zadań wielokrotnego wyboru o różnym stopniu trudności. W każdym
zadaniu tylko jedna odpowiedź jest prawidłowa.
5.
Udzielaj odpowiedzi tylko na załączonej karcie odpowiedzi, stawiając w odpowiedniej
rubryce znak X. W przypadku pomyłki należy błędną odpowiedź zaznaczyć kółkiem,
a następnie ponownie zakreślić odpowiedź prawidłową.
6.
Pracuj samodzielnie, bo tylko wtedy będziesz miał satysfakcję z wykonanego zadania.
7.
Kiedy udzielenie odpowiedzi będzie Ci sprawiało trudność, wtedy odłóż jego rozwiązanie
na później i wróć do niego, gdy zostanie Ci czas wolny.
8.
W czasie pracy możesz korzystać z kalkulatora do wykonywania niezbędnych obliczeń
oraz układu okresowego pierwiastków.
9.
Na rozwiązanie testu masz 60 minut.
Powodzenia!
Materiały dla ucznia:
−
instrukcja,
−
zestaw zadań testowych,
−
karta odpowiedzi.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
28
ZESTAW ZADAŃ TESTOWYCH
1.
Twardości wody nie powoduje jon
a)
Ca
2+
.
b)
Na
+
.
c)
Mg
2+
.
d)
Fe
3+
.
2.
Do wstępnego usuwania twardości wody można zastosować metodę sodową – wapienną.
Polega ona na dodaniu do wody
a) Ca(OH)
2
i NaCl..
b) Na(HCO
3
)
2
i Ca(OH)
2
.
c) NaCl i Ca(OH)
2
.
d) Na
2
CO
3
i Ca(OH)
2
.
3.
Twardość całkowita wody wynosi 26,2
0
n. Jeżeli twardość niewęglanowa tej wody
wynosi 9,2
0
n, to twardość węglanowa wynosi
a) 18,4
0
n.
b) 52,4
0
n.
c) 17,0
0
n.
d) 4,6
0
n.
4.
Usuwając twardość wody metodami chemicznymi powinna być zachowana następująca
kolejność dodawania odczynników
a) soda, wapno, fosforan trójsodowy.
b) wapno, soda, fosforan trójsodowy.
c) fosforan trójsodowy, wapno, soda.
d) fosforan trójsodowy, soda, wapno.
5.
Reakcja spalania siarki w piecu wtryskowym przebiega
a) bez użycia katalizatora w niskiej temperaturze.
b) bez użycia katalizatora w wysokiej temperaturze.
c) z użyciem katalizatora w niskiej temperaturze.
d) z użyciem katalizatora w wysokiej temperaturze.
6.
Do spalenia 1000 kg siarki o czystości 95% należy zużyć
a) 665 m
3
tlenu.
b) 333 m
3
tlenu.
c) 66,5 m
3
tlenu.
d) 33,3 m
3
tlenu.
7.
Tlenki siarki(VI) nie mogą być absorbowane w
a) roztworze kwasu stężonego.
b) roztworze kwasu rozcieńczonego.
c) oleum.
d) wodzie.
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
29
8.
Oleum to
a) rozcieńczony kwas siarkowy(VI).
b) stężony kwas siarkowy(VI).
c) kwas siarkowy o stężeniu 100%.
d) roztwór SO
3
w kwasie siarkowym(VI).
9.
Surowcem stosowanym do produkcji superfosfatu jest
a) baryt.
b) luizyt.
c) apatyt.
d) iperyt.
10.
Produkcja kwasu fosforowego z fosforytów jest uciążliwa dla środowiska naturalnego ze
względu na
a) zużycie dużych ilości powietrza.
b) powstawanie dużych ilości tlenków siarki.
c) powstawanie fosfogipsów.
d) powstawanie dużych ilości tlenków azotu.
11.
Na rysunku, przedstawiającym schemat instalacji produkcji kwasu siarkowego,
elementem oznaczonym cyfrą 2 jest
a) mieszalnik.
b) wieża absorpcyjna.
c) aparat kontaktowy.
d) piec do spalania siarki.
12.
Konieczność absorpcji fluorowodoru powstającego w procesie produkcji kwasu
fosforowego i superfosfatu potrójnego
a) powoduje znaczny wzrost kosztów produkcji tych substancji.
b) powoduje nieznaczny wzrost kosztów produkcji tych substancji.
c) nie zmienia kosztów produkcji tych substancji.
d) powoduje obniżenie kosztów produkcji tych substancji.
13.
Zawartość procentowa P
2
O
5
w Ca(H
2
PO
4
)
2
wynosi około
a) 27%.
b) 60%.
c) 40%.
d) 13%.
14.
Fosfogipsy powstające w czasie produkcji kwasu fosforowego
a) znalazły szerokie zastosowanie w budownictwie.
b) nie znalazły szerszego zastosowania.
c) znalazły szerokie zastosowanie w drogownictwie.
d) znalazły zastosowanie jako nawóz fosforowy.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
30
15.
Zgodnie z regułą przekory (Le Chateliera – Brauna) reakcja konwersji metanu z parą
wodną opisywana równaniem CH
4
+ H
2
O
CO + 3 H
2
∆
H = 200 kJ powinna
przebiegać
a) w wysokiej temperaturze i przy wysokim ciśnieniu.
b) w wysokiej temperaturze i przy niskim ciśnieniu.
c) w niskiej temperaturze i przy wysokim ciśnieniu.
d) w niskiej temperaturze i przy niskim ciśnieniu.
16.
Stosunek objętościowy produktów gazowych powstających w wyniku reakcji zgazowanie
węgla kamiennego przegrzaną parą wodną wynosi
a) 2:1.
b) 1:1.
c) 1:2.
d) 4:2.
17.
Azot (niezbędny składnik gazu do syntezy amoniaku) można uzyskać w reakcji
a) konwersji metanu z parą wodną.
b) konwersji etanu z parą wodną.
c) półspalania etanu lub węgla.
d) termicznego rozkładu metanu.
18.
Skutecznym nawozem fosforowym nie jest
a) CaHPO
4
.
b) Ca
3
(PO
4
)
2
.
c) NH
4
H
2
PO
4
.
d) (NH
4
)
2
HPO
4
.
19.
Przedstawiony znak ostrzegawczy określa
a) substancje bardzo łatwo palne.
b) substancje bardzo toksyczne.
c) substancje żrące.
d) substancje niebezpieczne dla środowiska.
20.
Z 6 moli wodoru można uzyskać w bezpośredniej reakcji katalitycznej z azotem
a) 6 moli amoniaku.
b) 2 mole amoniaku.
c) 4 mole amoniaku.
d) 3 mole amoniaku.
21.
Kwas azotowy uzyskuje się obecnie przemysłowo w trzech etapach
a) utlenianie katalityczne azotu, utlenianie NO do NO
2
, absorpcja powstałych tlenków
azotu w wodzie.
b) utlenianie katalityczne azotu, utlenianie NO do NO
2
, adsorpcja powstałych tlenków
azotu w wodzie.
c) utlenianie amoniaku, utlenianie NO do NO
2
, absorpcja powstałych tlenków azotu w
wodzie.
d) utlenianie amoniaku, utlenianie NO do NO
2
, adsorpcja powstałych tlenków azotu w
wodzie.
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
31
22.
Saletrę amonową (popularny nawóz azotowy) przedstawia wzór
a) Ca(NO
3
)
2
.
b) NH
2
CONH
2
.
c) NH
4
NO
3
.
d) NH
4
OCONH
2
.
23.
Na schemacie ideowym brak jest dwóch wpisów. W pustych miejscach powinny znaleźć
się wpisy
a) H
2
O i NaCl
(s)
.
b) CO
2
i H
2
O.
c) CO
2
i NaCl
(s)
.
d) CaO i H
2
O.
24.
Aby uzyskać 10 dm
3
solanki o stężeniu 310 g/dm
3
należy rozpuścić w wodzie
a) 31 kg czystego NaCl.
b) 3,1 kg czystego NaCl.
c) 31000 g czystego NaCl.
d) 310 kg czystego NaCl.
25.
Stosunek molowy produktów powstających w wyniku przeponowej elektrolizy wodnego
roztworu NaCl wynosi
a) 1:2:4.
b) 1:1:1.
c) 1:2:1.
d) 2:1:1.
26.
Kamień osadzający się na dnie naczyń w czasie gotowania wody zawiera głównie
a) CaO i MgCO
3
.
b) CaCO
3
i MgO.
c) Ca(OH)
2
i Mg(OH)
2
.
d) CaCO
3
i Mg(OH)
2
.
27.
Kwas siarkowy stężony przewozimy w cysternach zbudowanych
a) ze stali węglowych.
b) z żeliwa.
c) ze stali stopowych.
d) z aluminium.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
32
28.
Kwas azotowy stężony przewozimy w cysternach zbudowanych
a) ze stali węglowych.
b) z żeliwa.
c) ze stali stopowych.
d) z aluminium.
29.
Jeden z nawozów azotowych ulega wybuchowemu rozkładowi termicznemu. Nawozem
tym jest
a) saletra sodowa.
b) saletra wapniowa.
c) mocznik.
d) saletra amonowa.
30.
Oczyszczanie mechaniczne wody polega na przepuszczaniu jej kolejno przez
a) filtry, sita, osadniki i kraty.
b) kraty, filtry, sita i osadniki.
c) kraty, sita, osadniki i filtry.
d) filtry, sita, kraty i osadniki.
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
33
KARTA ODPOWIEDZI
Imię i nazwisko..................................................................................................................
Wytwarzanie podstawowych półproduktów i produktów nieorganicznych
Zakreśl poprawną odpowiedź.
Nr
zadania
Odpowiedź
Punkty
1
a
b
c
d
2
a
b
c
d
3
a
b
c
d
4
a
b
c
d
5
a
b
c
d
6
a
b
c
d
7
a
b
c
d
8
a
b
c
d
9
a
b
c
d
10
a
b
c
d
11
a
b
c
d
12
a
b
c
d
13
a
b
c
d
14
a
b
c
d
15
a
b
c
d
16
a
b
c
d
17
a
b
c
d
18
a
b
c
d
19
a
b
c
d
20
a
b
c
d
21
a
b
c
d
22
a
b
c
d
23
a
b
c
d
24
a
b
c
d
25
a
b
c
d
26
a
b
c
d
27
a
b
c
d
28
a
b
c
d
29
a
b
c
d
30
a
b
c
d
Razem:

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
34
TEST 2
Test typu próba pracy do jednostki modułowej „Wytwarzanie
podstawowych półproduktów i produktów nieorganicznych”
Proponowany test sumujący jest przeznaczony do przeprowadzenia po zakończonym
procesie kształcenia w module „Wytwarzanie podstawowych produktów i półproduktów
nieorganicznych”. Test ma charakter próby pracy i pozwala na ocenę umiejętności uczniów
w zakresie:
–
posługiwania się instrukcją,
–
organizacji stanowiska pracy laboratoryjnej,
–
oznaczania twardości wody,
–
wyznaczania wartości twardości wody na podstawie danych analitycznych,
–
interpretacji wyników pomiarów.
Test ma charakter sprawdzający, tzn. ukierunkowany jest na porównanie wyników
z założonymi w programie celami kształcenia.
Instrukcja dla nauczyciela
1.
Czas trwania testu 120 minut.
2.
Należy przygotować indywidualne stanowisko pracy dla każdego ucznia.
3.
Zapewnić dostęp do literatury potrzebnej do wykonania zadania.
4.
Omówić z uczniami przebieg testu praktycznego.
5.
Podczas testu nauczyciel pełni rolę obserwatora.
Uczeń może maksymalnie otrzymać 12 punktów.
Punktacja dla testu
–
test uczeń zaliczy jeśli uzyska 5 punktów,
–
ocena dostateczna 6–8 punktów,
–
ocena dobra 9–10 punktów,
–
ocena bardzo dobra 11–12 punktów.
Instrukcja dla ucznia
1.
Przeczytaj uważnie instrukcję wykonania zadania.
2.
Zanim przystąpisz do wykonania zadania, zaplanuj pracę. Pomoże Ci w tym KARTA
PRACY.
3.
Odpowiedzi wpisuj w wyznaczonych miejscach KARTY.
4.
Pracuj samodzielnie.
5.
Po zakończeniu zadania oddaj nauczycielowi KARTĘ PRACY.
6.
Powodzenia.
Na wykonanie zadania masz 90 minut.
Powodzenia!

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
35
Treść zadania
W wielu gałęziach przemysłu stosuje się wodę pozbawioną praktycznie twardości wody.
Najczęściej w tym celu stosuje się metodę jonitową, w której woda przepuszczana jest przez
kationit. Twoje zadanie polega na przeprowadzeniu procesu usuwania twardości wody metodą
jonitową oraz na określeniu skuteczności tej metody..
Instrukcja wykonania zadania
Aby wykonać zadanie, powinieneś:
1)
przeczytać instrukcję wykonania zadania,
2)
wykonać czynności opisane w instrukcji obsługi kolumny jonitowej,
3)
wykonać czynności laboratoryjne opisane w instrukcji oznaczania twardości wody,
4)
wyznaczyć twardość wody [mmol CaO/dm
3
],
5)
wyznaczyć twardość wody w stopniach niemieckich [
0
n],
6)
uzupełnić tabelę z wynikami pomiarów,
7)
określić klasę wody wodociągowej i wody po przejściu przez kolumnę jonitową na
podstawie tabeli 1.
Tabela 1. Klasyfikacja wód
Klasyfikacja wody pod względem twardości
twardość wody [
o
n]
rodzaj wody
0–4
bardzo miękka
4–8
miękka
8–20
twarda
ponad 20
bardzo twarda
Wyposażenie stanowiska pracy
–
kolumna jonitowa wypełniona kationitem,
–
zlewka o pojemności 400 cm
3
,
–
biureta,
−
pipeta jednomiarowa o pojemności 100 cm
3
,
–
3 kolby stożkowe o pojemności 250 cm
3
,
–
roztwór wersenianu dwusodowego (EDTA) o stężeniu 0,02 mol/dm
3
,
–
bufor amonowy (pH = 10),
–
nasycony roztwór czerni eriochromowej T w etanolu.
Stosowane oznaczenia w instrukcji wykonania zadania
T
c
– twardość ogólna (całkowita) [mmol CaO/dm
3
],
EDTA – wersenian dwusodowy,
V
próbki
– objętość próbki wody wzięta do oznaczenia [cm
3
],
V
EDTA
– objętość wersenianu dwusodowego zużyta na zmiareczkowanie próbki wody [cm
3
],
c
EDTA
– stężenie użytego roztworu EDTA [mol/dm
3
].
Użyteczne wzory
próbki
EDTA
EDTA
c
V
c
V
T
1000
⋅
⋅
=
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
36
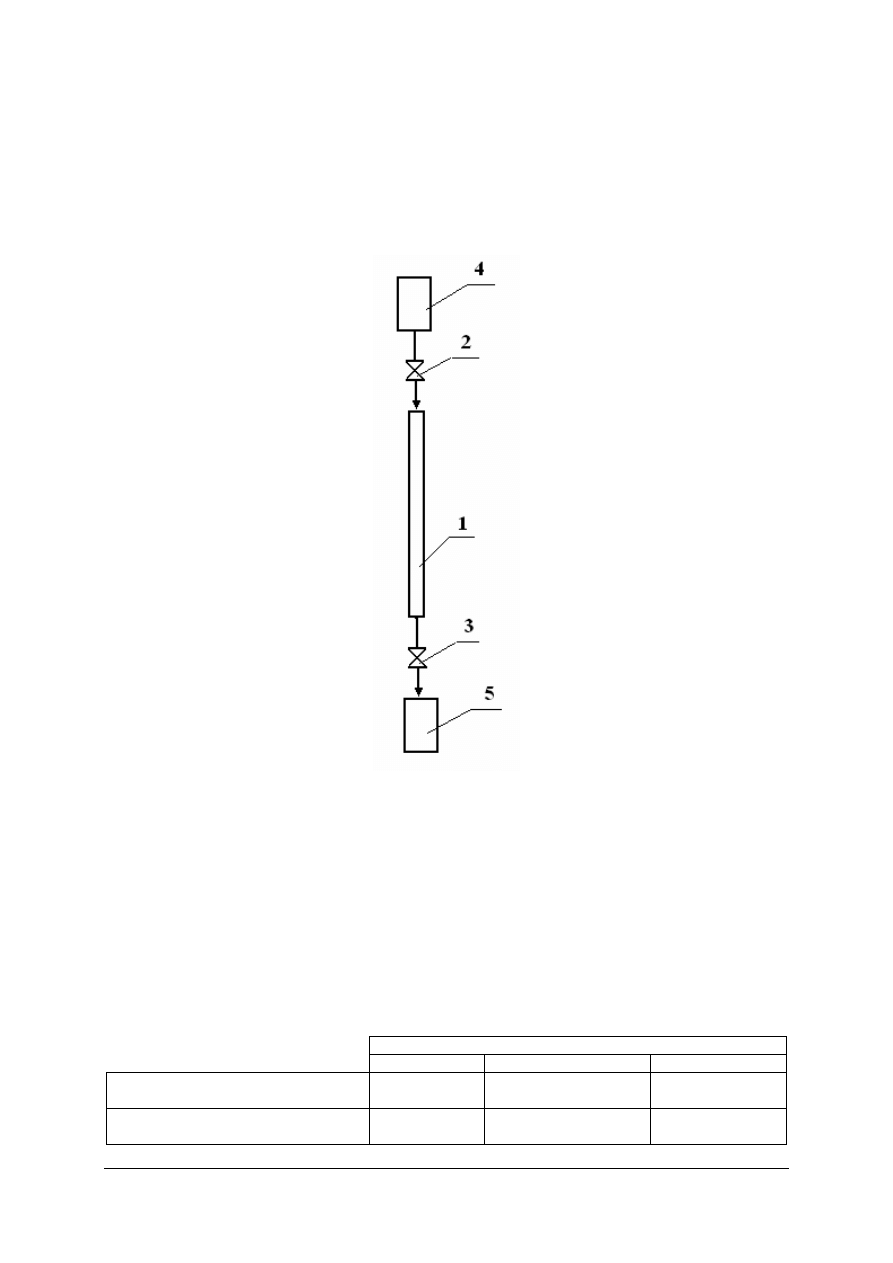
Instrukcja obsługi kolumny jonitowej
1.
Wlej do zbiornika wody wodociągowej około 1 dm
3
wody pobranej z sieci
wodociągowej.
2.
Otwórz zawory nr 2 i 3 na tyle, aby złoże jonitu cały czas było zalane wodą.
3.
Zakończ proces zmiękczania wody w momencie uzyskania około 400 cm
3
wody
zmiękczonej.
4.
Po zakończeniu procesu zmiękczania wody zamknij zawór nr 3, a następnie zawór nr 2.
Rysunek. Kolumna jonitowa: 1 – kolumna z kationitem; 2, 3 – zawory, 4 – zbiornik wody twardej,
5 – zbiornik wody zmiękczonej
Instrukcja oznaczania twardości wody
Do kolby stożkowej odmierz pipetą 100 cm
3
badanej wody, dodaj 10 cm
3
buforu
amonowego oraz 5 kropli czerni eriochromowej T. Zmiareczkować tak przygotowaną wodę
roztworem EDTA o stężeniu 0,02 mol/dm
3
, aż
do momentu zmiany zabarwienia
z czerwonego na niebieskie. Odczytaj z biurety objętość zużytego roztworu wersenianu.
Wykonaj trzy powtarzalne miareczkowania.
Wyniki pomiarów
Tabela 2. Wyniki oznaczenia twardości wody
Wyniki miareczkowania [cm
3
]
1
2
3
woda wodociągowa
woda po przejściu przez kolumnę
jonitowa
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
37
Karta pracy
Nazwisko i imię ucznia
Data
Uzyskana liczba punktów
Lp.
Elementy zadania
Odpowiedź
1.
Wyposażenie stanowiska pracy
2.
Oznaczenia twardości wody
wodociągowej
3.
Uruchomienie kolumny
jonitowej
4.
Zakończenie pracy kolumny
jonitowej
5.
Oznaczenie twardości wody
zmiękczonej
6.
Określenie klasy wody
wodociągowej
7.
Określenie klasy wody
zmiękczonej
8.
Wnioski

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
38
Karta obserwacji
Lp.
Czynność
Maksymalna
liczba
punktów
Uzyskana
liczba
punktów
1.
Wyposażenie stanowiska pracy
1
Wyniki oznaczenia
1
Obliczenie twardości wody
wodociągowej
1
2.
Oznaczenia
twardości wody
wodociągowej
Przestrzeganie zasad bhp
1
3.
Uruchomienie kolumny jonitowej
1
4.
Zakończenie pracy kolumny jonitowej
1
Wyniki oznaczenia
1
Obliczenie twardości wody
zmiękczonej
1
5.
Oznaczenie
twardości wody
zmiękczonej
Przestrzeganie zasad bhp
1
6.
Określenie klasy wody wodociągowej
1
7.
Określenie klasy wody zmiękczonej
1
8.
Wnioski
1

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
39
7.
LITERATURA
1.
Gomółkowie B. i E.: Technologia wód przemysłowych z ćwiczeniami. Oficyna
Wydawnicza Politechniki Wrocławskiej, Wrocław 1994
2.
Klepaczko-Filipiak B., Jakubiak Z., Wulkiewicz U.: Produkcja chemiczna. Podręcznik
dla uczniów liceum technicznego o profilu chemicznym. WSiP
3.
Molenda J.: Chemia w przemyśle. WSiP, Warszawa 1996
4.
Molenda J.: Chemia techniczna.WNT, Warszawa 1985
5.
Molenda J.: Technologia chemiczna. WSiP, Warszawa 1996
6.
Warych J.: Oczyszczanie przemysłowych gazów odlotowych. WNT, Warszawa 1996
Wyszukiwarka
Podobne podstrony:
17 Wytwarzanie podstawowych pol Nieznany (2)
16 Wytwarzanie podstawowych półproduktów i produktów
16 Ustalanie wyniku finansowego Nieznany (2)
matematyka podstawowe wzory i Nieznany
11 Wytwarzanie specjalnych wyro Nieznany (2)
12 Wytwarzanie zakladek, podnos Nieznany (3)
Ludwig von Mises Ekonomia i Pol Nieznany
16 Wspieranie osoby niepelnospr Nieznany (2)
krzysztofik,podstawy telekomuni Nieznany (2)
instrukcja podstawy AutoCad 1 i Nieznany
iii2 transformacja lorentza pol Nieznany
MSR MSR 16 Rzeczowe aktywa trwa Nieznany
Podstawy automatyki (w 1 i 2) p Nieznany
Noworyta, podstawy inzynierii c Nieznany (4)
Podstawy przedsiebiorczosci 3 i Nieznany
16 Rozpoznawanie stanow biologi Nieznany
więcej podobnych podstron