
K.Czopek, M.Zazulak – Notatki w internecie. Wstęp do fizyki atomowej i kwantowej.
IV.
TEORIA (MODEL) BOHRA ATOMU (1913)
Bohr zastanawiał się, jak wyjaśnić strukturę widm liniowych.
Elektron musi krążyć, aby zrównoważyć siłę Coulomba (przyciągającą). Skoro krąży to
doznaje przyspieszenia i promieniuje, a wówczas traci energię.
IV.1. WIDMA PROMIENIOWANIA ATOMÓW
Rys. IV.1. Schemat spektrometru optycznego. Wiązka światła pada na pryzmat i zostaje rozszczepiona.
Rys.IV.2. Z Rys.IV.1. – na kliszy uzyskamy taki obraz padającej wiązki. Jest to widmo liniowe.
Rodzaje widm – podział:
I. według (ze względu na) długość fali λ
a) widma optyczne
– powstają w wyniku zmiany energii elektronów zewnętrznych
– 1 –

K.Czopek, M.Zazulak – Notatki w internecie. Wstęp do fizyki atomowej i kwantowej.
(100Å ≤ λ ≤ daleka podczerwień)
– widma widzialne (VIS):
4000Å ≤ λ ≤ 8000Å
– widma podczerwone (IR):
λ ≥ 8000Å
– widma nadfioletowe (UV):
λ ≤ 4000Å
b) widma rtg (rentgenowskie)
– powstają w wyniku zmiany energii elektronów wewnętrznych (najbliższych jądra
atomowego)
II. według struktury linii
a) widma liniowe | | | || | || | : atomy (jony) swobodne
b) widma pasmowe ||| |||| ||| |||| – gdy linie są zgrupowane bardzo gęsto obok
siebie: drobiny (jony drobin) np. CO
2
, NH
3
, CH
4
,...
c) widma ciągłe – są charakterystyczne dla materii skondensowanej: ciała stałe
(metale), ciecze i gazy w wysokich ciśnieniach. Nie da się jednoznacznie
przypisać konkretnej substancji.
a) i b) są charakterystyczne dla danej substancji – określają ją w sposób jednoznaczny
Dwie linie blisko siebie w widmie – dublet (np. widmo sodu).
III. ze względu na sposób obserwacji
a) widma emisyjne – obserwujemy promieniowanie wysyłane
b) widma absorbcyjne – powstają gdy widmo ciągłe przepuścimy przez daną
substancję (np. gaz), różnica widma ciągłego i liniowego. Na podstawie
analizy linii widmowych możemy stwierdzić przez jakie pierwiastki widmo
zostało przepuszczone
– 2 –
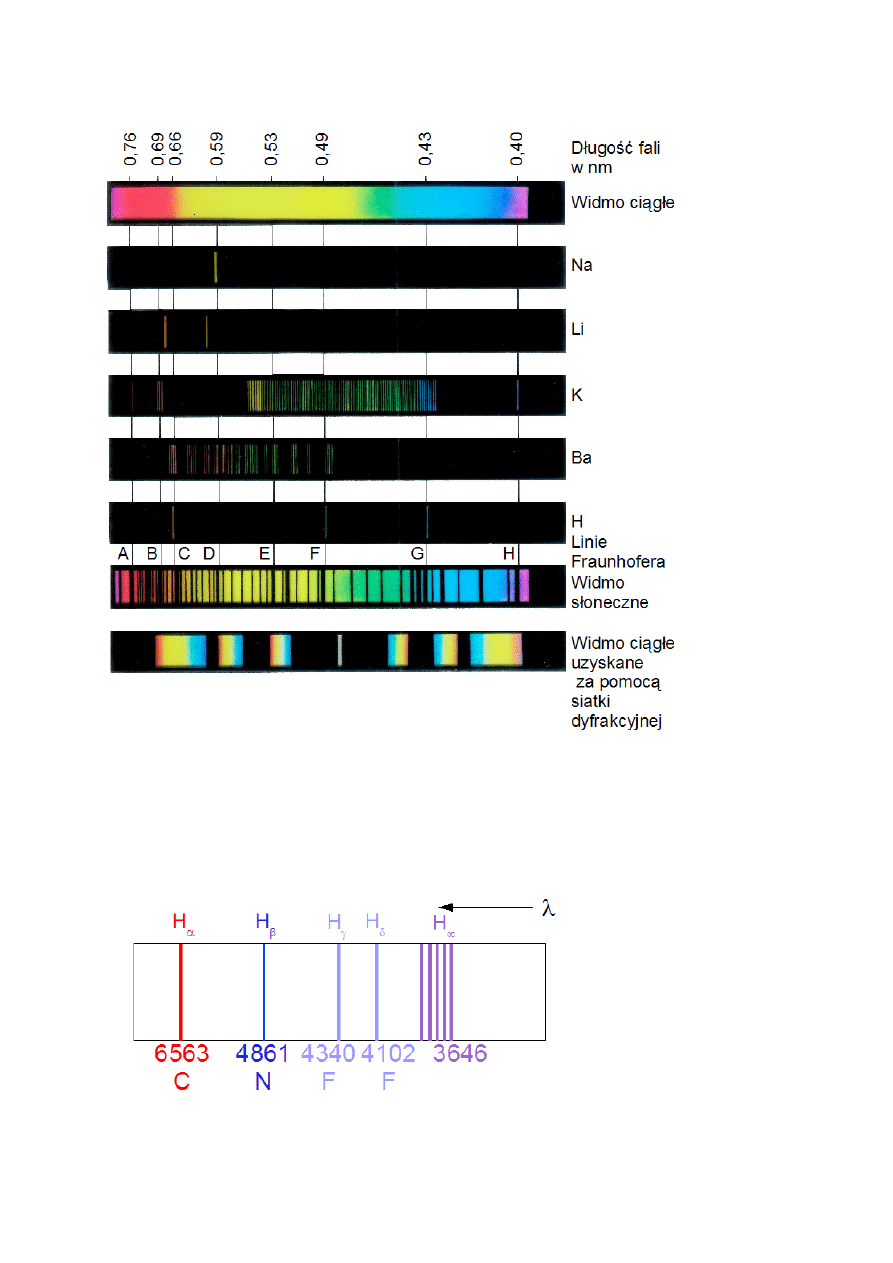
K.Czopek, M.Zazulak – Notatki w internecie. Wstęp do fizyki atomowej i kwantowej.
Rys.IV.3. Przykłady widm.
IV.2. WIDMO ATOMU WODORU (DOŚWIADCZENIE)
Rys.IV.4. Widmo atomu wodoru – przedstawienie graficzne ilustrujące serię Balmera.
– 3 –
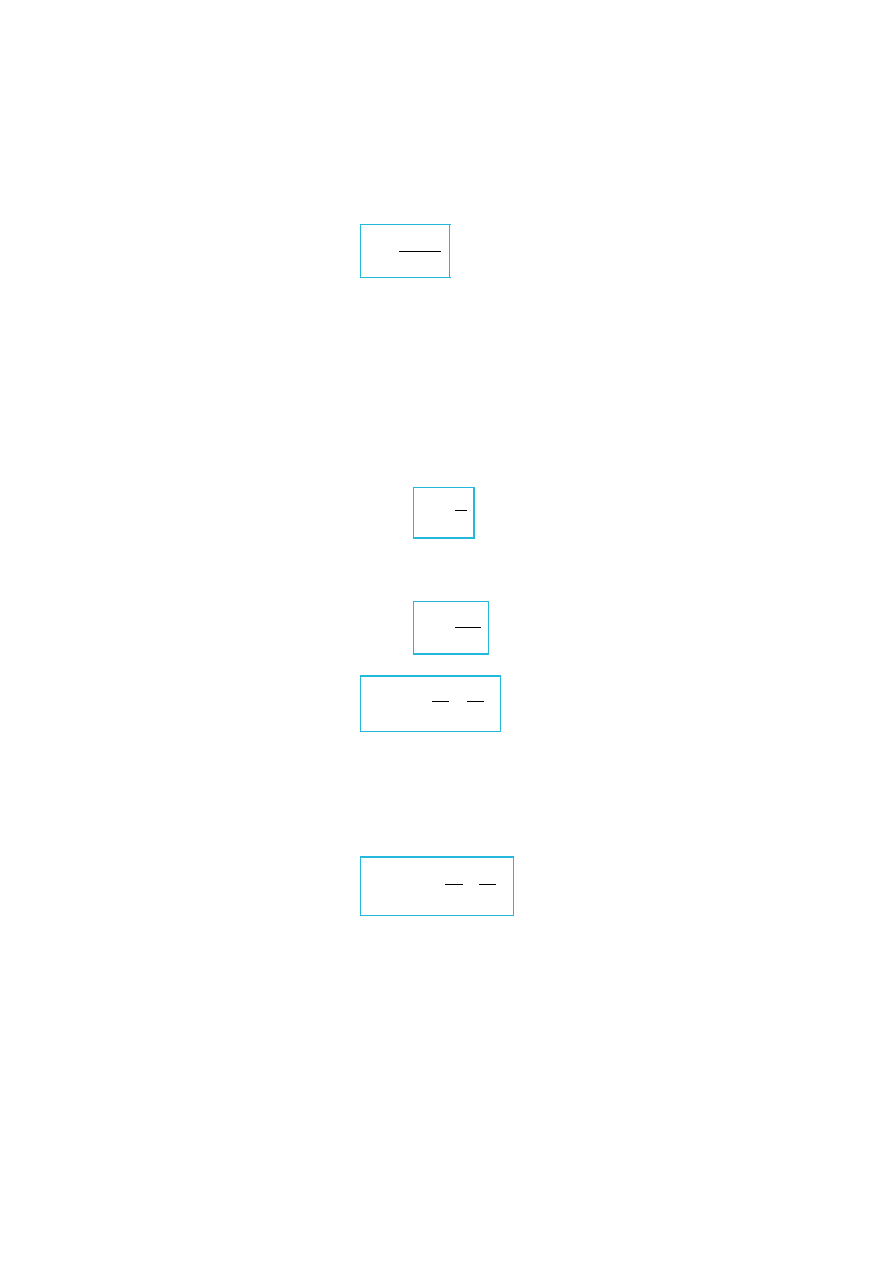
K.Czopek, M.Zazulak – Notatki w internecie. Wstęp do fizyki atomowej i kwantowej.
Balmer zaproponował wzór dzięki któremu możemy znaleźć położenie każdej z linii
widmowych atomu wodoru.
n
=
B
⋅n
2
n
2
−4
,
n = 3,4,5,....
(IV.2.1)
λ
3
=
λ
α
= 6563 [Å]
H
∞
– granica serii Balmera ( λ =3646Å)
Każda seria kończy się pewną linią graniczną.
W serii Balmera wykryto 10 linii.
Rydberg wprowadził pewną modyfikację z której wynika, że wygodniej położenie linii
opisywać przez tzw. liczbę falową k, którą wyrażają zależności (IV.2.2a) lub (IV.2.2b):
k
=
1
(IV.2.2a)
lub
k
=
2
(IV.2.2b)
k
n
=R
H
1
2
2
−
1
n
2
,
n = 3,4,5,...
(IV.2.3)
gdzie:
stała Rydberga – R
H
= 109677,58 cm
-1
Znanych jest 6 serii linii widmowych, których linie opisuje uogólniony wzór Rydberga:
k
= R
∞
Z
2
1
n
1
2
−
1
n
2
2
(IV.2.4)
n
2
= n
1
+1, n
1
= const dla danej serii i 1 ≤ n
1
≤ 6
– 4 –
K.Czopek, M.Zazulak – Notatki w internecie. Wstęp do fizyki atomowej i kwantowej.
SERIA
ROK
n
1
ZAKRES
Lymana
Balmera
Paschena
1906
1885
1908
1
2
3
UV
VIS+UV
IR
przed teorią
Bohra
Bracketta
Pfunda
Humpkreysa
1922
1924
1952
4
5
6
po teorii Bohra
IR
IR
IR
Tabela IV.2. Serie widmowe atomu wodoru.
Model Bohra przewidział istnienie dalszych serii w podczerwieni zanim zostały praktycznie
wykryte.
Teoria Bohra wyprowadzona dla atomu z jednym elektronem – atomy wodoropodobne.
IV.3. TERMY I ZASADA KOMBINACJI RYDBERGA – RITZA (1908)
k
=
R
H
n
1
2
−
R
H
n
2
2
k
=T
1
−T
1
, T
1
=
R
H
n
1
2
, T
2
=
R
H
n
2
2
T
n
=
df
R
H
n
2
(IV.3.1)
Wzór (IV.3.1) – pojęcie termu, którego matematyczna postać jest inna dla każdego
pierwiastka.
Położenie dla dowolnego widma (linii) możemy przedstawić jako różnicę dwóch termów:
k
n
=T
n
'
−T
n1
'
Wzory termów dla atomów innych niż wodór, mają inną postać.
Zasada kombinacji Rydberga – Ritza
Liczby falowe dowolnych linii spektralnych mogą być wyrażone jako różnice odpowiednich
termów. Termy te poprzez kombinacje z innymi termami mogą służyć do obliczania liczb
– 5 –

K.Czopek, M.Zazulak – Notatki w internecie. Wstęp do fizyki atomowej i kwantowej.
falowych innych linii tego samego widma.
Podsumowanie:
Widma atomowe nie są ciągłe – są liniowe, a więc skwantowane!
IV.4. POSTULATY BOHRA
Teoria Bohra oparta jest na następujących postulatach:
I. Elektron porusza się po orbicie kołowej i podlega prawom fizyki klasycznej
(równowaga zapewniona przez prawo Coulomba i II zasadę dynamiki Newtona).
Siła przyciągająca między ładunkiem a jądrem jest równoważona przez siłę
odśrodkową.
II. Zamiast nieskończonej liczby orbit , które dozwolone są z punktu widzenia
mechaniki klasycznej, elektron może poruszać się tylko po takich orbitach, dla
których orbitalny moment pędu L spełnia warunek:
L
= n⋅ħ
, n = 1,2,3,...
ħ
=
df
h
2
(IV.4.1)
L
=∣L∣
– kręt orbitalny
L = r×p ,
p = m⋅v
Jest to tzw. postulat kwantowy.
III. Całkowita energia na danej orbicie stacjonarnej jest stała:
E=const
A zatem Bohr przyjął, że elektron nie traci energii!
IV. Przy przejsciu elektronu z jednej orbity na drugą atom wysyła promieniowanie.
E
2
→ E
1
< E
2
– 6 –
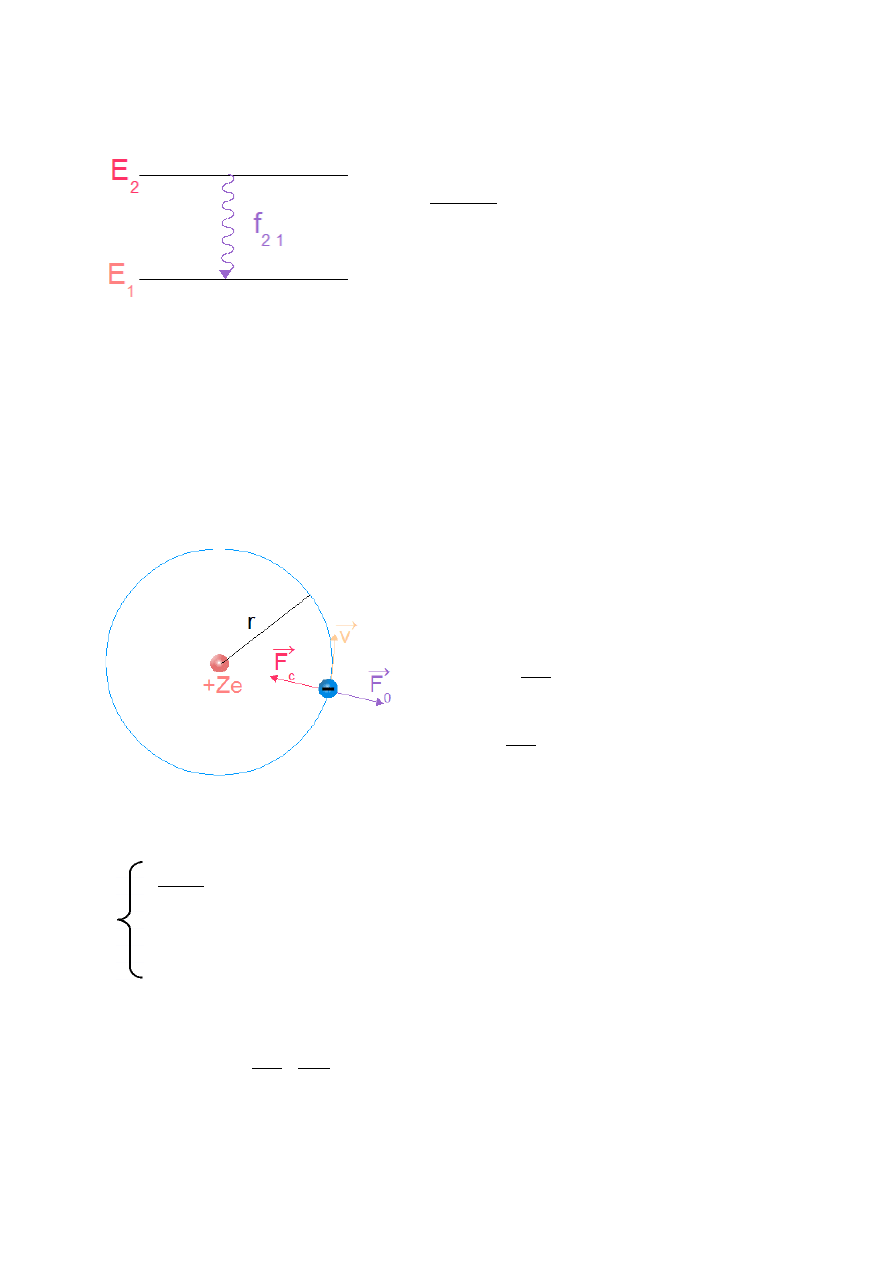
K.Czopek, M.Zazulak – Notatki w internecie. Wstęp do fizyki atomowej i kwantowej.
f
21
=
E
2
− E
1
h
– częstość wyemitowanego
promieniowania
Rys.IV.5. Promieniowanie emitowane przy przejściu elektronu z orbity wyższej na niższą.
Postulat analogiczny do postulatu Einsteina!
Bazując na tych postulatach można wyprowadzić wzór Rydberga.
IV.5. WYPROWADZENIE WZORU RYDBERGA.
F
e
=F
o
F
c
=k
'
Ze
2
r
2
F
o
=
mv
2
r
Rys. IV.6. Elektron krążący po orbicie wokół jądra atomu.
1
4
0
układ (SI)
k'=
1
układ (Gaussa)
założenie: k'=1
Ze
2
r
2
=
mv
2
r
, z czego i ze wzoru (IV.5.3) wynika, że
– 7 –
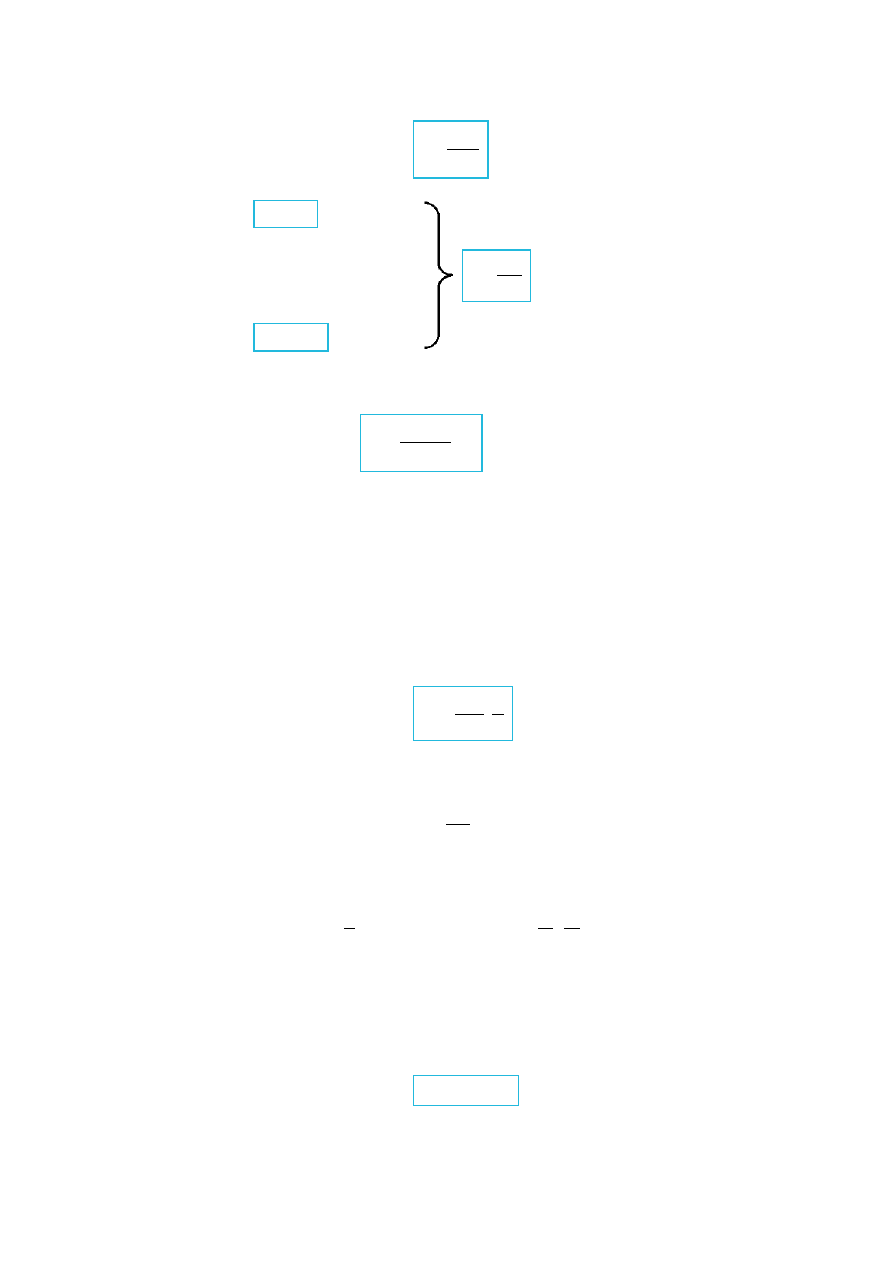
K.Czopek, M.Zazulak – Notatki w internecie. Wstęp do fizyki atomowej i kwantowej.
r
=
Ze
2
mv
2
(IV.5.4)
L
=nħ
(IV.5.1)
v
=
nħ
mr
(IV.5.3)
L
=mvr
(IV.5.2)
A zatem:
r
n
=
ħ
2
Ze
2
⋅m
⋅n
2
n = 1,2,3,
(IV.5.5)
r
1
:r
2
: r
3
:...
=1: 4 :9:...
z wzoru (IV.5.5) możemy wyliczyć promień wodoru na pierwszej orbicie (w stanie
podstawowym) – promień Bohra:
r
1
=5,3 ⋅10
−9
cm
Z (IV.5.3) i (IV.5.5) wynika, że prędkość na n-tej orbicie wynosi:
v
n
=
Ze
2
ħ
⋅
1
n
(IV.5.6)
Z wzoru (IV.5.6) możemy wyliczyć, że:
v
1
=2 ⋅10
8
cm
s
< 1% c
A zatem jak widać, nie ma efektu relatywistycznego.
v
k
~
1
n
, czyli
v
1
:v
2
: v
3
=1 :
1
2
:
1
3
Jak wynika z powyższych obliczeń, największą prędkość uzyskuje elektron na 1 orbicie.
Całkowita energia elektronu jest sumą energii kinetycznej E
k
i potencjalnej E
p
:
E
=E
k
E
p
(IV.5.7)
– 8 –
K.Czopek, M.Zazulak – Notatki w internecie. Wstęp do fizyki atomowej i kwantowej.
E
k
=
mv
2
2
=
Ze
2
2r
(IV.5.8)
E
p
=
∫
Ze
2
r
2
dr
=−
Ze
2
r
(IV.5.9)
E
=−
Ze
2
2r
(IV.5.10)
Z zależności (IV.5.7) – (IV.5.10) wynika, że:
E
=−E
k
Czyli, że energia całkowita elektronu jest ujemna, a więc elektron jest związany.
E
n
=−
Z
2
e
4
2ħ
2
⋅
1
n
2
(IV.5.11)
E
n
– całkowita energia elektronu na n–tej orbicie.
Z zależności (IV.5.11) można obliczyć
E
1
=−13,6 eV
, stąd wynika, że najsilniej
związany jest elektron na pierwszej powłoce.
E
1
=−13,6 eV
– taką energię trzeba dostarczyć ,aby oderwać elektron z 1 orbity
(zjonizować atom wodoru w stanie podstawowym).
E
n
=−
me
4
Z
2
2ħ
2
⋅
1
n
2
(IV.5.12)
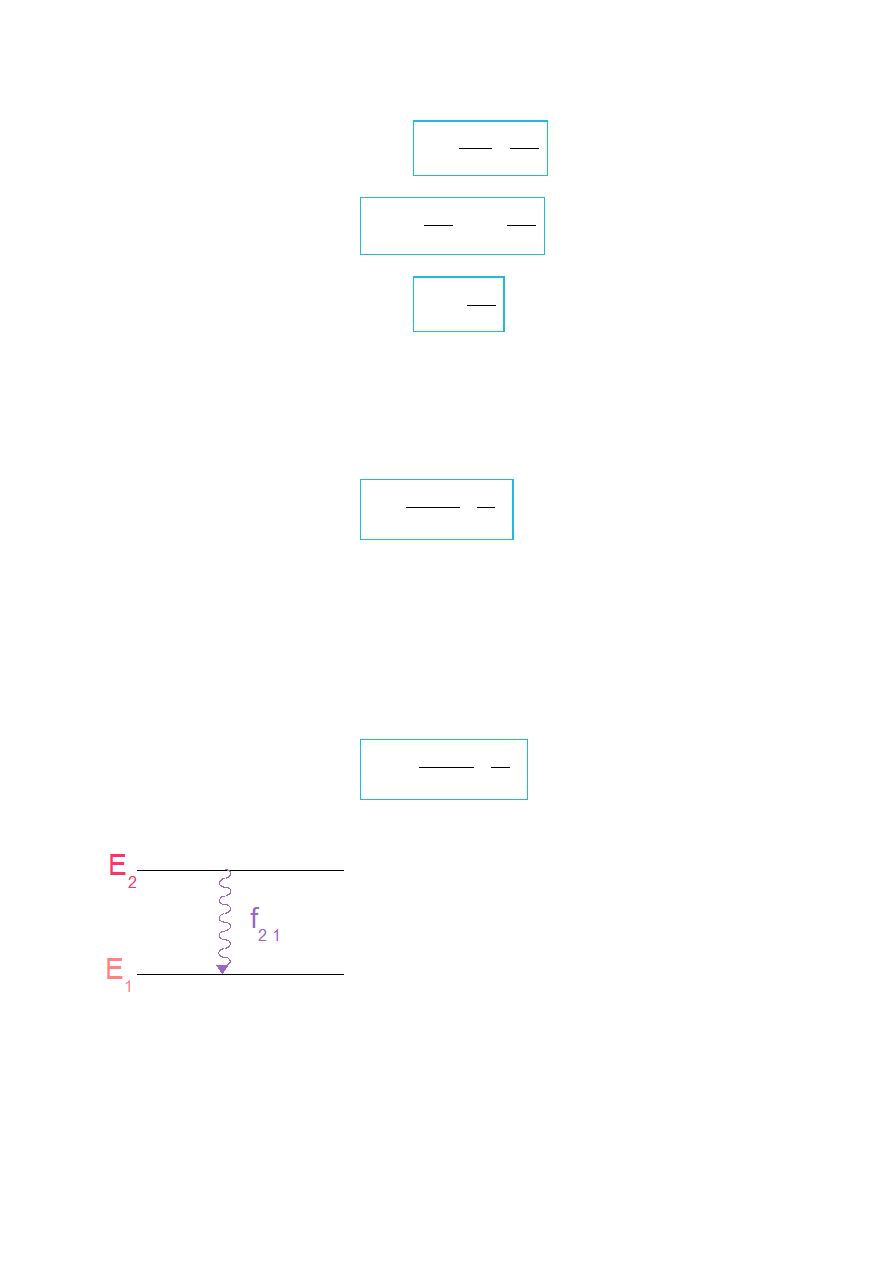
Rys.IV.7. Przejście między stanami E
2
– E
1
.
– 9 –
K.Czopek, M.Zazulak – Notatki w internecie. Wstęp do fizyki atomowej i kwantowej.
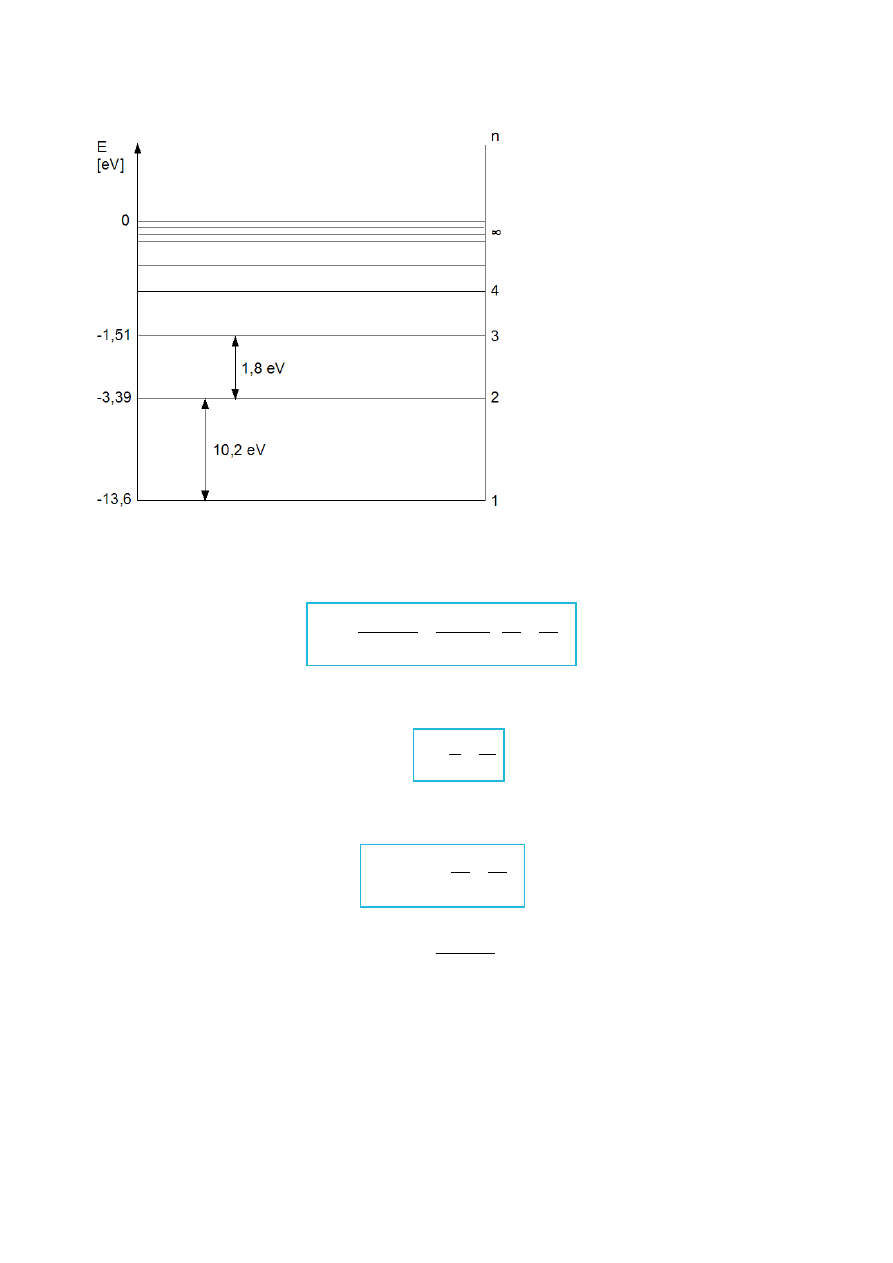
Rys.IV.8. Drabina poziomów energetycznych.
Znając energię dowolnego poziomu energetycznego, możemy wyznaczyć częstość f:
f
21
=
E
2
−E
1
h
=
me
4
Z
2
4
ħ
3
1
n
1
2
−
1
n
2
2
(IV.5.13)
Wprowadzamy liczbę falową k daną wzorem (IV.2.2a):
k
=
1
λ
=
f
c
(IV.5.14)
Po podstawieniu częstości danej wzorem (IV.5.13) do wzoru (IV.5.14) otrzymujemy:
k
= R
∞
Z
2
1
n
1
2
−
1
n
2
2
(IV.5.15)
R
∞
=
df
me
4
4
ℏ
3
c
Po wstawieniu wartości liczbowych można wyliczyć, że:
R
∞
=109737,3128 cm
−1
Wzór (IV.5.15) określa położenie dowolnej linii. Dla Z=1 jest on zgodny ze wzorem
Rytberga.
– 10 –
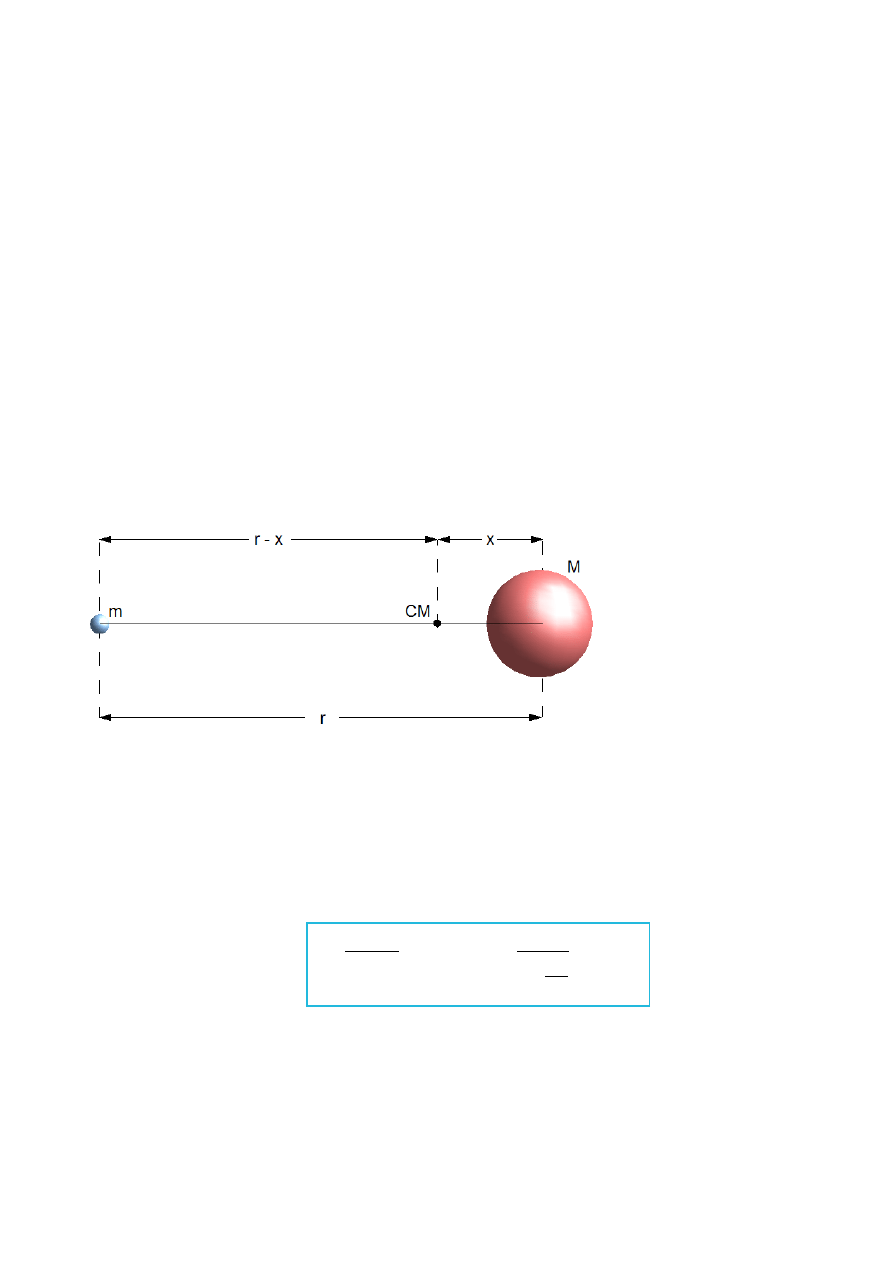
K.Czopek, M.Zazulak – Notatki w internecie. Wstęp do fizyki atomowej i kwantowej.
R
H
=109677,58 cm
−1
R
∞
≃R
H
± 0,05%
Teoria Bohra jest w stanie wyjaśnić położenie linii w tych wszystkich 6 seriach widmowych
wodoru. Potwierdziła bardzo dokładnie położenie linii widmowych w znanych 3 seriach
oraz przewidziała istnienie 3 kolejnych. Każda seria odpowiada przejściu elektronu z
dowolnej powłoki n
2
= (n
1
+ n) na powłokę n
1
.
IV.6. POPRAWKA NA SKOŃCZONĄ MASĘ JĄDRA, M≠ ∞
W rzeczywistości, w atomie wodoropodobnym, oba ciała jądro i elektron poruszają się
wokół środka masy CM.
Rys.IV.9. Schematyczne przedstawienie środka masy w układzie jądro – elektron (nie w skali). Masa jądra
atomowego M jest skończona i wynosi niecałe 200 m
e
, im lżejsze jądro atomowe tym większe przesunięcie
środka ciężkości CM w stronę elektronu. M – masa elektronu, r – odległość elektronu od jądra atomowego, x
– odległość środka ciężkości atomu od środka jądra atomowego.
Można pokazać, że kręt elektronu w takim przypadku (tzn. gdy masa elektronu jest
skończona) wynosi:
L
= mM
m
M
⋅r
2
⋅=
mr
2
1
1
m
M
mr
2
(IV.6.1)
A zatem możemy stosować wszystkie wyprowadzone wcześniej wzory, tyle ze za masę
wstawiamy tzw. masę zredukowaną μ.
– 11 –
K.Czopek, M.Zazulak – Notatki w internecie. Wstęp do fizyki atomowej i kwantowej.
=
df
mM
m
M
(IV.6.2)
Uwzględniając to, że jądro ma skończoną masę, wzór Rydberga ma poniższą postać:
k
= R
M
Z
2
1
n
1
2
−
1
n
2
2
(IV.6.3)
R
M
=
e
4
4
e ℏ
3
(IV.6.4)
R
M
– stała Rytberga dla atomów ze skończoną wartością masy jądra.
IV.7. DOŚWIADCZENIE FRANCKA- HERTZA (1914)
Eksperymentalne potwierdzenie punktu IV.6.
Doświadczenie Francka – Hertza dotyczy zderzania się elektronów z dowolnymi atomami
metali (np. rtęci).
Jeżeli poszczególne poziomy energetyczne w atomie są skwantowane, to poziomy całego
atomu powinny być skwantowane (suma).
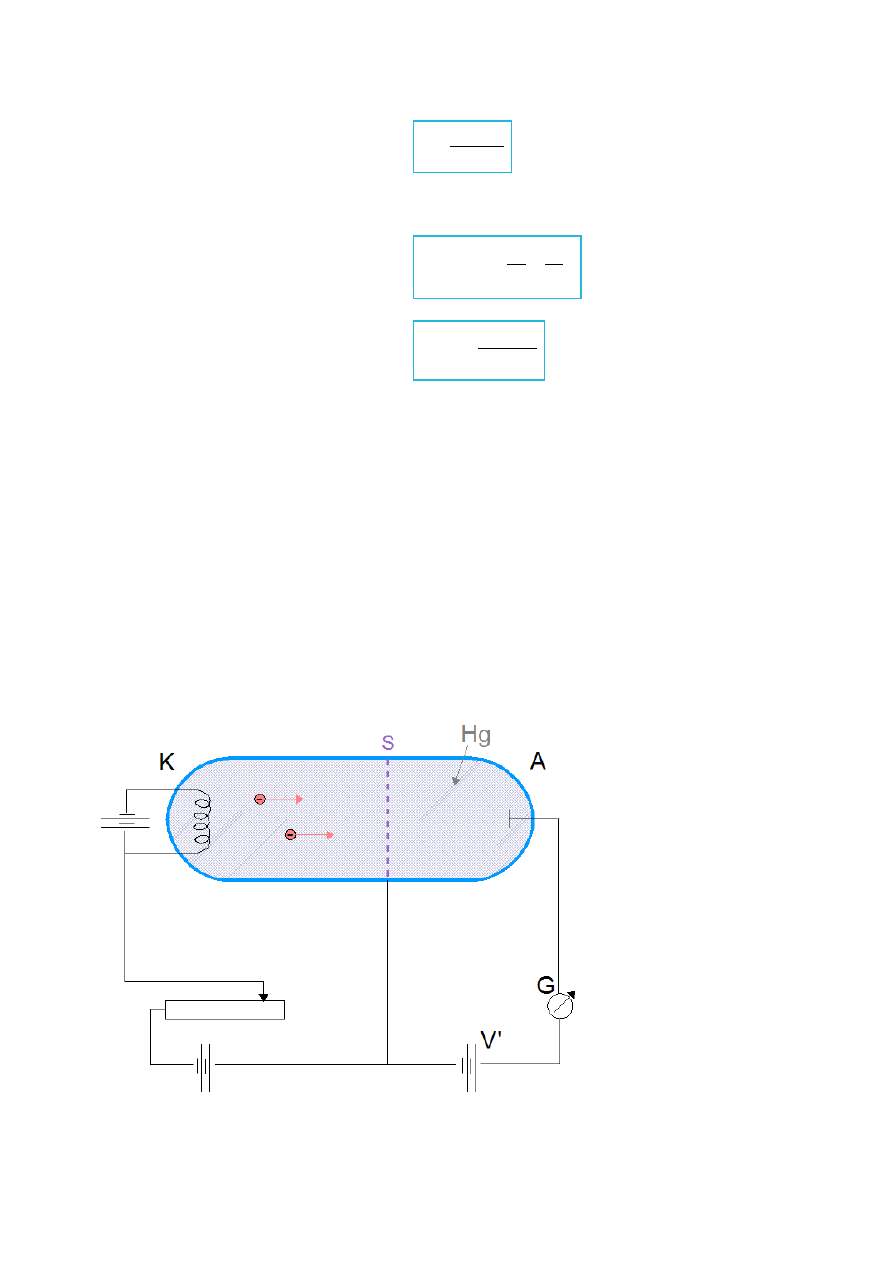
Rys.IV.10. Ilustracja doświadczenia Francka – Hertza. Bańka została wypełniona atomami Hg. S – siatka
(aby elektrony z katody K mogły przelecieć do anody A) służąca jako dodatkowa elektroda. Pomiędzy siatką
– 12 –
K.Czopek, M.Zazulak – Notatki w internecie. Wstęp do fizyki atomowej i kwantowej.
S a anodą A – potencjał hamujący V'.
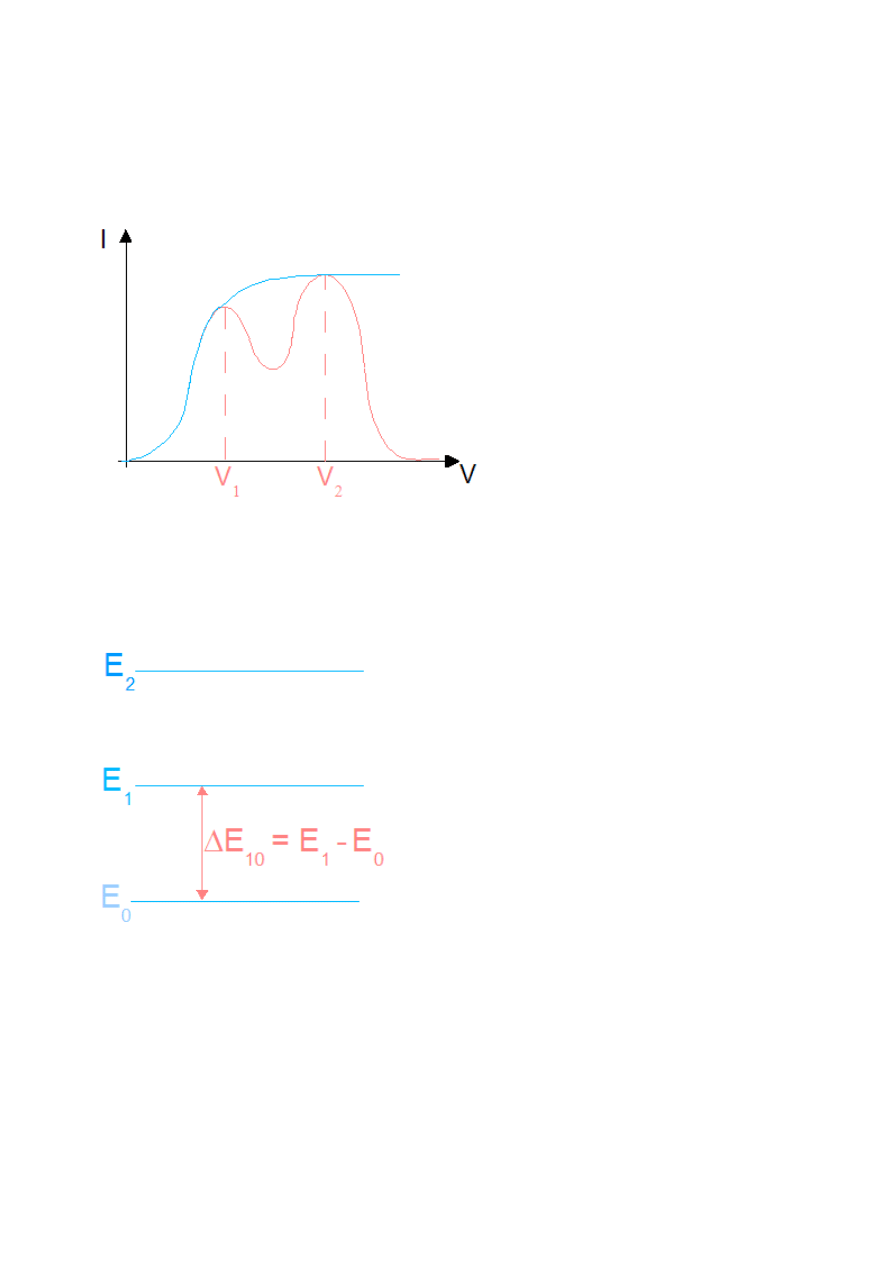
Rys.IV.11. Wykres niebieski – jeżeli stany atomów są skwantowane możliwe jest tylko pokazanie
odpowiedniej dawki energii (ukazuje jak zmieniałoby się natężenie gdyby w bańce była próżnia i elektrony
nie zderzały się z atomami Hg, lub też gdyby te zderzenia były sprężyste). Wykres czerwony – ilustruje
rzeczywisty przebieg zależności (przy zderzeniach niesprężystych część energii jest przekazywana przez
elektrony atomom rtęci.)
E
k
≠ ∆ E
10
E
k
=eV
∆ E
k
= ∆ E
10
eV
1
=∆ E
10
eV
2
=∆ E
20
V
1
=4,9 eV
Rys.IV.12. Schemat poziomów energetycznych układu skwantowanego.
–
W charakterystyce i – V obserwujemy skoki (piki) związane ze wzbudzeniem atomów
Hg do coraz wyższych potencjałów energetycznych
–
doświadczenie pokazuje w sposób jakościowy oraz ilościowy (można wyliczyć), że
atom jest układem skwantowanym
Przy napięciu V
1
wzbudzenie do E
1
, przy V
2
wzbudzenie do E
2.
– 13 –
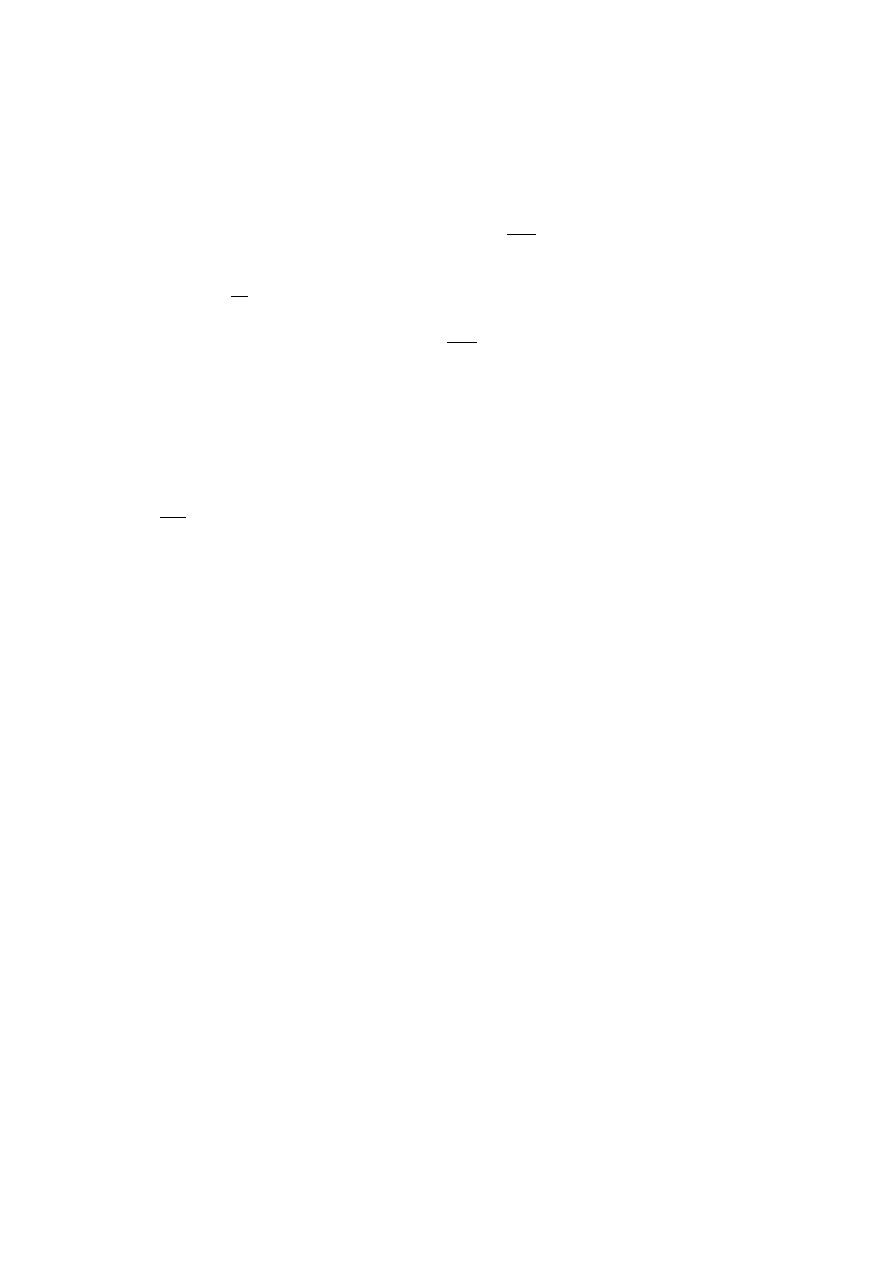
K.Czopek, M.Zazulak – Notatki w internecie. Wstęp do fizyki atomowej i kwantowej.
Jeżeli znamy napięcie pierwszego piku
V
1
=4,9 eV ,
to możemy obliczyć częstość f
1
:
eV
1
=hf
1
→ f
1
=
eV
1
h
A ponieważ f
1
=
c
1
, to możemy obliczyć długość fali
λ
1
:
1
=
hc
eV
1
Z teorii dostajemy
1
=2530 Å UV
Z doświadczenia Francka – Hertza
1
FH
=2537 Å
A zatem
∆
≈0,3%
Doświadczenie to potwierdza słuszność teorii Bohra.
– 14 –
Document Outline
Wyszukiwarka
Podobne podstrony:
03 Model Bohra atomu wodoru Z
1 Budowa atomu model Bohra cw 11
Model Bohra budowy atomu, Radosna Tfurczość Własna, referaty pół-moje
Model budowy atomu wodoru postulaty Bohra
Model Bohra budowy atomu wodoru
Model budowy atomu Bohra
9Efekt Comptona i model budowy atomu wg bohra
Model budowy atomu wodoru postulaty Bohra
28 04 2013 cw id 31908 Nieznany
04 Egzamin Poprawkowy 2010 201 Nieznany (2)
5 Teoria pasmowa ciala stalego Nieznany (2)
04 metoda dobrego startu zajec Nieznany
A4 tabelka Model id 49824 Nieznany (2)
04 Melosik To samo supermarke Nieznany
PKM Model Fenomenologicznyv3 id Nieznany
dach Model id 130818 Nieznany
1 teoria 1i 2 2id 9964 Nieznany
9 04 2014 Linert id 48152 Nieznany (2)
więcej podobnych podstron