
Podstawy Chemii Nieorganicznej
Ć
wiczenia laboratoryjne
kod kursu:
CHC 0120
ZWIĄZKI KOMPLEKSOWE
Opracowanie
:
Ewa Matczak-Jon
WPROWADZENIE
Zwi
ą
zki zło
ż
one z atomu centralnego, zazwyczaj atomu metalu, i poł
ą
czonych z nim innych
atomów lub grup atomów (ligandów) nazywamy zwi
ą
zkami koordynacyjnymi, zwi
ą
zkami komplek-
sowymi lub kompleksami. Zwi
ą
zki koordynacyjne mog
ą
wyst
ę
powa
ć
jako jony kompleksowe
ujemne, jak [Fe(NCS)
6
]
3-
, [CoCl
6
]
3-
,
jony dodatnie jak [Ni(H
2
O)
6
]
2+
[Ag(NH
3
)
2
]
+
, a tak
ż
e jako oboj
ę
t-
ne kompleksy, np. [PtCl
2
(NH
3
)
2
]. Bez wzgl
ę
du na to czy kompleks jest jonem czy cz
ą
steczk
ą
obo-
j
ę
tn
ą
, jednostk
ę
koordynacyjn
ą
składaj
ą
c
ą
si
ę
z atomu centralnego i ligandów przy zapisie nale
ż
y
wyodr
ę
bni
ć
przez umieszczenie jej w nawiasie kwadratowym. Sumaryczny ładunek jednostki ko-
ordynacyjnej (kompleksu) jest równy sumie ładunków atomu centralnego i ligandów tworz
ą
cych
kompleks.
Atom centralny jest tym atomem w kompleksie, który zajmuj
ą
c pozycj
ę
centraln
ą
wi
ąż
e in-
ne atomy lub grupy atomów. Atomami centralnymi w [Fe(NCS)
6
]
3-
, [CoCl
6
]
3-
,
[Ni(H
2
O)
6
]
2+
,
[Ag(NH
3
)
2
]
+
, [PtCl
2
(NH
3
)
2
] s
ą
wi
ę
c odpowiednio atomy:
ż
elaza, kobaltu, niklu, srebra i platyny.
Wi
ą
zanie pomi
ę
dzy atomem centralnym a ligandem nazywamy wi
ą
zaniem koordynacyjnym.
Utworzenie wi
ą
zania koordynacyjnego jest mo
ż
liwe gdy ligand rozporz
ą
dza wolnymi parami elek-
tronowymi, a atom centralny pustymi orbitalami atomowymi, które mog
ą
te pary przyj
ąć
. Z punktu
widzenia teorii kwasów i zasad Lewisa ligand (donor pary lub par elektronowych) jest zasad
ą
.
Atom centralny (akceptor par elektronowych) jest kwasem. I tak np. w jonie kompleksowym
[Fe(NCS)
6
]
3-
jon Fe
3+
jest kwasem Lewisa, natomiast ka
ż
dy ligand (jon NCS
-
) jest zasad
ą
Lewisa.
Wi
ą
zanie koordynacyjne jest silniejsze od jonowego ale słabsze od kowalencyjnego.
Ligandami mog
ą
by
ć
zarówno cz
ą
steczki oboj
ę
tne (NH
3
, H
2
O, CO, en) jak i aniony (Cl
-
, F
-
Br
-
, CN
-
, SCN
-
, ox
2-
, acac
-
) dostarczaj
ą
c jednego, dwu lub wi
ę
cej atomów donorowych do utwo-
rzenia wi
ą
zania koordynacyjnego. Ligandy dostarczaj
ą
ce jednego atomu donorowego nazywamy
jednokleszczowymi. W przypadku gdy ligand koordynuje do atomu centralnego u
ż
ywaj
ą
c równo-
cze
ś
nie dwu lub wi
ę
cej atomów donorowych mówimy o ligandach chelatowych lub kleszczowych,
a proces koordynacji nazywamy chelatowaniem.
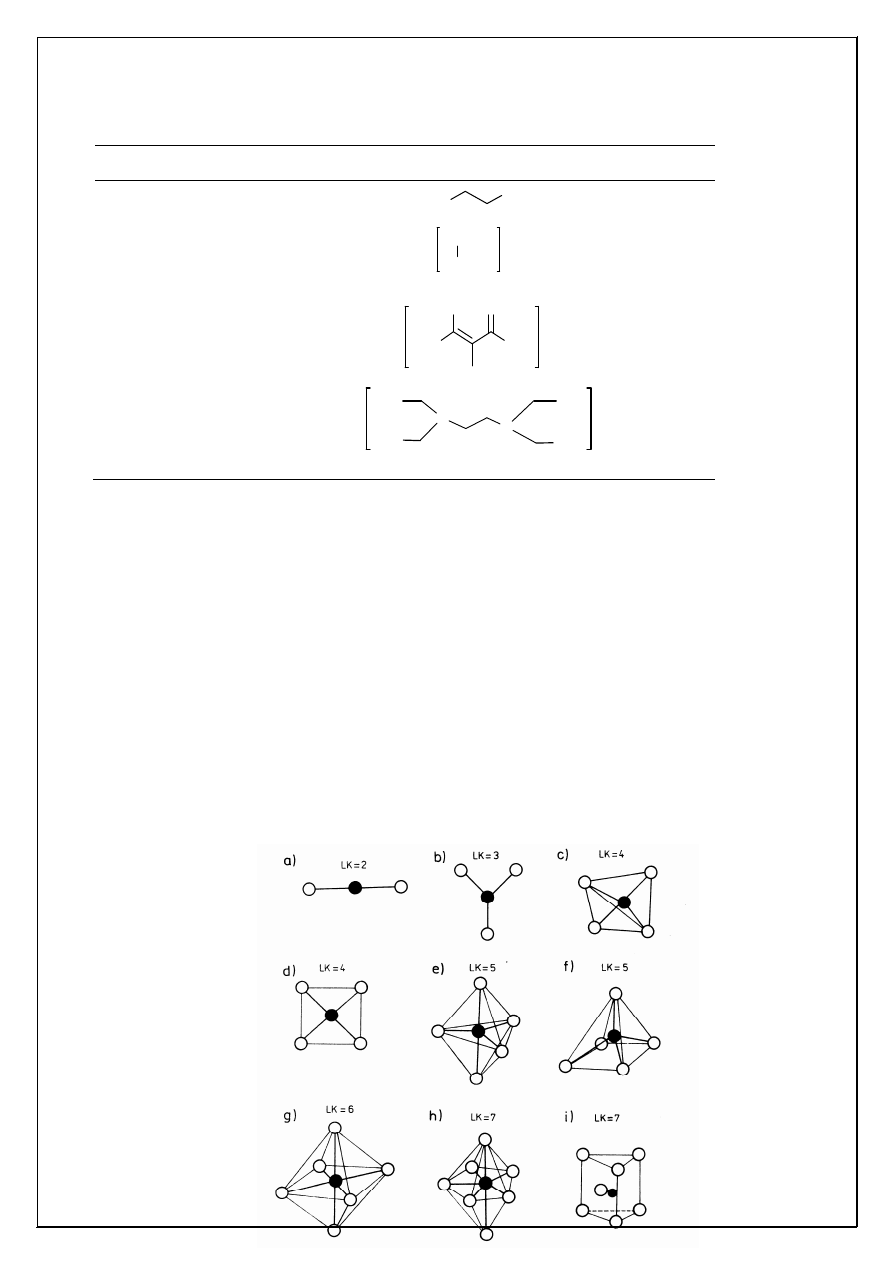
*
2
Przykłady ligandów chelatowych
nazwa
wzór
(*)
oznaczenie
etylenodiamina
en
jon szczawianowy
(C
2
O
4
)
2-
ox
jon acetyloacetonianowy
acac
jon kwasu etylenodiaminate-
traoctowego
N
N
COO
COO
OOC
OOC
:
:
:
:
:
:
4-
EDTA
(*)
pary elektronowe tworz
ą
ce wi
ą
zania koordynacyjne wskazano za pomoc
ą
dwukropka umieszczonego we wzorach
strukturalnych ligandów
Liczb
ę
atomów donorowych poł
ą
czonych bezpo
ś
rednio z atomem centralnym nazywamy
liczb
ą
koordynacji lub liczb
ą
koordynacyjn
ą
(L.K). Kompleksy o liczbie koordynacji 6 s
ą
najcz
ę
-
ś
ciej spotykanymi kompleksami jonów metali grup przej
ś
ciowych. Liczba koordynacji 4 jest rów-
nie
ż
cz
ę
sto spotykana, szczególnie w kompleksach jonów metali przej
ś
ciowych o du
ż
ej liczbie
elektronów na orbitalach typu d. Zwi
ą
zki o L.K = 4 spotyka si
ę
te
ż
w kompleksach kationów grup
głównych np. [AlF
4
]
-
,
[BF
4
]
-
. Liczba koordynacji 2 spotykana jest gdy jonami centralnymi s
ą
Ag
+
czy
Au
+
,
np. [Ag(NH
3
)
2
]
+
, [Ag(CN)
2
]
-
, [Au(CN)
2
]
-
. Zwi
ą
zki kompleksowe o wi
ę
kszych liczbach koordyna-
cji (7, 8, 9) spotykane s
ą
rzadziej, wtedy gdy atomy centralne wykazuj
ą
du
ż
e rozmiary.
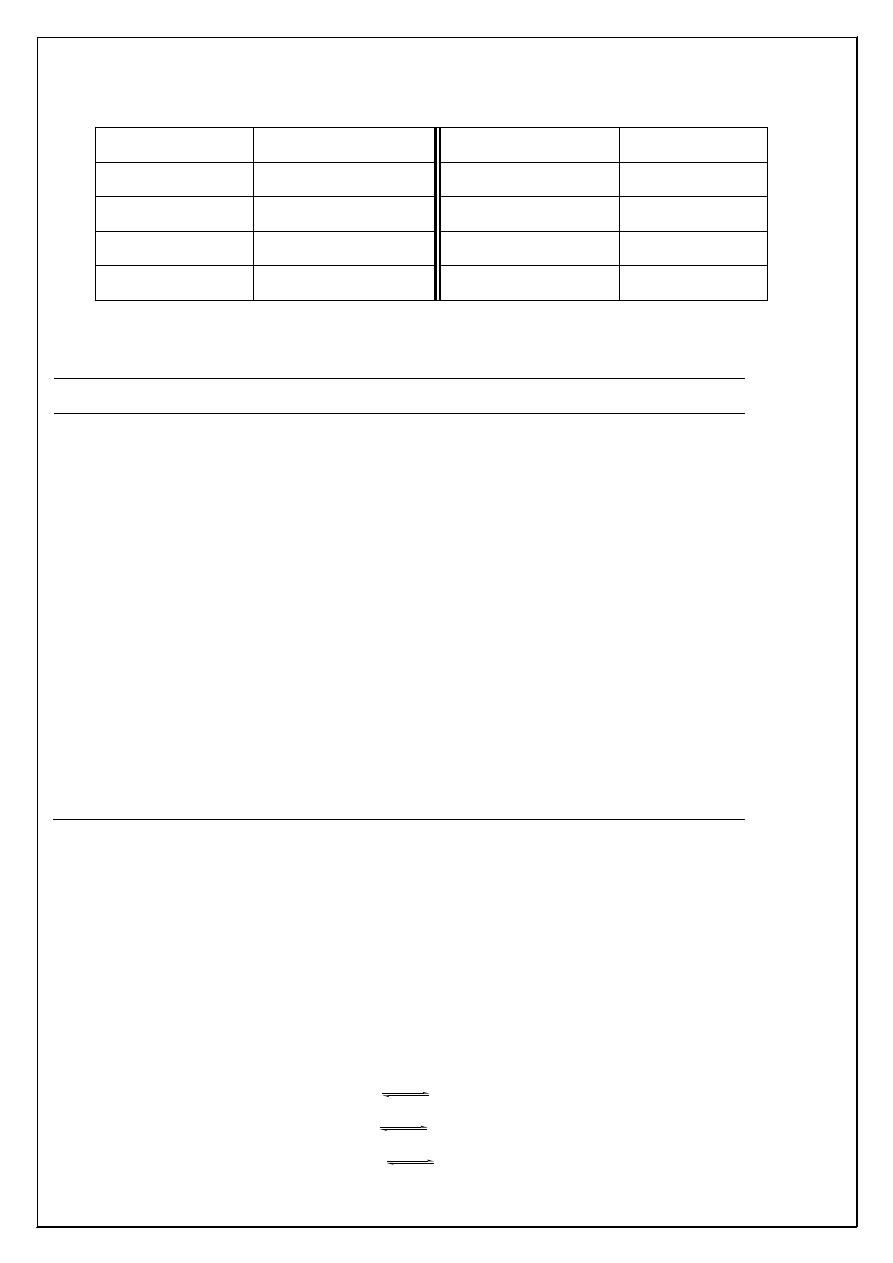
Typowe geometrie koordynacyjne oraz przykłady kompleksów jedno-i dwukleszczowych
H
2
N
NH
2
..
..
COO
COO
..
..
2-
H
3
C
CH
3
O
O
H
..
..
-

*
3
Ogólnie przyjmuje si
ę
,
ż
e atomy liganda zwi
ą
zane bezpo
ś
rednio z atomem centralnym
okre
ś
laj
ą
wielo
ś
cian koordynacyjny wokół tego atomu. Tak wi
ę
c jony [Fe(NCS)
6
]
3-
i [Ni(en)
3
]
2+
s
ą
jonami oktaedrycznymi, jon [Co(NCS)
4
]
2-
jest jonem tetraedrycznym, [PtCl
4
]
2-
jest jonem płaskim
kwadratowym a jon [HgI
3
]
-
ma otoczenie trygonalne.
Nomenklatura zwi
ą
zków kompleksowych
(a) Przy zapisie wzorów chemicznych zwi
ą
zków kompleksowych atom centralny wymienia si
ę
jako
pierwszy. Ligandy zapisuje si
ę
w kolejno
ś
ci: ligandy anionowe uło
ż
one w porz
ą
dku alfabetycz-
nym, ligandy oboj
ę
tne w porz
ą
dku alfabetycznym. Wzór całego kompleksu zamyka si
ę
w kwa-
dratowych klamrach. Je
ś
li ligandy s
ą
wieloatomowe ich wzory zamyka si
ę
w nawiasach okr
ą
-
głych. Istnieje zwyczaj przedstawiania wzoru liganda tak, aby jego atom donorowy był najbli
ż
ej
atomu centralnego, np. w przypadku jonu tiocyjanianowego: SCN
-
,
który mo
ż
e koordynowa
ć
jako jon :SCN
-
i :NCS
-
odpowiednio: [Fe(NCS)
6
]
3-
i [Hg(SCN)
4
]
2-
.
Je
ś
li podaje si
ę
wzór jonu
kompleksowego bez towarzysz
ą
cego mu przeciw-jonu, ładunek jonu pisze si
ę
na zewn
ą
trz
klamry kwadratowej jako prawy górny wska
ź
nik, np. [Cr(H
2
O)
6
]
3+
. Mo
ż
na wskaza
ć
stopie
ń
utlenienia atomu centralnego za pomoc
ą
cyfry rzymskiej umieszczonej jako prawy górny
wska
ź
nik przy symbolu pierwiastka, np. [Cr
III
Cl
3
(H
2
O)
3
]. Wzór zapisujemy bez odst
ę
pów po-
mi
ę
dzy symbolami lub wzorami poszczególnych jonów.
(b) Podaj
ą
c nazw
ę
kompleksu ligandy wymieniamy w porz
ą
dku alfabetycznym przed nazw
ą
ato-
mu centralnego bez wzgl
ę
du na ładunek liganda. Do wskazania liczby ligandów w otoczeniu
atomu centralnego stosuje si
ę
proste przedrostki: di-, tri-, tetra-, penta-, heksa-, np.
[FeF(H
2
O)
5
]
2+
: jon pentaakwafluoro
ż
elaza(III), [Ni(H
2
O)
2
(NH
3
)
4
]
2+
, jon diakwatetraaminani-
klu(II), [PdCl
4
]
2-
: tetrachloropalladan(II). Stopie
ń
utlenienia atomu centralnego wskazuje si
ę
przez doł
ą
czenie do nazwy atomu centralnego liczby utlenienia pisanej cyframi rzymskimi.
Liczb
ę
t
ą
umieszcza si
ę
w nawiasie okr
ą
głym. Przedrostki bis-, tris-, tetrakis stosuje si
ę
przy
wyra
ż
eniach zło
ż
onych lub jako przedrostki zwielokratniaj
ą
ce. Wtedy nazw
ę
, która ma by
ć
mno
ż
ona umieszcza si
ę
w nawiasie, np. [PtCl
2
(NH
2
CH
3
)
2
]: dichlorobis(metyloamina)platyna(II).
Nie zostawia si
ę
odst
ę
pów pomi
ę
dzy liczb
ą
utlenienia a reszt
ą
nazwy.
(c) Nazywaj
ą
c kompleksy anionowe do nazwy atomu centralnego dodajemy ko
ń
cówk
ę
–an, np.
[Fe(CN)
6
]
4-
: heksacyjano
ż
elazian(II); [PtCl
4
]
2-
: tetrachloroplatynian(II).
W kompleksach kationowych podaje si
ę
niezmienion
ą
nazw
ę
jonu centralnego, np.
[Cu(H
2
O]
6
2+
: jon heksaakwamiedzi(II), [Cr(H
2
O)
6
]
3+
:
jon heksaakwachromu(III).
W kompleksach oboj
ę
tnych nazwa kationu nie odmienia si
ę
, np. [PtCl
2
(NH
3
)
2
]: diaminadichlo-
roplatyna(II), [Fe(NCS)
3
(H
2
O)
3
]: triakwatritiocyjaniano
ż
elazo(III).
(d) Nazwy ligandów anionowych w kompleksach ko
ń
cz
ą
si
ę
na –o. Nazwy ligandów oboj
ę
tnych
lub kationowych stosuje si
ę
bez zmiany i umieszcza w nawiasach. Wyj
ą
tek stanowi
ą
akwa,
Fe
SCN
SCN
NCS
NCS
NCS
NCS
NCS
Co
SCN
NCS
NCS
[Fe(NCS)
6
]
3-
[Co(NCS)
4
]
2-
Ni
H
2
N
H
2
N
NH
2
NH
2
H
2
N
H
2
N
[Ni(en)
3
]
2+
Pt
Cl
Cl
Cl
Cl
[PtCl
4
]
2-
I
Hg
I
I
[HgI
3
]
-
*
4
amina, karbonyl i nityrozyl.
Nazwy niektórych ligandów nieorganicznych
OH
-
hydrokso
Cl
-
chloro
O
2-
okso (oksydo)
C
2
O
4
2-
szczawiano
S
2-
tio (sufido)
H
2
O
akwa
CN
-
cyjano
NH
3
amina
NCS
-
tiocyjaniano
CO
karbonyl
Przykłady wzorów i nazw niektórych kompleksów
Równowagi zwi
ą
zków kompleksowych w roztworach wodnych
W wodzie jony metali wyst
ę
puj
ą
wył
ą
cznie w postaci uwodnionej jako akwakationy (M
n+
(aq)
).
Liczba zwi
ą
zanych cz
ą
steczek wody determinowana jest przez liczb
ę
koordynacji typow
ą
dla da-
nego kationu. Tworzenie si
ę
jonów kompleksowych w roztworze jest stopniow
ą
wymian
ą
cz
ą
ste-
czek H
2
O z otoczenia koordynacyjnego atomu centralnego na inne ligandy. Ustala si
ę
przy tym
szereg równowag zale
ż
nych od st
ęż
enia wprowadzanego liganda.
Gdy do roztworu [Cu(H
2
O)
6
]
2+
dodajemy st
ęż
ony amoniak podstawienie cz
ą
steczek amonia-
ku odbywa si
ę
przez stopniow
ą
eliminacj
ę
cz
ą
steczek wody z akwakompleksu:
[Cu(H
2
O)
6
]
2+
+ NH
3
[Cu(H
2
O)
5
(NH
3
)]
2+
+ H
2
O
(1)
[Cu(H
2
O)
5
(NH
3
)]
2+
+ NH
3
[Cu(H
2
O)
4
(NH
3
)
2
]
2+
+ H
2
O
(2)
[Cu(H
2
O)
4
(NH
3
)
2
]
2+
+ NH
3
[Cu(H
2
O)
3
(NH
3
)
3
]
2+
+ H
2
O
(3)
wzór
nazwa
[Co(NH
3
)
6
]
2+
jon heksaaminakobaltu(II)
[Co(NH
3
)
6
]Cl
3
chlorek heksaaminakobaltu(III)
[CoCl(NH
3
)
5
]
+
jon pentaaminachlorokobaltu(II)
[Co(H
2
O)
2
(NH
3
)
4
]
2+
jon diakwatetraaminakobaltu(II)
[CoCl
4
]
2-
tetrachlorokobaltan(II)
[K
4
(Fe(CN)
6
]
heksacyjano
ż
elazian(II) potasu
[Cr(NCS)
4
(NH
3
)
2
]
-
diaminatetratiocyjanianochromian(III)
K
2
[Co(NCS)
4
]
tetratiocyjanianokobaltan(II) potasu
[Hg(SCN)
4
]
2-
tetratiocyjanianort
ę
cian(II)
[CrCl
3
(H
2
O)
3
]
triakwatrichlorochrom(III)
K
2
[PdCl
4
]
tetrachloropalladan(II) potasu
Ni(en)
3
2+
jon tris(etylenodiamina)niklu(II)

*
5
[Cu(H
2
O)
3
(NH
3
)
3
]
2+
+ NH
3
[Cu(H
2
O)
2
(NH
3
)
4
]
2+
+ H
2
O
(4)
Wszystkie przedstawione wy
ż
ej równowagi s
ą
ze sob
ą
ś
ci
ś
le powi
ą
zane co oznacza,
ż
e
zakłócenie jednej z nich powoduje zakłócenie pozostałych. Jon [Cu(H
2
O)]
6
2+
pozostaje w równo-
wadze nie tylko z jonem [Cu(H
2
O)
5
(NH
3
)]
2+
ale równie
ż
z amoniakiem i wod
ą
oraz z pozostałymi
jonami kompleksowymi: ([Cu(H
2
O)
4
(NH
3
)
2
]
2+
, [Cu(H
2
O)
3
(NH
3
)
3
]
2+
,
[Cu(H
2
O)
2
(NH
3
)
4
]
2+
). Dodanie
stosunkowo niewielkiej ilo
ś
ci amoniaku do roztworu zawieraj
ą
cego jony [Cu(H
2
O)
6
]
2+
powoduje,
ż
e
tworz
ą
si
ę
głównie jony kompleksowe [Cu(H
2
O)
5
(NH
3
)]
2+
.
Dodawanie kolejnych porcji amoniaku
przesuwa stan równowagi reakcji nast
ę
pczych (1)
÷
(4) w kierunku tworzenia [Cu(H
2
O)
2
(NH
3
)
4
]
2+
.
Przy zało
ż
eniu
ż
e st
ęż
enie wody jest stałe, stopniowe stałe trwało
ś
ci dla kompleksów powstaj
ą
-
cych w reakcjach (1)
÷
(4) mo
ż
na wyrazi
ć
nast
ę
puj
ą
co:
]}
}{[NH
]
O)
{[Cu(H
}
)]
(NH
O)
{[Cu(H
K
3
2
6
2
2
3
5
2
1
+
+
=
(1-a)
K
1
= 1,4 x 10
4
]}
}{[NH
)]
(NH
O)
{[Cu(H
}
]
)
(NH
O)
{[Cu(H
K
3
2
3
5
2
2
2
3
4
2
2
+
+
=
(2-a)
K
2
=3,1 x 10
3
]}
}{[NH
]
)
(NH
O)
{[Cu(H
}
]
)
(NH
O)
{[Cu(H
K
3
2
2
3
4
2
2
3
3
3
2
3
+
+
=
(3-a)
K
3
=8,0 x 10
2
]}
}{[NH
]
)
(NH
O)
{[Cu(H
}
]
)
(NH
O)
{[Cu(H
K
3
2
3
3
3
2
2
4
3
2
2
4
+
+
=
(4-a)
K
4
=1,35 x 10
2
Wyra
ż
enia w nawiasach klamrowych odpowiadaj
ą
st
ęż
eniom molowym odpowiednich jonów
kompleksowych, akwajonu metalu i liganda.
Im wy
ż
sza jest warto
ść
liczbowa stałej równowagi dla danej reakcji tym wi
ę
ksze jest st
ęż
e-
nie powstaj
ą
cego kompleksu, a wi
ę
c jego trwało
ść
. Porównuj
ą
c stałe K
1
, K
2
, K
3
i K
4
mo
ż
na łatwo
zauwa
ż
y
ć
,
ż
e z atomem centralnym najsilniej zwi
ą
zany jest pierwszy ligand, kolejne ligandy wi
ą
-
zane s
ą
coraz słabiej. Główn
ą
przyczyn
ą
zmniejszania si
ę
stałych trwało
ś
ci w miar
ę
przył
ą
czania
kolejnych ligandów s
ą
wzgl
ę
dy statystyczne.
Je
ś
li rozpatrzy
ć
równowag
ę
opisan
ą
reakcj
ę
sumaryczn
ą
:
[Cu(H
2
O)
6
]
2+
+ 4 NH
3
[Cu(H
2
O)
2
(NH
3
)
4
]
2+
+ 4 H
2
O
to wówczas stał
ą
równowagi dla tej reakcji mo
ż
na zapisa
ć
jako:
4
3
2
6
2
2
4
3
2
2
4
]}
}{[NH
]
O)
{[Cu(H
}
]
)
(NH
O)
{[Cu(H
β
+
+
=
Stał
ą
β
4
nazywamy skumulowan
ą
stał
ą
trwało
ś
ci. Mo
ż
na j
ą
wyznaczy
ć
mno
żą
c przez siebie stro-
nami wyra
ż
enia (1-a)
÷
(4-a). Otrzymujemy wówczas
β
4
= K
1
⋅
K
2
⋅
K
3
⋅
K
4
.

*
6
Ogólnie stałe
β
i
mo
ż
na wyrazi
ć
) jako:
i
i
aq
i
i
L
M
ML
]
][
[
]
[
)
(
=
β
W naszym przykładzie dla reakcji (1) skumulowana stała trwało
ś
ci
β
1
= K
1
,
dla reakcji : [Cu(H
2
O)
6
]
2+
+ 2 NH
3
[Cu(H
2
O)
4
(NH
3
)
2
]
2+
+ 2 H
2
O
β
2
= K
1
⋅
K
2
,
dla reakcji: [Cu(H
2
O)
6
]
2+
+ 3 NH
3
[Cu(H
2
O)
3
(NH
3
)
3
]
2+
+3 H
2
O
β
3
= K
1
⋅
K
2
⋅
K
3
.
W literaturze skumulowane stałe trwało
ś
ci podawane s
ą
najcz
ęś
ciej w postaci log
β
i
.
Porównuj
ą
c ze sob
ą
stałe trwało
ś
ci dwóch ró
ż
nych kompleksów o takim samym atomie
centralnym mo
ż
na przewidzie
ć
, który z nich b
ę
dzie trwalszy w danych warunkach. Na przykład
skumulowane stałe trwało
ś
ci log
β
i
dla kompleksów [Fe(NCS)
6
]
3-
i [FeF
3
(H
2
O)
3
] wynosz
ą
odpo-
wiednio log
β
6
= 6 i log
β
3
= 12.
Oznacza to,
ż
e po wprowadzeniu do roztworu zawieraj
ą
cego jony [Fe(NCS)
6
]
3-
odpowied-
niej ilo
ś
ci
jonów F
-
(np. przez dodanie stałego NH
4
F) kompleks ten ulegnie praktycznie całkowitej
przemianie w kompleks [FeF
3
(H
2
O)
3
]. Efekt ten jest łatwy do zaobserwowania, poniewa
ż
jon
[Fe(NCS)
6
]
3-
daje zabarwienie krwistoczerwone, natomiast kompleks [FeF
3
(H
2
O)
3
] jest bezbarwny.
Kompleksy chelatowe charakteryzuj
ą
si
ę
znacznie wi
ę
ksz
ą
trwało
ś
ci
ą
ni
ż
kompleksy z li-
gandami prostymi. Jest to w znacznym stopniu zwi
ą
zane z korzystn
ą
zmian
ą
entropii odpowiada-
j
ą
c
ą
usuni
ę
ciu ze sfery koordynacyjnej atomu centralnego ligandów niechelatuj
ą
cych, np. wody.
Jako przykład mo
ż
e posłu
ż
y
ć
reakcja chelatacji jonu niklu(II) przez sze
ś
ciokleszczowy ligand
EDTA:
[Ni(H
2
O)
6
]
2+
+ H
2
EDTA
2-
[Ni(EDTA)]
2-
+ 6 H
2
O + 2 H
+
log
β
1
= 18,56
Równanie pokazuje,
ż
e liczba cz
ą
steczek po reakcji jest wyra
ź
nie wi
ę
ksza ni
ż
przed reak-
cj
ą
. W czasie reakcji maleje wi
ę
c stopie
ń
uporz
ą
dkowania układu, a wi
ę
c wzrasta jego entropia.
EDTA tworzy bardzo trwałe kompleksy z wi
ę
kszo
ś
ci
ą
jonów metali, nawet z takimi jonami
jak Ca
2+
(log
β
1
= 10,70) czy Mg
2+
(log
β
1
= 8,69). Ta własno
ść
powoduje,
ż
e EDTA wykorzystywa-
ny jest w chemii analitycznej, m.in. w analizie miareczkowej: kompleksometrii. EDTA stosowany
jest te
ż
w medycynie do wi
ą
zania jonów metali, które w organizmie człowieka mog
ą
wyst
ę
powa
ć
w toksycznych ilo
ś
ciach. Dodaje si
ę
go równie
ż
do
ż
ywno
ś
ci jako
ś
rodek ograniczaj
ą
cy dost
ę
p
szkodliwych bakterii do metali, co zapobiega psuciu si
ę
ż
ywno
ś
ci.
LITERATURA
1. A. Biela
ń
ski „Podstawy chemii nieorganicznej”, Wydawnictwo Naukowe PWN, Warszawa 2002.
2. Nomenklatura chemii nieorganicznej, Zalecenia 1990, red. Z. Stasicka, Wydawnictwo Uniwersy-
tetu Wrocławskiego, Wrocław 1998.

7
Pytania kontrolne:
1. Podaj nazwy nast
ę
puj
ą
cych zwi
ą
zków i jonów kompleksowych: K
2
[PdCl
4
], [Ni(H
2
O)
2
(NH
3
)
4
]
2+
,
[Ag(CN)
2
]
-
, [FeF
2
(H
2
O)
4
]
+
, [CdCl
4
]
2-
[Pt(OH)(H
2
O)
3
]
+
2. Napisz wzory chemiczne nast
ę
puj
ą
cych jonów i zwi
ą
zków kompleksowych:
(a) jon pentaakwadiwodorofosforano
ż
elaza(III),
(b) diaminatetratiocyjanianochromian(III) sodu,
(c) dicyjanosrebrzan(I),
(d) chlorek diakwatetraaminakobaltu(III),
(e) jon diaminasrebra(I),
(f) jon heksaaminakobaltu(III),
(g) diaminadichloroplatyna(II),
(h) triakwatrifluoro
ż
elazo(III).
3. Podaj liczb
ę
koordynacji atomów centralnych w nast
ę
puj
ą
cych jonach i zwi
ą
zkach kompleksowych:
[Ni(en)
3
]
2+
, [PtCl
2
(NH
3
)
2
], [CoCl
2
(C
2
O
4
)
2
]
4-
,
[FeCl
2
(H
2
O)
2
(en)]
+
, [Ni(NH
3
)
6
]
2+
, [Ag(NH
3
)
2
]
+
.
4. Oblicz wyra
ż
enie na skumulowan
ą
stał
ą
trwało
ś
ci log
β
2
dla jonu kompleksowego [Ag(NH
3
)
2
]
+
wiedz
ą
c,
ż
e w układzie zawieraj
ą
cym jony Ag
+
,
do którego dodano st
ęż
ony amoniak, powstaj
ą
dwa jony kom-
pleksowe nast
ę
pcze: [Ag(NH
3
)]
+
i [Ag(NH
3
)
2
]
+
o stałych trwało
ś
ci odpowiednio K
1
= 2,5·10
3
i K
2
= 1·10
4
.
5. Skumulowane stałe trwało
ś
ci
β
2
dla jonów [Ag(NH
3
)
2
]
+
i [Ag(CN)
2
]
-
wynosz
ą
odpowiednio 1,62·10
7
i
1·10
27
. Który z jonów kompleksowych b
ę
dzie dominowa
ć
w roztworze zawieraj
ą
cym jony [Ag(NH
3
)
2
]
+
je
ż
eli do niego dodano nadmiar jonów CN
-
.

8
WYKONANIE DO
Ś
WIADCZE
Ń
Do
ś
wiadczenie 1. Barwy akwakompleksów i aminakompleksów
Odczynniki: Sole: siarczan kobaltu(II) (CoSO
4
), siarczan niklu(II) (NiSO
4
), siarczan miedzi(II)
(CuSO
4
), siarczan cynku(II) (ZnSO
4
). Roztwory: 2 M roztwór kwasu siarkowego(VI)
(H
2
SO
4
), 6 M roztwór amoniaku (NH
3
·H
2
O).
Cel
ć
wiczenia: Przeprowadzenie reakcji, w których powstaj
ą
jony kompleksowe:
[Cu(H
2
O)
2
(NH
3
)
4
]
2+
,
[Co(NH
3
)
6
]
2+
, [Ni(NH
3
)
6
]
2+
, [Zn(NH
3
)
6
]
2+
.
Dodanie stosunkowo małej ilo
ś
ci rozcie
ń
czonego roztworu NH
3
·H
2
O do roztworu, w którym obec-
ne s
ą
akwajony miedzi(II), kobaltu(II) i niklu(II) prowadzi do reakcji konkurencyjnej wzgl
ę
dem re-
akcji kompleksowania. Wytr
ą
ca si
ę
osad wodorotlenosoli, który nast
ę
pnie roztwarza si
ę
w nad-
miarze amoniaku np.:
2 [Cu(H
2
O)
6
]
2+
+2 SO
4
2-
+ 2 NH
3
·H
2
O
Cu
2
(OH)
2
SO
4
↓
+ 2 NH
4
+
+ SO
4
2-
+ 12 H
2
O
Cu
2
(OH)
2
SO
4
+ 8 NH
3
·H
2
O
2 [Cu(H
2
O)
2
(NH
3
)
4
]
2+
+ SO
4
2-
+ 2 OH
-
+ 4 H
2
O
Z kolei dodanie roztworu amoniaku do roztworu zawieraj
ą
cego jony [Zn(H
2
O)
6
]
2+
powoduje wytr
ą
-
canie osadu Zn(OH)
2
, który nast
ę
pnie roztwarza si
ę
w nadmiarze odczynnika:
Zn(OH)
2
+ 6 NH
3
·H
2
O
[Zn(NH
3
)
6
]
2+
+ 2 OH
-
+ 6 H
2
O
Wykonanie:
W czterech suchych probówkach umie
ść
po kilka kryształków bezwodnych soli CoSO
4
, Ni-
SO
4
, CuSO
4
i ZnSO
4
. Do ka
ż
dej probówki z sol
ą
dodaj około 1 cm
3
wody destylowanej i
kilka kropli H
2
SO
4
.
(* )
Zawarto
ść
probówek wymieszaj a
ż
do rozpuszczenia soli.
•
Zaobserwuj zmiany barwy soli przy przej
ś
ciu od soli bezwodnej do uwodnionej.
Do ka
ż
dej z probówek zawieraj
ą
cych roztwory soli dodawaj powoli NH
3
·H
2
O, w ilo
ś
ci wy-
starczaj
ą
cej do całkowitego wytr
ą
cenia, a nast
ę
pnie całkowitego roztworzenia powstaj
ą
-
cego osadu. Zawarto
ść
probówek w trakcie dodawania roztworu amoniaku nale
ż
y mie-
sza
ć
bagietk
ą
.
•
Zanotuj barwy roztworów w ka
ż
dej z probówek.
•
Zwró
ć
uwag
ę
na stopniow
ą
zmian
ę
zabarwienia w roztworze zawieraj
ą
cym jony
[Co(NH
3
)
6
]
2+
.
(
**)
Roztwór zwi
ą
zku kompleksowego miedzi(II) nale
ż
y pozostawi
ć
do dalszych
do
ś
wiadcze
ń
(do
ś
wiadczenie 4).
(*)
Jony Co
2+
(aq)
, Ni
2+
(aq)
, Cu
2+
(aq)
i Zn
2+
(aq)
s
ą
kationami słabych zasad. Aby unikn
ąć
ich hydrolizy roztwór
nale
ż
y zakwasi
ć
kilkoma kroplami H
2
SO
4
.
(**)
Jon [Co(NH
3
)
6
]
2+
jest bardzo nietrwały. Na powietrzu utlenia si
ę
do jonu heksaaminakobaltu(III).
4 [Co(NH
3
)
6
]
2+
+ 2 H
2
O + O
2
4 [Co(NH
3
)
6
]
3+
+ 4 OH
-
Opracowanie wyników:
•
Zapisz równania reakcji:
9
(a) dysocjacji elektrolitycznych badanych soli w roztworach wodnych,
(b) wytr
ą
cania osadów wodorotlenosoli kobaltu(II) i niklu(II) za pomoc
ą
NH
3
·H
2
O,
(c) roztwarzania osadów wodorotlenosoli: Co
2
(OH)
2
SO
4
i Ni
2
(OH)
2
SO
4
w nadmiarze
NH
3
·H
2
O,
(d) otrzymywania aminakompleksów z akwajonów kobaltu(II), niklu(II), miedzi(II) i cyn-
ku(II) przy zało
ż
eniu,
ż
e do roztworów dodano st
ęż
ony amoniak w nadmiarze wy-
starczaj
ą
cym do natychmiastowego utworzenia odpowiednich jonów komplekso-
wych.
•
Zapisz nazwy aminakompleksów.
•
Uzupełnij tabel
ę
wpisuj
ą
c odpowiednie formy chemiczne i barwy zwi
ą
zków :
sól bezwodna
barwa
akwajon
barwa
aminakompleks
barwa
NiSO
4
CuSO
4
ZnSO
4
[Co(NH
3
)
6
]
2+
CoSO
4
[Co(NH
3
)
6
]
3+
Do
ś
wiadczenie 2. Maskowanie jonów
Odczynniki: 0.3 M roztwór chlorku
ż
elaza(III) (FeCl
3
), 0.5 M roztwór chlorku kobaltu(II)
(CoCl
2
), stały tiocyjanian potasu (KSCN), stały fluorek amonu (NH
4
F), alkohol izo-
amylowy (3-metylo-1-butanol (CH
3
)
2
CHCH
2
CH
2
OH).
Cel
ć
wiczenia: Przeprowadzenie reakcji pozwalaj
ą
cej na wykrycie jonów kobaltu(II) w
obecno
ś
ci jonów
ż
elaza(III).
Reakcje kompleksowania pozwalaj
ą
ce zamaskowa
ć
jony przeszkadzaj
ą
ce stosowane s
ą
w celu
zwi
ę
kszenia selektywno
ś
ci odczynników stosowanych w reakcjach analitycznych. S
ą
one przykła-
dem jednego z wa
ż
niejszych zastosowa
ń
zwi
ą
zków kompleksowych w chemii analitycznej. Ma-
skowanie jonu przeszkadzaj
ą
cego polega na przeprowadzeniu go w wyniku reakcji komplekso-
wania z odpowiednim ligandem w odpowiednio trwały kompleks. Zwi
ą
zany w tej postaci jon jest
niezdolny do reakcji zakłócaj
ą
cej prawidłowy przebieg wykrywania innego jonu.
Zarówno jon Fe
3+
(aq)
jak i Co
2+
(aq)
reaguj
ą
w
ś
rodowisku wodnym z tiocyjanianem potasu daj
ą
c
barwne jony kompleksowe. Dla uproszczenia podano tylko te formy kompleksowe, których st
ęż
e-
nia w warunkach eksperymentu s
ą
najwy
ż
sze. Zwró
ć
uwag
ę
,
ż
e ich stałe trwało
ś
ci log
β
1
s
ą
zbli-
ż
one.
[Fe(H
2
O
6
)]
3+
+ NCS
-
[Fe(NCS)(H
2
O)
5
]
2+
+ H
2
O
log
β
1
= 2.14
[Co(H
2
O)
6
]
2+
+ NCS
-
[Co(NCS)(H
2
O)
5
]
+
+ H
2
O
log
β
1
= 1.87
Jony F
-
reaguj
ą
z [Fe(H
2
O)
6
]
3+
daj
ą
c bezbarwny jon kompleksowy bardziej trwały ni
ż
jon
[Fe(NCS)(H
2
O)
5
]
2+
Pozwala to wykry
ć
jony kobaltu(II) w obecno
ś
ci jonów
ż
elaza(III) za pomoc
ą
reakcji z tiocyjanianem potasu.
10
Wykonanie:
W jednej probówce umie
ść
odpowiednio 1-2 krople roztworu FeCl
3
, a w drugiej 4-5 kropli
roztworu CoCl
2
, do obu dodaj po około 2 cm
3
H
2
O. Do ka
ż
dego roztworu dodaj ostro
ż
nie
porównywaln
ą
ilo
ść
(szczypt
ę
) stałego KSCN.
•
Zaobserwuj barwy obu roztworów.
Do probówki (1) zawieraj
ą
cej [Fe(NCS)(H
2
O)
5
]
2+
dodaj stały NH
4
F, do odbarwienia roztwo-
ru.
•
W jakiej formie zwi
ą
zane s
ą
teraz jony
ż
elaza(III) ?
Do probówki (2) zawieraj
ą
cej [Co(NCS)(H
2
O)
5
]
+
dodaj alkohol izoamylowy
(*
)
i energicznie
wstrz
ą
saj.
•
Jakie zmiany obserwujesz?
Probówk
ę
z zawarto
ś
ci
ą
pozostaw do porównania.
W kolejnej probówce (3) zmieszaj 1-2 krople roztworu FeCl
3
i 4-5 kropli roztworu CoCl
2
,
dodaj ok. 2 cm
3
wody a nast
ę
pnie tak
ą
jak poprzednio ilo
ść
stałego KSCN.
•
Zanotuj barw
ę
roztworu.
•
Zamaskuj
ż
elazo(III), jaka powinna by
ć
barwa roztworu po wykonaniu tej reakcji?
Dodaj alkoholu izoamylowego aby wykry
ć
obecno
ść
jonów [Co(NCS)
4
]
2-
.
•
Porównaj barwy roztworów z probówek (2) i (3).
(*)
alkohol izoamylowy ułatwia wymian
ę
c
żą
steczek wody w otoczeniu Co
2+
(aq)
na jony SCN
-
, co prowadzi do
powstania pewnej ilo
ś
ci trwałych jonów [Co(NCS)
4
]
2-
(log
β
4=7,94)
Opracowanie wyników:
•
Na czym polega maskowanie jonów w chemii analitycznej.
•
Zapisz równania reakcji zachodz
ą
cych w probówce (3).
•
Uzupełnij tabel
ę
wpisuj
ą
c odpowiednie nazwy i barwy jonów kompleksowych.
Do
ś
wiadczenie 3. Zwi
ą
zki kompleksowe
ż
elaza(III)
(wykona
ć
w grupach 2-3 osobowych)
Odczynniki: Sole: 9
⋅⋅⋅⋅
hydrat azotanu
ż
elaza(III) (Fe(NO
3
)
3
·9H
2
O), chlorek sodu (NaCl), fluorek
amonu (NH
4
F), heksacyjano
ż
elazian(II) potasu (K
4
[Fe(CN)
6
]). Roztwory: 85% kwas fos-
forowy(V) (H
3
PO
4
), 2 M roztwór kwasu azotowego(V) (HNO
3
), 1 M roztwór tiocyjanianu
potasu (KSCN).
Cel
ć
wiczenia: W do
ś
wiadczeniu nale
ż
y przeprowadzi
ć
szereg reakcji wymiany, w których
kolejno b
ę
d
ą
powstawa
ć
zwi
ą
zki kompleksowe z jonami
ż
elaza(III).
jon kompleksowy
nazwa
barwa
[Fe(NCS)(H
2
O)
5
]
2+
[FeF(H
2
O)
5
]
2+
[Co(NCS)(H
2
O)
5
]
+
[Co(NCS)
4
]
2-
11
Schemat wykonania reakcji jest nast
ę
puj
ą
cy:
[Fe(H
2
O)
6
]
3+
+ X
-
[FeX(H
2
O)
5
]
2+
+ H
2
O (1)
[FeX(H
2
O)
5
]
2+
+ Y
-
[FeY(H
2
O
5
)]
2+
+ X
-
(2)
X
-
, Y
-
= Cl
-
, F
-
, NCS
-
, H
2
PO
4
-
Ostatnim zwi
ą
zkiem kompleksowym uzyskanym w cyklu reakcji b
ę
dzie kompleks Fe
4
[Fe(CN)
6
]
3
wytr
ą
caj
ą
cy si
ę
w postaci ciemnoniebieskiego osadu.
Wykonanie:
Ć
wiczenie nale
ż
y wykona
ć
w zlewce o pojemno
ś
ci co najmniej 250 cm
3
.
Dodaj szczypt
ę
stałego Fe(NO
3
)
3
·9H
2
O, a nast
ę
pnie rozpu
ść
sól w obj
ę
to
ś
ci ok. 100 cm
3
wody destylowanej. Porównaj barw
ę
roztworu z danymi w tabeli poni
ż
ej.
(*)
Dodaj ostro
ż
nie
kilka kropli 2 M HNO
3
aby cofn
ąć
hydroliz
ę
jonu [Fe(OH)(H
2
O)
5
]
2+
(patrz tabela).
Analizuj
ą
c stałe log
β
1
ustal kolejno
ść
dodawania do roztworu odpowiednio : NaCl, NH
4
F,
KNCS i H
3
PO
4
w taki sposób, aby otrzyma
ć
wszystkie jony kompleksowe z ligandami
X
-
i Y
-
umieszczone w tabeli:
jon
log
β
1
barwa
[Fe(OH)(H
2
O)
5
]
2+
ż
ółto-czerwony
Fe(H
2
O)
6
3+
bezbarwny
[FeCl(H
2
O)
5
]
2+
0,63
ż
ółty
[FeF(H
2
O)
5
]
2+
5,16
bezbarwny
[Fe(NCS)(H
2
O)
5
]
2+
2,14
czerwony
[Fe(H
2
PO
4
)(H
2
O)
5
]
2+
1,33
bezbarwny
(*)
[Fe(H
2
O)
6
]
3+
+ H
2
O
[Fe(OH)(H
2
O)
5
]
2+
+ H
3
O
+
Wykonaj reakcje w zaplanowanej kolejno
ś
ci. Po wykonaniu ostatniej reakcji dodaj do roz-
tworu stały K
4
[Fe(CN)
6
] aby otrzyma
ć
Fe
4
[Fe(CN)
6
]
3.
W czasie przeprowadzania wszystkich reakcji roztwór w zlewce nale
ż
y miesza
ć
bagietk
ą
.
Ka
ż
dy z kolejnych odczynników dodawaj ostro
ż
nie (szpachelk
ą
lub wkraplaj
ą
c), do poja-
wienia si
ę
pierwszej zmiany barwy zgodnie z tabel
ą
. Unikaj nadmiaru, szczególnie nadmia-
ru jonów F
-
, które mog
ą
przeszkadza
ć
w wykonaniu nast
ę
pnej reakcji.
Opracowanie wyników:
•
Uzupełnij tabel
ę
. Uszereguj wszystkie zwi
ą
zki kompleksowe
ż
elaza(III) w kolejno
ś
ci
zgodnej z kolejno
ś
ci
ą
przeprowadzania kolejnych reakcji wymiany.
Kompleks
Nazwa
log
β
1
barwa
[Fe(H
2
O
6
]
3+
……

12
•
Zapisz równania zachodz
ą
cych reakcji.
•
Jak musiały zmienia
ć
si
ę
stałe log
β
1
dla kolejnych jonów kompleksowych aby reakcje
te mo
ż
na było przeprowadzi
ć
?
Do
ś
wiadczenie 4. Rozkład jonu kompleksowego
Odczynniki: roztwór siarczanu diakwatetraaminamiedzi(II) z pierwszego do
ś
wiadczenia,
2 M roztwór kwasu siarkowego(VI) (H
2
SO
4
), 0,5 M roztwór AKT (amid kwasu -
tiooctowego: CH
3
CSNH
2
).
Cel
ć
wiczenia: Przeprowadzenie reakcji rozkładu jonu kompleksowego [Cu(H
2
O)
2
(NH
3
)
4
]
2+
poprzez zwi
ą
zanie w trwał
ą
form
ę
chemiczn
ą
atomu centralnego lub ligandów.
Je
ś
li do roztworu zawieraj
ą
cego jony kompleksowe [Cu(H
2
O)
2
(NH
3
)
4
]
2+
wprowadzimy jony wodo-
rowe b
ę
dzie zachodzi
ć
reakcja:
[Cu(H
2
O)
2
(NH
3
)
4
]
2+
+ 4 H
+
+ 4 H
2
O
[Cu(H
2
O)
6
]
2+
+ 4 NH
4
+
Rozkład jonu kompleksowego nast
ę
puje tu w wyniku zwi
ą
zania ligandów, jakimi s
ą
cz
ą
steczki
amoniaku w jony amonowe, które nie dysponuj
ą
wolnymi parami elektronowymi.
Dodanie do roztworu zawieraj
ą
cego [Cu(H
2
O)
2
(NH
3
)
4
]
2+
jonów S
2-
pochodz
ą
cych z dysocjacji H
2
S
prowadzi z kolei do wytr
ą
cenia trudnorozpuszczalnego siarczku miedzi(II).
[Cu(H
2
O)
2
(NH
3
)
4
]
2+
+ H
2
S
CuS
↓
+ 4 NH
3
+ 2 H
+
+ 2 H
2
O
czarny osad
W tym przypadku powstanie trudnorozpuszczalnej soli powoduje rozkład jonu kompleksowego na
skutek zwi
ą
zania jego atomu centralnego.
Wykonanie:
Roztwór siarczanu diakwatetraaminamiedzi(II) nale
ż
y rozdzieli
ć
do dwóch probówek. Do
pierwszej probówki dodawaj kroplami kwas siarkowy, tak długo a
ż
roztwór uzyska barw
ę
charakterystyczn
ą
dla jonu [Cu(H
2
O)
6
]
2+
.
Do drugiej probówki dodaj 5 kropli roztworu AKT
(*)
.
Probówk
ę
ogrzewaj na ła
ź
ni wodnej a
ż
do zaobserwowania zmian.
(*)
AKT hydrolizuje w wy
ż
szej temperaturze z wydzieleniem H
2
S:
CH
3
CSNH
2
+ 2 H
2
O
CH
3
COO
-
+ NH
4
+
+ H
2
S
↑
Opracowanie wyników:
•
Zapisz reakcje, zanotuj obserwacje.
•
Jak
ą
barw
ę
powinien mie
ć
po zako
ń
czeniu reakcji roztwór w pierwszej probówce?
Wyszukiwarka
Podobne podstrony:
więcej podobnych podstron