
Centralna Komisja Egzaminacyjna w Warszawie
EGZAMIN MATURALNY 2010
CHEMIA
POZIOM ROZSZERZONY
Klucz punktowania odpowiedzi
MAJ 2010
Egzamin maturalny z chemii
Klucz punktowania odpowiedzi – poziom rozszerzony
2
Zadanie 1. (0–1)
Obszar standardów
Standard
Wiadomości i rozumienie
Wykazanie się znajomością i rozumieniem pojęć związanych
z budową atomu w jakościowym ujęciu mechaniki
kwantowej (I.1.a)
Poprawna odpowiedź
Symbol
pierwiastka Numer
okresu
Numer grupy
Symbol bloku
Ga
4 lub IV
lub czwarty
13 lub IIIA
lub III główna
p
1 p. – poprawne podanie symbolu pierwiastka, numeru okresu i grupy oraz symbolu bloku
układu okresowego
0 p. – podanie co najmniej jednej błędnej odpowiedzi
– brak co najmniej jednej odpowiedzi
Zadanie 2. (0–2)
Wiadomości i rozumienie
Zapisanie równań naturalnych przemian promieniotwórczych
i sztucznych reakcji jądrowych (I.3.a)
Poprawna odpowiedź
Równanie przemiany, jakiej ulega izotop polonu
210
84
Po:
210
4
206
84
2
82
Po
He
Pb
lub
210
4
206
84
2
82
Po
α +
Pb
Równanie przemiany, w której powstaje izotop azotu
13
N:
7
n
N
He
B
1
0
13
7
4
2
10
5
lub
10
4
13
1
5
2
7
0
B +
α
N +
n
2 p.
– poprawne napisanie obu równań
1 p.
– poprawne napisanie jednego równania
0 p.
– błędne napisanie obu równań lub brak odpowiedzi
Zadanie 3. (0–1)
Korzystanie z informacji
Dokonanie selekcji i analizy informacji (II.3)
Poprawna odpowiedź
CCl
4
Li
2
O SO
2
CS
2
BaBr
2
1 p.
– podkreślenie wzorów Li
2
O i BaBr
2
0 p.
– podkreślenie wzoru tylko jednej substancji
– podkreślenie wzorów Li
2
O i BaBr
2
oraz wzoru co najmniej jednej innej substancji
– podkreślenie wzorów innych substancji lub brak odpowiedzi
Egzamin maturalny z chemii
Klucz punktowania odpowiedzi – poziom rozszerzony
3
Zadanie 4. (0–1)
Wiadomości i rozumienie
Zapisanie równania reakcji na podstawie słownego opisu
przemiany (I.3.a)
Poprawna odpowiedź
2HClO
4
Cl
2
O
7
+ H
2
O
1 p.
– poprawne napisanie równania reakcji; adnotacje nad strzałką równania reakcji nie mają
wpływu na ocenę
0 p.
– błędne napisanie równania reakcji (błędne wzory reagentów lub błędne współczynniki
stechiometryczne) lub brak odpowiedzi
Zadanie 5. (0–3)
a) (0–1)
Tworzenie informacji
Dokonanie uogólnienia (III.3)
Poprawna odpowiedź
2000,0 hPa
2000 hPa
1 p.
– poprawne podanie wartości ciśnienia w prawidłowych jednostkach
0 p.
– błędne podanie wartości ciśnienia
– wyrażenie ciśnienia w nieprawidłowych jednostkach
– pominięcie jednostki ciśnienia
– brak odpowiedzi
b) (0–2)
Korzystanie z informacji
Zastosowanie do obliczeń równania Clapeyrona (II.5.b)
Przykładowe poprawne rozwiązania
V
1
= V
2
1
1
1
2
2
2
2
2
1
p
T
p T
2000 581,3
p
p
2415,5 hPa
p
T
T
481,3
pV = nRT n =
pV
RT
n =
2000 2
0,1mola
83,1 481,3
2
0,1 83,1 581,3
p
2
2415,3 hPa
1
2
1
n R T
n R 100
n R 100
p
p
V
V
V
2
0,1 83,1 100
p
2000
2415,5 hPa
2
2 p.
– zastosowanie poprawnej metody obliczenia wartości ciśnienia (wynikającej z równania
Clapeyrona zależności między danymi a szukaną), poprawne wykonanie obliczeń oraz
podanie wyniku z właściwą dokładnością, poprawnym zaokrągleniem
i w prawidłowych jednostkach
1 p.
– zastosowanie poprawnej metody obliczenia wartości ciśnienia i:
– popełnienie błędów rachunkowych prowadzących do błędnego wyniku liczbowego
– podanie wyniku z niewłaściwą dokładnością
– podanie wyniku w nieprawidłowych jednostkach
– błąd w zaokrągleniu wyniku
– pominięcie jednostki
Egzamin maturalny z chemii
Klucz punktowania odpowiedzi – poziom rozszerzony
4
0 p.
metody obliczenia wartości ciśnienia lub brak odpowiedzi
alnych
acji
Sformułowanie wniosku (III.3)
– zastosowanie błędnej
ależy zwrócić uwagę na zależność wartości wyniku końcowego od ewentu
N
wcześniejszych zaokrągleń. Należy uznać za poprawne wszystkie wyniki, które są
konsekwencją przyjętych przez zdającego poprawnych zaokrągleń.
adanie 6. (0–1)
Z
Tworzenie inform
P
powied
Y
azu X
b brak odpowiedzi
adanie 7. (0–2)
ormacji
Skonstruowanie tabeli prezentującej określone dane oraz
rzykłady poprawnej od
zi
(gaz lub substancja) X
gęstość X > gęstości Y
d
X
> d
Y
lub ρ
X
> ρ
Y
d
X
= 2d
Y
lub ρ
X
= 2ρ
1 p.
– poprawne wskazanie g
0 p.
– błędne wskazanie gazu (Y) lu
Z
Korzystanie z inf
wykonanie wykresu według podanych zależności (II.4.a)
Poprawna odpowiedź
ęc 100 g roztworu – 25,37 g KCl i
c
p
= 25,37%, wi
g
63
,
74
m
O
H
2
74,63 g H
2
O ––– 25,37 g KCl
100 g H
g
34
g
99
,
33
g
63
,
74
g
37
,
25
g
100
2
O ––– x g KCl x =
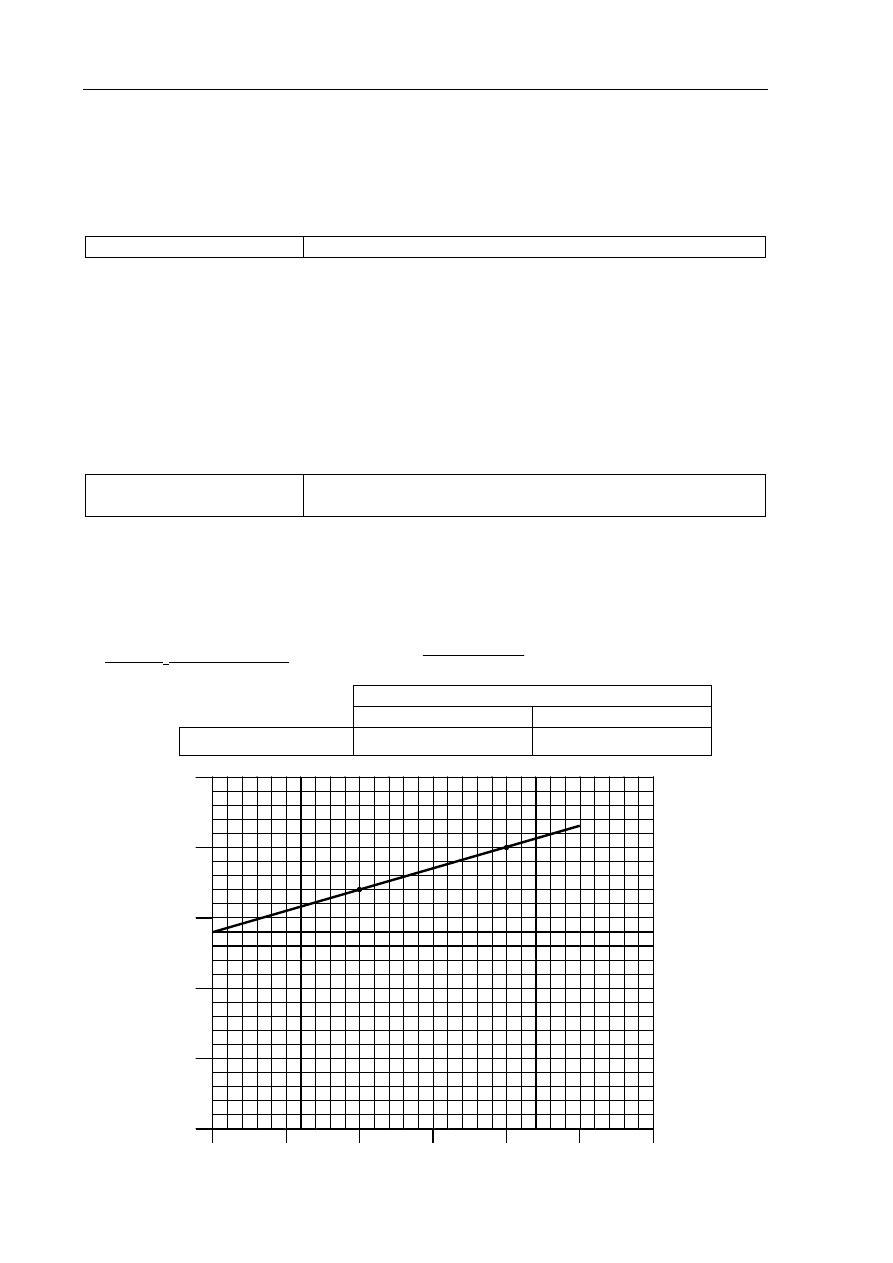
Rozpuszczalność, g/100 g H
2
O
20
o
C 40
o
C
Chlorek
potasu
34
40
50
40
30
20
Ro
zp
uszc
za
lno
ść
, g/
100 g
H
2
O
10
0
0
10 20 30 40 50 60
Temperatura, ºC
Egzamin maturalny z chemii
Klucz punktowania odpowiedzi – poziom rozszerzony
5
2 p.
– poprawne podanie rozpuszczalności chlorku potasu w temperaturze 20
o
C oraz
poprawne narysowanie wykresu rozpuszczalności tej soli w zakresie temperatur od 0
o
C
do 50
o
C (wykres powinien być linią prostą); zapis obliczeń nie jest wymagany, ale
jeżeli obliczenia są zapisane, muszą być poprawne
1 p.
– poprawne podanie rozpuszczalności chlorku potasu w temperaturze 20
o
C i błędne
narysowanie wykresu rozpuszczalności tej soli (inny niż wskazany zakres temperatur
lub wykres nie jest linią prostą)
– błędne podanie rozpuszczalności chlorku potasu w temperaturze 20
o
C, ale poprawne
wykorzystanie tych danych do narysowania wykresu rozpuszczalności soli w zakresie
temperatur od 0
o
C do 50
o
C (wykres powinien być linią prostą); jeżeli zdający otrzymał
błędny wynik niecałkowity, to punkt na wykresie odpowiadający temu wynikowi
powinien zawierać się między dwiema odpowiadającymi temu wynikowi liniami siatki
na osi rozpuszczalności
0 p.
– błędne podanie rozpuszczalności chlorku potasu w temperaturze 20
o
C i błędne
narysowanie wykresu rozpuszczalności tej soli (inny niż wskazany zakres temperatur
lub wykres nie jest linią prostą, lub popełnienie błędu w naniesieniu punktu
odpowiadającego rozpuszczalności KCl w temperaturze 20
o
C lub 40
o
C)
– brak odpowiedzi
Korz
Zadanie 8. (0–2)
ystanie z informacji
Wykonywanie obliczeń chemicznych z zastosowaniem
pojęcia mola i objętości molowej gazów; obliczenie stężenia
procentowego (II.5.b,d)
Przykładowe poprawne rozwiązania
astosowaniem do obliczeń
z z
krąglonych
niezao
mas molowych chloru i wodoru:
36
M
HCl
= 35,45 + 1,01 = 36,46 g/mol
,46 g –––––– 22,4 dm
3
x ––––– 112,0 dm
3
x = 182,3 g
p
182,3
100% 15, 42%
1182,3
c
z zastosowaniem do obliczeń zaokrąglonych mas molowych chloru i wodoru:
HCl
= 35,5 + 1 = 36,5 g/mol
,5g –––––– 22,4 dm
3
––––– 112,0 dm
3
x = 182,5 g
M
36
x
182,5
p
1182,5
c
100% 15, 43%
2
awn
olnego
(wynikającej z definicj
ą
gazów w warunkach n
iędzy danymi a szukaną), poprawne
danie wyniku z właściwą dokładnością, poprawnym
go i:
h prowadzących do błędnego wyniku liczbowego
ściwą dokładnością
tkach
– błąd w zaokrągleniu wyniku
– pominięcie jednostek
p.
– zastosowanie popr
ej metody obliczenia stężenia procentowego kwasu s
i stężenia procentowego i uwzględniającej objętość molow
ormalnych zależności m
wykonanie obliczeń oraz po
zaokrągleniem i w prawidłowych jednostkach
– zastosowanie poprawnej metody obliczenia stężenia procentowego kwasu solne
1 p.
– popełnienie błędów rachunkowyc
– podanie wyniku z niewła
– podanie wyniku w nieprawidłowych jednos
Egzamin maturalny z chemii
Klucz punktowania odpowiedzi – poziom rozszerzony
6
0 p.
– zastosowanie błędnej metody obliczenia stężenia procentowego kwasu solnego lub brak
od
Nal
eżność wartości wyniku końcowego od ewentualnych
wcz
za poprawne wszystkie wyniki, które są
konsekwencją przyj
ągleń.
Zadanie 9. (0–2)
Korz
powiedzi
zal
eży zwrócić uwagę na
eśniejszych zaokrągleń. Należy uznać
ętych przez zdającego poprawnych zaokr
a) (0–1)
ystanie z informacji
Analiza informacji zawartych w tablicach chemicznych –
przewidywanie odczynu wodnego roztworu soli (II.1.b)
Popra
1 p.
0 p.
rwony) lub brak odpowiedzi
b) (
Wi
iegu reakcji równaniem zapisanym
wna odpowiedź
Kwiaty zabarwiły się na kolor niebieski.
– poprawne określenie koloru kwiatów
– błędne określenie koloru kwiatów (różowocze
0–1)
Zilustrowanie przeb
adomości i rozumienie
w formie jonowej skróconej (I.3.a)
ady poprawn
Przykł
ej odpowiedzi
+
2
NH
3
·H
2
O + H
+
ów
0
na
nniki
stechiometryczne lub za
ładów kwasów i zasad według teorii Brönsteda
NH
4
+ H
2
O
⇄ NH
3
+ H
3
O
+
NH
4
+ 2H
2
O
⇄ NH
3
·H
2
O + H
3
O
+
NH
4
⇄ NH
3
+ H
+ H O
⇄
NH
4
1 p.
– poprawne napisanie r
p.
– błędne napisanie rów
nania reakcji w formie jonowej skróconej
nia reakcji (błędne wzory reagentów lub błędne współczy
pis niejonowy) lub brak odpowiedzi
Zadanie 10. (0–2)
k
Wiadomości i rozumienie
Podanie przy
(I.2.b)
Poprawna odpowiedź
Sprzężona para 1
Zasada 1:
OH
Kwas 1:
H
2
O
Sprzężona para 2
Kwas 2
CH
3
NH
3
Zasada
:
+
2:
CH
3
NH
2
lub odwrotnie, tzn. CH
sprzężona para 2.
3
3
3
NH
2
jako sprzężona para 1 oraz H
2
O i OH jako
kwasów i zasad stanowiących obie sprzężone pary kwas-
p.
– błędne napisanie wzorów kwasów i zasad stanowiących obie sprzężone pary kwas-
ak odpowiedzi
NH
+
i CH
p
2 .
– poprawne napisanie wzorów
zasada (po 1 p. za każdą parę)
1 p.
– poprawne napisanie wzoru kwasu i zasady stanowiących jedną sprzężoną parę kwas-
zasada
0
zasada lub br
Egzamin maturalny z chemii
Klucz punktowania odpowiedzi – poziom rozszerzony
7
Z
Korzystanie z informacji
danych przedstawionych w tabeli – określenie mocy
elektrolitu na podstawie wartości stopnia dysocjacji (II.1.b)
adanie 11. (0–1)
Analiza
Prz k
y łady poprawnej odpowiedzi
C H
CH
6
OH HCO
(kw
y lu
wy (kwa
arb
wy lub benzoesowy (kwas)
me
owy
1 p.
– p
poda
lub n
w
ej kolejności
oru lub nazwy któregoś z wymienianych kwasów
a) (0–
atyce chemicznej (II.1.a)
3
COOH
5
CO
as) etanow
b octo
OH
s) benzenok
oksylo
tanowy lub mrówk
oprawne
nie wzorów
azw kwasów e właściw
0 p.
– podanie wzorów lub nazw kwasów w niewłaściwej kolejności
– błędny zapis wz
– brak odpowiedzi
ie 12. (0–2)
Zadan
1)
Korzystanie z informacji
Dokonanie analizy informacji zawartych w tekstach
o tem
Poprawna odpowiedź
NaX + HY → NaY + HX
NaY + HX → reakcja nie zachodzi
1 p.
– poprawne dokończenie równania reakcji pierwszej i stwierdzenie, że reakcja druga nie
zachodzi
0 p.
– błędne dokończenie równania reakcji pierwszej
– dokończenie równania reakcji drugiej
– stwierdzenie, że reakcja pierwsza nie zachodzi
– brak odpowiedzi
b) (0–1)
Korzystanie z informacji
Dokonanie analizy informacji zawartych w tekstach
o tematyce chemicznej (II.1.a)
Poprawna odpowiedź
HX
1 p.
– wskazanie wzoru kwasu HX
0 p.
– wskazanie wzoru kwasu HY lub brak odpowiedzi
Zadanie 13. (0–1)
Tworzenie informacji
Dokonanie uogólnienia i sformułowanie wniosku (III.3)
Przykłady poprawnej odpowiedzi
(Ponieważ) stała dysocjacji nie zależy od stężenia (elektrolitu).
(Ponieważ) stopień dysocjacji zależy od stężenia (elektrolitu).
1 p.
– poprawne wyjaśnienie
0 p.
– wyjaśnienie niepoprawne lub niewystarczające lub brak odpowiedzi
Przykład odpowiedzi niewystarczającej
Ponieważ stała dysocjacji jest bardziej uniwersalną miarą mocy elektrolitu.

Egzamin maturalny z chemii
Klucz punktowania odpowiedzi – poziom rozszerzony
8
Zadanie 14. (0–2)
Korzystanie z informacji
Obliczenie stężenia równowagowego jednego z reagentów
(II.5.f)
Przykładowe poprawne rozwiązanie
3
2
2
dm
/
mol
1
,
30
x
x
3
,
0
9
x
]
O
H
[
i
]
O
H
][
CO
[
K
2
2
]
H
][
CO
[
9
,
12
3
,
6
2 p.
– zastosowanie poprawnej metody obliczenia równowagowego stężenia pary wodnej
(wynikającej z prawa działania mas zależności między danymi a szukaną), poprawne
ścią, poprawnym
rawnej metody obliczenia równowagowego stężenia pary wodnej
błędów rachunkowych prowadzących do błędnego wyniku liczbowego
ku z niewłaściwą dokładnością
anie wyniku w nieprawidłowych jednostkach
wyn
dnej me
wykonanie obliczeń oraz podanie wyniku z właściwą dokładno
zaokrągleniem i w prawidłowych jednostkach
1 p.
– zastosowanie pop
i popełnienie
– podanie wyni
– pod
– błąd w zaokrągleniu
– pominięcie jednostek
iku
tody obliczenia stężenia lub brak odpowiedzi
0 p.
– zastosowanie błę
Zadanie 15. (0–2)
Ko
ie stężeń początkowych reagentów (II.5.f)
rzystanie z informacji
Obliczen
ładowe pop
Przyk
rawne rozwiązanie
0
C
l/dm
3
CO
= [CO] + [CO
2
] = 0,3 + 6,3 = 6,6 mo
2
0
H
C
= [H
2
] – [CO
2
] = 12,9 – 6,3 = 6,6 mol/dm
3
2
CO
H
n
=
n
2
0
CO
C
6,6
0
H
C
=
6, 6
= 1:1
2
nej
;
– zastosowanie poprawn
unku molowego
dów rachunkowych prowadzących do błędnego wyniku liczbowego
stosowanie błędnej metody obliczenia stosunku molowego lub brak odpowiedzi
Wiadomości i rozumienie
Zapisanie równania reakcji chemicznej na podstawie
p.
– zastosowanie popraw
metody obliczenia stosunku molowego
1
n
:
n
2
H
CO
ej metody obliczenia stos
1
:
1 p.
2
CO
H
n
: n
i popełnienie błę
0 p.
– za
Zadanie 16. (0–2)
a) (0–1)
słownego opisu przemiany (I.3.a)
Przykłady poprawnej odpowiedzi
CrCl + 3NH + 3H O Cr(OH) + 3NH Cl
3
3
2
3
4
CrCl
3
+ 3(NH
3
·H
2
O)
Cr(OH)
3
+ 3NH
4
Cl
CrCl
3
+ 3NH
3
·H
2
O
Cr(OH) + 3NH Cl
cji w formie cząsteczkowej
współczynniki
3
4
1 p.
– poprawne napisanie równania reak
p
0 .
– błędne napisanie równania reakcji (błędne wzory reagentów lub błędne
stechiometryczne) lub brak odpowiedzi

Egzamin maturalny z chemii
Klucz punktowania odpowiedzi – poziom rozszerzony
9
b) (0–1)
Tworzenie informacji
Zaklasyfikowanie substancji na podstawie opisu reakcji
chemicznych (III.3)
Poprawna odpowiedź
(Ma właściwości) amfoteryczne lub (charakter) amfoteryczny
– poprawne określenie charakteru chemicznego związku tworzącego osad
Zadan
a) (0–
wej skróconej (I.3.a)
1 p.
0 p.
– błędne określenie charakteru chemicznego lub brak odpowiedzi
ie 17. (0–4)
2)
Wiadomości i rozumienie
Zastosowanie prawa zachowania masy i prawa zachowania
nia równań reakcji utleniania i redukcji
ładunku do uzgadnia
zapisanych w formie jono
Pop
Równanie procesu utleniania: Fe
→ Fe + e (x 6)
względniające bilans masy i bilans ładunku) napisanie obu równań
– poprawne napisanie jednego równania w formie jonowej i błędne zapisanie drugiego
rmie niejonowej (zapis formalny)
0 p.
–
ory reagentów lub błędne współczynniki
s
– błę
ń procesom utleniania i redukcji
– br
dpo
dzi
iania
rawna odpowiedź
Równanie procesu redukcji: Cr
2
O
7
+ 14H + 6e
→ 2Cr + 7H
2
O (x 1)
2
3
2
3
– poprawne (u
2 p.
w formie jonowej
1 p.
równania lub zapisanie go w fo
– brak zapisu jednego równania reakcji
błędne napisanie obu równań (błędne wz
techiometryczne lub zapis niejonowy)
dne przypisanie równa
ak o
wie
b) (0–1)
Wiadomości i rozumienie
Zastosowanie zasady bilansu elektronowego do uzgadn
równań reakcji zapisanych w formie jonowej skróconej (I.3.a)
Poprawna odpowiedź
(1)Cr
2
O
7
+ 6Fe
2
2
+ 14H
→ 2Cr + 6Fe + 7H
2
O
rawne uzupełnienie współczynników stechiometrycznych; zdający otrzymuje 1p.
nież wtedy, gdy nie otrzymał oceny pozytywnej za zapis równań w części a)
e d
0 p.
– błędne uzupełnienie wsp
ub brak odpowiedzi
skazanie utleniacza i reduktora (I.1.h)
3
3
1 p.
– pop
rów
zadania, ale poprawni
obrał współczynniki w części b)
ółczynników stechiometrycznych l
c) (0–1)
Wiadomości i rozumienie
W
Poprawna odpowiedź
Stosunek molowy utleniacza do reduktora: 1 : 6
eduktora (1:6 lub inny
zęści b) zadania) lub brak odpowiedzi
1 p.
– poprawne określenie stosunku molowego utleniacza do r
wynikający z nieprawidłowo dobranych współczynników w części b) zadania)
0 p.
– błędne określenie stosunku molowego utleniacza do reduktora (każdy wynik, który nie
odpowiada zapisowi równania reakcji w c
Egzamin maturalny z chemii
Klucz punktowania odpowiedzi – poziom rozszerzony
10
Zadanie 18. (0–2)
Tworzenie informacji
i przyczynowo-skutkowych –
przewidywanie kierunku przebiegu reakcji utleniania-
redukcji (III.1)
a) (0–1)
Określenie zależnośc
Przykłady poprawnej odpowiedzi
Cd + 2NiO(OH) + 2H
2
O → Cd(OH)
2
+ 2Ni(OH)
2
Cd + 2NiO(OH) + 2H
2
O + 2OH
–
→ Cd(OH)
2
+ 2Ni(OH)
2
+ 2OH
–
Cd + 2NiO(OH) + 2H
2
O + 2OH
–
→ Cd(OH)
2
+ 2Ni(OH)
2
+ 2OH
–
rawne napisanie sumarycznego równania reakcji
dne napisanie sumarycznego równania reakcji (błędne wzory substratów lub
e
iu
reakcji)
– brak odpowiedzi
1 p.
– pop
p.
– błę
0
produktów, lub błędn współczynniki stechiometryczne, lub zapis „
⇄” w równan
b) (0–1)
Korzystanie z informacji
Obliczenie SEM ogniwa (II.5.e)
op
0 p.
omotorycznej (SEM) ogniwa lub wyrażenie jej
–
Zad
ie informacji
Zaproponowanie metody zapobiegania korozji
P rawna odpowiedź
SEM (= 0,52 V –(–0,81 V)) = 1,33 V
1 p.
– poprawne obliczenie wartości siły elektromotorycznej (SEM) ogniwa we właściwych
jednostkach (zapis obliczeń nie jest wymagany)
– błędne podanie wartości siły elektr
w niewłaściwych jednostkach, lub pominięcie jednostek
brak odpowiedzi
anie 19. (0–1)
Tworzen
elektrochemicznej (III.2)
Poprawna odpowiedź
nk
p.
– błędne podanie nazwy lub symbolu metalu (miedź lub Cu) lub brak odpowiedzi
Zadan
redukcji (III.1)
Wybrany metal: cy
1 p.
– poprawne podanie nazwy lub symbolu metalu
0
ie 20. (0–1)
Tworzenie informacji
Określenie zależności przyczynowo-skutkowych –
przewidywanie kierunku przebiegu reakcji utleniania-
ki na wewnętrznej stalowej powierzchni
1 p.
–
Poprawna odpowiedź
Po mechanicznym uszkodzeniu cynowej powło
zamkniętej puszki z konserwą cyna ulega procesowi utleniania.
poprawne dokończenie zdania
0 p.
– błędne dokończenie zdania (wskazanie redukcji lub wskazanie obu procesów) lub brak
odpowiedzi
Egzamin maturalny z chemii
Klucz punktowania odpowiedzi – poziom rozszerzony
11
Zadanie 21. (0–1)
Korzystanie z informacji
Uzupełnienie brakujących danych na podstawie informacji
I.2)
podanych w formie tekstu o tematyce chemicznej (I
Poprawna odpowiedź
H H H
C C C
H
H
H
CH
2
= CH – CH
3
poprawne napisanie wzoru strukturalnego lub półstrukturalnego
błędne na
1 p.
–
0 p.
–
pisanie wzoru lub brak odpowiedzi
22. (0–3)
nych na podstawie
Zadanie
Wiadomości i rozumienie
Zapisanie równań reakcji chemicz
słownego opisu przemian (I.3.a)
Poprawna odpowiedź
Równania reakcji:
1. CH
2
=CHCH
2
CH
3
+ HCl
(brak katalizatora, temperatura pokojowa )
CH
3
CHClCH
2
CH
3
2. CH
3
CHClCH
2
CH
3
+ KOH
C
80
lub
T
oraz
EtOH
lub
OH
H
C
lub
alkohol
5
2
CH
3
CH=CHCH
3
+ KCl + H
2
O
3
+ H
2
O
2
4
H lub H SO
3. CH
3
CH=CHCH
CH
3
CH(OH)CH
2
CH
3
3
nie trz
ych warunków
reakcji w równaniu reak
ń reakcji (z zaznaczeniem wymaganych warunków
e zapisanie jednego równania reakcji (błędne wzory reagentów lub
iki stechiometryczne, lub niezaznaczenie warunków reakcji
ganych
akcji) i błędne zapisanie dwóch równań reakcji (błędne wzory reagentów
spółczynniki stechiometryczne, lub niezaznaczenie warunków reakcji
ji drug
– brak dwóch równań reakc
0 p.
– błędne napisanie wszy
eakcji (błędne wzory reagentów lub błędne
b niezaznaczenie warunków reakcji w równaniu
b trzeciej)
p.
– poprawne napisa
ech równań reakcji z zaznaczeniem wymagan
cji drugiej i trzeciej
2 p.
– poprawne napisanie dwóch równa
reakcji) i błędn
błędne współczynn
w równaniu reakcji drugiej lub trzeciej)
– brak jednego równania reakcji
p.
–
poprawne napisanie jednego równania reakcji (z zaznaczeniem wyma
1
warunków re
lub błędne w
w równaniu reakc
iej lub trzeciej)
ji
stkich równań r
współczynniki stechiometryczne, lu
reakcji drugiej lu
– brak odpowiedzi
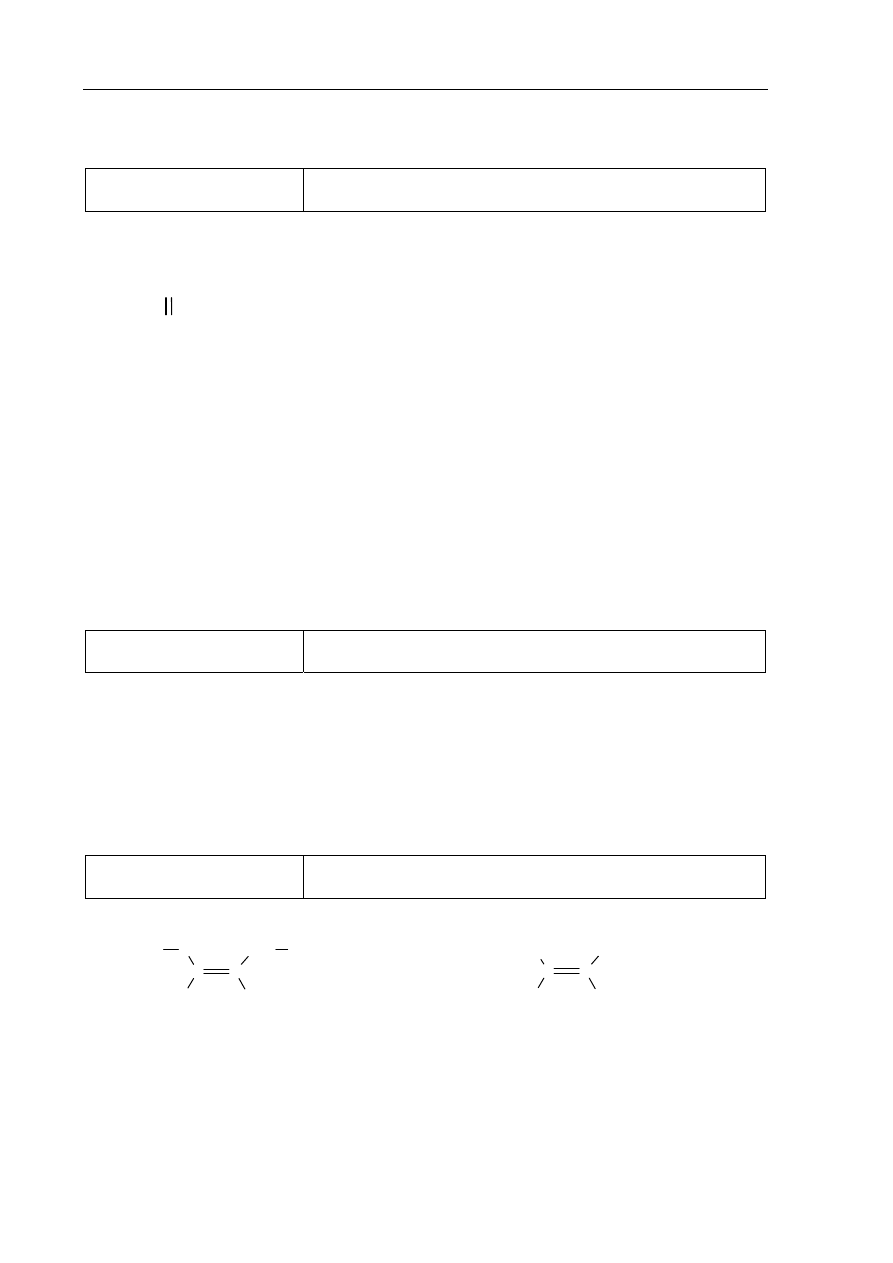
Egzamin maturalny z chemii
Klucz punktowania odpowiedzi – poziom rozszerzony
12
Zadanie 23. (0–3)
a
Korzystanie z informacji
ji
podanych w formie schematów procesów chemicznych (II.2)
) (0–2)
Uzupełnienie brakujących danych na podstawie informac
Po r
p awna odpowiedź
Wzór związku B:
CH
3
– C – CH
3
lub CH
3
COCH
3
O
Nazwa związku D: propanal lub kwas propanowy
anie poprawnej nazwy
p.
– poprawne napisanie wzoru półstrukturalnego związku B i podanie błędnej nazwy
bo brak nazwy związku D
ązku B
az
– poprawne napisanie wz
ązku D lub podanie
w związku B i związku D
wzoru związku B i podanie błędnej nazwy związku D
ykazanie się znajomością
eniem pojęć związanych
z typami reakcji (I.1.e)
2 p.
– poprawne napisanie wzoru półstrukturalnego związku B oraz pod
systematycznej związku D
1
związku D al
– błędne napisanie wzoru pó
i podanie poprawnej n
łstrukturalnego związku B albo brak wzoru zwi
wy związku D
orów półstrukturalnych związku B i zwi
poprawnych naz
0 p.
– błędne napisanie
– brak odpowiedzi
b) (0–1)
Wiadomości i rozumienie
W
i rozumi
(reakcja) podstawienia (nukleofilowego)
Zadan
Poprawna odpowiedź
(reakcja) substytucji (nukleofilowej)
1 p.
– poprawne określenie typu reakcji (substytucja lub podstawienie)
0 p.
– błędne określenie typu reakcji lub brak odpowiedzi
ie 24. (0–1)
Ko
łnianie brakujących danych na podstawie informacji
podanych w formie schematów procesów chemicznych (II.2)
rzystanie z informacji
Uzupe
Popra
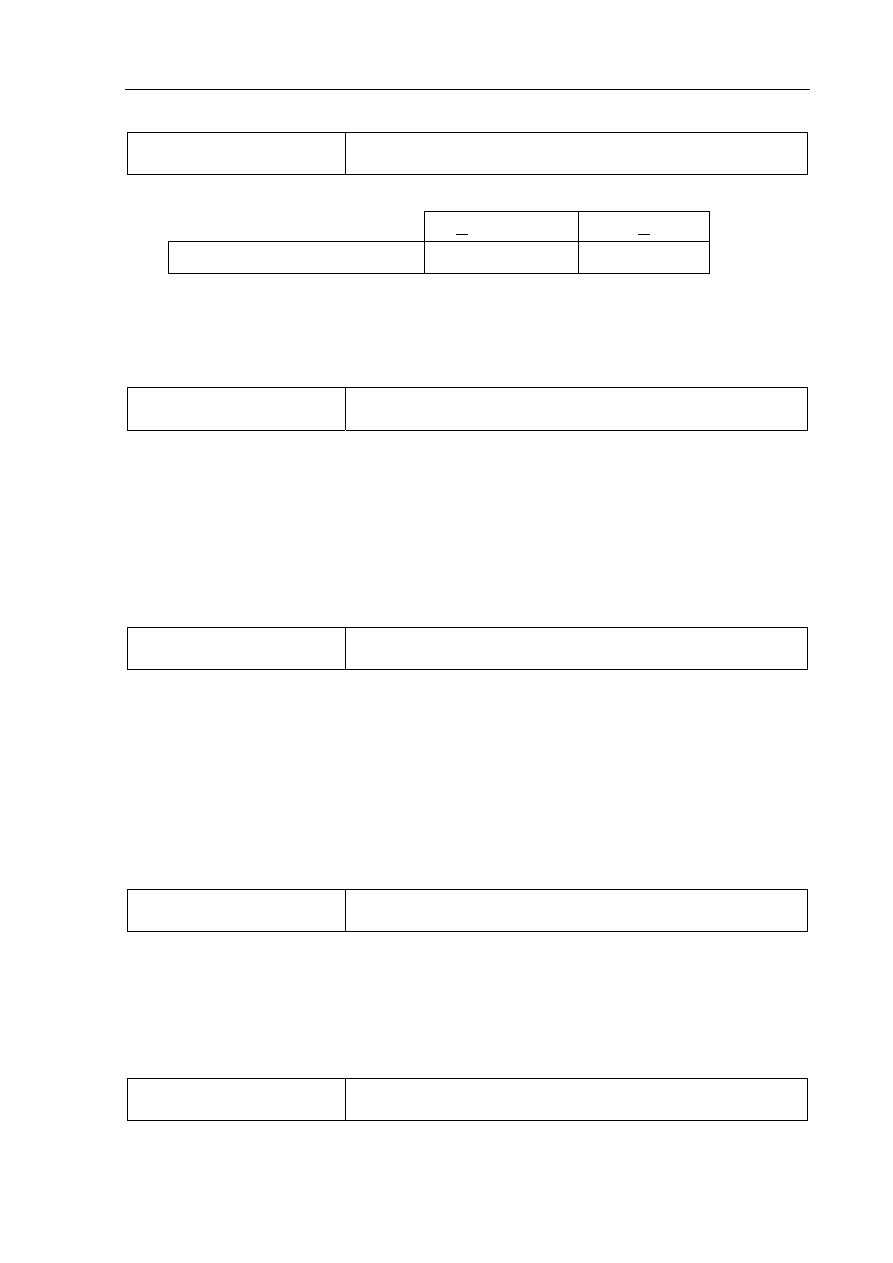
wna odpowiedź
CH
CH
CH
C
H
C
C
2
3
2
3
H
H
lub
C
C
H
H
C
2
H
5
H
5
C
2
ienie schem
1 p.
atu
0 p.
ie schematu lub brak odpowiedzi
– poprawne uzupełn
– błędne uzupełnien
Egzamin maturalny z chemii
Klucz punktowania odpowiedzi – poziom rozszerzony
13
Zadanie 25. (0–1)
Wiadomości i rozumienie
Określanie stopni utlenienia pierwiastka (węgla)
w cząsteczce związku organicznego (I.1.h)
Poprawna odpowiedź
C
H
3
–COOH CH
3
–COOH
Stopnie utlenienia atomów węgla
–III lub –3
(+) III lub (+) 3
1 p.
– poprawne określenie stopni utlenienia wskazanych atomów węgla
0 p.
– błędne określenie stopni utlenienia jednego lub obu atomów węgla
– brak co najmniej jednej odpowiedzi
adanie 26. (0–1)
Z
Wiadomości i rozumienie
Wykazanie się znajomością i rozumieniem pojęć związanych
z izomerią podstawienia (I.1.i)
Poprawna odpowiedź
1 p.
0 p.
ad
Wzory izomerów 1,2-dimetylobenzenu: II IV
– poprawne podanie obu numerów, którymi oznaczono wzory izomerów (II i IV)
– każda inna odpowiedź (np. wskazanie wzoru I)
brak odpowiedzi
–
Z anie 27. (0–3)
a) (0–1)
Wiadomości i rozumienie
Uzupełnienie równania reakcji na podstawie słownego opisu
przemiany (I.3.a)
Poprawna odpowiedź
CH
3
COCH
3
+ 3I
2
+ 4NaOH
)
(T
CHI
3
+ CH
3
COONa + 3NaI + 3H
2
O
to znaczy wpisanie poprawnych wzorów produktów
ych wzorów produktów reakcji lub
błędnych współczynników stechiometrycznych
dzi
b
Tworzenie informacji
chemicznych (III.3)
1 p.
– poprawne uzupełnienie schematu,
reakcji i poprawnych współczynników stechiometrycznych
0 p.
– błędne uzupełnienie schematu, np. wpisanie błędn
– brak odpowie
) (0–1)
Zaklasyfikowanie substancji na podstawie opisu reakcji
Po ra
p wna odpowiedź
CHI
3
p.
– poprawne napisanie wzoru produktu (CHI
3
)
ub brak odpowiedzi
Tworzenie informacji
Wybranie informacji, które są niezbędne do uzasadniania
własnego poglądu (III.3)
1
0 p.
– błędne napisanie wzoru produktu l
c) (0–1)

Egzamin maturalny z chemii
Klucz punktowania odpowiedzi – poziom rozszerzony
14
Przykłady poprawnej odpowiedzi
ie
Nie, ponieważ etanal zawie
al zawiera również grupę acetylową.
p.
– odpowiedź „nie” poprawne uzasadnie
– odpowiedź „nie” i brak uzasadnienie lub b
enie
Wiadomości i rozumienie
Opisanie typowych właściwości amin (I.2.b)
Nie, ponieważ etanal zaw ra również taką samą grupę.
ra również grupę CH
3
–CO–
Nie, ponieważ etan
1
0 p.
i
nie
łędne uzasadnienie
– odpowiedź „tak” i błędne uzasadni
– brak odpowiedzi
Zadanie 28. (0–2)
Poprawna odpowiedź
Zdanie 1. – P
odpowiedzi
atyce chemicznej (II.2)
Zdanie 2. – P
Zdanie 3. – F
2 p.
– podanie trzech poprawnych odpowiedzi
1 p.
– podanie dwóch poprawnych odpowiedzi
0 p.
– jedna poprawna odpowiedź lub brak poprawnych
– brak odpowiedzi
Zadanie 29. (0–2)
a) (0–1)
Korzystanie z informacji
Uzupełnienie brakujących danych na podstawie informacji
podanych w formie tekstu o tem
Poprawna odpowiedź
C
3
H
6
O
3
1 p.
– napisanie poprawnego wzoru sumarycznego
napisanie błędnego wzoru sumarycznego lub brak odpowied
0 p.
–
zi
Ko
ji
Uzupełnienie brakujących danych na podstawie informacji
podanych w formie tekstu o tematyce chemicznej (II.2)
b) (0–1)
rzystanie z informac
P
lub CH
2
(OH)CH
2
COOH
CH
2
COOH
nego w
0
o wzor
CH
2
C
O
oprawne odpowiedzi
OH
OH
C
H
2
CH
3
O
1 p.
– napisanie popraw
p.
– napisanie błędneg
zoru półstrukturalnego (lub strukturalnego)
u półstrukturalnego lub brak odpowiedzi

Egzamin maturalny z chemii
Klucz punktowania odpowiedzi – poziom rozszerzony
15
Zadanie 30. (0–1)
Korzystanie z informacji
Uzupełnienie brakujących danych na podstawie informacji
ematyce chemicznej (II.2)
podanych w formie tekstu o t
ź
Poprawna odpowied
H
3
+
)COOH
w
u
go wzoru półstrukturalnego jonu lub brak odpowiedzi
danie 31. (0–3)
Ko
ormacji
Dokonanie selekcji i analizy informacji podanej w formie
e chemicznej (II.3)
CH CH
2
C
O
O
HOOCCH
2
CH(N
1 p.
– napisanie poprawnego zoru półstrukturalnego (lub strukturalnego) jon
0 p.
– napisanie błędne
Za
rzystanie z inf
tekstu o tematyc
Poprawna odpowiedź
1. Glukoza i fruktoza są białymi, krystalicznymi substancjami stałymi. Bardzo dobrze
odzie. Odczyn ich wodnych roztworów jest obojętny.
z wodorotlenkiem miedzi(II) prowadzona na zimno potwierdza obecność
ąsteczce kilku grup hydroksylowych związanych z sąsiednimi atomami węgla.
dor
uje
w
o w
Fruktoza, podobnie jak g
czalne
e
, dlatego obserwujemy powstanie szafirowego roztworu. Wynik
ozy z wodorotlenkiem miedzi(II) prowadzonej w podwyższonej temperaturze
ące
, mimo że fruktoza zaliczana jest
za każdy
rawnie uzupełniony akapit, to znaczy ze wszystkimi poprawnymi uzupełnieniami)
2
ie d
1 p.
nie j
0 p.
– błędne uzupełnienie wszystkich akapitów lub brak odpowiedzi
danie 32. (0–2)
–1)
]
Tworzenie informacji
czenia – wybór odczynnika
pozwalającego na identyfikację różnych pochodnych
węglowodorów (III.2)
rozpuszczają się w w
glukozy
2. Reakcja
w jej cz
Glukoza w reakcji z wo
łaściwości redukujące, c
otlenkiem miedzi(II) przeprowadzanej na gorąco wykaz
iąże się z obecnością w jej cząsteczce grupy aldehydowej.
lukoza, tworzy z wodorotlenkiem miedzi(II) rozpusz
3.
związki kompleksow
reakcji frukt
wskazuje, że związek ten ma także właściwości redukuj
do ketoz.
– poprawne uzupełnienie wszystkich zdań w trzech akapitach (po 1 p.
3 p.
pop
p.
– poprawne uzupełnien
– poprawne uzupełnie
wóch akapitów
ednego akapitu
Za
a) (0
Zaprojektowanie doświad
1 p.
– za poprawny wybór odczynnika
0 p.
– za błędny wybór odczynnika lub brak odpowiedzi
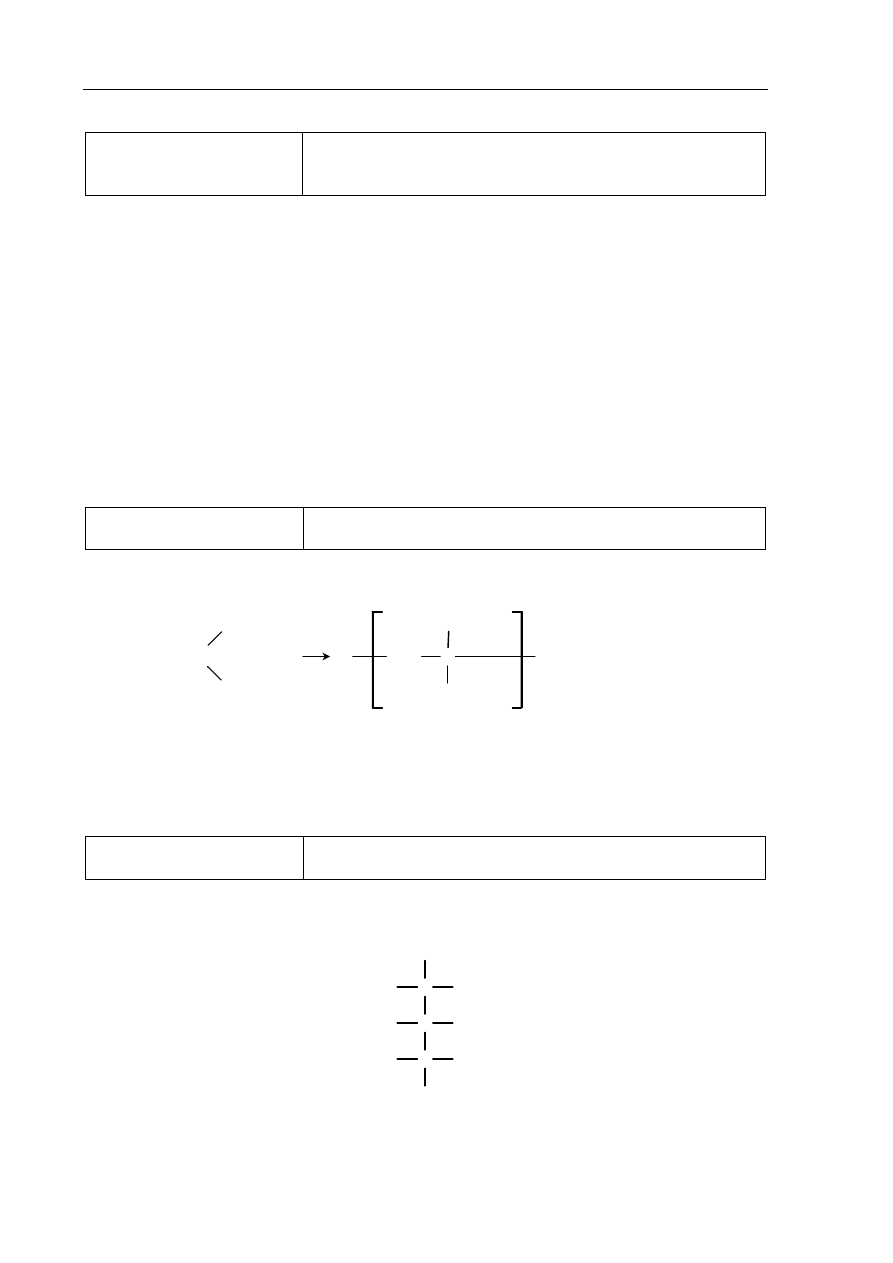
OH
C
O
H
+
NH
3
Poprawna odpowiedź
woda bromowa
Br
2 (aq)
Egzamin maturalny z chemii
Klucz punktowania odpowiedzi – poziom rozszerzony
16
b) (0–1)
Tworzenie informacji
Zaprojektowanie doświadczenia – sformułowanie
spostrzeżeń umożliwiających identyfikację badanych
substancji (III.2)
Przyk
łady poprawnej odpowiedzi
Probówka I: woda bromowa uległa odbarwieniu lub zaczęła się odbarwiać
Probówka II: woda bromowa nie uległa odbarwieniu lub nie zaczęła się odbarwiać lub
brak zmian lub brak objawów reakcji lub warstwa wodna (woda bromowa) odbarwia
się, a warstwa CCl
4
zabarwia się na pomarańczowo lub żółto lub brązowo
ie ich braku) dla obu probówek, który
reaguje z trioleinianem glicerolu, a w probówce II nie
– błędny opis zmian w obu probówkach
mian w jednej probówce
adanie 33. (0–1)
enie
Zapisanie równania reakcji ilustrującego właściwości
związków organicznych (I.3.a)
1 p.
– każdy poprawny opis zmian (lub stwierdzen
wskazuje, że w probówce I brom
reaguje z tristearynianem glicerolu
0 p.
– błędny wybór odczynnika w części a) zadania
– błędny opis z
– brak odpowiedzi
Z
Wiadomości i rozumi
Poprawna odpowiedź
CH
2
C
CH
3
COOCH
3
COOCH
3
n CH
2
=C
n
CH
3
1 p.
– poprawne uzupełnienie schematu, to znaczy wpisanie poprawnego wzoru produktu
reakcji
najomością i rozumieniem pojęć związanych
I.1.i)
0 p.
– błędne uzupełnienie schematu lub brak odpowiedzi
ie 34. (0–1)
Zadan
Wiadomości i rozumienie
Wykazanie się z
z izomerią konfiguracyjną (optyczną) (
Poprawna odpowiedź
CHO
C
CH
2
OH
O
H
H
C
C
H
OH
O
H
H
1 p.
– poprawne uzupełnienie schematu
0 p.
– błędne uzupełnienie schematu lub brak odpowiedzi

Egzamin maturalny z chemii
Klucz punktowania odpowiedzi – poziom rozszerzony
17
asady oceniania
Z
nkty t
owiadające
poleceniom zawartym w zada
związania zadań uwzglę
ok rozumowania niż podany w kluczu
asadami punktacji.
jedna jest
pr
Je
Do
od
ogą być zwielokrotnione), ale bilans musi być
łczynników powoduje utratę 1 punktu
z
oceniane są: metoda, wykonanie obliczeń
i
jednostką. Błędny zapis jednostki lub jej brak przy ostatecznym
ym powoduje utratę 1 punktu. W obliczeniach wymagane jest poprawne
ników liczbowych.
ia
metody
uje punktów.
a poprawne spostrzeżenia i wnioski będące konsekwencją niewłaściwie
anego doświadczenia zdający nie otrzymuje punktów.
Elementy odpowiedzi umieszczone w nawiasach nie są wymagane.
Ogólne z
dający otrzymuje pu
ylko za poprawne rozwiązania, precyzyjnie odp
niach.
dniające inny t
Ro
oceniane są zgodnie z ogólnymi z
Gdy do jednego polecenia zdający podaje kilka odpowiedzi (z których
awidłowa, inne nieprawidłowe), to nie otrzymuje punktów za żadną z nich.
żeli polecenie brzmi: Napisz równanie reakcji..., to w odpowiedzi zdający powinien
napisać równanie reakcji chemicznej, a nie jej schemat.
bór współczynników w równaniach reakcji chemicznych może różnić się
przedstawionego w kluczu (np. m
prawidłowy. Niewłaściwy dobór lub brak wspó
a zapis tego równania.
W rozwiązaniach z
podanie wyniku z
adań rachunkowych
wyniku liczbow
zaokrąglanie wy
Za poprawne obliczen
będące konsekwencją zastosowania niepoprawnej
zdający nie otrzym
Z
zaprojektow
Document Outline
- Zadanie 1. (0–1)
- Zadanie 2. (0–2)
- Zadanie 3. (0–1)
- Zadanie 4. (0–1)
- Zadanie 5. (0–3)
- Zadanie 6. (0–1)
- Zadanie 7. (0–2)
- Zadanie 8. (0–2)
- Zadanie 9. (0–2)
- Zadanie 10. (0–2)
- Zadanie 11. (0–1)
- Zadanie 12. (0–2)
- Zadanie 13. (0–1)
- Zadanie 14. (0–2)
- Zadanie 15. (0–2)
- Zadanie 16. (0–2)
- Zadanie 17. (0–4)
- Wiadomości i rozumienie
- Zastosowanie prawa zachowania masy i prawa zachowania ładunku do uzgadniania równań reakcji utleniania i redukcji zapisanych w formie jonowej skróconej (I.3.a)
- Wiadomości i rozumienie
- Zastosowanie zasady bilansu elektronowego do uzgadniania równań reakcji zapisanych w formie jonowej skróconej (I.3.a)
- Wiadomości i rozumienie
- Wskazanie utleniacza i reduktora (I.1.h)
- Zadanie 18. (0–2)
- Zadanie 19. (0–1)
- Zadanie 20. (0–1)
- Zadanie 21. (0–1)
- Zadanie 22. (0–3)
- Zadanie 23. (0–3)
- Zadanie 24. (0–1)
- Zadanie 25. (0–1)
- Zadanie 26. (0–1)
- Zadanie 27. (0–3)
- Zadanie 28. (0–2)
- Zadanie 29. (0–2)
- Zadanie 30. (0–1)
- Zadanie 31. (0–3)
- Zadanie 32. (0–2)
- b) (0–1)
- Zadanie 33. (0–1)
- Zadanie 34. (0–1)
Wyszukiwarka
Podobne podstrony:
więcej podobnych podstron