Chemia Organiczna-konwersatorium; gr. A1; 2014/15Z (B. Kozik)
1
Spektroskopia w podczerwieni (IR)
- przykład spektroskopii absorbcyjnej
(pomiar ilości światła zaabsorbowanego przez związek chem., jako funkcja długości fali świetlnej)
Zależność między energią kwantu promieniowania (
εεεε [J]), długością fali (λ
λ
λ
λ [m]),
i częstością (
ν
ν
ν
ν [Hz = 1/s]):
λ
ν
ε
hc
h
=
=
λ
ν
c
=
W spektroskopii IR fala charakteryzowana jest przez liczbę falową
ν
~
[cm
-1
]:
liczba falowa
ν
~
[cm
-1
] = 1 /
λ
λ
λ
λ [cm]
∼
∼
∼
∼ ν
ν
ν
ν (częstość)
]
m
[
]
cm
/
m
[
10000
]
cm
[
1
]
cm
[
1
µ
λ
µ
λ
ν
=
=
−
;
]
cm
[
]
cm
/
m
[
10000
]
m
[
1
−
=
v
µ
µ
λ
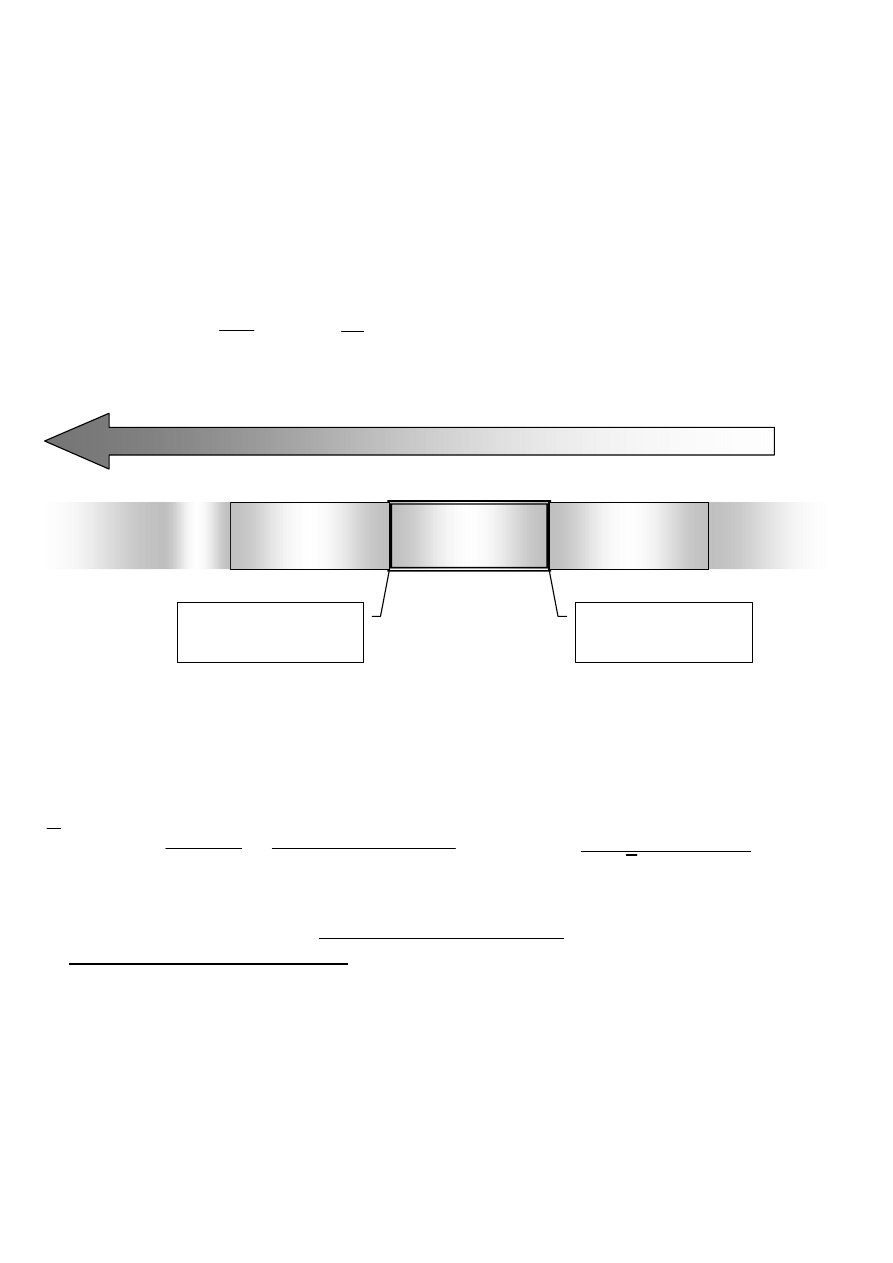
- Spektroskopia IR umożliwia obserwację drgań atomów połączonych wiązaniami
→
identyfikacja grup funkcyjnych w cząsteczce
Drgania oscylacyjne są wzbudzane falami z zakresu
λ
= 25-2,5
µm (
ν
~
=400-4000 cm
-1
)
ENERGIA
λ = 2,5 µm
ν = 4000 cm
-1
λ = 25 µm
ν = 400 cm
-1
przejścia elektronowe
podczerwień
IR
bliska
podczerwień
UV
mikrofale
daleka
podczerwień
VIS
przejścia oscylacyjne
przejścia rotacyjne
gdzie: h - stała Plancka: 6,62
× 10
-34
J
×s
c - prędkość światła: 3
×10
8
m/s
Chemia Organiczna-konwersatorium; gr. A1; 2014/15Z (B. Kozik)
2
• Drgania wiązań w cząsteczkach:
CH
CH
3
I
CH
3
2-jodopropan
C
C
I
C
H
H
H
H
H
H
H
Ruchy oscylacyjne atomów w cząsteczce można rozłożyć na tzw. drgania normalne
(niezależne, brak rotacji, zachowany środek ciężkości-brak translacji).
np. drgania szkieletu węglowego jodku izopropylu:
DRGANIA ROZCIĄGAJĄCE (WALENCYJNE); oznaczane:
ν
ν
ν
ν
symetryczne
asymetryczne
(następuje zmiana głównie długości wiązań)
DRGANIA (ZGINAJĄCE) DEFORMACYJNE; oznaczane:
δ
δ
δ
δ ((((ω
ω
ω
ω,,,, ρ
ρ
ρ
ρ,,,, ττττ,,,, εεεε,,,, ........))))
wachlarzowe
nożycowe
(dominuje zmiana kątów między wiązaniami)
wahadłowe
wachlarzowe
(poza płaszczyzną)
(w płaszczyźnie)
Chemia Organiczna-konwersatorium; gr. A1; 2014/15Z (B. Kozik)
3
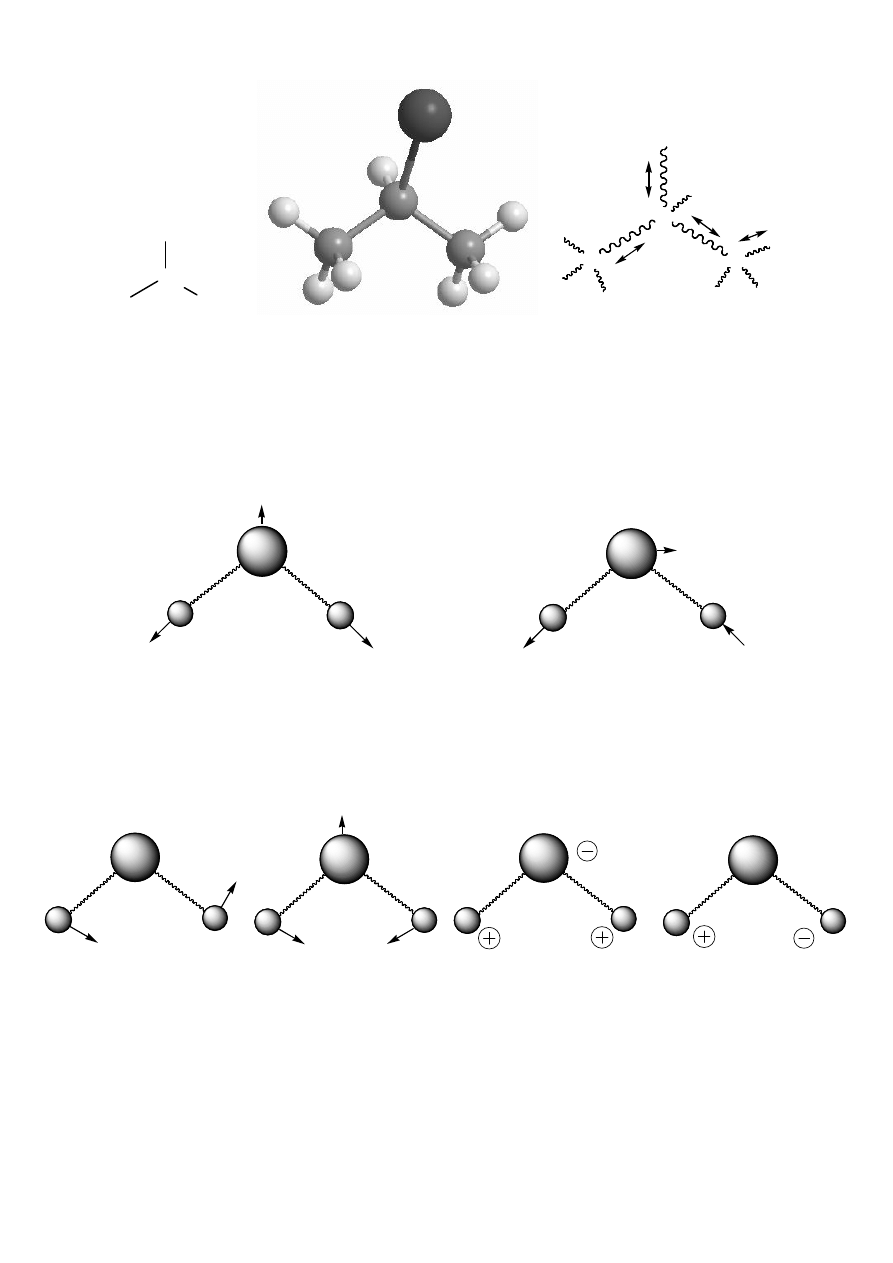
•
Absorbcja fal elektromagnetycznych
Przejście cząsteczki do wyższego stanu oscylacyjnego (E
0
→ E
1
, E
0
→ E
2,
E
1
→ E
2
itp.) może nastąpić pod wpływem promieniowania elektromagnetycznego.
WARUNKI:
I. Spośród wiązki fal o różnych długościach (
λ
λ
λ
λ
1
,
λ
λ
λ
λ
2
,
λ
λ
λ
λ
3
...) absorbowana jest
tylko fala o energii
εεεε dopasowanej do różnicy między poziomami stanu
wyjściowego i wzbudzonego.
Schemat absorbcji:
PRÓBKA
v=0
v=1
E
0
E
1
∆E = ε
2
ε
1
(λ
1
)
λ
1
λ
3
λ
4
λ
5
ε
2
(λ
2
)
ε
3
(λ
3
)
ε
4
(λ
4
)
ε
5
(λ
5
)
Przedstawiono tylko przejście E
0
→ E
1
, gdyż
w temperaturze pokojowej ok. 99 %
cząsteczek znajduje się w stanie podstawowym (v = 0), a przejścia E
0
→ E
2
,
E
0
→ E
3
itp. są mało prawdopodobne.
II. Tylko drganie, któremu towarzyszy zmiana momentu dipolowego
cząsteczki (
∆
∆
∆
∆µ
µ
µ
µ ≠
≠
≠
≠0) jest wzbudzane falami IR (jest aktywne w podczerwieni).
Np. drganie wiązania
C-C w CH
3
-CH
3
jest
nieaktywne w podczerwieni
•
Schemat spektrometru IR (dwuwiązkowego, dyspersyjnego)
detektor
i analizator
rejestrator
próbka
kuweta odnośnikowa
źródło promieni IR
(np. pręt Nernsta)
wiązka pomiarowa
i porównawcza
widmo
Chemia Organiczna-konwersatorium; gr. A1; 2014/15Z (B. Kozik)
4
•
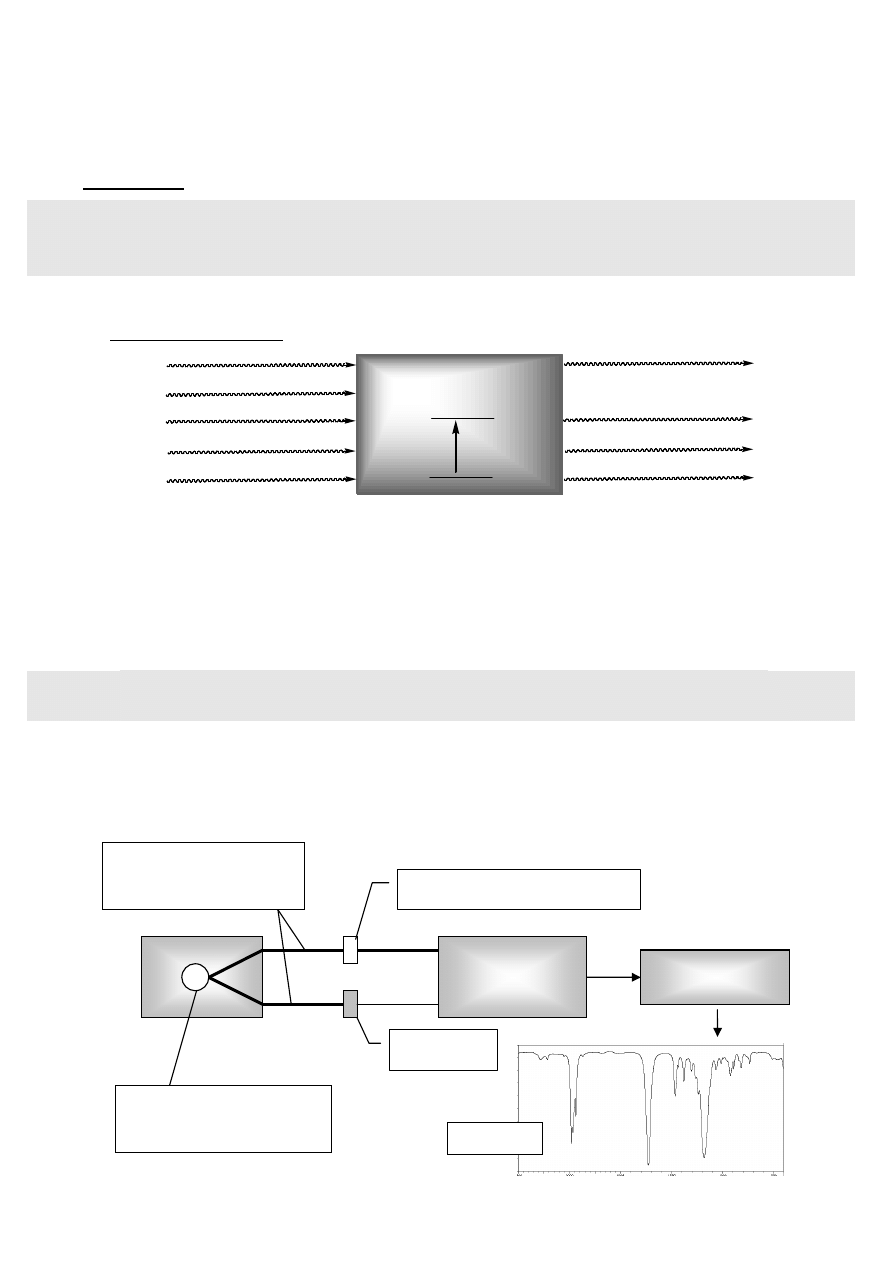
Modele drgań rozciągających
m
1
m
2
f
Model uproszczony
(niezgodny z rzeczywistością): oscylator harmoniczny
(energia potencjalna oscylatora jest proporcjonalna do kwadratu jego odkształcenia),
w ujęciu mechaniki kwantowej prowadzi do:
)
2
1
(
2
+
=
v
m
f
h
E
r
osc
π
w konsekwencji:
v=0
v=1
v=2
v=3
E
0
E
1
E
2
E
3
Model optymalny: oscylator anharmoniczny (złożona zależność energii
potencjalnej oscylatora od jego odkształcenia), w ujęciu mechaniki kwantowej
prowadzi do:
+
−
+
=
2
)
2
1
(
)
2
1
(
2
v
x
v
m
f
h
E
r
osc
π
w konsekwencji:
v=0
v=1
v=2
v=3
E
0
E
1
E
2
E
3
E
osc
- energia oscylatora
v -
oscylacyjna liczba kwantowa
(v = 0, 1, 2, ...)
m
r
- masa zredukowana m
r
= m
1
m
2
/(m
1
+m
2
)
f -
stała siłowa wiązania
- odległości między poziomami identyczne:
r
m
f
h
E
π
2
=
∆
- jedyne dopuszczalne przejście dla
∆v = ± 1
- różne odległości między poziomami:
[
]
)
1
(
2
1
2
1
+
−
=
∆
+
v
x
m
f
h
E
r
v
v
π
- możliwe są przejścia o
∆v = ±1, ±2, ±3,...
(
∆v = +1: ton podstawowy, ∆v = +2, +3,... : nadtony)
x - współczynnik anharmoniczności
Chemia Organiczna-konwersatorium; gr. A1; 2014/15Z (B. Kozik)
5
•
Widmo IR, przewidywanie zakresów absorbcji
Położenie pasm absorbcji
drgań rozciągających
można przewidzieć
korzystając z zależności:
r
osc
m
f
E
~
~
~
∆
ν
Przykłady:
rozc. C-C (alkan) 1200 cm
-1
rozc. C
sp
3
-H
2840-3000 cm
-1
rozc. C=C (alken) 1660 cm
-1
rozc. C
sp
2
-H
3010-3100 cm
-1
rozc. C
≡
C (alkin)
2100-2200 cm
-1
rozc. C
sp
-H
3300 cm
-1
rozc. C-N
1200 cm
-1
rozc. C=N
1645 cm
-1
rozc. C
≡
N
2210-2260 cm
-1
(intensywniejsze niż C
≡
C)
rozc. C
sp
3
-H
2840-3000 cm
-1
rozc. N-H
3300-3500 cm
-1
rozc. O-H
2500-3600 cm
-1
rozc. C=C (izolowane) 1640-1680 cm
-1
rozc. C=O (izolowane) ok. 1705-1740 cm
-1
(aldehydy i ketony)
4000
3000
2000
1500
1000
400
liczba falowa [cm
-1
]
T
ra
n
s
m
it
a
n
c
ja
[
%
]
(p
rz
e
p
u
s
z
c
z
a
ln
o
ś
ć
)
50
0
obszar "finger-print"
rozc.
O-H
N-H
i C-H
ro
z
c
. C
≡
C
o
ra
z
C
≡
N
rozc.
C=O
C=C
i
C=N
wiele pasm:
rozc. C-O, C-C,...
deformacyjne, ...
f - stała siłowa
, miara "sztywności
wiązania", wzrasta z:
- rzędem ("krotnością") wiązania
- jonowością wiązania
- zmniejszeniem długości
m
r
- masa zredukowana
zależy od
mas atomów tworzących oscylator
Chemia Organiczna-konwersatorium; gr. A1; 2014/15Z (B. Kozik)
6
•
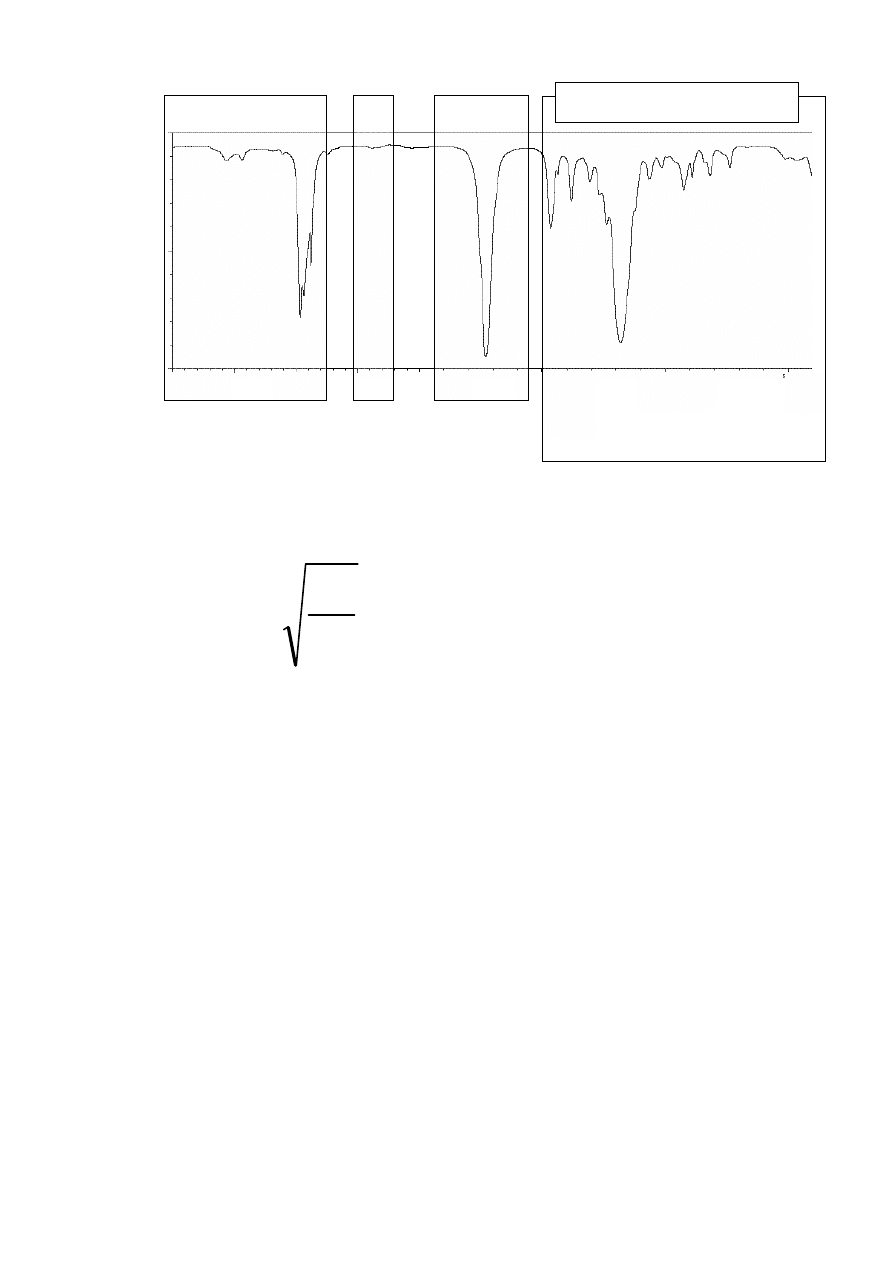
Wpływ sprzężenia na położenie pasm absorbcji (m. in. C=C i C=O)
rozc. C=C (izolowane)
1640-1680 cm
-1
rozc. C=C (sprzężone)
1620-1640 cm
-1
rozc. C=C (aromatyczne) ok. 1600 cm
-1
np.:
cykloheksen
1645 cm
-1
cykloheksa-1,3-dien
1620 cm
-1
benzen
1600 cm
-1
ν
maleje
H
O
H
O
butanal
1731 cm
-1
but-2-enal
1690 cm
-1
O
O
cykloheksanon
1718 cm
-1
cykloheks-2-enon
1675 cm
-1
O
O
O
O
octan fenylu
1760 cm
-1
benzoesan metylu
1715 cm
-1
•
Standardowe przygotowanie próbki
- < 2 mg związku;
- ciecze: film (kropla cieczy rozprowadzona między płytkami NaCl - nie absorbuje
w zakresie 2.5 – 25
µm);
- ciała stałe - "pastylka" sprasowana ze związku roztartego z KBr
- zawiesina substancji w
nujolu (mieszanina wyższych węglowodorów) lub
HCB (heksachlorobutadien)
- roztwory – w specjalnych kuwetach (rzadziej stosowane).
Chemia Organiczna-konwersatorium; gr. A1; 2014/15Z (B. Kozik)
7
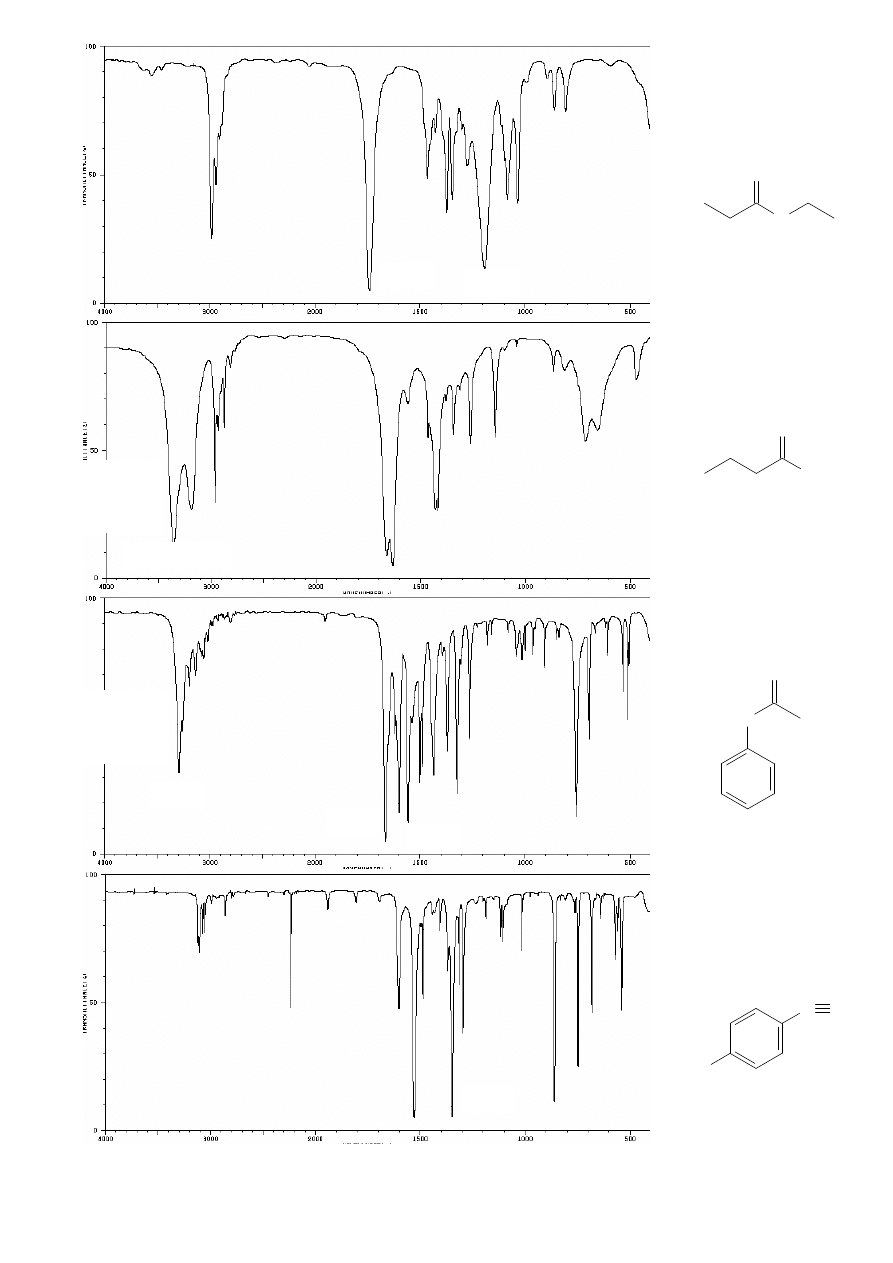
•
Rozpoznawanie grup funkcyjnych (wiązań obecnych w cząsteczce) na
podstawie widm:
ν
C
sp
-H
2928
2959
1465
3079
1650
3316
2120
ALKENY:
np. heks-1-en
ALKANY:
np.
n
-heksan
ALKINY:
np. heks-1-yn
(terminalny)
okt-4-yn
1380
brak pasm
ν
C
≡C
oraz
ν
C
sp
-H
!!
ν
C
sp3
-H
ν
C
sp2
-H
ν
C=C
ν
C
≡C
δ
(CH
3
w pł. asym.)
δ
(CH
2
w pł.)
δ
(CH
3
w pł. sym.)

Chemia Organiczna-konwersatorium; gr. A1; 2014/15Z (B. Kozik)
8
3016
3084
nadtony
1584
1478
Cl
ZW. AROMATYCZNE:
np. chlorobenzen
ALKOHOLE:
np. butan-1-ol
OH
szerokie
pasmo
ν
O-H
3000-3600
1073
ETERY:
np. eter dietylowy
O
1130
eter etylowo-fenylowy
(fenetol)
/niesymetryczny/
O
1246
1050
pasmo
ν
C-O
1070-1150
2 pasma
ν
C-O
:
1020-1075 (asym.)
1200-1275 (sym.)
pasmo
ν
C-O
1060-1150
(położenie zależy
od rzędowości
alkoholu)
Uwaga!: dla alkoholi
niezasocjowanych (bez
wiąz. wodorowych) ostre
pasmo
ν
O-H
3550-3650
pasma
ν
C
Ar
=C
Ar
przy ok. 1600
oraz 1475-1500
pasma
ν
C
sp
2
-H
3010-3100
Chemia Organiczna-konwersatorium; gr. A1; 2014/15Z (B. Kozik)
9
2 (lub 3)
pasma
ν
N-H
3300-3500
pasmo
δ
N-H
ok. 1600
AMINY:
np. butano-2-amina (1
o
)
NH
2
N,N
-dimetyloanilina (3
o
)
N
1728
N
-metylobutanoamina (2
o
)
NH
ALDEHYDY:
np. 2-metylobutanal
O
H
1711 i 2811
1 pasmo
ν
N-H
3300-3500
brak pasm
ν
N-H
i
δ
N-H
pasmo
ν
C=O
1720-1740
2 pasma
ν
CO-H
przy ok.
2720 i 2820 !!
pasmo
δ
N-H
ok. 1600
3292
1578
3286 i
3362
1603

Chemia Organiczna-konwersatorium; gr. A1; 2014/15Z (B. Kozik)
10
szerokie pasmo
dimerów
2500-3400
KETONY:
np. pentan-3-on
1716
O
1775
KWASY
KARBOKSYLOWE:
np. kw. izowalerianowy
(3-metylobutanowy)
O
OH
BEZWODNIKI
KWASOWE
np. bezwodnik octowy
O
O
O
CHLORKI
KWASOWE
np. chlorek benzoilu
O
Cl
1733
1710
zwykle 2 pasma
ν
C=O
przy ok. 1800-1775
ν
C-Cl
671
1827
1766
2 pasma
ν
C=O
:
1800-1830 (asym.)
1740-1775 (sym.)
ν
C-O
1224
pasmo
ν
C=O
1680-1750
pasmo
ν
C=O
1705-1725
Chemia Organiczna-konwersatorium; gr. A1; 2014/15Z (B. Kozik)
11
ESTRY:
np. propionian etylu
O
O
1740
1200
3294
1557
acetanilid (2
o
)
1665
HN
O
AMIDY:
np. butyroamid (1
o
)
O
NH
2
3366 i 3184
1662 i 1634
2234
1530
1350
NITRYLE,
ZW. NITROWE:
np. nitryl kwasu
p
-nitrobenzoesowego
C
O
2
N
N
2 pasma
ν
N-H
przy ok.
3180 i 3350
pasmo
ν
C=O
1700-1750
2 pasma
ν
C-O
:
sym. oraz
asym. (wyższe
wart. cm
-1
; int.
zbliżona do
pasma
ν
C=O
)
1 pasmo
ν
N-H
przy ok.
3300
2 pasma
tzw.
amidowe
:
I.
ν
C=O
ok. 1650
II.
δ
N-H
1620-1650
/faza stała/
2 pasma
tzw.
amidowe
:
I.
ν
C=O
1630-1680
II.
δ
N-H
1515-1570
/faza stała/
(w amidach 3
o
tylko
1 pasmo 1630-1670)
Uwaga!: położenie pasm
amidowych zależy od tego,
czy pomiar dokonywany
jest w fazie stałej czy
w rozc. roztworze
2 silne pasma
ν
N=O
:
1300-1350 (sym.)
1500-1560 (asym.)
pasmo
ν
C
≡N
powyżej 2200
(intensywniejsze niż
ν
C
≡C
)

Chemia Organiczna-konwersatorium; gr. A1; 2014/15Z (B. Kozik)
12
•
Podstawowe, łatwe do interpretacji pasma absorbcji w spektroskopii IR
zakres absorbcji
[cm
-1
]
wiązanie
typ związku
uwagi
3550-3650
O-H
alkohole, fenole
monomeryczne, bez wiązań wodorowych - ostre pasmo
3000-3600
O-H
alkohole, fenole
zasocjowane, wiązania wodorowe - szerokie pasmo
3300-3500
N-H
aminy
zwykle dwa pasma dla NH
2
, jedno dla NH
ok. 3300
≡C-H
alkiny
tylko dla terminalnych
3100-3400
N-H
amidy
zwykle dwa pasma dla NH
2
, jedno dla NH
2500-3400
O-H
kwasy
bardzo szerokie pasmo
3010-3100
=C-H
alkeny, areny
zazwyczaj słabe
2840-3000
-C-H
alkany
kilka pasm, intensywność zależy od ilości grup alifat.
ok. 2700 i 2820
O=C-H
aldehydy
słabe pasma
2210-2260
C
≡N
nitryle
2100-2200
C
≡C
alkiny
dobrze widoczne tylko dla terminalnych alkinów
1650-1830
C=O
- chlorki kwasowe: 1775-1800;
- bezwodniki: dwa pasma różniące się o ok. 60 cm
-1
– jedno w zakresie
1800-1830, drugie 1740-1775 cm
-1
;
- estry: 1700-1750
(cykliczne laktony: 5 czł.-1780; 4 czł.- 1840)
- kwasy: 1680-1750 (często szerokie)
- aldehydy i ketony: 1660-1740
(ketony cykliczne 4 i 5-członowe: do 1780)
- amidy (-CONH
2
) dwa pasma ok. 1630 i 1650 (w KBr),
ok. 1600 i 1690 w roztworze;
(-CONHR) dwa pasma 1515-1570 i 1630-1680 (w KBr),
1510-1550 i 1670-1700 (w roztworze);
(CONR
2
) jedno pasmo: 1630-1670 (w KBr i w roztworze);
(gdy C=O sprzężone z Ar lub C=C - niższe wartości !!)
1640-1680
C=C
alkeny
niższe wartości gdy C=C sprzężone z Ar, C=O lub C=C
ok. 1600
oraz 1475-1500
C
Ar
=C
Ar
zw.
aromatyczne
zmienna intensywność
ok. 1540 i 1360
NO
2
zw. nitrowe
intensywne
1050 - 1300
C-O
- fenole: 1180-1260;
-alkohole: 1050-1200;
- estry: dwa pasma ok. 1150 i 1200-1300;
- etery dialifatyczne: 1070-1150;
- etery nienasyc.: dwa pasma ok. 1050 i ok. 1250
Wyszukiwarka
Podobne podstrony:
więcej podobnych podstron